Celecoxib
 | |
 | |
| Klinische Daten | |
|---|---|
| Aussprache | /sɛlɪˈkɒksɪb/ SEL-i-KOK-sib |
| Handelsnamen | Celebrex, Onsenal, Elyxyb, andere |
| AHFS/Drugs.com | Monographie |
| MedlinePlus | a699022 |
| Lizenz-Daten | |
| Schwangerschaft Kategorie |
|
| Wege der Verabreichung | Durch den Mund |
| Wirkstoffklasse | Cyclooxygenase-2 (COX-2)-Hemmer |
| ATC-Code |
|
| Rechtlicher Status | |
| Rechtlicher Status |
|
| Pharmakokinetische Daten | |
| Bioverfügbarkeit | Unbekannt |
| Proteinbindung | 97% (hauptsächlich an Serumalbumin) |
| Verstoffwechselung | Leber (hauptsächlich CYP2C9) |
| Eliminationshalbwertszeit | 7,8 Stunden; 11 Stunden (bei leichter Leberfunktionsstörung); 13 Stunden (bei mittelschwerer bis schwerer Leberfunktionsstörung) |
| Ausscheidung | Fäkalien (57%), Urin (27%) |
| Bezeichnungen | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB-Ligand |
|
| Chemische und physikalische Daten | |
| Formel | C17H14F3N3O2S |
| Molare Masse | 381,37 g-mol-1 |
| 3D-Modell (JSmol) | |
SMILES
| |
InChI
| |
| (Überprüfen) | |
Celecoxib, das unter anderem unter dem Markennamen Celebrex verkauft wird, ist ein COX-2-Hemmer und nichtsteroidales Antirheumatikum (NSAID). Es wird zur Behandlung von Schmerzen und Entzündungen bei Osteoarthritis, akuten Schmerzen bei Erwachsenen, rheumatoider Arthritis, Spondylitis ankylosans, schmerzhafter Menstruation und juveniler rheumatoider Arthritis eingesetzt. Es kann auch verwendet werden, um das Risiko von kolorektalen Adenomen bei Menschen mit familiärer adenomatöser Polyposis zu verringern. Es wird durch den Mund eingenommen. Die Wirkung tritt in der Regel innerhalb einer Stunde ein. ⓘ
Häufige Nebenwirkungen sind Bauchschmerzen, Übelkeit und Durchfall. Schwerwiegende Nebenwirkungen können Herzinfarkte, Schlaganfälle, Magen-Darm-Perforation, Magen-Darm-Blutungen, Nierenversagen und Anaphylaxie sein. Die Einnahme wird für Menschen mit einem hohen Risiko für Herzerkrankungen nicht empfohlen. Die Risiken sind ähnlich wie bei anderen NSAIDs wie Ibuprofen und Naproxen. Die Anwendung in der Spätschwangerschaft oder während der Stillzeit wird nicht empfohlen. ⓘ
Celecoxib wurde 1993 patentiert und kam 1999 in den medizinischen Gebrauch. Es ist als Generikum erhältlich. Im Jahr 2019 war es mit mehr als 6 Millionen Verschreibungen das 102. am häufigsten verschriebene Medikament in den Vereinigten Staaten. ⓘ
| Strukturformel ⓘ | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Celecoxib | |||||||||||||||
| Andere Namen |
4-[5-(4-Methylphenyl)-3-(trifluormethyl)-pyrazol-1-yl]benzensulfonamid | |||||||||||||||
| Summenformel | C17H14F3N3O2S | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse |
COX-2-Hemmer, Antineoplastische Mittel | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 381,37 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Es wurde in den 1990er Jahren bei Monsanto/Searle (später von Pfizer übernommen) von Philip Needleman entwickelt. Im Vergleich zu anderen Nicht-Opioid-Analgetika sind selektive COX-2-Hemmer erheblich teurer und durchgängig verschreibungspflichtig. ⓘ
Medizinische Anwendungen
Celecoxib ist indiziert zur Behandlung von Arthrose, rheumatoider Arthritis, akuten Schmerzen, Schmerzen des Bewegungsapparats, schmerzhafter Menstruation, Spondylitis ankylosans, juveniler rheumatoider Arthritis und zur Verringerung der Anzahl von Dickdarm- und Mastdarmpolypen bei Menschen mit familiärer adenomatöser Polyposis. Es kann bei Kindern mit juveniler rheumatoider Arthritis eingesetzt werden, die älter als zwei Jahre sind und mehr als 10 kg wiegen. ⓘ
Bei postoperativen Schmerzen ist es Ibuprofen mehr oder weniger gleichwertig. Bei der Schmerzlinderung ist es ähnlich wie Paracetamol (Paracetamol), das die erste Wahl bei der Behandlung von Arthrose ist. ⓘ
Der Nachweis der Wirkungen ist nicht eindeutig, da eine Reihe von Studien, die vom Hersteller durchgeführt wurden, nicht zur unabhängigen Analyse freigegeben wurden. ⓘ
Celecoxib ist zur Behandlung von degenerativen Gelenkerkrankungen (Arthrose), chronischer Polyarthritis (rheumatoide Arthritis) und des Morbus Bechterew (Spondylitis ankylosans) zugelassen. ⓘ
In dem unter dem Handelsnamen Onsenal zugelassenen Anwendungsgebiet der neben einer chirurgischen Therapie ergänzenden Behandlung von Patienten mit familiärer adenomatöser Polyposis (FAP) nahm Pfizer das Mittel im April 2011 in den Ländern der EU vom Markt. ⓘ
Familiäre adenomatöse Polyposis
Es wurde zur Verringerung von Dickdarm- und Mastdarm-Polypen bei Menschen mit familiärer adenomatöser Polyposis eingesetzt, aber es ist nicht bekannt, ob es die Krebsrate senkt, daher ist es aus diesem Grund keine gute Wahl. ⓘ
Unerwünschte Wirkungen
- Kardiovaskuläre Ereignisse: NSAIDs werden mit einem erhöhten Risiko für schwerwiegende (und möglicherweise tödliche) kardiovaskuläre thrombotische Ereignisse, einschließlich Herzinfarkt und Schlaganfall, in Verbindung gebracht. Das Risiko kann mit der Dauer der Anwendung oder mit vorbestehenden kardiovaskulären Risikofaktoren oder Erkrankungen erhöht sein. Das individuelle kardiovaskuläre Risikoprofil sollte vor der Verschreibung bewertet werden. Neu auftretender Bluthochdruck oder eine Verschlimmerung des Bluthochdrucks kann auftreten (NSAIDs können das Ansprechen auf Thiazide oder Schleifendiuretika beeinträchtigen) und kann zu kardiovaskulären Ereignissen beitragen; Blutdruck überwachen und bei Patienten mit Bluthochdruck mit Vorsicht anwenden. Kann zu Natrium- und Flüssigkeitsretention führen, daher mit Vorsicht bei Patienten mit Ödemen oder Herzinsuffizienz anwenden. Das langfristige kardiovaskuläre Risiko bei Kindern ist nicht untersucht worden. Um das Risiko kardiovaskulärer Ereignisse zu verringern, sollte die niedrigste wirksame Dosis für die kürzeste Zeitspanne in Übereinstimmung mit den individuellen Zielen des Patienten verwendet werden; für Patienten mit hohem Risiko sollten alternative Therapien in Betracht gezogen werden. Das erhöhte Risiko liegt bei etwa 37 %.
- Gastrointestinale Ereignisse: NSAIDs können das Risiko für schwere gastrointestinale Ulzerationen, Blutungen und Perforationen (die tödlich sein können) erhöhen. Diese Ereignisse können zu jeder Zeit während der Therapie und ohne Vorwarnung auftreten. Vorsicht ist geboten bei Erkrankungen des Magen-Darm-Trakts (Blutungen oder Geschwüre), gleichzeitiger Therapie mit Aspirin, Antikoagulantien und/oder Kortikosteroiden, Rauchen, Alkoholkonsum, älteren oder geschwächten Patienten. Verwenden Sie die niedrigste wirksame Dosis für die kürzeste Zeitspanne, in Übereinstimmung mit den individuellen Zielen des Patienten, um das Risiko von unerwünschten Ereignissen im Magen-Darm-Trakt zu verringern; bei Patienten mit hohem Risiko sollten alternative Therapien in Betracht gezogen werden. Bei gleichzeitiger Anwendung mit ≤325 mg Aspirin besteht ein deutlich erhöhtes Risiko für gastrointestinale Komplikationen (z. B. Geschwüre); eine begleitende gastroprotektive Therapie (z. B. Protonenpumpenhemmer) wird empfohlen. Das erhöhte Risiko liegt bei etwa 81 %.
- Hämatologische Wirkungen: Anämie kann auftreten; bei Langzeitbehandlung Hämoglobin oder Hämatokrit überwachen. Celecoxib beeinflusst in der Regel nicht die Prothrombinzeit, die partielle Thromboplastinzeit oder die Thrombozytenzahl; es hemmt die Thrombozytenaggregation in den zugelassenen Dosen nicht. ⓘ
Bei Personen mit einer Vorgeschichte von Geschwüren oder Magen-Darm-Blutungen ist besondere Vorsicht geboten. Mäßige bis schwere Leberschäden oder Magen-Darm-Toxizität können mit oder ohne Warnsymptome bei Personen auftreten, die mit NSAIDs behandelt werden. ⓘ
Im Oktober 2020 verlangte die US-Arzneimittelbehörde (FDA) eine Aktualisierung des Beipackzettels für alle nichtsteroidalen entzündungshemmenden Medikamente, um das Risiko von Nierenproblemen bei ungeborenen Babys zu beschreiben, die zu niedrigem Fruchtwasser führen. Sie empfehlen, NSAIDs bei Schwangeren ab der 20. Schwangerschaftswoche zu vermeiden. ⓘ
Überempfindlichkeit gegenüber Sulfonamiden, gastrointestinale Blutungen, schwere Leberfunktionsstörungen, entzündliche Magen-Darmerkrankungen, schwere Niereninsuffizienz, Herzinsuffizienz, koronare Herzkrankheit, periphere arterielle Verschlusskrankheit und zerebrovaskuläre Erkrankungen schließen eine Einnahme von Celecoxib aus. ⓘ
Laut der CNT-Studie erhöht die Einnahme von Celecoxib das Risiko von oberen gastrointestinalen Komplikationen um ein 1,8-Faches. ⓘ
Allergie
Celecoxib enthält einen Sulfonamid-Anteil und kann bei Personen, die auf andere sulfonamidhaltige Arzneimittel allergisch reagieren, allergische Reaktionen hervorrufen. Dies gilt zusätzlich zur Kontraindikation bei Menschen mit schweren Allergien gegen andere NSAIDs. Die Wahrscheinlichkeit, dass es bei Personen, die in der Vergangenheit bereits auf Aspirin oder nichtselektive NSAIDs reagiert haben, Hautreaktionen hervorruft, ist jedoch gering (ca. 4 %). NSAIDs können schwerwiegende unerwünschte Hautereignisse verursachen, einschließlich exfoliative Dermatitis, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse; Ereignisse können ohne Vorwarnung und bei Patienten ohne vorherige bekannte Sulfa-Allergie auftreten. Die Einnahme sollte bei den ersten Anzeichen eines Hautausschlags (oder einer anderen Überempfindlichkeitsreaktion) abgebrochen werden. ⓘ
Herzinfarkt und Schlaganfall
Eine Metaanalyse von Hunderten von klinischen Studien aus dem Jahr 2013 ergab, dass Coxibs (die Medikamentenklasse, zu der auch Celecoxib gehört) das Risiko für schwerwiegende kardiovaskuläre Probleme um etwa 37 % gegenüber Placebo erhöhen. Im Jahr 2016 lieferte eine randomisierte Studie eindeutige Beweise dafür, dass eine Behandlung mit Celecoxib nicht eher zu schlechten kardiovaskulären Ergebnissen führt als eine Behandlung mit Naproxen oder Ibuprofen. Daher kam ein Beratungsgremium der FDA im Jahr 2018 zu dem Schluss, dass Celecoxib kein größeres Risiko für Herzinfarkte und Schlaganfälle birgt als die häufig verwendeten NSAIDs Ibuprofen oder Naproxen, und empfahl der FDA, eine Änderung ihrer Empfehlungen für Ärzte in Bezug auf die Sicherheit von Celecoxib in Betracht zu ziehen. ⓘ
Der COX-2-Hemmer Rofecoxib (Vioxx) wurde 2004 wegen seines Risikos vom Markt genommen. Wie alle NSAIDs auf dem US-amerikanischen Markt trägt auch Celecoxib eine von der FDA vorgeschriebene "Black Box Warnung" vor kardiovaskulären und gastrointestinalen Risiken. Im Februar 2007 warnte die American Heart Association, dass bei "Patienten mit einer Vorgeschichte oder einem hohen Risiko für Herz-Kreislauf-Erkrankungen ... die Verwendung von COX-2-Hemmern zur Schmerzlinderung auf Patienten beschränkt werden sollte, für die es keine geeigneten Alternativen gibt, und dann nur in der niedrigsten Dosis und für die kürzeste notwendige Dauer." ⓘ
In einer 2005 in den Annals of Internal Medicine veröffentlichten Studie wurde festgestellt, dass die kardiovaskulären Auswirkungen von COX-2-Hemmern je nach Medikament unterschiedlich sind. Andere COX-2-selektive Inhibitoren wie Rofecoxib weisen deutlich höhere Herzinfarktraten auf als Celecoxib. Im April 2005 kam die FDA nach einer umfassenden Prüfung der Daten zu dem Schluss, dass es wahrscheinlich ist, "dass es einen 'Klasseneffekt' für ein erhöhtes Herz-Kreislauf-Risiko bei allen NSAIDs gibt". In einer Meta-Analyse randomisierter Kontrollstudien aus dem Jahr 2006 wurden die zerebrovaskulären Ereignisse im Zusammenhang mit COX-2-Hemmern untersucht, wobei jedoch keine signifikanten Risiken im Vergleich zu nicht-selektiven NSAIDs oder Placebos festgestellt wurden. ⓘ
Wechselwirkungen mit anderen Arzneimitteln
Celecoxib wird vorwiegend durch Cytochrom P450 2C9 metabolisiert. Vorsicht ist geboten bei gleichzeitiger Anwendung von 2C9-Inhibitoren wie Fluconazol, die die Celecoxib-Serumspiegel stark erhöhen können. Bei gleichzeitiger Anwendung mit Lithium erhöht Celecoxib die Lithium-Plasmaspiegel. Bei gleichzeitiger Anwendung mit Warfarin kann Celecoxib zu einem erhöhten Risiko von Blutungskomplikationen führen. Das Risiko von Blutungen und Magengeschwüren steigt auch weiter an, wenn SSRIs in Kombination mit Celecoxib angewendet werden. Das Arzneimittel kann das Risiko eines Nierenversagens in Verbindung mit Angiotensin-konvertierenden Enzyminhibitoren, wie Lisinopril, und Diuretika, wie Hydrochlorothiazid, erhöhen. ⓘ
Schwangerschaft
In den Schwangerschaftskategorien der US FDA ist das Medikament vor der 30. Schwangerschaftswoche in Kategorie C und ab der 30. ⓘ
Mechanismus der Wirkung
Entzündungshemmend
Celecoxib ist ein hochselektiver reversibler Hemmer der COX-2-Isoform der Cyclooxygenase und hemmt die Umwandlung von Arachidonsäure in Prostaglandin-Vorstufen. Daher hat es schmerzlindernde und entzündungshemmende Eigenschaften. Nicht-selektive NSAIDs (wie Aspirin, Naproxen und Ibuprofen) hemmen sowohl COX-1 als auch COX-2. Die Hemmung von COX-1 (die Celecoxib in therapeutischen Konzentrationen nicht hemmt) hemmt die Produktion von Prostaglandinen und die Produktion von Thromboxan A2, einem Thrombozytenaktivator. COX-1 wird traditionell als konstitutiv exprimiertes "Housekeeping"-Enzym definiert und spielt eine Rolle beim Schutz der Magen-Darm-Schleimhaut, der Hämodynamik der Nieren und der Thrombozyten-Thrombogenese. COX-2 hingegen wird in hohem Maße in Zellen exprimiert, die an Entzündungen beteiligt sind, und wird durch bakterielle Lipopolysaccharide, Zytokine, Wachstumsfaktoren und Tumorpromotoren hochreguliert. Celecoxib hemmt COX-2 etwa 10-20 Mal selektiver als COX-1. Es bindet sich mit seiner polaren Sulfonamid-Seitenkette an eine hydrophile Seitentaschenregion in der Nähe der aktiven COX-2-Bindungsstelle. Theoretisch ermöglicht diese Selektivität Celecoxib und anderen COX-2-Hemmern, Entzündungen (und Schmerzen) zu reduzieren und gleichzeitig gastrointestinale Nebenwirkungen (z. B. Magengeschwüre) zu minimieren, die bei nicht-selektiven NSAIDs häufig auftreten. ⓘ
Anti-Krebsmittel
Bei seiner Verwendung zur Verringerung von Dickdarmpolypen wirkt Celecoxib auf Gene und Signalwege, die an der Entzündung und bösartigen Umwandlung von Tumoren beteiligt sind, nicht aber auf normales Gewebe. ⓘ
Celecoxib bindet an Cadherin-11 (was die Verringerung der Krebsprogression erklären könnte). ⓘ
Struktur-Wirkungs-Beziehung
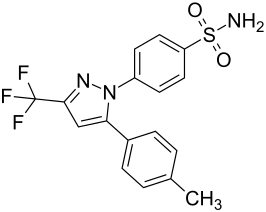
Die Searle-Forschungsgruppe stellte fest, dass sich die beiden entsprechend substituierten aromatischen Ringe an benachbarten Positionen des zentralen Rings befinden müssen, um eine angemessene COX-2-Hemmung zu bewirken. An der 1,5-Diarylpyrazol-Einheit können verschiedene Modifikationen vorgenommen werden, um die Struktur-Wirkungs-Beziehung von Celecoxib abzuleiten. Es wurde festgestellt, dass ein para-Sulfamoylphenyl an Position 1 des Pyrazols eine höhere Potenz zur selektiven COX-2-Hemmung aufweist als ein para-Methoxyphenyl (siehe Strukturen 1 und 2, unten). Darüber hinaus ist bekannt, dass ein 4-(Methylsulfonyl)phenyl oder 4-Sulfamoylphenyl für die COX-2-Hemmung erforderlich ist. Ersetzt man beispielsweise eine dieser Einheiten durch einen -SO2NHCH3-Substituenten, so verringert sich die COX-2-hemmende Wirkung, wie bei einer sehr hohen Hemmkonzentration-50 festgestellt wurde (siehe Strukturen 3 - 5). An der 3-Position des Pyrazols bietet eine Trifluormethyl- oder Difluormethylsubstitution eine höhere Selektivität und Wirksamkeit als eine Fluormethyl- oder Methylsubstitution (siehe Strukturen 6 - 9). ⓘ
Celecoxib ist Verbindung 22; das 4-Sulfamoylphenyl am 1-Pyrazol-Substituenten ist für die COX-2-Hemmung erforderlich, und die 4-Methylgruppe am 5-Pyrazol-System hat eine geringe sterische Hinderung, um die Wirksamkeit zu maximieren, während die 3-Trifluormethylgruppe eine höhere Selektivität und Wirksamkeit bietet. Um die Selektivität von Celecoxib zu erklären, muss der Unterschied in der freien Bindungsenergie zwischen dem Arzneimittelmolekül und den COX-1-Enzymen im Vergleich zu den COX-2-Enzymen analysiert werden. Die strukturellen Veränderungen unterstreichen die Bedeutung der Bindung an den Rest 523 in der seitlichen Bindungstasche des Cyclooxygenase-Enzyms, der bei COX-1 ein Isoleucin und bei COX-2 ein Valin ist. Diese Mutation scheint zur COX-2-Selektivität beizutragen, indem sie ein sterisches Hindernis zwischen dem Sulfonamid-Sauerstoff und der Methylgruppe von Ile523 schafft, das den Celecoxib-COX-1-Komplex effektiv destabilisiert. ⓘ
Geschichte
Celecoxib wurde ursprünglich von Pfizer zur Behandlung von Arthritis auf den Markt gebracht. Celecoxib und andere selektive COX-2-Hemmer, Valdecoxib, Parecoxib und Mavacoxib, wurden von einem Team der Searle-Abteilung von Monsanto unter der Leitung von John Talley entdeckt. ⓘ
Wegen der Entdeckung von Celecoxib kam es zu zwei Gerichtsverfahren. Daniel L. Simmons von der Brigham Young University (BYU) entdeckte 1988 das COX-2-Enzym, und 1991 ging die BYU eine Zusammenarbeit mit Monsanto ein, um Medikamente zur Hemmung dieses Enzyms zu entwickeln. Die Pharmasparte von Monsanto wurde später von Pfizer aufgekauft. 2006 verklagte die BYU Pfizer wegen Vertragsbruchs und behauptete, Pfizer habe die vertraglichen Lizenzgebühren nicht ordnungsgemäß an die BYU zurückgezahlt. Im April 2012 wurde ein Vergleich geschlossen, in dem sich Pfizer zur Zahlung von 450 Millionen Dollar verpflichtete. Weitere wichtige Entdeckungen im Bereich COX-2 wurden an der University of Rochester gemacht, die diese Entdeckungen patentieren ließ. Als das Patent erteilt wurde, verklagte die Universität Searle (später Pfizer) in der Sache University of Rochester v. G.D. Searle & Co., 358 F.3d 916 (Fed. Cir. 2004). Das Gericht entschied 2004 zugunsten von Searle und vertrat im Wesentlichen die Auffassung, dass die Universität eine Methode beansprucht hatte, die eine Verbindung zur Hemmung von COX-2 erforderte, aber keine schriftliche Beschreibung dieser Verbindung enthielt, so dass das Patent ungültig war. ⓘ
Laut der National Academy of Sciences beaufsichtigte Philip Needleman, der 1989 Vizepräsident von Monsanto und 1993 Präsident von Searle war, die Forschung zu COX-2, die zur Entwicklung des entzündungshemmenden Medikaments Celecoxib (Celebrex) führte. Von 2000 bis 2003 war er Senior Executive Vice President und Chief Scientist von Pharmacia. Celecoxib wurde von G. D. Searle & Company entdeckt und entwickelt und von der FDA am 31. Dezember 1998 zugelassen. Es wurde von der Monsanto Company (Muttergesellschaft von Searle) und Pfizer unter dem Markennamen Celebrex gemeinsam vermarktet. Monsanto fusionierte mit Pharmacia, dessen medizinische Forschungsabteilung von Pfizer übernommen wurde, wodurch Pfizer Eigentümer von Celebrex wurde. Das Medikament stand im Mittelpunkt eines großen Patentstreits, der 2004 zu Gunsten von Searle (später Pfizer) entschieden wurde. In der Rechtssache University of Rochester v. G.D. Searle & Co., 358 F.3d 916 (Fed. Cir. 2004), machte die University of Rochester geltend, dass das United States Pat. Nr. 6,048,850 (in dem eine Methode zur Hemmung von COX-2 beim Menschen unter Verwendung eines Wirkstoffs beansprucht wurde, ohne dass tatsächlich offengelegt wurde, um welchen Wirkstoff es sich dabei handelte) Medikamente wie Celecoxib umfasse. Das Gericht entschied zu Gunsten von Searle und stellte im Wesentlichen fest, dass die Universität eine Methode beansprucht hatte, die einen Wirkstoff zur Hemmung von COX-2 erforderte, jedoch keine schriftliche Beschreibung dieses Wirkstoffs enthielt, so dass das Patent ungültig war. ⓘ
Nachdem Rofecoxib im September 2004 vom Markt genommen worden war, verzeichnete Celecoxib einen kräftigen Umsatzanstieg. Die Ergebnisse der APC-Studie im Dezember desselben Jahres weckten jedoch Bedenken, dass Celebrex ähnliche Risiken wie Rofecoxib bergen könnte, und Pfizer kündigte kurz darauf ein Moratorium für die Direktwerbung für Celebrex an. Der Umsatz erreichte im Jahr 2006 2 Milliarden Dollar. Vor der Verfügbarkeit von Generika war Celebrex eines der umsatzstärksten Medikamente von Pfizer mit einem Umsatz von mehr als 2,5 Milliarden US-Dollar [im Jahr 2012] und wurde im Jahr 2011 2,4 Millionen Menschen verschrieben". Im Jahr 2012 hatten 33 Millionen Amerikaner Celecoxib eingenommen. ⓘ
Pfizer nahm 2006 die Werbung für Celebrex in Zeitschriften wieder auf und startete im April 2007 eine Fernsehwerbung mit einem unorthodoxen, 2+1⁄2-minütigen Werbespot, in dem die unerwünschten Wirkungen von Celebrex im Vergleich zu anderen entzündungshemmenden Medikamenten ausführlich diskutiert wurden. Der Spot wurde von der Verbraucherschutzorganisation Public Citizen kritisiert, die die Vergleiche in der Werbung als irreführend bezeichnete. Pfizer reagierte auf die Bedenken von Public Citizen mit der Zusicherung, dass das Unternehmen die Risiken und Vorteile von Celebrex gemäß den Vorgaben der FDA wahrheitsgemäß bewirbt. ⓘ
Gesellschaft und Kultur
Gefälschte Wirksamkeitsstudien
Pfizer und sein Partner Pharmacia präsentierten die Ergebnisse ihrer Studie, wonach Celebrex "den Magen besser vor schweren Komplikationen schützt als andere Medikamente". Dies wurde zum wichtigsten Verkaufsargument von Celebrex. Nach Untersuchungen der Bundesbehörden stellte sich jedoch heraus, dass Pfizer und Pharmacia "nur die Ergebnisse der ersten sechs Monate einer einjährigen Studie vorgelegt hatten und nicht die gesamte Studie." Diese Teilergebnisse wurden dann im The Journal of the American Medical Association veröffentlicht. Im Jahr 2001 veröffentlichte die US Food and Drug Administration (FDA) die vollständigen Ergebnisse der Studie von Pfizer und Pharmacia, aus denen hervorging, dass sie wichtige Daten zurückgehalten hatten. 2012 entsiegelte ein Bundesrichter "Tausende von Seiten interner Dokumente und Zeugenaussagen" in einem "langjährigen Wertpapierbetrugsverfahren gegen Pfizer." ⓘ
Am 11. März 2009 enthüllte Scott S. Reuben, ehemaliger Leiter der Abteilung für akute Schmerzen am Baystate Medical Center in Springfield, Massachusetts, dass die Daten von 21 Studien, die er zur Wirksamkeit des Medikaments (und anderer wie Vioxx) verfasst hatte, gefälscht worden waren. Die schmerzlindernde Wirkung der Medikamente war übertrieben dargestellt worden. Reuben war auch ein ehemaliger bezahlter Sprecher von Pfizer. Obwohl Pfizer von 2002 bis 2007 einen Großteil der Forschungsarbeiten von Dr. Reuben finanzierte und viele seiner Studien die Wirksamkeit der Pfizer-Medikamente Celebrex und Lyrica bei postoperativen Schmerzen belegten", hatte Pfizer keine Kenntnis von den gefälschten Daten. Keine der zurückgezogenen Studien wurde vor der Zulassung des Medikaments bei der US-amerikanischen Food and Drug Administration oder bei den Zulassungsbehörden der Europäischen Union eingereicht. Obwohl Pfizer eine öffentliche Erklärung abgab, in der es hieß: "Es ist sehr enttäuschend, von den angeblichen Handlungen von Dr. Scott Reuben zu erfahren. Als wir uns entschlossen, die Forschung von Dr. Reuben zu unterstützen, arbeitete er für ein glaubwürdiges akademisches medizinisches Zentrum und schien ein seriöser Forscher zu sein." Die 2012 entsiegelten Dokumente enthüllten, dass Mitarbeiter von Pharmacia bereits im Februar 2000 eine Strategie entwickelt hatten, um die Ergebnisse zu präsentieren. ⓘ
Verfügbarkeit
Pfizer vermarktet Celecoxib unter dem Markennamen Celebrex, und es ist als orale Kapseln mit 50, 100, 200 oder 400 mg Celecoxib erhältlich. ⓘ
Es ist in vielen Ländern als Generikum unter verschiedenen Markennamen legal erhältlich. In den USA war Celecoxib durch drei Patente geschützt, von denen zwei am 30. Mai 2014 abliefen und eines (US RE44048) am 2. Dezember 2015 auslaufen sollte. Am 13. März 2014 wurde dieses Patent wegen Doppelpatentierung für ungültig erklärt. Nach Ablauf des Patents am 30. Mai 2014 ließ die FDA die ersten Versionen von generischem Celecoxib zu. ⓘ
Forschung
Psychiatrie
Auf der Grundlage der Theorie, dass Entzündungen bei der Entstehung schwerer psychischer Störungen eine Rolle spielen, wurde Celecoxib bei einer Reihe von psychiatrischen Erkrankungen getestet, darunter schwere Depressionen, bipolare Störungen und Schizophrenie. ⓘ
Bipolare Störung
Eine Meta-Analyse, die Studien zu Celecoxib als Zusatztherapie bei bipolaren Störungen untersuchte, war nicht schlüssig, da die Qualität der Nachweise gering war. ⓘ
Familiäre adenomatöse Polyposis
Es wurde zur Verringerung von Dickdarm- und Mastdarm-Polypen bei Menschen mit familiärer adenomatöser Polyposis eingesetzt, aber es ist nicht bekannt, ob es die Krebsrate senkt, daher ist es aus diesem Grund keine gute Wahl. ⓘ
Krebsprävention
Die Rolle, die Celecoxib bei der Verringerung der Häufigkeit bestimmter Krebsarten spielen könnte, war Gegenstand zahlreicher Studien. Es gibt jedoch keine medizinische Empfehlung für die Verwendung dieses Arzneimittels zur Krebsbekämpfung. ⓘ
Die Verwendung von Celecoxib zur Verringerung des Risikos von Darmkrebs wurde untersucht, aber weder Celecoxib noch ein anderes Medikament ist für diese Verwendung angezeigt. Kleine klinische Studien bei Personen mit sehr hohem Risiko (aus FAP-Familien) zeigten, dass Celecoxib das Wachstum von Polypen verhindern kann. Daraufhin wurden groß angelegte randomisierte klinische Studien durchgeführt. Die Ergebnisse zeigen, dass das Wiederauftreten von Polypen bei Personen, die täglich mit Celecoxib behandelt werden, um 33 bis 45 % zurückgeht. Allerdings traten in den mit Celecoxib behandelten Gruppen deutlich häufiger schwere kardiovaskuläre Ereignisse auf. Aspirin zeigt eine ähnliche (und möglicherweise stärkere) Schutzwirkung, hat nachweislich kardioprotektive Wirkungen und ist deutlich billiger, aber es gibt keine direkten klinischen Studien, in denen die beiden Medikamente miteinander verglichen wurden. ⓘ
Krebsbehandlung
Anders als bei der Krebsvorbeugung geht es bei der Krebsbehandlung um die Therapie von Tumoren, die sich bereits gebildet und im Körper des Patienten festgesetzt haben. Derzeit laufen zahlreiche Studien, um festzustellen, ob Celecoxib für diese Erkrankung nützlich sein könnte. Bei molekularen Studien im Labor wurde jedoch deutlich, dass Celecoxib neben seinem bekanntesten Ziel, COX-2, auch mit anderen intrazellulären Komponenten interagieren kann. Die Entdeckung dieser zusätzlichen Angriffspunkte hat viele Kontroversen ausgelöst, und die ursprüngliche Annahme, dass Celecoxib das Tumorwachstum in erster Linie durch die Hemmung von COX-2 reduziert, wurde umstritten. ⓘ
Sicherlich ist die Hemmung von COX-2 für die entzündungshemmende und schmerzlindernde Wirkung von Celecoxib von entscheidender Bedeutung. Es ist jedoch unklar, ob die Hemmung von COX-2 auch bei den krebshemmenden Wirkungen dieses Medikaments eine entscheidende Rolle spielt. So zeigte eine kürzlich durchgeführte Studie mit bösartigen Tumorzellen, dass Celecoxib das Wachstum dieser Zellen in vitro hemmen kann, COX-2 dabei aber keine Rolle spielt; noch auffälliger ist, dass die krebshemmenden Wirkungen von Celecoxib auch bei der Verwendung von Krebszelltypen erzielt wurden, die COX-2 gar nicht enthalten. Karen Seibert und Kollegen haben Untersuchungen veröffentlicht, die eine antiangiogene und antitumorale Wirkung von Celecoxib in Tiermodellen zeigen. ⓘ
Die Idee, dass neben COX-2 auch andere Angriffspunkte für die krebshemmende Wirkung von Celecoxib wichtig sind, wird durch Studien mit chemisch modifizierten Celecoxib-Versionen zusätzlich unterstützt. Mehrere Dutzend Celecoxib-Analoga wurden mit kleinen Änderungen in ihrer chemischen Struktur hergestellt. Einige dieser Analoga behielten ihre COX-2-hemmende Wirkung bei, während viele andere dies nicht taten. Als jedoch die Fähigkeit all dieser Verbindungen, Tumorzellen in Zellkulturen abzutöten, untersucht wurde, hing die antitumorale Potenz überhaupt nicht davon ab, ob die jeweilige Verbindung COX-2 hemmen konnte oder nicht, was zeigt, dass die Hemmung von COX-2 für die krebshemmende Wirkung nicht erforderlich war. Eine dieser Verbindungen, 2,5-Dimethyl-Celecoxib, der die Fähigkeit zur Hemmung von COX-2 völlig fehlt, zeigte sogar eine stärkere krebshemmende Wirkung als Celecoxib. ⓘ
Klinische Angaben
Wechselwirkungen mit anderen Medikamenten
Bei gleichzeitiger Einnahme von oralen Antikoagulantien besteht ein erhöhtes Blutungsrisiko, deshalb sollte besonders zu Behandlungsbeginn die INR überwacht werden. Celecoxib kann die Wirkung von Diuretika und Antihypertensiva verringern. ⓘ
Unerwünschte Wirkungen (Nebenwirkungen)
Häufig werden Infektionen der oberen Atemwege, Schlaflosigkeit und Schwindel beobachtet. Gelegentlich treten Anämie, Tinnitus und Urtikaria auf. Seltene Nebenwirkungen sind Ataxie, Magengeschwüre, Darmperforationen, Haarausfall und erhöhte Lichtempfindlichkeit. Einige Studien hatten eine vermehrte Herzinfarktrate zum Ergebnis; eine schwedische Kohortenstudie auf Basis der Registerdaten von knapp sieben Millionen Menschen konnte ein erhöhtes Risiko durch COX-2-Hemmer nicht bestätigen. Celecoxib hemmt außerdem das Enzym Arachidonat-5-Lipoxygenase (5-LO). ⓘ
Pharmakologische Eigenschaften
Bei oraler Einnahme erreicht Celecoxib eine maximale Bioverfügbarkeit von 50–70 %. Zwei bis drei Stunden nach der Aufnahme erreicht Celecoxib die maximale Plasmakonzentration im Blut. Die Einnahme von zu fettreichem Essen verzögert die Resorption um circa eine Stunde. Die Plasmaproteinbindung beträgt etwa 97 %. Die Eliminationshalbwertszeit liegt bei sechs bis zwölf Stunden. ⓘ
Dosierung
Celecoxib soll maximal alle 12 Stunden verabreicht werden. Somit liegt die (empfohlene) Tagesdosierung bei 200–400 mg pro Tag, die Tageshöchstdosis beträgt 400 mg. ⓘ
Handelsnamen
- Celebrex (Deutschland, Österreich, Schweiz, Monopräparat) ⓘ