Fullerene




| Teil einer Reihe von Artikeln über ⓘ |
| Nanowerkstoffe |
|---|
 |
| Kohlenstoff-Nanoröhrchen |
|
| Fullerene |
|
| Andere Nanopartikel |
|
| Nanostrukturierte Materialien |
|
|
|
Ein Fulleren ist ein Kohlenstoff-Allotrop, dessen Molekül aus Kohlenstoffatomen besteht, die durch Einfach- und Doppelbindungen so verbunden sind, dass sie ein geschlossenes oder teilweise geschlossenes Netz mit verschmolzenen Ringen aus fünf bis sieben Atomen bilden. Das Molekül kann eine Hohlkugel, ein Ellipsoid, eine Röhre oder viele andere Formen und Größen haben. Graphen (isolierte Atomschichten aus Graphit), das ein flaches Netz aus regelmäßigen sechseckigen Ringen ist, kann als extremes Mitglied der Familie angesehen werden. ⓘ
Fullerene mit einer geschlossenen Maschentopologie werden informell mit ihrer empirischen Formel Cn bezeichnet, die oft mit Cn geschrieben wird, wobei n die Anzahl der Kohlenstoffatome ist. Für einige Werte von n kann es jedoch mehr als ein Isomer geben. ⓘ
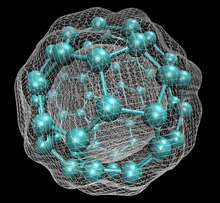
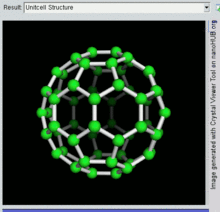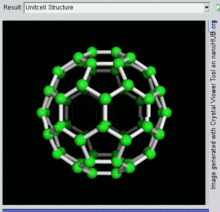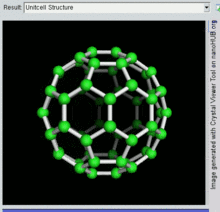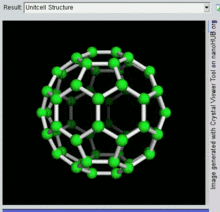
Die Familie ist nach Buckminsterfulleren (C60), dem berühmtesten Mitglied, benannt, das wiederum nach Buckminster Fuller benannt ist. Die geschlossenen Fullerene, insbesondere C60, werden wegen ihrer Ähnlichkeit mit dem Standardball des Vereinsfußballs (Soccer") auch informell Buckyballs genannt. Geschachtelte geschlossene Fullerene werden auch als Bucky Onions bezeichnet. Zylindrische Fullerene werden auch als Kohlenstoff-Nanoröhren oder Buckytubes bezeichnet. Die feste Form von reinen oder gemischten Fullerenen wird Fullerit genannt. ⓘ
Fullerene wurden schon seit einiger Zeit vorhergesagt, aber erst nach ihrer zufälligen Synthese im Jahr 1985 wurden sie in der Natur und im Weltraum entdeckt. Mit der Entdeckung der Fullerene wurde die Zahl der bekannten Kohlenstoff-Allotrope, die zuvor auf Graphit, Diamant und amorphen Kohlenstoff wie Ruß und Holzkohle beschränkt war, erheblich erweitert. Sie sind Gegenstand intensiver Forschung, sowohl im Hinblick auf ihre Chemie als auch auf ihre technischen Anwendungen, insbesondere in der Materialwissenschaft, Elektronik und Nanotechnologie. ⓘ

Als Fullerene (Einzahl: das Fulleren) werden hohle, geschlossene Moleküle (mit häufig hoher Symmetrie, z. B. Ih-Symmetrie für C60) aus Kohlenstoffatomen, die sich in Fünf- und Sechsecken anordnen, bezeichnet. Sie stellen (neben Diamant, Graphit, Lonsdaleit, Chaoit, Kohlenstoffnanoröhren und Graphen) eine weitere Modifikation des chemischen Elements Kohlenstoff dar. ⓘ
Geschichte
Die erste Veröffentlichung zu Fullerenen von dem japanischen Chemiker Eiji Ōsawa, der ihre Existenz theoretisch vorhersagte und berechnete, stammt aus dem Jahr 1970. Diese und folgende seiner Publikationen veröffentlichte er in japanischer Sprache, weswegen erst die 15 Jahre später am 14. November 1985 in der Zeitschrift Nature erschienene Publikation der Forscher Robert F. Curl jr. (USA), Sir Harold W. Kroto (England) und Richard E. Smalley (USA) weltweite Aufmerksamkeit erlangte. Diese erhielten dafür 1996 den Nobelpreis für Chemie, während Osawa unberücksichtigt blieb. ⓘ
Vor diesen Veröffentlichungen zu Fullerenen gab es einige zu „Hohlmolekülen“, beispielsweise einen Artikel von David Jones im New Scientist 1966, nachgedruckt auch im Buch „Zittergas und schräges Wasser“ (S. 27 f.), mit Rechnungen zur Stabilität von Hohlmolekülen, wobei die damals größten bekannten Moleküle nur Dodekaeder-Form hatten, also nur 20 Atome enthielten. ⓘ
2010 wurden Fullerene durch Infrarotaufnahmen des Weltraumteleskops Spitzer im planetarischen Nebel Tc 1 nachgewiesen. Sie sind die größten nachgewiesenen Moleküle im extraterrestrischen Weltraum. ⓘ
Vorhersagen und begrenzte Beobachtungen
Das ikosaedrische C
60H
60-Käfig wurde 1965 als eine mögliche topologische Struktur erwähnt. Eiji Osawa sagte die Existenz von C
60 im Jahr 1970 vorausgesagt > Er stellte fest, dass die Struktur eines Corannulen-Moleküls eine Untermenge der Form eines Fußballs war, und stellte die Hypothese auf, dass auch eine vollständige Ballform existieren könnte. Japanische Fachzeitschriften berichteten über seine Idee, aber weder sie noch ihre Übersetzungen erreichten Europa oder Amerika. ⓘ
Ebenfalls 1970 schlug R. W. Henson (damals beim britischen Atomic Energy Research Establishment) die C
60-Struktur vor und fertigte ein Modell davon an. Leider waren die Beweise für diese neue Form des Kohlenstoffs zu dieser Zeit sehr schwach, so dass der Vorschlag mit Skepsis aufgenommen und nie veröffentlicht wurde. Er wurde erst 1999 anerkannt. ⓘ
Im Jahr 1973 führte eine Gruppe von Wissenschaftlern aus der UdSSR unabhängig von Henson eine quantenchemische Analyse der Stabilität von C
60 und berechnete seine elektronische Struktur. Die Arbeit wurde 1973 veröffentlicht, aber die wissenschaftliche Gemeinschaft schenkte dieser theoretischen Vorhersage keine große Bedeutung. ⓘ
Um 1980 identifizierte Sumio Iijima das Molekül von C
60 anhand einer elektronenmikroskopischen Aufnahme von Ruß, wo es den Kern eines Teilchens mit der Struktur einer "buckligen Zwiebel" bildete. ⓘ
Entdeckung von C
60
1985 entdeckte Harold Kroto von der University of Sussex in Zusammenarbeit mit James R. Heath, Sean O'Brien, Robert Curl und Richard Smalley von der Rice University Fullerene in dem rußigen Rückstand, der bei der Verdampfung von Kohlenstoff in einer Heliumatmosphäre entsteht. Im Massenspektrum des Produkts erschienen diskrete Peaks, die Molekülen mit der exakten Masse von sechzig oder siebzig oder mehr Kohlenstoffatomen entsprechen, nämlich C
60 und C
70. Das Team identifizierte ihre Struktur als die inzwischen bekannten "Buckyballs". <span title="Aus: Englische Wikipedia, Abschnitt "Discovery of C
60"" class="plainlinks"><br_/>60 ⓘ
Der Name "Buckminsterfulleren" wurde schließlich für C
60 von den Entdeckern als Hommage an den amerikanischen Architekten Buckminster Fuller gewählt, da die Struktur eine vage Ähnlichkeit mit den von ihm populär gemachten geodätischen Kuppeln aufweist, die, wenn sie zu einer vollständigen Kugel erweitert würden, ebenfalls die ikosaedrische Symmetriegruppe aufweisen würden. Die Endung "ene" wurde gewählt, um darauf hinzuweisen, dass die Kohlenstoffe ungesättigt sind, da sie nur mit drei anderen Atomen verbunden sind, anstatt der üblichen vier. Der verkürzte Name "Fulleren" wurde schließlich für die gesamte Familie verwendet. <span title="Aus: Englische Wikipedia, Abschnitt "Discovery of C
60"" class="plainlinks"><br_/>60 ⓘ
Kroto, Curl und Smalley wurden 1996 für ihre Rolle bei der Entdeckung dieser Molekülklasse mit dem Nobelpreis für Chemie ausgezeichnet. <span title="Aus: Englische Wikipedia, Abschnitt "Discovery of C
60"" class="plainlinks"><br_/>60 ⓘ
Weitere Entwicklungen
Kroto und das Rice-Team entdeckten neben C60 bereits weitere Fullerene, und die Liste wurde in den folgenden Jahren noch erheblich erweitert. Kohlenstoff-Nanoröhrchen wurden erstmals 1991 entdeckt und synthetisiert. ⓘ
Nach ihrer Entdeckung wurde festgestellt, dass winzige Mengen von Fullerenen in rußenden Flammen und durch Blitzentladungen in der Atmosphäre erzeugt werden. Im Jahr 1992 wurden Fullerene in einer Familie von Mineraloiden, den Shungiten, in Karelien, Russland, gefunden. ⓘ
Die Produktionstechniken wurden von vielen Wissenschaftlern verbessert, darunter Donald Huffman, Wolfgang Krätschmer, Lowell D. Lamb und Konstantinos Fostiropoulos. Dank ihrer Bemühungen war es 1990 relativ einfach, grammgroße Proben von Fullerenpulver herzustellen. Die Reinigung von Fulleren ist nach wie vor eine Herausforderung für Chemiker und bestimmt zu einem großen Teil die Fullerenpreise. ⓘ
Im Jahr 2010 wurden die Spektralsignaturen von C60 und C70 vom Spitzer-Infrarotteleskop der NASA in einer Wolke kosmischen Staubs um einen 6500 Lichtjahre entfernten Stern beobachtet. Kroto kommentierte: "Dieser höchst aufregende Durchbruch liefert überzeugende Beweise dafür, dass der Buckyball, wie ich schon lange vermutet habe, seit Urzeiten in den dunklen Nischen unserer Galaxie existiert." Die Astronomin Letizia Stanghellini meint: "Es ist möglich, dass Buckyballs aus dem Weltall den Samen für das Leben auf der Erde lieferten." Im Jahr 2019 wurden ionisierte C60-Moleküle mit dem Hubble-Weltraumteleskop im Raum zwischen diesen Sternen entdeckt. ⓘ
Arten
Es gibt zwei große Fulleren-Familien mit recht unterschiedlichen Eigenschaften und Anwendungen: die geschlossenen Buckyballs und die offenen zylindrischen Kohlenstoff-Nanoröhren. Es gibt jedoch auch Hybridstrukturen zwischen diesen beiden Klassen, wie z. B. Kohlenstoff-Nanoknospen - Nanoröhren, die mit halbkugelförmigen Maschen oder größeren "Buckybuds" versehen sind. ⓘ
Buckyballs
Buckminster-Fulleren
Buckminsterfulleren ist das kleinste Fullerenmolekül mit fünfeckigen und sechseckigen Ringen, bei dem keine zwei Fünfecke eine Kante teilen (was destabilisierend sein kann, wie bei Penten). Es ist auch das am häufigsten vorkommende Fulleren in der Natur, da es häufig in Ruß zu finden ist. ⓘ
Die Summenformel von Buckminsterfulleren lautet C
60 und seine Struktur ist ein abgestumpftes Ikosaeder, das einem Fußball aus zwanzig Sechsecken und zwölf Fünfecken ähnelt, mit einem Kohlenstoffatom an den Spitzen jedes Polygons und einer Bindung entlang jeder Polygonkante. ⓘ
Der van-der-Waals-Durchmesser eines Buckminsterfulleren-Moleküls beträgt etwa 1,1 Nanometer (nm). Der Durchmesser von Kern zu Kern eines Buckminsterfulleren-Moleküls beträgt etwa 0,71 nm. ⓘ
Das Buckminsterfulleren-Molekül hat zwei Bindungslängen. Die 6:6-Ringbindungen (zwischen zwei Sechsecken) können als "Doppelbindungen" betrachtet werden und sind kürzer als die 6:5-Bindungen (zwischen einem Sechseck und einem Fünfeck). Seine durchschnittliche Bindungslänge beträgt 1,4 Å. ⓘ
Andere Fullerene
Ein weiteres, recht häufig vorkommendes Fulleren hat die empirische Formel C
70, aber auch Fullerene mit 72, 76, 84 und sogar bis zu 100 Kohlenstoffatomen werden häufig hergestellt. ⓘ
Das kleinstmögliche Fulleren ist das dodekaedrische C
20. Es gibt keine Fullerene mit 22 Scheitelpunkten. Die Zahl der verschiedenen Fullerene C2n wächst mit zunehmendem n = 12, 13, 14, ..., etwa proportional zu n9 (Sequenz A007894 im OEIS). Zum Beispiel gibt es 1812 nicht-isomorphe Fullerene C
60. Man beachte, dass nur eine Form von C
60, Buckminsterfulleren, kein Paar benachbarter Fünfecke aufweist (das kleinste Fulleren dieser Art). Zur weiteren Veranschaulichung des Wachstums gibt es 214.127.713 nicht-isomorphe Fullerene C
200, von denen 15.655.672 keine benachbarten Fünfecke haben. Optimierte Strukturen vieler Fulleren-Isomere sind im Internet veröffentlicht und aufgelistet. ⓘ
Heterofullerene haben Heteroatome, die die Kohlenstoffe in käfig- oder röhrenförmigen Strukturen ersetzen. Sie wurden 1993 entdeckt und erweitern die Gesamtklasse der Fullerene erheblich, da sie an ihren Oberflächen baumelnde Bindungen aufweisen können. Bemerkenswerte Beispiele sind Bor-, Stickstoff- (Azafulleren), Sauerstoff- und Phosphorderivate. ⓘ
Kohlenstoff-Nanoröhrchen

Kohlenstoff-Nanoröhrchen sind zylindrische Fullerene. Diese Kohlenstoffröhren sind in der Regel nur wenige Nanometer breit, können aber von weniger als einem Mikrometer bis zu mehreren Millimetern Länge reichen. Sie haben oft geschlossene Enden, können aber auch offen sein. Es gibt auch Fälle, in denen sich der Durchmesser der Röhre verringert, bevor sie sich verschließt. Ihre einzigartige Molekularstruktur führt zu außergewöhnlichen makroskopischen Eigenschaften, darunter hohe Zugfestigkeit, hohe elektrische Leitfähigkeit, hohe Duktilität, hohe Wärmeleitfähigkeit und relative chemische Inaktivität (da sie zylindrisch und "planar" sind, d. h. keine "freiliegenden" Atome haben, die leicht verdrängt werden können). Eine vorgeschlagene Verwendung von Kohlenstoff-Nanoröhren ist die Verwendung in Papierbatterien, die 2007 von Forschern des Rensselaer Polytechnic Institute entwickelt wurde. Ein weiterer, sehr spekulativer Verwendungsvorschlag im Bereich der Raumfahrttechnologien ist die Herstellung von hochfesten Kohlenstoffkabeln, die für einen Weltraumaufzug benötigt werden. ⓘ
Abgeleitete Produkte
Buckyballs und Kohlenstoff-Nanoröhren wurden als Bausteine für eine Vielzahl von Derivaten und größeren Strukturen verwendet, wie z. B.
- Verschachtelte Buckyballs ("Kohlenstoff-Nanozwiebeln" oder "Buckyonions"), die für Schmiermittel vorgeschlagen wurden;
- verschachtelte Kohlenstoff-Nanoröhren ("Kohlenstoff-Megatubes")
- Verbundene "Ball-and-Chain"-Dimere (zwei Buckyballs, die durch eine Kohlenstoffkette verbunden sind)
- Ringe aus miteinander verbundenen Buckyballs. ⓘ
Heterofullerene und Nicht-Kohlenstoff-Fullerene
Nach der Entdeckung von C60 wurden viele Fullerene synthetisiert (oder mit Hilfe von Molekülmodellierungsmethoden theoretisch untersucht), bei denen einige oder alle Kohlenstoffatome durch andere Elemente ersetzt sind. Vor allem anorganische Nanoröhren haben viel Aufmerksamkeit auf sich gezogen. ⓘ
Bor
Eine Art von Buckyball, bei dem Boratome anstelle des üblichen Kohlenstoffs verwendet werden, wurde 2007 vorhergesagt und beschrieben. Die B
80-Struktur, bei der jedes Atom 5 oder 6 Bindungen bildet, wurde als stabiler vorhergesagt als der C
60 Buckyball. Nachfolgende Analysen ergaben jedoch, dass die vorhergesagte Ih-symmetrische Struktur schwingungsinstabil ist und der resultierende Käfig einen spontanen Symmetriebruch erleiden würde, was zu einem krausen Käfig mit seltener Th-Symmetrie (Symmetrie eines Volleyballs) führen würde. Die Zahl der Sechsringe in diesem Molekül beträgt 20 und die Zahl der Fünfringe 12. In der Mitte jedes Sechserrings befindet sich ein zusätzliches Atom, das an jedes umgebende Atom gebunden ist. Durch die Anwendung eines systematischen globalen Suchalgorithmus wurde später festgestellt, dass das zuvor vorgeschlagene b
80-Fulleren kein globales Maximum für 80-atomige Borcluster ist und daher in der Natur nicht vorkommt; die stabilsten Konfigurationen sind komplex. In derselben Arbeit wurde festgestellt, dass die Energielandschaft von Bor im Gegensatz zu anderen Elementen viele ungeordnete Strukturen mit niedriger Energie aufweist, so dass reine Bor-Fullerene in der Natur nicht vorkommen dürften. ⓘ
Allerdings wurde ein unregelmäßiger B
40-Komplex mit der Bezeichnung Borospheren wurde 2014 hergestellt. Dieser Komplex hat zwei sechseckige Flächen und vier siebeneckige Flächen mit D2d-Symmetrie, die von einem Netzwerk aus 48 Dreiecken durchzogen sind. ⓘ
Andere Elemente
Anorganische (kohlenstofffreie) Fulleren-Strukturen wurden mit Molybdän(IV)-sulfid (MoS2), das seit langem als graphitähnliches Schmiermittel verwendet wird, Wolfram (WS2), Titan (TiS2) und Niob (NbS2) hergestellt. Diese Materialien erwiesen sich als stabil bis zu mindestens 350 Tonnen/cm2 (34,3 GPa). ⓘ
Ikosaedrische oder verzerrt-ikosaedrische Fulleren-ähnliche Komplexe wurden auch für Germanium, Zinn und Blei hergestellt; einige dieser Komplexe sind groß genug, um die meisten Übergangsmetallatome aufzunehmen. ⓘ
Wichtigste Fullerene
Nachstehend finden Sie eine Tabelle der wichtigsten geschlossenen Kohlenstoff-Fullerene, die bisher synthetisiert und charakterisiert wurden, mit ihrer CAS-Nummer, sofern bekannt. Fullerene mit weniger als 60 Kohlenstoffatomen werden als "niedrigere Fullerene" bezeichnet, solche mit mehr als 70 Atomen als "höhere Fullerene". ⓘ
| Formel | Ziff. Isom.[1] |
Mol. Symm. |
krist. Symm. |
Raumgruppe | Nr. | Pearson Symbol |
a (nm) | b (nm) | c (nm) | β° | Z | ρ (g/cm3) ⓘ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| C 20 |
1 | Ih | ||||||||||
| C 60 |
1 | Ih | ||||||||||
| C 70 |
1 | D5h | ||||||||||
| C 72 |
1 | D6h | ||||||||||
| C 74 |
1 | D3h | ||||||||||
| C 76 |
2 | D2* | Monoklin | P21 | 4 | mP2 | 1.102 | 1.108 | 1.768 | 108.10 | 2 | 1.48 |
| Kubisch | Fm3m | 225 | cF4 | 1.5475 | 1.5475 | 1.5475 | 90 | 4 | 1.64 | |||
| C 78 |
5 | D2v | ||||||||||
| C 80 |
7 | |||||||||||
| C 82 |
9 | C 2, C2v, C3v |
Monoklin | P21 | 4 | mP2 | 1.141 | 1.1355 | 1.8355 | 108.07 | 2 | |
| C 84 |
24 | D2*, D2d | Kubisch | Fm3m | 1.5817 | 1.5817 | 1.5817 | 90 | ||||
| C 86 |
19 | |||||||||||
| C 88 |
35 | |||||||||||
| C 90 |
46 | |||||||||||
| C 3996 |
In der Tabelle ist "Num.Isom." die Anzahl der möglichen Isomere im Rahmen der "isolierten Fünfeckregel", die besagt, dass zwei Fünfecke in einem Fulleren keine gemeinsamen Kanten haben sollten.
"Mol.Symm." ist die Symmetrie des Moleküls, während "Cryst.Symm." die des kristallinen Gerüsts im festen Zustand ist. Beide werden für die experimentell am häufigsten vorkommende(n) Form(en) angegeben. Das Sternchen * kennzeichnet Symmetrien mit mehr als einer chiralen Form. ⓘ
Wenn C
76 oder C
82-Kristalle aus Toluollösung gezüchtet werden, weisen sie eine monokline Symmetrie auf. Die Kristallstruktur enthält Toluolmoleküle, die zwischen die Kugeln des Fullerens gepackt sind. Das Verdampfen des Lösungsmittels aus C
76 in eine kubisch-flächenzentrierte Form umgewandelt. Sowohl monokline als auch kubisch-flächenzentrierte (fcc) Phasen sind für besser charakterisierte C
60 und C
70-Fullerene bekannt. ⓘ
Eigenschaften
Fullerene sind braun-schwarze Pulver von metallischem Glanz. Sie lösen sich in manchen organischen Lösungsmitteln (z. B. Toluol) unter charakteristischer Färbung. Fullerene lassen sich bei ca. 400 °C sublimieren. ⓘ

Verschiedene Möglichkeiten zur Verwendung als Katalysator, Schmiermittel, zur Herstellung künstlicher Diamanten, in der Medizin, als Halbleiter und Supraleiter sind Gegenstand der Forschung. ⓘ
Aufgrund der Bindungsverhältnisse im Molekül kann es extrem viele Radikale aufnehmen und binden (Radikalfänger). Diese sollen für den Alterungsprozess der Haut mitverantwortlich sein. Diese Wirkung von Fullerenen ist jedoch nicht wissenschaftlich belegt. ⓘ
Eine Studie von 2012 berichtet, die orale Gabe von C60 aufgelöst in Olivenöl bei Ratten zeige keine toxische Wirkung und habe die Lebensdauer der Ratten deutlich verlängert. Eine Reproduktion dieses Ergebnisses steht allerdings noch aus. ⓘ
Topologie
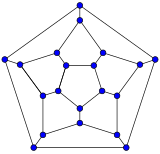
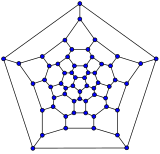
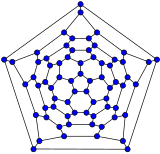
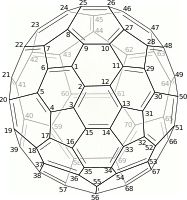
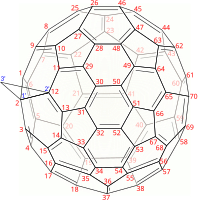
Schlegel-Diagramme werden häufig verwendet, um die 3D-Struktur von Fullerenen mit geschlossener Schale zu verdeutlichen, da 2D-Projektionen in diesem Sinne oft nicht ideal sind. ⓘ
Mathematisch ausgedrückt kann die kombinatorische Topologie (d. h. die Kohlenstoffatome und die Bindungen zwischen ihnen, ohne Berücksichtigung ihrer Positionen und Abstände) eines Fullerens mit geschlossener Schale und einer einfachen kugelähnlichen mittleren Oberfläche (orientierbar, Genus Null) als konvexes Polyeder dargestellt werden; genauer gesagt als sein eindimensionales Skelett, das aus seinen Ecken und Kanten besteht. Das Schlegel-Diagramm ist eine Projektion dieses Skeletts auf eine der Flächen des Polyeders, und zwar durch einen Punkt knapp außerhalb dieser Fläche, so dass alle anderen Eckpunkte in diese Fläche hineinragen. ⓘ
- Schlegel-Diagramme von einigen Fullerenen
C70 ⓘ
Das Schlegel-Diagramm eines geschlossenen Fullerens ist ein Graph, der planar und 3-regelmäßig ist (oder "kubisch"; das bedeutet, dass alle Eckpunkte den Grad 3 haben). ⓘ
Ein geschlossenes Fulleren mit einer kugelförmigen Hülle muss mindestens einige Zyklen haben, die Fünfecke oder Heptagone sind. Genauer gesagt, wenn alle Flächen 5 oder 6 Seiten haben, folgt aus der Eulerschen Polyederformel V-E+F=2 (wobei V, E, F die Anzahl der Ecken, Kanten und Flächen sind), dass V gerade sein muss und dass es genau 12 Fünfecke und V/2-10 Sechsecke geben muss. Ähnliche Einschränkungen bestehen, wenn das Fulleren heptagonale (siebenatomige) Zyklen hat. ⓘ
Offene Fullerene, wie Kohlenstoff-Nanoröhren und Graphen, können vollständig aus sechseckigen Ringen bestehen. Theoretisch könnte ein langes Nanoröhrchen, dessen Enden zu einer geschlossenen, torusartigen Platte verbunden sind, auch vollständig aus Sechsecken bestehen. ⓘ
Bindung
Da jedes Kohlenstoffatom nur mit drei statt der üblichen vier Nachbaratome verbunden ist, ist es üblich, diese Bindungen als eine Mischung aus einfachen und doppelten kovalenten Bindungen zu beschreiben. Die Hybridisierung des Kohlenstoffs in C60 wurde mit sp2.01 angegeben. Der Bindungszustand kann durch Raman-Spektroskopie, IR-Spektroskopie und Röntgen-Photoelektronenspektroskopie analysiert werden. ⓘ
Verkapselung
Zusätzliche Atome, Ionen, Cluster oder kleine Moleküle können im Inneren von Fullerenen eingeschlossen werden, um Einschlussverbindungen zu bilden, die als endoedrische Fullerene bekannt sind. Ein ungewöhnliches Beispiel ist das eiförmige Fulleren Tb3N@C
84, das gegen die Regel des isolierten Fünfecks verstößt. Beweise für einen Meteoriteneinschlag am Ende des Perms wurden durch die Analyse von Edelgasen gefunden, die in Fullerenen eingeschlossen sind. ⓘ
Forschung
In den frühen 2000er Jahren waren die chemischen und physikalischen Eigenschaften von Fullerenen ein heißes Thema in der Forschung und Entwicklung. Popular Science diskutierte mögliche Anwendungen von Fullerenen (Graphen) in Rüstungen. ⓘ
Auf dem Gebiet der Nanotechnologie gehören Hitzebeständigkeit und Supraleitfähigkeit zu den am intensivsten untersuchten Eigenschaften. ⓘ
Es gibt viele Berechnungen, die mit ab-initio-Quantenmethoden für Fullerene durchgeführt wurden. Mit DFT- und TD-DFT-Methoden lassen sich IR-, Raman- und UV-Spektren ermitteln. Die Ergebnisse solcher Berechnungen können mit experimentellen Ergebnissen verglichen werden. ⓘ
Fulleren ist ein ungewöhnlicher Reaktant in vielen organischen Reaktionen wie der 1993 entdeckten Bingel-Reaktion. ⓘ
Aromatizität
Forschern ist es gelungen, die Reaktivität von Fullerenen zu erhöhen, indem sie aktive Gruppen an deren Oberfläche anbrachten. Buckminsterfulleren weist keine "Superaromatizität" auf, d. h. die Elektronen in den hexagonalen Ringen delokalisieren nicht über das gesamte Molekül. ⓘ
Ein kugelförmiges Fulleren mit n Kohlenstoffatomen hat n pi-bindende Elektronen, die sich frei verlagern können. Diese sollten versuchen, über das gesamte Molekül zu delokalisieren. Die Quantenmechanik einer solchen Anordnung sollte nur einer Schale der bekannten quantenmechanischen Struktur eines einzelnen Atoms entsprechen, mit einer stabilen gefüllten Schale für n = 2, 8, 18, 32, 50, 72, 98, 128 usw. (d. h. zweimal eine perfekte Quadratzahl), aber diese Reihe umfasst nicht 60. Diese 2(N + 1)2-Regel (mit N ganzzahlig) für sphärische Aromatizität ist das dreidimensionale Analogon der Hückelschen Regel. Das Kation 10+ würde diese Regel erfüllen und müsste aromatisch sein. Dies wurde mit Hilfe quantenchemischer Modellierung nachgewiesen, die das Vorhandensein starker diamagnetischer Kugelströme im Kation zeigte. ⓘ
Infolgedessen neigt C
60 in Wasser dazu neigt, zwei weitere Elektronen aufzunehmen und ein Anion zu werden. Das unten beschriebene nC
60, das im Folgenden beschrieben wird, ist möglicherweise das Ergebnis des Versuchs von C
60 versucht, eine lockere Metallbindung zu bilden. ⓘ
Nomenklatur
Lange Zeit weigerte sich die für verbindliche Empfehlungen zur Nomenklatur chemischer Verbindungen zuständige IUPAC, den Trivialnamen Fulleren anzuerkennen. Erst im Jahr 2002 änderte sie ihre Meinung und empfiehlt seitdem die Verwendung von Fulleran, Fulleren und Fulleroid. Das bedeutet eine erhebliche Erleichterung, denn bis dahin ist der korrekte, das heißt IUPAC-konforme Name, z. B. des [60]Fullerens (C60), folgender gewesen:
Reaktionen von C60
Fullerene bieten drei Ansatzpunkte für chemische Modifikationen. Durch Additionsreaktionen an die Doppelbindungen erhält man exohedrale Addukte. Das Ersetzen von Kohlenstoffatomen aus der Käfighülle durch z. B. Stickstoffatome zum C59N bezeichnet man als substitutionelles Doping. Schließlich bieten derartige Käfigstrukturen noch die Möglichkeit, Atome oder Verbindungen in den Hohlraum einzubringen. Verbindungen dieser Art bezeichnet man als endohedrale Komplexe. Zur Kennzeichnung endohedraler Komplexe hat sich in der Literatur die Schreibweise X@Cn durchgesetzt, bei der sich ein Atom oder Cluster X im Inneren eines Fullerenkäfigs aus n Kohlenstoffatomen befindet. ⓘ
C60 besitzt einen Hohlraum mit einem Durchmesser von 400 pm, in den Metall- und Nichtmetallatome eingelagert werden können. Ein Beispiel ist die Einlagerungsverbindung des Heliums, die mit der Notation He@C60 korrekt bezeichnet wird. He@C60 entsteht, wenn Graphit in einer Helium-Atmosphäre verdampft wird. ⓘ
Weiterhin kann C60 die für Aromaten aber auch Alkene typischen Reaktionen wie Hydrierung, Halogenierung, Ozonolyse und Birch-Reduktion eingehen. Jedoch findet in der Regel keine vollständige Umsetzung aller Doppelbindungen statt; nur mit Fluor kann die Zusammensetzung C60F60 erreicht werden. ⓘ
Weitere interessante Verbindungen sind die ionischen Alkalimetall-Fulleride: C60 kann mit Natrium und Kalium reduziert werden. Dabei entstehen Verbindungen der Zusammensetzung MC60, M2C60 und M3C60 (M = Na, K). KC60 kristallisiert in der Natriumchlorid-Struktur. In K3C60 liegt das C603−-Anion vor und bildet eine kubisch-dichteste Kugelpackung, wobei die K+-Kationen alle vorhandenen Tetraeder- und Oktaeder-Lücken in der Kristallstruktur besetzen. K3C60 ist ein Supraleiter. ⓘ
In der Gruppe von Anton Zeilinger an der Universität Wien (siehe Weblink) wurde die Interferenz von C60-Molekülen am Gitter beobachtet. Damit wurden die von Louis de Broglie postulierten Materiewellen auch für relativ makroskopische Objekte gezeigt. ⓘ
In der Arbeitsgruppe von Jochen Mattay an der Universität Bielefeld wurden weitreichende Untersuchungen über die Funktionalisierung der Fullerene zu Aza-Heterofullerenen gemacht. ⓘ
Natürliches Vorkommen
Fullerene kommen in der Natur nur in wirtschaftlich nicht verwertbaren Mengen (Konzentrationen) vor. ⓘ
Mit Hilfe der Massenspektrometrie wurden Fullerene nachgewiesen im graphitartigen Shungit, im durch Blitzeinschlag entstandenen glasartigen Fulgurit, in Kratern von Meteoriteneinschlägen und im Kerzenruß. ⓘ
Mit Hilfe des Hubble-Teleskops wurden große Mengen des C60-Fullerens im interstellaren Raum nachgewiesen. ⓘ
Reaktionen
Polymerisation
Unter hohem Druck und bei hoher Temperatur kollabieren die Buckyballs und bilden verschiedene ein-, zwei- oder dreidimensionale Kohlenstoffgerüste. Einstrangige Polymere werden mit Hilfe der Atomtransfer-Radikal-Additions-Polymerisation (ATRAP) gebildet. ⓘ
"Ultrahartes Fullerit" ist ein Begriff, der häufig verwendet wird, um Material zu beschreiben, das durch Hochdruck-Hochtemperatur-Bearbeitung (HPHT) von Fullerit hergestellt wird. Durch diese Behandlung wird Fullerit in eine nanokristalline Form von Diamant umgewandelt, die Berichten zufolge bemerkenswerte mechanische Eigenschaften aufweist. ⓘ
Chemie
Fullerene sind stabil, aber nicht völlig unreaktiv. Die sp2-hybridisierten Kohlenstoffatome, die sich in planarem Graphit in ihrem Energieminimum befinden, müssen gebogen werden, um die geschlossene Kugel oder Röhre zu bilden, was zu einer Winkelverformung führt. Die charakteristische Reaktion von Fullerenen ist die elektrophile Addition an 6,6-Doppelbindungen, die die Winkeldehnung verringert, indem sie sp2-hybridisierte Kohlenstoffatome in sp3-hybridisierte umwandelt. Die Veränderung der hybridisierten Orbitale führt zu einer Verringerung der Bindungswinkel von etwa 120° in den sp2-Orbitalen auf etwa 109,5° in den sp3-Orbitalen. Diese Verringerung der Bindungswinkel führt dazu, dass sich die Bindungen beim Schließen der Kugel oder des Rohrs weniger stark biegen, wodurch das Molekül stabiler wird. ⓘ
Löslichkeit

60 in nativem Olivenöl extra, das die charakteristische violette Farbe von unverändertem C
60-Lösungen ⓘ
Fullerene sind in vielen organischen Lösungsmitteln löslich, z. B. in Toluol, Chlorbenzol und 1,2,3-Trichlorpropan. Die Löslichkeit ist im Allgemeinen eher gering, beispielsweise 8 g/L für C60 in Schwefelkohlenstoff. Fullerene sind jedoch das einzige bekannte Allotrop des Kohlenstoffs, das sich in gängigen Lösungsmitteln bei Raumtemperatur auflösen lässt. Eines der besten Lösungsmittel ist 1-Chlornaphthalin, in dem sich 51 g/L C60 lösen lassen. ⓘ
Lösungen von reinem Buckminsterfulleren haben eine tiefviolette Farbe. Lösungen von C
70 sind rötlich braun. Die höheren Fullerene C
76 bis C
84 haben eine Vielzahl von Farben. ⓘ
Millimetergroße Kristalle von C
60 und C
70, sowohl rein als auch solvatisiert, können aus Benzollösung gezüchtet werden. Die Kristallisation von C
60 aus Benzollösung unter 30 °C (wenn die Löslichkeit maximal ist) ergibt ein triklines festes Solvat C
60-4C
6H
6. Oberhalb von 30 °C erhält man ein solvatfreies fcc C
60. ⓘ
Quantenmechanik
Im Jahr 1999 wiesen Forscher der Universität Wien nach, dass der Welle-Teilchen-Dualismus auf Moleküle wie Fulleren anwendbar ist. ⓘ
Supraleitfähigkeit
Fullerene sind normalerweise elektrische Isolatoren, aber wenn sie mit Alkalimetallen kristallisiert werden, kann die entstehende Verbindung leitend oder sogar supraleitend sein. ⓘ
Chiralität
Einige Fullerene (z. B. C
76, C
78, C
80 und C
84) sind von Natur aus chiral, da sie D2-symmetrisch sind, und wurden bereits erfolgreich aufgespalten. Derzeit wird an der Entwicklung spezifischer Sensoren für ihre Enantiomere geforscht. ⓘ
Stabilität
Zur Beschreibung der molekularen Mechanismen, die zur Bildung von Fullerenen führen, wurden zwei Theorien vorgeschlagen. Die ältere "Bottom-up"-Theorie besagt, dass sie Atom für Atom aufgebaut werden. Der alternative "Top-down"-Ansatz besagt, dass Fullerene entstehen, wenn viel größere Strukturen in ihre Einzelteile zerfallen. ⓘ
Im Jahr 2013 entdeckten Forscher, dass sich asymmetrische Fullerene aus größeren Strukturen bilden, die sich zu stabilen Fullerenen zusammensetzen. Bei der synthetisierten Substanz handelte es sich um ein spezielles Metallofulleren, das aus 84 Kohlenstoffatomen mit zwei zusätzlichen Kohlenstoffatomen und zwei Yttriumatomen im Inneren des Käfigs besteht. Mit dem Verfahren wurden etwa 100 Mikrogramm hergestellt. ⓘ
Sie fanden jedoch heraus, dass das asymmetrische Molekül theoretisch zu fast jedem bekannten Fulleren und Metallofulleren zusammenfallen könnte. Geringfügige Störungen, bei denen einige Molekülbindungen gebrochen werden, bewirken, dass der Käfig hochsymmetrisch und stabil wird. Diese Erkenntnis stützt die Theorie, dass Fullerene aus Graphen gebildet werden können, wenn die entsprechenden Molekülbindungen durchtrennt werden. ⓘ
Systematische Benennung
Um ein Fulleren zu benennen, muss man laut IUPAC die Anzahl der Mitgliedsatome der Ringe, aus denen das Fulleren besteht, seine Symmetriepunktgruppe in der Schoenflies-Schreibweise und die Gesamtzahl der Atome angeben. Zum Beispiel wird das Buckminsterfulleren C60 systematisch als (C
60-Ih)[5,6]fullerene. Der Name der Punktgruppe sollte in jedem Derivat dieses Fullerens beibehalten werden, auch wenn die Symmetrie durch die Ableitung verloren geht. ⓘ
Um die Position von substituierten oder angefügten Elementen anzugeben, werden die Fullerenatome in der Regel spiralförmig nummeriert, wobei in der Regel mit dem Ring auf einer der Hauptachsen begonnen wird. Wenn die Struktur des Fullerens eine solche Nummerierung nicht zulässt, wurde ein anderes Ausgangsatom gewählt, um dennoch eine spiralförmige Abfolge zu erreichen. ⓘ
Letzteres ist bei C70 der Fall, das (C
70-D5h(6))[5,6]Fulleren in IUPAC-Notation. Die Symmetrie D5h(6) bedeutet, dass dies das Isomer ist, bei dem die C5-Achse durch ein Fünfeck verläuft, das von Sechsecken und nicht von Fünfecken umgeben ist. ⓘ
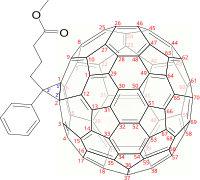
-PCBM, [1,2]-Isomer.
IUPAC-Name ist 4-(3'-Phenyl-3'H-cyclopropa[1,2](-D5h(6))[5,6]fulleren-3'-yl)butyrat. ⓘ
In der Nomenklatur der IUPAC werden vollständig gesättigte Analoga von Fullerenen als Fullerane bezeichnet. Wenn ein oder mehrere Kohlenstoffe durch andere Elemente ersetzt sind, wird die Verbindung als Heterofulleren bezeichnet. Wird eine Doppelbindung durch eine Methylenbrücke -CH2- ersetzt, ist die resultierende Struktur ein Homofulleren. Wenn ein Atom vollständig entfernt wird und die fehlenden Valenzen mit Wasserstoffatomen gesättigt sind, handelt es sich um ein Norfulleren. Wenn Bindungen entfernt werden (sowohl Sigma- als auch Pi-Bindungen), wird die Verbindung zu einem Secofulleren; wenn einige neue Bindungen in unkonventioneller Reihenfolge hinzugefügt werden, handelt es sich um ein Cyclofulleren. ⓘ
Die Heidelberger Experimente


Einen ersten Hinweis für die Existenz des hochsymmetrischen C60-Moleküls lieferten 1988 UV- und IR-Spektren von Spuren von Kohlestaub (Ruß) gemessen durch Wolfgang Krätschmer und dem Praktikanten Bernd Wagner. Durch eine eigenwillige Einstellung seines Experiments gelang es dem Praktikanten, eine Kohlestaubprobe herzustellen, in deren IR-Spektrum sich vier diskrete Linien zeigten, die Krätschmer als "Pumpenöl" einschätzte. Wagner hatte mittels Kontaktlichtbogen Graphit in einer Schutzgasatmosphäre von 50 Torr Argon verdampft, und dabei zum ersten Mal geringe Spuren eines molekularen Materials erzeugt, dessen schwache IR-Spektren mit früheren theoretischen Vorhersagen für C60 gut übereinstimmten. ⓘ
Monate später, im Februar 1989, griff Konstantinos Fostiropoulos gleich zu Beginn seiner Doktorarbeit das brachliegende Experiment Wagners auf. Nach nur wenigen Wochen hatte er das Kontaktlichtbogen-Verfahren soweit weiterentwickelt, dass er vom Potential der Wagner'schen Arbeit zunächst sich selbst überzeugen konnte. Schließlich gelang es ihm, unter 100 Torr Helium sehr dünne aber hochkonzentrierte Fullerenschichten herzustellen. Sofort wurde für den vorjährigen MPIK-Jahresbericht (1988) von Krätschmer ein Bericht über die Praktikumsarbeit von Bernd Wagner verfasst (Krätschmer und Wagner). Später entwickelte Fostiropoulos zwei weitere Verfahren, eines durch Widerstandsheizung für empfindliche Elektroden und ein robustes Lichtbogen-Verfahren für die effiziente Produktion, sodass schließlich die präparative Herstellung im Grammmaßstab pro Tag und die definitive Charakterisierung des vermuteten Fußballmoleküls möglich wurde. ⓘ
Das Widerstandsheizung-Verfahren diente Fostiropoulos, um dem Argument der Verunreinigung durch Kohlenwasserstoffe ("Pumpenöl") zu begegnen. Dazu entwickelte er eine bindemittelfreie Sintermethode und stellte Graphitelektroden aus Kohlestaub des 13C-Isotops (99 %) her, um diese durch Widerstandsheizung unter 100 Torr He zu verdampfen. So erreichte er im Dezember 1989 eine (fast) vollständige isotopische Substitution und generierte das exotische 13C60, womit der notwendige Nachweis schlussendlich erbracht war, dass der molekulare Träger der IR-Absorptionen ein reines Kohlenstoffmolekül hoher Symmetrie war und nicht eine Verunreinigung. ⓘ
Anfang Mai 1990 kam schließlich der Durchbruch. Zum ersten Mal konnte Fostiropoulos ein natürliches Fullerengemisch (C60, C70, C84 …) unter dem Schutzgas Ar (oder unter Vorvakuum) thermisch aus dem generierten Kohlestaub treiben und damit Quarz- und Si-Substrate für die Spektroskopie beschichten. Diese Filme erwiesen sich in der Folge als löslich in Benzol, sodass die Extraktion aus dem Ruß mittels Filtration oder Soxhlet-Einsatz deutlich vereinfacht wurde und eine chromatografische Trennung der Fullerene gelang. Das Lichtbogen-Verfahren wie auch die Extraktion der Fullerene aus dem Ruß mittels Lösungsmittel wurde zur heute gebräuchlichen industriellen Herstellung ausgereift. ⓘ
Erst dieses letzte der drei Heidelberger Herstellungsverfahren ermöglichte ab 1991 die Forschung an Fullerenen im großen Maßstab: Zwei Graphitelektroden werden unter reduziertem Druck in statischer Schutzgasatmosphäre (Helium oder Argon) im Lichtbogen verdampft. Der Dampf kondensiert an der kühlenden Atmosphäre, und es bildet sich ein aufsteigender Rauch. Der so produzierte Ruß enthält bis zu 15 % Fullerene. Die generierten Fullerene können anschließend aus dem Ruß thermisch ausgetrieben werden oder lassen sich alternativ mit einem unpolaren Lösungsmittel (Benzol, Toluol …) herauslösen. ⓘ
Die gewonnene Fulleren-Mischung besteht zu ca. 90 % aus C60 und ca. 10 % C70. Dagegen entstehen höhere Fullerene nur in Spuren. Durch Chromatographie, z. B. an Aktivkohle und/oder Kieselgel, kann die Fulleren-Mischung aufgetrennt werden. ⓘ
Möglich ist auch die Herstellung unter ausschließlicher Verwendung rationaler Synthesen, wobei hier im letzten Schritt eine Flash-Vakuum-Pyrolyse erfolgt. Die Ausbeute bei diesem Verfahren liegt allerdings nur bei etwa einem Prozent, weshalb es deutlich teurer als die Herstellung im Lichtbogen ist. ⓘ
Die Fullerene C60 und C70 kommen natürlich in Shungit und Fulgurit, aber auch molekular im Interstellaren Medium vor. ⓘ
Die Fullerenproduktion beginnt im Allgemeinen mit der Herstellung von fullerenreichem Ruß. Die ursprüngliche (und immer noch aktuelle) Methode bestand darin, einen starken elektrischen Strom zwischen zwei nahe beieinander liegenden Graphitelektroden in einer inerten Atmosphäre zu schicken. Der dabei entstehende Lichtbogen verdampft den Kohlenstoff zu einem Plasma, das dann zu einem rußigen Rückstand abkühlt. Alternativ wird Ruß durch Laserablation von Graphit oder Pyrolyse von aromatischen Kohlenwasserstoffen erzeugt. Die Verbrennung von Benzol ist das effizienteste Verfahren, das am MIT entwickelt wurde. ⓘ
Bei diesen Verfahren entsteht ein Gemisch aus verschiedenen Fullerenen und anderen Formen von Kohlenstoff. Die Fullerene werden dann mit geeigneten organischen Lösungsmitteln aus dem Ruß extrahiert und durch Chromatographie getrennt. Man kann Milligramm-Mengen von Fullerenen mit 80 Atomen oder mehr erhalten. C76, C78 und C84 sind im Handel erhältlich. ⓘ
Anwendungen
Fullerene wurden in großem Umfang für verschiedene biomedizinische Anwendungen eingesetzt, darunter für die Entwicklung von hochleistungsfähigen MRT-Kontrastmitteln, Röntgenkontrastmitteln, photodynamischer Therapie sowie für die Verabreichung von Medikamenten und Genen, die in mehreren umfassenden Übersichten zusammengefasst sind. ⓘ
Tumorforschung
Während in der Krebsforschung in der Vergangenheit die Strahlentherapie im Vordergrund stand, ist die photodynamische Therapie ein wichtiges Thema, da ein Durchbruch bei der Behandlung von Tumorzellen Patienten mit unterschiedlichen Erkrankungen mehr Möglichkeiten bietet. Jüngste Experimente mit HeLa-Zellen in der Krebsforschung beinhalten die Entwicklung neuer Photosensibilisatoren mit verbesserter Fähigkeit, von Krebszellen absorbiert zu werden und dennoch den Zelltod auszulösen. Wichtig ist auch, dass ein neuer Photosensibilisator nicht zu lange im Körper verbleibt, um unerwünschte Zellschäden zu vermeiden. ⓘ
Fullerene können so hergestellt werden, dass sie von HeLa-Zellen absorbiert werden. Die C
60-Derivate können unter anderem mit Hilfe der funktionellen Gruppen L-Phenylalanin, Folsäure und L-Arginin an die Zellen abgegeben werden. ⓘ
Die Funktionalisierung der Fullerene zielt darauf ab, die Löslichkeit des Moleküls in den Krebszellen zu erhöhen. Krebszellen nehmen diese Moleküle aufgrund einer Hochregulierung von Transportern in der Krebszelle in erhöhtem Maße auf, wobei in diesem Fall Aminosäuretransporter die funktionellen L-Arginin- und L-Phenylalanin-Gruppen der Fullerene einschleusen. ⓘ
Sobald sie von den Zellen absorbiert werden, reagieren die C
60-Derivate auf Lichtstrahlung reagieren, indem sie molekularen Sauerstoff in reaktiven Sauerstoff umwandeln, der in den HeLa-Zellen und anderen Krebszellen, die das Fulleren-Molekül absorbieren können, Apoptose auslöst. Diese Forschung zeigt, dass eine reaktive Substanz auf Krebszellen abzielen und dann durch Lichtstrahlung ausgelöst werden kann, wodurch die Schädigung des umliegenden Gewebes während der Behandlung minimiert wird. ⓘ
Wenn die Krebszellen das Fulleren-Molekül absorbieren und der Lichtstrahlung ausgesetzt werden, schädigt die Reaktion, bei der reaktiver Sauerstoff entsteht, die DNA, Proteine und Lipide, aus denen die Krebszelle besteht. Diese Zellschäden zwingen die Krebszelle zur Apoptose, was zu einer Verkleinerung des Tumors führen kann. Nach Beendigung der Lichtbestrahlung nimmt das Fulleren die freien Radikale wieder auf, um eine Schädigung anderer Gewebe zu verhindern. Da sich diese Behandlung auf die Krebszellen konzentriert, ist sie eine gute Option für Patienten, deren Krebszellen sich in Reichweite der Lichtstrahlung befinden. Mit fortschreitender Forschung könnte die Behandlung tiefer in den Körper eindringen und von den Krebszellen besser aufgenommen werden. ⓘ
Sicherheit und Toxizität
Im Jahr 2013 wurde ein umfassender Bericht über die Toxizität von Fullerenen veröffentlicht, in dem die Arbeiten von den frühen 1990er Jahren bis heute untersucht wurden und der zu dem Schluss kam, dass die seit der Entdeckung der Fullerene gesammelten Erkenntnisse kaum darauf hindeuten, dass C
60 toxisch ist. Die Toxizität dieser Kohlenstoff-Nanopartikel ist nicht nur dosis- und zeitabhängig, sondern hängt auch von einer Reihe anderer Faktoren ab, wie z. B.:
- Art (z. B.: C
60, C
70, M@C
60, M@C
82) - funktionelle Gruppen, die zur Wasserlöslichkeit dieser Nanopartikel verwendet werden (z. B.: OH, COOH)
- Art der Verabreichung (z. B.: intravenös, intraperitoneal) ⓘ
Es wurde empfohlen, die Pharmakologie jedes neuen Fulleren- oder Metallofulleren-basierten Komplexes einzeln als eine andere Verbindung zu bewerten. ⓘ
Populäre Kultur
Beispiele für Fullerene tauchen häufig in der Populärkultur auf. Fullerene tauchten in der Fiktion auf, lange bevor Wissenschaftler sich ernsthaft für sie interessierten. In einer humorvoll spekulativen Kolumne für New Scientist aus dem Jahr 1966 schlug David Jones die Möglichkeit vor, riesige hohle Kohlenstoffmoleküle herzustellen, indem man ein ebenes hexagonales Netz durch Hinzufügen von Fremdatomen verzerrt. ⓘ
Name
Die bekanntesten und stabilsten Vertreter der Fullerene haben die Summenformeln C60, C70, C76, C80, C82, C84, C86, C90 und C94. Das mit Abstand am besten erforschte Fulleren ist C60, das zu Ehren des Architekten Richard Buckminster Fuller Buckminster-Fulleren (auf Englisch auch buckyball) genannt wurde, da es den von ihm konstruierten geodätischen Kuppeln ähnelt. Es besteht aus 12 Fünfecken und 20 Sechsecken, die zusammen ein Abgestumpftes Ikosaeder (Archimedischer Körper) bilden. Da ein klassischer Fußball dieselbe Struktur hat, wird es auch Fußballmolekül (footballen) genannt. ⓘ
Herstellung
Erstmals wurde C60 1984 von E. A. Rohlfing, D. M. Cox und A. Kaldor in Spuren „hergestellt“. Allerdings hatten die Autoren in ihrer Publikation das Ergebnis ihrer Molekularstrahlexperimente falsch interpretiert und die besondere Struktur und Wichtigkeit des Kohlenstoffclusters mit 60 Atomen nicht erkannt. Die richtige Interpretation eines vergleichbaren Experiments lieferte dann ein Jahr später die Forschergruppe Harold W. Kroto, James R. Heath, Sean C. O'Brien, Robert F. Curl und Richard E. Smalley 1985. Sie stellten dabei erstmals die Hypothese der Fußballform des derart nachgewiesenen C60-Clusters auf. ⓘ
Über eine im Vakuum drehende Graphitscheibe hinweg wird unter hohem Druck ein kurzer Heliumpuls geblasen. Gleichzeitig wird mitten in diesen Heliumpuls die Graphitoberfläche von einem Laserpuls getroffen. Das Laserlicht hatte in dem Versuch eine Wellenlänge von 532 nm, mit dem innerhalb einer Bestrahlungszeit von 5 ns eine Energie von 30 bis 40 mJ übertragen wurde. Der Kohlenstoff des Graphits sublimiert dabei schlagartig atomar und verbindet sich in der kühlenden Heliumumgebung zu penta- und hexagonalen Ringstrukturen, die sich, während sie von dem Heliumpuls aus dem Bestrahlungsraum hinausgetrieben werden, in einer Reaktionskammer zu Kohlenstoffclustern beliebiger Größe, darunter Fullerenen, verbinden und im Massenspektrometer nachgewiesen werden. Die Ausbeute an C60 war jedoch so gering, dass die Untersuchung weiterer Eigenschaften nicht möglich war. Insbesondere blieb auch die hypothetische Fußballstruktur unbewiesen. ⓘ
Verwendung
C60 eignet sich als Komponente in unterschiedlichen Konzepten organischer Solarzellen (OPV – organic photovoltaic). Solche Systeme basieren auf einer Absorberschicht, die aus einer Donator-Akzeptor-Kombination besteht. Wegen seiner hohen Elektronenaffinität ist das C60-Molekül für die Rolle als Elektronenakzeptor einzigartig und wird deshalb in solchen Bauteilen fast ausschließlich eingesetzt. Als Elektronendonator stehen dagegen eine große Zahl organischer Moleküle, wie z. B. das ebenfalls thermisch stabile Zn-Phthalocyanin, und viele Polymere zur Verfügung. ⓘ
Am Helmholtz-Zentrum Berlin für Materialien und Energie hatte eine Forschungsgruppe um Konstantinos Fostiropoulos 2001 eine organische Solarzelle aus C60 und Zn-Phthalocyanin, präpariert aus der Gasphase, mit einer Rekordeffizienz von η=2,5 % erreicht. Bis heute (Stand 2015) erreichen fullerenbasierte OPV-Konzepte Effizienzen bis zu 12 %. Eine industrielle Fertigung organischer Solarzellen wird angestrebt. ⓘ