Natriumacetat

| |

| |

| |
| Bezeichnungen | |
|---|---|
| Bevorzugte IUPAC-Bezeichnung
Natriumacetat | |
| Andere Bezeichnungen
Heißes Eis (Natriumacetat Trihydrat)
| |
| Bezeichner | |
3D-Modell (JSmol)
|
|
Beilstein-Referenz
|
3595639 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| Arzneimittelbank |
|
| EC-Nummer |
|
Gmelin-Referenz
|
20502 |
| KEGG |
|
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII |
|
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
C2H3NaO2 |
| Molekulare Masse | 82,034 g-mol-1 |
| Erscheinungsbild | Weißes zerfließendes Pulver |
| Geruch | Geruch nach Essig (Essigsäure) bei Erhitzen bis zur Zersetzung |
| Dichte | 1,528 g/cm3 (20 °C, wasserfrei) 1,45 g/cm3 (20 °C, Trihydrat) |
| Schmelzpunkt | 324 °C (615 °F; 597 K) (wasserfrei) 58 °C (136 °F; 331 K) (Trihydrat) |
| Siedepunkt | 881,4 °C (1.618,5 °F; 1.154,5 K) (wasserfrei) 122 °C (252 °F; 395 K) (Trihydrat) zersetzt sich |
Löslichkeit in Wasser
|
Wasserfrei: 119 g/100 mL (0 °C) 123,3 g/100 mL (20 °C) 125,5 g/100 mL (30 °C) 137,2 g/100 mL (60 °C) 162,9 g/100 mL (100 °C) Trihydrat: 32,9 g/100 mL (-10 °C) 36,2 g/100 mL (0 °C) 46,4 g/100 mL (20 °C) 82 g/100 mL (50 °C) |
| Löslichkeit | Löslich in Alkohol, Hydrazin, SO2 |
| Löslichkeit in Methanol | 16 g/100 g (15 °C) 16,55 g/100 g (67,7 °C) |
| Löslichkeit in Ethanol | Trihydrat: 5,3 g/100 mL |
| Löslichkeit in Aceton | 0,5 g/kg (15 °C) |
| Acidität (pKa) | 51 (20 °C) 4,75 (in Mischung mit CH3COOH als Puffer) |
| Basizität (pKb) | 9.25 |
Magnetische Suszeptibilität (χ)
|
-37,6-10-6 cm3/mol |
Brechungsindex (nD)
|
1.464 |
| Struktur | |
Kristallstruktur
|
Monoklin |
| Thermochemie | |
Wärmekapazität (C)
|
100,83 J/mol-K (wasserfrei) 229 J/mol-K (Trihydrat) |
Std. molare
Entropie (S |
138,1 J/mol-K (wasserfrei) 262 J/mol-K (Trihydrat) |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-709,32 kJ/mol (wasserfrei) -1604 kJ/mol (Trihydrat) |
Gibbssche freie Energie (ΔfG˚)
|
-607,7 kJ/mol (wasserfrei) |
| Pharmakologie | |
ATC-Code
|
B05XA08 (WHO) |
| Gefahren | |
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |
Hauptgefahren
|
Reizend |
| NFPA 704 (Feuerdiamant) | |
| Flammpunkt | >250 °C (482 °F; 523 K) |
Selbstentzündung
temperatur |
600 °C (1.112 °F; 873 K) |
| Letale Dosis oder Konzentration (LD, LC): | |
LD50 (mittlere Dosis)
|
3530 mg/kg (oral, Ratte) |
| Sicherheitsdatenblatt (SDS) | Externes SDB |
| Verwandte Verbindungen | |
Andere Anionen
|
Natriumformiat Natriumpropionat |
Andere Kationen
|
Kaliumacetat Calciumacetat |
Verwandte Verbindungen
|
Natriumdiacetat |
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Natriumacetat, NaCH3COO, auch NaOAc abgekürzt, ist das Natriumsalz der Essigsäure. Dieses farblose, zerfließende Salz hat eine breite Palette von Verwendungsmöglichkeiten. ⓘ
Anwendungen
Biotechnologisch
Natriumacetat wird als Kohlenstoffquelle für die Kultivierung von Bakterien verwendet. Natriumacetat ist auch nützlich, um die Ausbeute bei der DNA-Isolierung durch Ethanolfällung zu erhöhen. ⓘ
Industriell
Natriumacetat wird in der Textilindustrie zur Neutralisierung von Schwefelsäureabfällen und als Photoresist bei der Verwendung von Anilinfarbstoffen verwendet. Es dient auch als Beizmittel bei der Chromgerbung und verhindert die Vulkanisierung von Chloropren bei der Herstellung von synthetischem Gummi. Bei der Verarbeitung von Baumwolle für Einwegwattepads wird Natriumacetat verwendet, um den Aufbau von statischer Elektrizität zu verhindern. ⓘ
Langlebigkeit von Beton
Natriumacetat wird verwendet, um Wasserschäden an Beton zu mindern, indem es als Betonversiegelung fungiert. Gleichzeitig ist es umweltfreundlich und billiger als die üblicherweise verwendete Epoxid-Alternative zur Versiegelung von Beton gegen Wasserdurchdringung. ⓘ
Lebensmittel
Natriumacetat kann Lebensmitteln als Gewürz zugesetzt werden, manchmal in Form von Natriumdiacetat, einem Eins-zu-Eins-Komplex aus Natriumacetat und Essigsäure, der die E-Nummer E262 hat. Es wird häufig verwendet, um Kartoffelchips einen Salz- und Essiggeschmack zu verleihen, und kann als Ersatz für Essig auf Kartoffelchips verwendet werden, da es dem Endprodukt keine Feuchtigkeit hinzufügt. Natriumacetat (wasserfrei) wird häufig als Mittel zur Verlängerung der Haltbarkeit und zur Kontrolle des pH-Werts verwendet. In niedriger Konzentration ist es für den Verzehr geeignet. ⓘ
Pufferlösung
Eine Lösung aus Natriumacetat (einem basischen Salz der Essigsäure) und Essigsäure kann als Puffer dienen, um einen relativ konstanten pH-Wert zu halten. Dies ist vor allem bei biochemischen Anwendungen nützlich, bei denen die Reaktionen in einem leicht sauren Bereich (pH 4-6) ablaufen. ⓘ
Heizkissen


Natriumacetat ist der Lebensmittelzusatzstoff E 262a. Natriumacetat wird als Geschmacksvermittler, Stabilisator oder Säureregulator in Getreideprodukten, Backwaren, Gelees, Bonbons und Suppen verwendet; Natriumdiacetat als Geschmacksvermittler, Säureregulator in Brot und Backwaren, Soßen, Suppen und Süßwaren. Durch pH-Wert Senkung kommt auch eine Verwendung als Konservierungsmittel in Betracht. Ferner kommt es in Kombination mit verschiedenen Fruchtsäuren (Äpfelsäure, Citronensäure, Weinsäure usw.) in Kartoffelchips der Geschmacksrichtung „Salt & Vinegar“ als Zutat vor. ⓘ
Auch in Kosmetika wird Natriumacetat zuweilen verwendet, dort neben der Funktion als Puffer auch zur Maskierung des Grundgeruchs. ⓘ
Aus übersättigter Natriumacetatlösung lassen sich zu Demonstrationsversuchen einfach Kristalle herstellen, die Eisbergen ähneln. Hierfür werden Impfkristalle auf den Boden eines Becherglases gelegt und langsam mit einer übersättigten Natriumacetatlösung begossen. Es bilden sich sofort Kristalle und häufen sich zu einem eisbergähnlichen Turm auf. ⓘ
Das sogenannte „Instant-Ice“ basiert auf demselben Prinzip. Man füllt ein (durchsichtiges) Gefäß mit der Lösung auf und berührt mit der Fingerspitze die Oberfläche der Lösung. Diese kristallisiert sofort aus und wird fest wie Eis. (Die Fingerspitze ersetzt hier den Impfkristall.) ⓘ
Die Kristallisation des Natriumacetats ist stark exotherm, so dass hierbei viel Energie in Form von Wärme frei wird. Sie wird in Wärmekissen genutzt, wobei das Trihydrat in regenerierbaren Handwärmern als Latentwärmespeicher dient. ⓘ
Natriumacetat wird auch in Heizkissen, Handwärmern und heißem Eis verwendet. Natriumacetat-Trihydrat-Kristalle schmelzen bei 58-58,4 °C (136,4-137,1 °F) und lösen sich in ihrem Kristallwasser auf. Wenn man sie über den Schmelzpunkt hinaus erhitzt und anschließend abkühlen lässt, wird die wässrige Lösung übersättigt. Diese Lösung kann auf Raumtemperatur abkühlen, ohne Kristalle zu bilden. Durch Druck auf eine Metallscheibe im Heizkissen entsteht ein Keimbildungszentrum, das die Lösung wieder zu festem Natriumacetat-Trihydrat kristallisiert. Der bindungsbildende Prozess der Kristallisation ist exotherm. Die latente Schmelzwärme beträgt etwa 264-289 kJ/kg. Im Gegensatz zu anderen Arten von Wärmepaketen, die auf irreversiblen chemischen Reaktionen beruhen, kann ein Natriumacetat-Wärmepaket problemlos wiederverwendet werden, indem man das Paket einige Minuten lang in kochendes Wasser taucht, bis sich die Kristalle vollständig aufgelöst haben, und es dann langsam auf Raumtemperatur abkühlen lässt. ⓘ
Herstellung

Für den Laborgebrauch ist Natriumacetat preiswert und wird in der Regel nicht synthetisiert, sondern gekauft. Es wird manchmal in einem Laborexperiment durch die Reaktion von Essigsäure, üblicherweise in einer 5-8%igen Lösung, die als Essig bekannt ist, mit Natriumcarbonat ("Waschsoda"), Natriumbicarbonat ("Backsoda") oder Natriumhydroxid ("Lauge" oder "Ätznatron") hergestellt. Bei jeder dieser Reaktionen entstehen Natriumacetat und Wasser. Wenn eine Natrium- und Karbonationen enthaltende Verbindung als Reaktant verwendet wird, reagiert das Karbonatanion von Natriumbikarbonat oder -karbonat mit dem Wasserstoff der Carboxylgruppe (-COOH) in Essigsäure und bildet Kohlensäure. Kohlensäure zersetzt sich unter normalen Bedingungen leicht in gasförmiges Kohlendioxid und Wasser. Dies ist die Reaktion, die in dem bekannten "Vulkan" stattfindet, der entsteht, wenn die Haushaltsprodukte Backpulver und Essig zusammengebracht werden.
- CH3COOH + NaHCO3 → CH3COONa + H2CO
3 - H2CO
3 → CO
2 + H
2O ⓘ
Industriell wird Natriumacetat-Trihydrat durch Reaktion von Essigsäure mit Natriumhydroxid unter Verwendung von Wasser als Lösungsmittel hergestellt.
- CH3COOH + NaOH → CH3COONa + H2O ⓘ
Im Labormaßstab kann es z. B. durch Reaktion von Natriumcarbonat (Soda) und Essigsäure gewonnen werden:
Ebenso z. B. durch Neutralisation von Natronlauge mit Essigsäure:
Struktur
Die Kristallstruktur von wasserfreiem Natriumacetat ist als abwechselnde Natriumcarboxylat- und Methylgruppenschichten beschrieben worden. Die Struktur von Natriumacetat-Trihydrat besteht aus einer verzerrten oktaedrischen Koordination des Natriums. Benachbarte Oktaeder teilen sich die Kanten und bilden eindimensionale Ketten. Zweidimensionale Wasserstoffbrückenbindungen zwischen Acetat-Ionen und Hydratationswasser verbinden die Ketten zu einem dreidimensionalen Netzwerk. ⓘ
| Grad der Hydratation | Na-Koordination | Stark gebundene Aggregation | Schwach gebundene Aggregation |
|---|---|---|---|
| Wasserfrei | 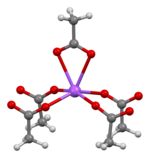
|
 2D-Blatt |
 Blätter gestapelt mit hydrophobe Oberflächen in Kontakt |
| Trihydrat | 
|
 1D-Kette |
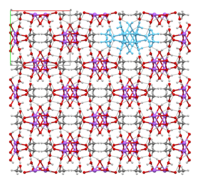 durch Wasserstoffbrückenbindungen verbundene Ketten (eine Kette ist hellblau hervorgehoben) |
Reaktionen
Natriumacetat kann zur Bildung eines Esters mit einem Alkylhalogenid wie Bromethan verwendet werden:
- CH3COONa + BrCH2CH3 → CH3COOCH2CH3 + NaBr ⓘ
Natriumacetat wird unter forcierten Bedingungen (Pyrolyse in Gegenwart von Natriumhydroxid) zu Methan (CH4) decarboxyliert:
- CH3COONa + NaOH → CH4 + Na2CO3 ⓘ
Calciumoxid ist der typische Katalysator für diese Reaktion. Cäsiumsalze katalysieren diese Reaktion ebenfalls. ⓘ
Als Latentwärmespeicher
In umgerüsteten Tankcontainern, die Natriumacetat als Latentwärmespeicher enthalten, können bis zu 2,5 MWh Wärme pro 20-Fuß-ISO-Container (ca. 33 m³) transportiert werden, das entspricht ca. 75 kWh pro m³. So kann beispielsweise die Abwärme von Blockheizkraftwerken nutzbar gemacht werden. ⓘ



