Menthol
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugter IUPAC-Name
5-Methyl-2-(propan-2-yl)cyclohexan-1-ol | |||
| Andere Bezeichnungen
2-Isopropyl-5-methylcyclohexan-1-ol
2-Isopropyl-5-Methylcyclohexanol 3-p-Menthanol Hexahydrothymol Menthomenthol Pfefferminz-Kampfer | |||
| Kennzeichnungsmittel | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII |
| ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C10H20O | ||
| Molekulare Masse | 156,269 g-mol-1 | ||
| Erscheinungsbild | Weißer oder farbloser kristalliner Feststoff | ||
| Dichte | 0,890 g-cm-3, fest (racemisches oder (-)-Isomer) | ||
| Schmelzpunkt | 36-38 °C (97-100 °F; 309-311 K) racemisch 42-45 °C, (-)-Isomer, α-kristalline Form | ||
| Siedepunkt | 214,6 °C (418,3 °F; 487,8 K) | ||
Löslichkeit in Wasser
|
Schwach löslich, (-)-Isomer | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
reizend, entzündlich | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|

| ||
Signalwort
|
Warnhinweis | ||
Gefahrenhinweise
|
H315, H319 | ||
Sicherheitshinweise
|
P264, P280, P302+P352, P305+P351+P338, P332+P313, P337+P313, P362 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 93 °C (199 °F; 366 K) | ||
| Sicherheitsdatenblatt (SDS) | Externes SDB | ||
| Verwandte Verbindungen | |||
Verwandte Alkohole
|
Cyclohexanol, Pulegol, Dihydrocarveol, Piperitol | ||
Verwandte Verbindungen
|
Menthone, Menthen, Thymol, p-Cymen, Citronellal | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
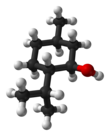
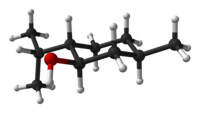
Menthol ist eine organische Verbindung, genauer gesagt ein Monoterpenoid, das synthetisch hergestellt oder aus den Ölen von Krauseminze, Pfefferminze oder anderen Minzen gewonnen wird. Es handelt sich um eine wachsartige, klare oder weiße kristalline Substanz, die bei Raumtemperatur fest ist und leicht darüber schmilzt. ⓘ
Die in der Natur vorkommende Hauptform von Menthol ist (-)-Menthol, dem die (1R,2S,5R)-Konfiguration zugeordnet ist. Menthol hat lokalanästhetische und reizlindernde Eigenschaften und wird häufig zur Linderung von leichten Halsreizungen verwendet. Menthol wirkt auch als schwacher κ-Opioidrezeptor-Agonist. ⓘ
Im Jahr 2017 war es mit mehr als zwei Millionen Verschreibungen das 193. am häufigsten verschriebene Medikament in den Vereinigten Staaten. ⓘ
Das natürliche, linksdrehende (−)-Menthol kommt in vielen ätherischen Ölen, besonders in Minzölen, vor. ⓘ
Struktur
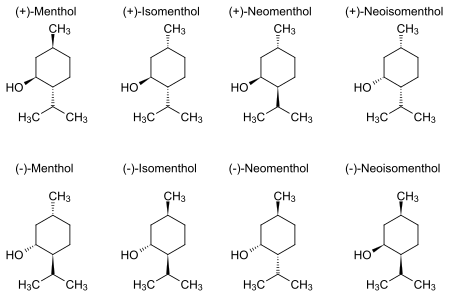
Natürliches Menthol liegt in einem reinen Stereoisomer vor, fast immer in der (1R,2S,5R)-Form (untere linke Ecke des Diagramms unten). Die acht möglichen Stereoisomere sind:
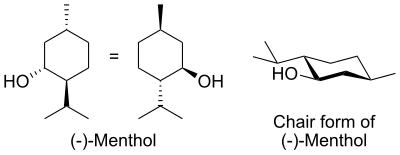
In der natürlichen Verbindung befindet sich die Isopropylgruppe in trans-Orientierung sowohl zur Methyl- als auch zur Hydroxylgruppe. Sie kann also auf jede der gezeigten Weisen gezeichnet werden:
Die (+)- und (-)-Enantiomere von Menthol sind aufgrund ihrer Cyclohexan-Konformation die stabilsten unter ihnen. Da sich der Ring selbst in einer Stuhlkonformation befindet, können sich alle drei sperrigen Gruppen in äquatorialen Positionen orientieren. ⓘ
Die beiden Kristallformen von racemischem Menthol haben Schmelzpunkte von 28 °C und 38 °C. Reines (-)-Menthol hat vier Kristallformen, von denen die α-Form, die bekannten breiten Nadeln, am stabilsten ist. ⓘ
Verwendung


Die Fähigkeit von Menthol, die kälteempfindlichen TRPM8-Rezeptoren in der Haut chemisch auszulösen, ist für das bekannte kühlende Gefühl verantwortlich, das es hervorruft, wenn es eingeatmet, gegessen oder auf die Haut aufgetragen wird. In diesem Sinne ähnelt Menthol dem Capsaicin, der Chemikalie, die für die Schärfe von scharfen Chilis verantwortlich ist (die ebenfalls die Wärmesensoren anregt, ohne eine tatsächliche Temperaturveränderung zu verursachen). ⓘ
Die schmerzlindernden Eigenschaften von Menthol werden durch eine selektive Aktivierung der κ-Opioidrezeptoren vermittelt. Menthol blockiert Kalziumkanäle und spannungsempfindliche Natriumkanäle und verringert so die neuronale Aktivität, die die Muskeln stimulieren kann. ⓘ
Einige Studien zeigen, dass Menthol als positiver allosterischer Modulator des GABAA-Rezeptors wirkt und die gabaerge Übertragung in PAG-Neuronen erhöht. Menthol hat auch ähnliche anästhetische Eigenschaften wie Propofol, da es die gleichen Stellen des GABAA-Rezeptors moduliert. ⓘ
Menthol wird in der Zahnpflege häufig als topisches antibakterielles Mittel verwendet, das gegen verschiedene Arten von Streptokokken und Laktobazillen wirkt. Menthol senkt auch den Blutdruck und wirkt der Vasokonstriktion durch Aktivierung des TRPM8 entgegen. ⓘ
Menthol wird in verschiedensten Produkten als desinfizierender Bestandteil sowie als Duft- und Aromastoff zugesetzt, so etwa in Süßwaren (0,05–0,1 %) und Likör (0,1–0,2 %), Parfüm (0,05–0,4 %), Körperpflege-, Zahn- und Mundpflegemitteln (0,5–2,0 %), Lotionen (0,2–0,3 %) und Haarwässern (0,2–0,5 %). ⓘ
Medizinisch ist Menthol Bestandteil von Salben (bis zu 6 %) und Einreibemitteln gegen Hautirritationen bei leichten Verbrennungen, Insektenstichen oder Juckreiz. Es wirkt am Kälte-Menthol-Rezeptor (TRPM8). Daher erzeugt Menthol ein kühles Gefühl beim Auftragen auf die Haut, ohne jedoch tatsächlich die Körpertemperatur zu beeinflussen. Bei Reizung nasaler Kälterezeptoren entsteht das Gefühl einer erleichterten Atmung. ⓘ
Außerdem wirkt Menthol als schwacher Agonist am κ-Opioid-Rezeptor (KOR). ⓘ
In der Bienenpflege dient Menthol als Mittel gegen Milbenbefall. ⓘ
Tabakprodukte
Tabakprodukten wird Menthol seit den 1920er Jahren zugesetzt. Es vermindert beim Inhalieren des Rauches das Reiz- und Schmerzempfinden im Atemtrakt. Es verändert die Dichte von Nikotinrezeptoren im Zentralnervensystem. Zusätzlich verändert es den Metabolismus von Nikotin und erhöht dessen Bioverfügbarkeit. Es verstärkt die Nikotinsucht. EU-weit ist das Inverkehrbringen von Tabakerzeugnissen mit Mentholzusatz seit dem 20. Mai 2020 verboten; Hülsen mit Menthol-Aroma sind weiterhin erlaubt. ⓘ
Vorkommen
Aus Ackerminze (Mentha arvensis L.) wird in Japan seit dem 17. Jahrhundert Pfefferminzöl gewonnen. Dieses enthält (−)-Menthol als Hauptbestandteil. ⓘ
Von den Isomeren kommt (−)-Menthol in der Natur am häufigsten vor. Man findet es im ätherischen Öl von Pflanzen der Gattung Mentha; im „Japanischen Pfefferminzöl“ aus in Japan oder China angebauter Ackerminze (Mentha arvensis) sind bis zu 90 % enthalten. Auch im Öl der Pfefferminze (Mentha piperita) ist (−)-Menthol die Hauptkomponente. Menthole finden sich auch in anderen Gattungen und Arten der Familie der Lippenblütler (Labiatae), so in der Krause Minze, dem Arabischen Bergkraut (Micromeria fruticosa), und den Gewürzpflanzen Estragon (Artemisia dracunculus), Basilikum (Ocimum basilicum), Majoran (Origanum majorana), Oregano (Origanum vulgare), Rosmarin (Rosmarinus officinalis), Salbei (Salvia) und Thymianen (Thymus), aber auch in Bittermelonen (Momordica charantia), und Sonnenblumen (Helianthus annuus). (+)-Menthol kommt in hoher Konzentration in der Polei-Minze (Mentha pulegium) vor. (+)-Neomenthol findet sich im japanischen Pfefferminzöl, (−)-Neoisomenthol mit bis zu einem Prozent im Geraniumöl. ⓘ
Polei-Minze ⓘ
Mentha arvensis (Wilde Minze) ist die wichtigste Minzart, die zur Herstellung von natürlichen Mentholkristallen und Mentholflocken verwendet wird. Diese Art wird hauptsächlich in der Region Uttar Pradesh in Indien angebaut. ⓘ
Biosynthese
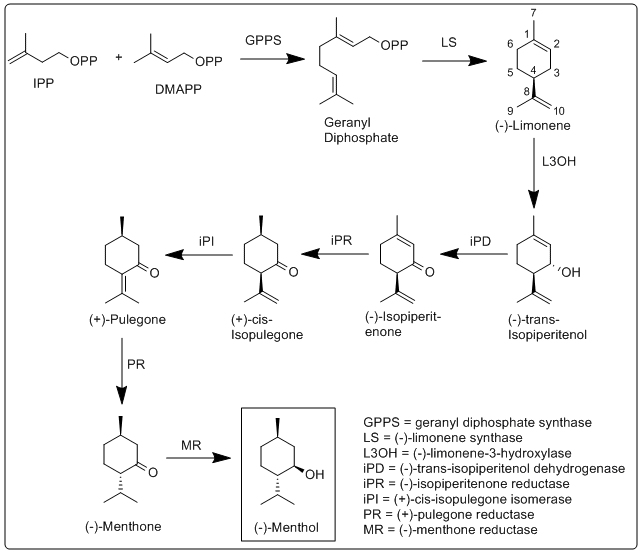
Die Biosynthese von Menthol wurde in Mentha × piperita untersucht und die daran beteiligten Enzyme wurden identifiziert und charakterisiert. Sie beginnt mit der Synthese des Terpens Limonen, gefolgt von Hydroxylierung und mehreren Reduktions- und Isomerisierungsschritten. ⓘ
Genauer gesagt findet die Biosynthese von (-)-Menthol in den sekretorischen Drüsenzellen der Pfefferminzpflanze statt. Die Geranyldiphosphat-Synthase (GPPS) katalysiert zunächst die Reaktion von IPP und DMAPP zu Geranyldiphosphat. Anschließend katalysiert die (-)-Limonensynthase (LS) die Zyklisierung von Geranyldiphosphat zu (-)-Limonen. (-)-Limonen-3-Hydroxylase (L3OH) katalysiert dann mit Hilfe von O2 und NADPH die allylische Hydroxylierung von (-)-Limonen an der 3-Position zu (-)-trans-Isopiperitenol. (-)-trans-Isopiperitenol-Dehydrogenase (iPD) oxidiert die Hydroxylgruppe an der 3-Position mit Hilfe von NAD+ weiter zu (-)-Isopiperitenon. (-)-Isopiperitenon-Reduktase (iPR) reduziert dann die Doppelbindung zwischen den Kohlenstoffen 1 und 2 unter Verwendung von NADPH, um (+)-cis-Isopulegon zu bilden. Die (+)-cis-Isopulegon-Isomerase (iPI) isomerisiert dann die verbleibende Doppelbindung zu (+)-Pulegon. Die (+)-Pulegon-Reduktase (PR) reduziert dann diese Doppelbindung mit Hilfe von NADPH zu (-)-Menthone. Die (-)-Menthone-Reduktase (MR) reduziert dann die Carbonylgruppe mit Hilfe von NADPH zu (-)-Menthol. ⓘ
Herstellung
Natürliches Menthol wird durch Gefrieren von Pfefferminzöl gewonnen. Die dabei entstehenden Mentholkristalle werden anschließend durch Filtration abgetrennt. ⓘ
Die weltweite Gesamtproduktion von Menthol belief sich 1998 auf 12.000 Tonnen, von denen 2.500 Tonnen synthetisch hergestellt wurden. Im Jahr 2005 war die Jahresproduktion von synthetischem Menthol fast doppelt so hoch. Die Preise liegen im Bereich von 10-20 $/kg mit Spitzenwerten in der Region von 40 $/kg, haben aber auch schon 100 $/kg erreicht. Im Jahr 1985 wurde geschätzt, dass China den größten Teil des weltweiten Angebots an natürlichem Menthol produzierte, obwohl es den Anschein hat, dass Indien China auf den zweiten Platz verdrängt hat. ⓘ
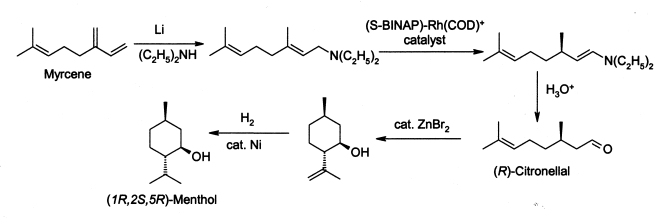
Menthol wird als einzelnes Enantiomer (94 % e.e.) in einer Größenordnung von 3.000 Tonnen pro Jahr von der Takasago International Corporation hergestellt. Das Verfahren beruht auf einer asymmetrischen Synthese, die von einem Team unter der Leitung von Ryōji Noyori entwickelt wurde, der für seine Arbeit an diesem Verfahren 2001 den Nobelpreis für Chemie erhielt:
Das Verfahren beginnt mit der Bildung eines allylischen Amins aus Myrcen, das in Gegenwart eines BINAP-Rhodiumkomplexes eine asymmetrische Isomerisierung durchläuft, um (nach Hydrolyse) enantiomerenreines R-Citronellal zu erhalten. Dieses wird durch eine mit Zinkbromid eingeleitete Carbonyl-En-Reaktion zu Isopulegol [de] cyclisiert, das dann zu reinem (1R,2S,5R)-Menthol hydriert wird. ⓘ
Ein weiteres kommerzielles Verfahren ist das Haarmann-Reimer-Verfahren (nach der Firma Haarmann & Reimer, die heute zu Symrise gehört). Dieses Verfahren geht von m-Kresol aus, das mit Propen zu Thymol alkyliert wird. Diese Verbindung wird in der nächsten Stufe hydriert. Racemisches Menthol wird durch fraktionierte Destillation isoliert. Die Enantiomere werden durch chirale Trennung in Reaktion mit Methylbenzoat, selektive Kristallisation und anschließende Hydrolyse getrennt. ⓘ
Racemisches Menthol kann auch durch Hydrierung von Thymol, Menthon oder Pulegon hergestellt werden. In beiden Fällen ist es möglich, das L-Enantiomer durch eine weitere Verarbeitung (kristallisierende Auftrennung des Menthylbenzoatkonglomerats) zu konzentrieren, was jedoch weniger effizient ist, obwohl die höheren Verarbeitungskosten durch niedrigere Rohstoffkosten ausgeglichen werden können. Ein weiterer Vorteil dieses Verfahrens besteht darin, dass D-Menthol als chiraler Hilfsstoff neben dem üblicherweise verwendeten L-Antipode kostengünstig zur Verfügung steht. ⓘ
Jährlich werden weltweit über 19.000 Tonnen (−)-Menthol hergestellt, wobei etwa zwei Drittel aus Pflanzen gewonnen und ein Drittel synthetisch hergestellt werden. Die pflanzliche Gewinnung erfolgt durch Ausfrieren des kristallinen Menthols aus dem etherischen Öl der Ackerminze. Die technische Synthese des (−)-Menthols erfolgt aktuell nach verschiedenen Verfahren bei den Firmen Symrise (vormals Haarmann & Reimer, ab 1973), Takasago (ab 1984) und BASF (ab 2012). ⓘ
Das Bild zeigt eine technische Synthese des (−)-Menthols. Sie geht vom Citronellal (1) aus, dem Zinkbromid zugefügt wird. In einer Carbonyl-En-Reaktion wird es zum Isopulegol (2) umgewandelt. Dieses wird an Nickelkatalysatoren zum Menthol (3) hydriert. Dies ist aber nur eine von vielen Menthol-Synthesen: Menthol lässt sich auch ausgehend vom Pulegon, Phellandren, 3-Caren, Pinen, Limonen, Myrcen, Piperiton oder durch Hydrierung vom Thymol beziehungsweise dem Kresol synthetisieren. ⓘ
Anwendungen
Menthol ist in vielen Produkten enthalten, und zwar aus den unterschiedlichsten Gründen. Dazu gehören:
- In rezeptfreien Produkten zur kurzfristigen Linderung von leichten Halsschmerzen und leichten Reizungen im Mund- und Rachenraum.
- Beispiele: Lippenbalsam und Hustenmittel.
- Als Juckreizstillendes Mittel zur Linderung von Juckreiz.
- Als örtliches Analgetikum wird es zur Linderung kleinerer Schmerzen wie Muskelkrämpfe, Verstauchungen, Kopfschmerzen und ähnlicher Beschwerden verwendet, allein oder in Kombination mit Chemikalien wie Kampfer, Eukalyptusöl oder Capsaicin. In Europa wird es in der Regel als Gel oder Creme angeboten, während in den USA sehr häufig Pflaster und Körperumschläge verwendet werden.
- Beispiele: Tiger Balm, IcyHot-Pflaster oder Knie-/Ellenbogenmanschetten.
- Als Penetrationsverstärker bei der transdermalen Verabreichung von Medikamenten.
- In abschwellenden Mitteln für Brust und Nasennebenhöhlen (Creme, Pflaster oder Naseninhalator).
- Beispiele: Axe Brand, Vicks VapoRub, Mentholatum, VapoRem, Mentisan.
- In bestimmten Medikamenten zur Behandlung von Sonnenbränden, da es ein kühlendes Gefühl vermittelt (dann oft in Verbindung mit Aloe).
- In Aftershave-Produkten zur Linderung von Rasurbrand.
- Als Zusatzstoff für Rauchtabak in einigen Zigarettenmarken, um den Geschmack zu verbessern und die durch das Rauchen verursachten Reizungen des Rachens und der Nebenhöhlen zu verringern. Menthol erhöht auch die Dichte der Nikotinrezeptoren, was das Suchtpotenzial von Tabakprodukten erhöht.
- Wird häufig in Mundhygieneprodukten und Mitteln gegen Mundgeruch verwendet, z. B. in Mundwasser, Zahnpasta, Mund- und Zungensprays, und allgemein als Geschmacksstoff für Lebensmittel, z. B. in Kaugummi und Süßigkeiten.
- Als Pestizid gegen Tracheenmilben von Honigbienen.
- In der Parfümerie wird Menthol zur Herstellung von Menthylestern verwendet, um blumige Noten (insbesondere Rose) zu betonen.
- In Erste-Hilfe-Produkten wie "Mineraleis" zur Erzeugung eines Kühleffekts als Ersatz für echtes Eis, wenn kein Wasser oder Strom vorhanden ist (Beutel, Körperpflaster/-ärmel oder Creme).
- In verschiedenen Pflastern, die von fiebersenkenden Pflastern auf der Stirn von Kindern bis hin zu "Fußpflastern" zur Linderung zahlreicher Beschwerden reichen (letztere sind in Asien, insbesondere in Japan, sehr viel häufiger und ausgefeilter: einige Varianten verwenden "funktionelle Vorsprünge" oder kleine Beulen, um die Füße zu massieren und sie gleichzeitig zu beruhigen und zu kühlen).
- In einigen Schönheitsprodukten wie Haarspülungen, die auf natürlichen Inhaltsstoffen basieren (z. B. St. Ives).
- Als krampflösendes und die glatte Muskulatur entspannendes Mittel bei der oberen gastrointestinalen Endoskopie. ⓘ
In der organischen Chemie wird Menthol als chiraler Hilfsstoff in der asymmetrischen Synthese verwendet. So können z. B. aus Sulfinylchloriden und Menthol hergestellte Sulfinatester durch Reaktion mit Organolithiumreagenzien oder Grignard-Reagenzien zur Herstellung enantiomerenreiner Sulfoxide verwendet werden. Menthol reagiert mit chiralen Carbonsäuren zu diastereomischen Menthylestern, die für die chirale Trennung nützlich sind.
- Für den Hobbychemiker kann Menthol als Katalysator für die Herstellung von Natrium über das alkoholkatalysierte Magnesiumreduktionsverfahren verwendet werden.
- Menthol ist potenziell ergogen (leistungssteigernd) für sportliche Leistungen in heißer Umgebung. ⓘ
Reaktionen
Menthol reagiert in vielerlei Hinsicht wie ein normaler sekundärer Alkohol. Es wird durch Oxidationsmittel wie Chromsäure oder Dichromat zu Menthon oxidiert, wobei die Oxidation unter bestimmten Bedingungen weiter gehen und den Ring aufbrechen kann. Menthol lässt sich mit 2 %iger Schwefelsäure leicht dehydratisieren, wobei hauptsächlich 3-Menthen entsteht. Mit Phosphorpentachlorid (PCl5) erhält man Menthylchlorid. ⓘ
Geschichte
Im Westen wurde Menthol erstmals 1771 von dem Deutschen Hieronymus David Gaubius isoliert. Frühe Charakterisierungen wurden von Oppenheim, Beckett, Moriya und Atkinson vorgenommen. Es wurde 1861 von F. L. Alphons Oppenheim (1833-1877) benannt. ⓘ
Kompendium-Status
- Pharmakopöe der Vereinigten Staaten 23
- Japanische Pharmakopöe 15
- Lebensmittelchemischer Codex ⓘ
Sicherheit
Die geschätzte tödliche Dosis für Menthol (und Pfefferminzöl) beim Menschen kann bei 50-500 mg/kg liegen (LD50 akut: 3300 mg/kg [Ratte]. 3400 mg/kg [Maus]. 800 mg/kg [Katze]). ⓘ
Es wurde über das Überleben nach Dosen von 8 bis 9 g berichtet. Überdosierungseffekte sind Bauchschmerzen, Ataxie, Vorhofflimmern, Bradykardie, Koma, Schwindel, Lethargie, Übelkeit, Hautausschlag, Zittern, Erbrechen, Schwindel. ⓘ
Eigenschaften und Isomerie
Bei Raumtemperatur ist Menthol ein farbloser, kristalliner Feststoff mit Pfefferminzgeruch. Die Symmetrie des Kristallgitters ist trigonal, die Kristalle sind nadelförmig. ⓘ
2-Isopropyl-5-methylcyclohexanol besitzt drei stereogene Zentren, deshalb gibt es acht Stereoisomere:
| Isomere von Menthol ⓘ | ||||||||
|---|---|---|---|---|---|---|---|---|
| Name | (+)-Menthol | (−)-Menthol | (+)-Isomenthol | (−)-Isomenthol | (+)-Neomenthol | (−)-Neomenthol | (+)-Neoisomenthol | (−)-Neoisomenthol |
| Andere Namen | D-Menthol | Levomenthol,
L-Menthol |
D-Isomenthol | L-Isomenthol | D-Neomenthol | L-Neomenthol | D-Neoisomenthol | L-Neoisomenthol |
| (±)-Menthol, DL-Menthol, Racementhol
[DL-(±)-Gemisch] |
DL-Isomenthol [DL-(±)-Gemisch] | DL-Isomenthol [DL-(±)-Gemisch] | DL-Neoisomenthol [DL-(±)-Gemisch] | |||||
| Strukturformel | 
|

|

|

|

|

|

|

|
| Stereozentren | 1S,2R,5S | 1R,2S,5R | 1S,2R,5R | 1R,2S,5S | 1S,2S,5R | 1R,2R,5S | 1R,2R,5R | 1S,2S,5S |
| Schmelzpunkt | 31, 33, 35 und 42,5–43 °C
(4 Modifikationen) |
82,5 °C | ? | -8 °C | ||||
| ? | 53,5–54,5 °C[DL-(±)-Gemisch] | 50–51 °C[DL-(±)-Gemisch] | 14 °C[DL-(±)-Gemisch] | |||||
| Siedepunkt | 212 °C | 96,2–96,8 °C(10 mmHg) | 102 °C(19 mmHg) | 105 °C(12 mmHg) | ||||
| ? | 218,5–218,6 °C[DL-(±)-Gemisch] | 212,1–212,6 °C[DL-(±)-Gemisch] | 81 °C(6 mmHg)[DL-(±)-Gemisch] | |||||
| Drehwert | 49,6°(Ethanol) | 25,9°(Ethanol) | 20,7°(Ethanol) | 2,2°(Ethanol) | ||||
| CAS-Nummer | 15356-60-2 | 2216-51-5 | 23283-97-8 | 20752-33-4 | 2216-52-6 | 20747-49-3 | 20752-34-5 | 64282-88-8 |
| 89-78-1 [DL-(±)-Gemisch] | 3623-52-7 [DL-(±)-Gemisch] | 3623-51-6 [DL-(±)-Gemisch] | 491-02-1 [DL-(±)-Gemisch] | |||||
Alle sind sekundäre, einwertige Alkohole: Das Molekül weist eine Hydroxygruppe auf; an das Kohlenstoffatom, an welches diese Hydroxygruppe gebunden ist, sind direkt nur zwei weitere Kohlenstoffatome gebunden. Der internationale Freiname (INN) des aus (−)-Menthol und (+)-Menthol im Enantiomerenverhältnis von 1:1 bestehenden Stoffes ist Racementhol. ⓘ
Die Geschmacksschwelle liegt zwischen 0,2 ppm für (−)-Menthol und 1 ppm für (+)-Menthol. ⓘ
Die Stereoisomere unterscheiden sich unter anderem im Geruch:
- (+)- und (−)-Menthol riechen frisch, minzig und süß und machen den typischen Pfefferminzgeruch aus, wobei der Geruch beim (−)-Menthol circa dreimal stärker ausgeprägt ist. ⓘ
- Die Enantiomere des Isomenthols und Neomenthols riechen eher dumpf und unangenehm. ⓘ
- (−)-Neoisomenthol riecht nach Campher, schal, süß, minzig; (+)-Neoisomenthol hat einen Geruch nach Campher, schal und nach Wald, es riecht hingegen nicht minzig, kühl und frisch. ⓘ
Isomenthol, Neomenthol und Neoisomenthol weisen auch keinen – beim Einatmen im Mund subjektiv gefühlten – Kühleffekt auf. ⓘ
Reaktionsfähigkeit
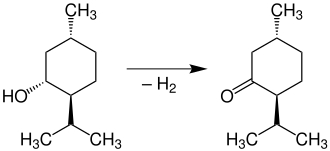
Die Oxidation von Menthol [im Bild (−)-Menthol] mit Chromsäure liefert Menthon [im Bild (−)-Menthon]:
Durch Einwirkung von konzentrierter Schwefelsäure wird Menthol [im Bild (−)-Menthol] zu Menthen dehydratisiert:
Verstoffwechselung
Die Verstoffwechselung des Menthols erfolgt hauptsächlich in der Leber durch Bildung von Mentholglucuronid. ⓘ