Mykoplasmen
| Mycoplasma ⓘ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
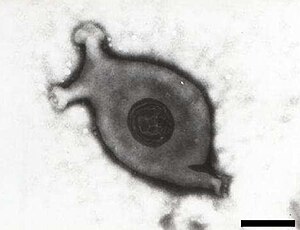
Mycoplasma gallisepticum | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Mycoplasma | ||||||||||||
| Nowak 1929 |
Der Ausdruck Mykoplasmen (Singular: Mykoplasma) ist die umgangssprachliche deutsche Bezeichnung für die sehr kleinen (0,2–0,3 µm) Vertreter der Klasse der Mollicutes (von lateinisch mollis „weich“ und cutis „Haut“, „die Weichhäutigen“). Im Gegensatz zu allen anderen Bakterien fehlt ihnen eine Zellwand. Sie leben aerob bis fakultativ anaerob und sind von vielgestaltiger (pleomorpher), veränderlicher, bläschenförmiger Gestalt. ⓘ
Mycoplasma (von altgriechisch μύκης mýkēs „Pilz“ sowie πλάσμα plásma „das Geformte“), ist eine Gattung der Mycoplasmataceae, der einzigen Familie der Ordnung Mycoplasmatales, welche zur Klasse der Mollicutes gehört (s. u.). ⓘ
Mykoplasmen (Mollicutes) sind meist parasitär, intra- und extrazellulär lebende Bakterien, die beim Menschen und Wirbeltieren die Ursache für zahlreiche Krankheiten sind. Wenige Arten sind Kommensalen oder opportunistische Krankheitserreger. Die erste Art wurde 1898 von kranken Rindern isoliert und beschrieben. Die häufig beobachteten pilzähnlichen Fadenformen waren namensprägend für die Gattung Mycoplasma. In der Humanmedizin gelang erst 1962 die Zuordnung der Art Mycoplasma pneumoniae zu einer Erkrankung. ⓘ
Mit einer Größe von 580–1.380 kbp haben die Gattungen Mycoplasma und Ureaplasma das kleinste Genom der zur Auto-Replikation befähigten Prokaryoten mit Ausnahme des Tiefsee-Archaeons Nanoarchaeum equitans (~500 kbp) und des in Blattflöhen lebenden Endosymbionten Carsonella ruddii (etwa 160 kbp). Ihr Genom weist meist einen relativen niedrigen Guanin-Cytosin (GC) Gehalt auf und ihre Zellmembran enthält Cholesterin, das sonst nur bei Eukaryoten gefunden wird. ⓘ
| Mykoplasmose ⓘ | |
|---|---|
| Fachgebiet | Infektionskrankheit |
Etymologie
Der Begriff "Mykoplasma", aus dem Griechischen μύκης, mykes (Pilz) und πλάσμα, Plasma (gebildet), wurde erstmals 1889 von Albert Bernhard Frank verwendet, um einen veränderten Zustand des Zytoplasmas von Pflanzenzellen zu beschreiben, der durch das Eindringen pilzähnlicher Mikroorganismen entstanden ist. Julian Nowak schlug später den Namen Mykoplasma für bestimmte fadenförmige Mikroorganismen vor, von denen man annimmt, dass sie sowohl zelluläre als auch azelluläre Stadien in ihrem Lebenszyklus haben, was erklären könnte, warum sie mit einem Mikroskop sichtbar sind, aber durch Filter hindurchgehen, die für andere Bakterien undurchlässig sind. Später wurden diese Mykoplasmen als pleuropneumonieähnliche Organismen (PPLO) bezeichnet, die in ihrer kolonialen Morphologie und Filtrierbarkeit dem Erreger (einer Mykoplasma-Art) der ansteckenden Rinderpleuropneumonie ähneln. Gegenwärtig werden alle diese Organismen als Mollicutes eingestuft, und der Begriff Mycoplasma bezieht sich ausschließlich auf die Gattung. ⓘ
Arten
- M. adleri
- M. agalactiae
- M. agassizii
- M. alkalesens
- M. alligatoris
- M. amphoriforme
- M. anatis
- M. anseris
- M. arginini
- M. arthritidis
- M. auris
- M. bovigenitalium
- M. bovirhinis
- M. bovis
- M. bovoculi
- M. buccale
- M. buteonis
- M. californicum
- M. canadense
- M. canis
- M. capricolum
- M. caviae
- M. cavipharyngis
- M. citelli
- M. cloacale
- M. coccoides
- M. collis
- M. columbinasale
- M. columbinum
- M. columborale
- M. conjunctivae
- M. corogypsi
- M. cottewii
- M. cricetuli
- M. crocodyli
- M. cynos
- M. dispar
- M. edwardii
- M. elephantis
- M. ellychniae
- M. equigenitalium
- M. equirhinis
- M. falconis
- M. fastidiosum
- M. faucium
- M. felifacium
- M. feliminutum
- M. feriruminatoris
- M. fermentans
- M. flocculare
- M. gallinaceum
- M. gallinarum
- M. gallisepticum
- M. gallopavonis
- M. gaeteae
- M. genitalium
- M. glycophilium
- M. gypis
- M. haemocanis
- M. haemofelis
- M. haemolamae
- M. haemomuris
- M. haemosuis
- M. hominis
- M. hyopneumoniae
- M. hypopharyngis
- M. hyorhinis
- M. hyosynoviae
- M. iguanae
- M. imitans
- M. incognitus
- M. indiense
- M. iners
- M. iowae
- M. lacutcae
- M. lagogenitalium
- M. leachii
- M. leonicptivi
- M. leopharyngis
- M. lipofaciens
- M. lipophilum
- M. lucivorax
- M. luminosum
- M. maculosum
- M. melaleucae
- M. meleagridis
- M. microti
- M. moatsii
- M. mobile
- M. molare
- M. muscosicanis
- M. muris
- M. mustelae
- M. mycoides
- M. neophronis
- M. neurolyticvum
- M. opalescens
- M. orale
- M. ovipneumoniae
- M. ovis
- M. oxoniensis
- M. penetrans
- M. phocae
- M. phocicerebrale
- M. phocidae
- M. phocirhinis
- M. pirum
- M. pneumoniae
- M. primatum
- M. pullorum
- M. pulmonis
- M. putrefaciens
- M. salivarium
- M. simbae
- M. spermatophilum
- M. spumans
- M. sturni
- M. sualvi
- M. subdolum
- M. suis
- M. synoviae
- M. testudineum
- M. testudinis
- M. verecunum
- M. wenyonii
- M. yeatsii ⓘ
Spezies, die Menschen infizieren
Andere als die unten aufgeführten Mycoplasma-Arten wurden beim Menschen nachgewiesen, es wird jedoch angenommen, dass sie von einem nicht-menschlichen Wirt übertragen wurden. Die folgenden Arten nutzen den Menschen als Primärwirt:
- M. amphoriforme
- M. buccale
- M. faucium
- M. fermentans
- M. genitalium
- M. hominis
- M. incognitus
- M. lipophilum
- M. orale
- M. penetrans
- M. pirum
- M. pneumoniae
- M. primatum
- M. salivarium
- M. spermatophilum ⓘ
Pathophysiologie
Mycoplasma-Arten wurden von Frauen mit bakterieller Vaginose isoliert. M. genitalium wird bei Frauen mit entzündlichen Beckenerkrankungen gefunden. Darüber hinaus ist die Infektion mit einem erhöhten Risiko für Gebärmutterhalsentzündung, Unfruchtbarkeit, Frühgeburt und Spontanabort verbunden. Mycoplasma genitalium hat eine Resistenz gegen einige Antibiotika entwickelt. Mycoplasma-Arten werden mit dem Atemnotsyndrom bei Säuglingen, bronchopulmonaler Dysplasie und intraventrikulären Blutungen bei Frühgeburten in Verbindung gebracht. ⓘ
Merkmale
Über 100 Arten wurden in die Gattung Mycoplasma aufgenommen, die zur Klasse der Mollicutes gehört. Sie sind Parasiten oder Kommensalen von Menschen, Tieren und Pflanzen. Die Gattung Mycoplasma nutzt Wirbeltiere und Arthropoden als Wirte. Es hat sich gezeigt, dass die Verfügbarkeit von Stickstoff in der Nahrung den Codon Bias und die Genomevolution bei Mycoplasma und Phytoplasma verändert. ⓘ
Mycoplasma-Arten gehören zu den kleinsten freilebenden Organismen (etwa 0,2 - 0,3 µm Durchmesser). Sie wurden in den Pleurahöhlen von Rindern gefunden, die an Pleuropneumonie leiden. Diese Organismen werden häufig als MLO (mycoplasma-like organisms) oder früher als PPLO (pleuropneumonia-like organisms) bezeichnet. ⓘ
Wichtige Merkmale der Mycoplasma-Arten
- Es gibt keine Zellwand, und die Plasmamembran bildet die äußere Begrenzung der Zelle.
- Aufgrund des Fehlens von Zellwänden können diese Organismen ihre Form verändern und sind pleomorph.
- Fehlen eines Zellkerns und anderer membrangebundener Organellen.
- Das genetische Material besteht aus einem einzigen DNA-Duplex und ist nackt.
- Ribosomen sind vom Typ 70S.
- Sie besitzen an einem Ende eine Replikationsscheibe, die den Replikationsprozess und die Trennung des genetischen Materials unterstützt.
- Heterotrophe Ernährung. Einige leben als Saprophyten, aber die meisten sind Parasiten von Pflanzen und Tieren. Der parasitäre Charakter ist auf die Unfähigkeit der Mykoplasmen zurückzuführen, den erforderlichen Wachstumsfaktor zu synthetisieren. ⓘ
Zell- und Koloniemorphologie
Aufgrund des Fehlens einer starren Zellwand können Mycoplasma-Arten (wie alle Mollicutes) ein breites Spektrum an Formen annehmen, von rund bis länglich. Sie sind pleomorph und können daher nicht als Stäbchen, Kokken oder Spirochäten identifiziert werden. ⓘ
Die Kolonien haben das typische "Spiegelei"-Erscheinungsbild (etwa 0,5 mm im Durchmesser). ⓘ
Vermehrung
1954 haben kontinuierliche Beobachtungen lebender Zellen mit Hilfe der Phasenkontrastmikroskopie gezeigt, dass Mycoplasma-Arten ("Mycoplasmen", früher als pleuropneumonia-ähnliche Organismen, PLO, bezeichnet, heute als Mollicutes klassifiziert) und L-Form-Bakterien (früher auch L-Phasen-Bakterien genannt) sich nicht durch binäre Spaltung vermehren, sondern durch einen ein- oder mehrpoligen Knospungsmechanismus. Es wurden Mikrofotografieserien von wachsenden Mikrokulturen verschiedener Stämme von PPLOs, L-Form-Bakterien und, als Kontrolle, einer Micrococcus-Art (die sich durch binäre Spaltung teilt) vorgestellt. Zusätzlich wurden elektronenmikroskopische Untersuchungen durchgeführt. ⓘ
Phylogenie
Die Gattung Mycoplasma zählt zur Familie der Mycoplasmataceae, welche zur Klasse der Mollicutes (umgangssprachlich Mykoplasmen) gehört. Die Klassifizierung dieser zellwandlosen, oft parasitischen oder endosymbiotischen Bakterien ist schwierig. Zunächst wurden die Mollicutes als Klasse in das Phylum (Stamm) Firmicutes gestellt, dann auf der Grundlage von 16S-rRNA-Analysen als eigenständiges Phylum Tenericutes abgetrennt (vgl. Systematik der Bakterien). Nach neuesten Genomvergleichen allerdings werden sie wieder den Firmicutes zugeordnet. ⓘ
Ein gemeinsames Merkmal der Klasse Mollicutes (Weichhäuter) und damit auch der Mykoplasmen ist das Fehlen einer Zellwand und die damit einhergehende Anfälligkeit für osmotische Schwankungen des umgebenden Mediums. Antibiotika, die an der Zellwand ansetzen (z. B. Penicilline) sind praktisch unwirksam gegen sie. Aufgrund der geringen Größe der Mykoplasmen lassen sie sich, im Gegensatz zu anderen Bakterien, nicht durch Sterilfilter mit einer nominalen Porengröße von 0,22 µm zurückhalten. Molekular-phylogenetische rRNA-Untersuchungen ergaben, dass die Mollicutes nicht an der Basis des bakteriellen phylogenetischen Baums stehen, sondern vielmehr durch degenerative Evolution aus Gram-positiven Bakterien der Lactobacillus-Gruppe mit einem niedrigen GC-Gehalt der DNA hervorgegangen sind. Im Zuge dieser degenerativen Evolution haben die Mollicutes einen erheblichen Teil ihrer genetischen Information verloren, so dass sie heute zu den Lebewesen mit dem kleinsten bekannten Genom zählen (Mollicutes: 580–2.300 kbp, E. coli: 4.500 kbp, Arabidopsis thaliana: 100.000 kbp, Homo sapiens: 3.400.000 kbp). Bakterien der Klasse Mollicutes leben nicht als freie Bakterien, sondern sind entweder auf eine Wirtszelle oder einen Wirtsorganismus angewiesen. ⓘ
Als Parasiten oder Kommensalen erhalten sie vom Wirtsorganismus essentielle Stoffwechselkomponenten wie z. B. Fettsäuren, Aminosäuren und Vorstufen der Nukleinsäuren. Die Möglichkeit zur Verkleinerung des Genoms wird auf die parasitäre Lebensweise der Mollicutes zurückgeführt. Für das Wachstum einiger Vertreter der Mollicutes ist auch Cholesterin erforderlich, eine Komponente, die normalerweise nicht in Bakterien gefunden wird und deren Synthesevorstufen ebenfalls von den Wirtszellen zur Verfügung gestellt wird. ⓘ
Früher wurden Mycoplasma-Spezies (oft als Mycoplasmen" bezeichnet, heute als Mollicutes" klassifiziert) manchmal als stabile L-förmige Bakterien oder sogar als Viren angesehen, aber phylogenetische Analysen haben sie als Bakterien identifiziert, die im Laufe der Evolution ihre Zellwände verloren haben. ⓘ
Verunreinigung im Labor
Mycoplasma-Arten werden in Forschungslabors häufig als Kontaminanten in Zellkulturen gefunden. Die Kontamination von Zellkulturen mit Mykoplasmen ist auf die Verunreinigung durch Personen oder kontaminierte Bestandteile des Zellkulturmediums zurückzuführen. Mykoplasmenzellen sind physikalisch gesehen klein - weniger als 1 µm - und daher mit einem herkömmlichen Mikroskop nur schwer zu erkennen. ⓘ
Mykoplasmen können zelluläre Veränderungen hervorrufen, einschließlich Chromosomenaberrationen, Veränderungen des Stoffwechsels und des Zellwachstums. Schwere Mykoplasmeninfektionen können eine Zelllinie zerstören. Zu den Nachweismethoden gehören DNA-Sonden, Enzym-Immunoassays, PCR, Ausplattieren auf empfindlichem Agar und Anfärben mit einem DNA-Farbstoff wie DAPI oder Hoechst. ⓘ
Schätzungsweise 11 bis 15 % der Zellkulturen in US-Labors sind mit Mykoplasmen kontaminiert. Eine Corning-Studie ergab, dass die Hälfte der US-Wissenschaftler ihre Zellkulturen nicht auf Mycoplasma-Kontamination untersucht. Die Studie stellte auch fest, dass in der ehemaligen Tschechoslowakei 100 % der nicht routinemäßig getesteten Zellkulturen kontaminiert waren, während nur 2 % der routinemäßig getesteten Kulturen kontaminiert waren (Studie S. 6). Da die Kontaminationsrate in den USA auf einer Studie mit Unternehmen beruht, die routinemäßig auf Mykoplasmen testen, könnte die tatsächliche Kontaminationsrate höher sein. In Europa ist die Kontaminationsrate höher, und in anderen Ländern ist sie noch höher (bis zu 80 % der japanischen Zellkulturen). Etwa 1 % der im Gene Expression Omnibus veröffentlichten Daten sind möglicherweise kontaminiert. Im Laufe der Jahre wurden mehrere antibiotikahaltige Formulierungen von Antimykoplasmen-Reagenzien entwickelt. ⓘ
Neben ihrer klinischen Bedeutung sind Mykoplasmen (hauptsächlich Mycoplasma orale) auch die gefährlichsten Kontaminationen in der normalen Zellkultur. Da sie lichtmikroskopisch wegen ihrer geringen Größe nur schwer zu erkennen sind und weil sie gegen Standardantibiotika resistent sind, bleiben sie oft unerkannt und beeinflussen so das zelluläre Wachstum und die Ergebnisse. ⓘ
Minimalgenom und synthetische Biologie
- Mycoplasma pneumoniae ist wichtigster Erreger der so genannten „atypischen Pneumonie“. Aber auch Tracheobronchitis, Pharyngitis, Meningitis, Mittelohrentzündungen und weitere Krankheitsbilder können von Mycoplasma pneumoniae verursacht werden. Zudem wird der Organismus mit Störungen des hämatopoetischen (blutbildenden) Systems, des zentralen Nervensystems, der Leber und Bauchspeicheldrüse sowie kardiovaskulären Syndromen in Verbindung gebracht.
- Mycoplasma genitalium ist neben Chlamydia trachomatis ein wichtiger Erreger der so genannten „non-gonococcal-Urethritis“, einer nicht durch Neisseria gonorrhoeae (den sog. „Gonokokken“) verursachten Harnröhren-Entzündung. Anfang 2008 berichtete eine Forschergruppe um Craig Venter, ihr sei es gelungen, erstmals das Erbmaterial eines Bakteriums komplett synthetisch herzustellen. Vorbild für den Nachbau des Genoms sei Mycoplasma genitalium gewesen; der Name des synthetischen Nachbaus ist Mycoplasma genitalium JCVI-syn1.0 (ursprünglich JCVI-1.0).
- Mycoplasma hominis verursacht z. B. Pyelonephritis, Endometritis und postpartales Fieber
- Mycoplasma fermentans spielt u. a. möglicherweise als ein Faktor bei der Entstehung der Symptome einer HIV-Infektion eine Rolle. Außerdem gibt es Berichte über eine mögliche Beteiligung bei der Entstehung der Symptome des „chronic fatigue syndrome“ (CFS) und dem eventuell auf dem CFS beruhenden „Golfkriegssyndrom“. ⓘ
Ein 2010 von Craig Venter und Kollegen vom JCVI chemisch synthetisiertes Genom einer Mycoplasma-Zelle, das vollständig auf synthetischer DNA basiert und sich selbst replizieren kann, wurde als ‚Mycoplasma laboratorium‘ (Arbeitstitel, kein Taxon) bezeichnet. Am 24. März 2016 veröffentlichte das JCVI Ergebnisse, wonach er ein synthetisches Bakterium Mycoplasma mycoides JCVI-syn3.0 mit 473 Genen, beziehungsweise 531.000 Basenpaaren, geschaffen hat, die es benötigt, um alle lebenswichtigen Prozesse durchzuführen (Minimalgenom). ⓘ
Pathogenität
Das P1-Antigen ist der wichtigste Virulenzfaktor von Mykoplasmen. P1 ist ein membranassoziiertes Protein, das die Adhäsion an Epithelzellen ermöglicht. Der P1-Rezeptor wird auch auf Erythrozyten exprimiert, was zu einer Autoantikörper-Agglutination bei Mykoplasmen-Infektionen führen kann. Mehrere Mykoplasmenarten können Krankheiten verursachen, darunter M. pneumoniae, das eine wichtige Ursache für atypische Lungenentzündungen ist (früher als "Wanderpneumonie" bezeichnet), und M. genitalium, das mit entzündlichen Beckenerkrankungen in Verbindung gebracht wird. Mycoplasma-Infektionen beim Menschen sind in 17 % der Fälle mit Hautausschlägen verbunden. ⓘ
Sexuell übertragbare Infektionen
Mycoplasma- und Ureaplasma-Arten sind nicht Teil der normalen Vaginalflora. Einige Mykoplasmenarten werden durch sexuellen Kontakt übertragen. ⓘ
Unfruchtbarkeit
Einige Mycoplasma-Spezies haben negative Auswirkungen auf die Fruchtbarkeit. M. hominis verursacht männliche Sterilität/Genitalentzündung beim Menschen. ⓘ
Säuglingssterblichkeit
Frühgeborene mit niedrigem Geburtsgewicht sind anfällig für Mycoplasma-Infektionen. ⓘ
Verbindungen zu Krebs
Mehrere Mykoplasmenarten werden häufig in verschiedenen Arten von Krebszellen nachgewiesen. Diese Arten sind:
- M. fermentans
- M. genitalium
- M. hyorhinis
- M. penetrans
- U. urealyticum ⓘ
Die meisten dieser Mykoplasmenarten haben in vitro eine starke Korrelation mit der bösartigen Transformation von Säugetierzellen gezeigt. ⓘ
Mykoplasmeninfektion und Wirtszelltransformation
Das Vorhandensein von Mykoplasmen wurde erstmals in den 1960er Jahren in Proben von Krebsgewebe nachgewiesen. Seitdem wurde in mehreren Studien versucht, einen Zusammenhang zwischen Mykoplasmen und Krebs zu finden und nachzuweisen, wie das Bakterium an der Entstehung von Krebs beteiligt sein könnte. Mehrere Studien haben gezeigt, dass Zellen, die chronisch mit dem Bakterium infiziert sind, eine mehrstufige Transformation durchlaufen. Die durch chronische Mykoplasmeninfektionen verursachten Veränderungen treten schrittweise auf und sind sowohl morphologisch als auch genetisch bedingt. Das erste sichtbare Zeichen einer Infektion ist die allmähliche Umwandlung der Zellen von ihrer normalen Form in eine Sichelform. Sie werden auch hyperchromatisch, da sich die DNA im Zellkern vermehrt. In späteren Stadien verlieren die Zellen die Notwendigkeit einer festen Unterlage, um zu wachsen und sich zu vermehren, sowie die normale kontaktabhängige Hemmung der Zellen. ⓘ
Mögliche intrazelluläre Mechanismen der mykoplasmatischen malignen Transformation
Karyotypische Veränderungen im Zusammenhang mit Mykoplasmeninfektionen ⓘ
Zellen, die über einen längeren Zeitraum mit Mykoplasmen infiziert sind, weisen signifikante chromosomale Anomalien auf. Dazu gehören die Hinzufügung von Chromosomen, der Verlust ganzer Chromosomen, der teilweise Verlust von Chromosomen und chromosomale Translokationen. Alle diese genetischen Anomalien können zum Prozess der bösartigen Umwandlung beitragen. Chromosomentranslokation und zusätzliche Chromosomen tragen zu einer abnorm hohen Aktivität bestimmter Proto-Onkogene bei, die durch diese genetischen Anomalien verursacht werden und zu denen die Kodierung von c-myc, HRAS und vav gehören. Die Aktivität von Proto-Onkogenen ist nicht die einzige Zellfunktion, die beeinträchtigt wird; auch Tumorsuppressorgene sind von den durch Mykoplasmen verursachten Chromosomenveränderungen betroffen. Ein teilweiser oder vollständiger Verlust von Chromosomen führt zum Verlust wichtiger Gene, die an der Regulierung der Zellproliferation beteiligt sind. Zwei Gene, deren Aktivität bei chronischen Infektionen mit Mykoplasmen deutlich verringert ist, sind die Tumorsuppressorgene Rb und p53. Ein weiterer möglicher Mechanismus der Karzinogenese ist die Aktivierung von RAC1 durch ein kleines GTPase-ähnliches Proteinfragment von Mykoplasmen. Ein wesentliches Merkmal, das Mykoplasmen von anderen karzinogenen Erregern unterscheidet, ist, dass die Mykoplasmen die zellulären Veränderungen nicht durch Einschleusen ihres eigenen genetischen Materials in die Wirtszelle verursachen. Der genaue Mechanismus, durch den das Bakterium die Veränderungen verursacht, ist noch nicht bekannt. ⓘ
- Teilweise Reversibilität der bösartigen Veränderungen ⓘ
Die durch Mycoplasma-Arten ausgelöste bösartige Transformation unterscheidet sich von der durch andere Krankheitserreger verursachten auch dadurch, dass der Prozess reversibel ist. Der Zustand der Umkehrbarkeit ist jedoch nur bis zu einem bestimmten Zeitpunkt während der Infektion möglich. Das Zeitfenster, in dem die Umkehrbarkeit möglich ist, ist sehr unterschiedlich und hängt in erster Linie von dem jeweiligen Mycoplasma ab. Bei M. fermentans ist die Transformation bis etwa zur 11. Woche der Infektion reversibel und beginnt zwischen der 11. und 18. Wenn die Bakterien mit Antibiotika (z. B. Ciprofloxacin oder Clarithromycin) abgetötet werden, bevor das irreversible Stadium erreicht ist, sollten sich die infizierten Zellen wieder normalisieren. ⓘ
Verbindungen zu Krebs in vivo und zukünftige Forschung
Epidemiologische, genetische und molekulare Studien deuten darauf hin, dass Infektionen und Entzündungen bestimmte Krebsarten, einschließlich Prostatakrebs, auslösen. M. genitalium und M. hyorhinis induzieren einen malignen Phänotyp in gutartigen menschlichen Prostatazellen (BPH-1), die nach 19 Wochen Exposition nicht tumorigen waren. ⓘ
Mit Mykoplasmen assoziierte Krebsarten
Dickdarmkrebs: In einer Studie zum Verständnis der Auswirkungen einer Mykoplasmen-Kontamination auf die Qualität kultivierter menschlicher Dickdarmkrebszellen wurde eine positive Korrelation zwischen der Anzahl der in der Probe vorhandenen M. hyorhinis-Zellen und dem Prozentsatz der CD133-positiven Zellen (ein Glykoprotein mit unbekannter Funktion) festgestellt. ⓘ
Magenkrebs: Es gibt deutliche Hinweise darauf, dass die Infektion mit M. hyorhinis zur Entstehung von Magenkrebs beiträgt und die Wahrscheinlichkeit der Entwicklung bösartiger Krebszellen erhöht. ⓘ
Lungenkrebs: Studien über Lungenkrebs haben die Annahme gestützt, dass zwischen dem Auftreten von Mykoplasmen-Stämmen bei Patienten und der Infektion mit Tumorigenese mehr als nur eine zufällige positive Korrelation besteht. ⓘ
Prostatakrebs: Es wurde festgestellt, dass p37, ein von M. hyorhinis kodiertes Protein, die Invasivität von Prostatakrebszellen fördert. Das Protein bewirkt auch, dass sich das Wachstum, die Morphologie und die Genexpression der Zellen verändern, so dass sie einen aggressiveren Phänotyp annehmen. ⓘ
Nierenkrebs: Patienten mit Nierenzellkarzinom (RCC) wiesen im Vergleich zur gesunden Kontrollgruppe eine signifikant hohe Menge an Mycoplasma sp. auf. Dies deutet darauf hin, dass Mycoplasma eine Rolle bei der Entstehung von Nierenkrebs spielen könnte. ⓘ
Klinisch bedeutsame Mykoplasmen
Mykoplasmen sind als parasitär lebende Bakterien die Ursache für zahlreiche Krankheiten beim Menschen und Wirbeltieren. In der Regel töten Bakterien aus der Klasse der Mollicutes ihren Wirt jedoch nicht ab. Vielmehr verursachen sie chronische Infektionen, was für eine gute Anpassung an die Wirte spricht, und verkörpern damit eine sehr erfolgreiche Art des Parasitismus. Einige Arten sind auch opportunistische Krankheitserreger, wenige Arten wurden auch als harmlose Kommensalen beschrieben, so wurde die Art Mycoplasma cottewii in Gehörgängen und seltener in Nasennebenhöhlen von Ziegen gefunden, eine Pathogenität konnte nicht nachgewiesen werden. ⓘ
Veterinärmedizin
- Mycoplasma mycoides spp. mycoides SC (small colony type) ist Erreger der anzeigepflichtigen Lungenseuche der Rinder. Es ist das erste bekannte Mykoplasma und wurde 1898 durch Edmond Nocard und Émile Roux beschrieben.
- Mycoplasma agalactiae ist Erreger der Infektiösen Agalaktie beim kleinen Wiederkäuer (Schaf, Ziege). Meist kommt es zu einer unbemerkten Euterentzündung mit Milchleistungsrückgang, selten auch zu Gelenks- oder Bindehautentzündungen (Konjunktivitis).
- Mycoplasma bovis verursacht Euterentzündungen mit Milchleistungsrückgang bei Milchkühen und kann bei Kälbern neben Lungenentzündungen auch schwere Gelenksentzündungen auslösen.
- Mycoplasma capricolum ist der Erreger der Lungenseuche der Ziegen.
- Mycoplasma conjunctivae ist der Erreger der Gämsblindheit.
- Mycoplasma felis, eventuell auch Mycoplasma gatae und Mycoplasma feliminutum, sind neben Herpes- und Caliciviren als Erreger am Katzenschnupfen-Komplex beteiligt.
- Mycoplasma gallisepticum ist Erreger von Atemwegserkrankungen beim Geflügel (CRD: chronic respiratory disease beim Huhn und infektiöse Sinusitis bei der Pute). Häufig kommt es zu einer Mischinfektion mit anderen viralen oder bakteriellen Krankheitserregern (z. B.: Coryza contagiosa mit Haemophilus paragallinarum).
- Die sogenannten hämatotrophen Mykoplasmen verursachen bei Katzen (Mycoplasma haemofelis, Mycoplasma haemominutum und Mycoplasma turicensis, s. Feline infektiöse Anämie), Hunden (Mycoplasma haemocanis) und Schweinen (Mycoplasma suis, s. Eperythrozoonose der Schweine) Anämien. Sie wurden früher zu den Rickettsien gezählt.
- Mycoplasma hyopneumoniae verursacht die Enzootische Pneumonie der Schweine
- Mycoplasma hyorhinis und Mycoplasma hyosynoviae sind die Erreger der Mykoplasmenarthritis und -polyserositis der Schweine
- Mycoplasma pulmonis ist der Erreger der Mykoplasmose der Ratte, der häufigsten Erkrankung der oberen Atemwege bei als Heim- oder Labortier gehaltenen Wanderratten. ⓘ
Morphologie der Zellen und Kolonien
Die Zellformen der Mykoplasmen (Mollicutes) sind vielgestaltig (pleomorph), oft bläschenförmig (coccoid). Ihre Kolonien zeigen eine charakteristische Spiegeleiform. ⓘ
Probenentnahme, Transport und Nachweis
Aufgrund einer fehlenden bakteriellen Zellwand sind die Mykoplasmen in Proben und Untersuchungsmaterialien sehr empfindlich gegenüber Austrocknung. Proben an Tupfern müssen daher schnell weiterverarbeitet werden oder in ein Transportmedium eingebracht werden. Mykoplasmen in Gewebe- und Sputumproben können unbehandelt transportiert werden. Ein Intervall von 24 bis 48 Stunden zwischen Probenentnahme und Probenanalyse kann mit Kühlung auf +4 °C überbrückt werden. Auch das Einfrieren der Proben auf −70 °C ist möglich. Da Mykoplasmen keine Zellwand haben, können sie nur auf speziellen Nährböden angezüchtet werden. Deshalb hat sich als schnelle und billige Standardmethode die Polymerase-Kettenreaktion (PCR) zum Nachweis etabliert. Dies gilt aber nicht für alle Mykoplasmen. ⓘ