Faktor-V-Leiden-Mutation
Die Faktor-V-Mutation Typ Leiden („Faktor-fünf-Mutation Typ Leiden“; häufig als FVL-Mutation abgekürzt) ist der häufigste angeborene thrombophile Risikomarker. Das Thromboserisiko ist bei heterozygoten Anlageträgern um das 4- bis 7-fache gegenüber der Normalbevölkerung erhöht. Bei homozygoten Anlageträgern dürfte das Thromboserisiko um das etwa 11,5- bis 26-fache erhöht sein. „Leiden“ steht für die niederländische Universitätsstadt, wo die Mutation 1994 zuerst beschrieben wurde. Diese genetische Variante führt zu einer Resistenz gegen aktiviertes Protein C, d. h. Faktor V kann durch aktiviertes Protein C nur unzureichend inaktiviert werden. Das veränderte Basentriplett führt zum Einbau der Aminosäure Glutamin an Stelle von Arginin an Position 506 des Proteins. Der so entstandene Gerinnungsfaktor wird Faktor-V Leiden, kurz FVL, genannt. Durch die Veränderung in der Proteinsequenz kommt die so genannte APC-Resistenz zustande: Normalerweise wird der aktivierte Faktor V (FVa) durch das aktivierte Protein C (APC) durch Proteolyse abgebaut und damit wirkungslos gemacht. Durch die veränderte Struktur im FVL wird der Abbau von Faktor Va durch APC inhibiert (er wird „resistent“), und der Faktor Va behält seine gerinnungsfördernde Wirkung. Hierdurch kommt es zu einem Ungleichgewicht an gerinnungshemmenden und gerinnungsfördernden Einflüssen, wodurch die Neigung, Thrombosen zu entwickeln, zunimmt (Thrombophilie). ⓘ
Anzeichen und Symptome
Die Symptome von Faktor-V-Leiden sind von Person zu Person unterschiedlich. Es gibt Menschen mit dem F5-Gen, die nie eine Thrombose entwickeln, während bei anderen vor dem 30. Lebensjahr immer wieder Thrombosen auftreten. Diese Variabilität wird durch die Anzahl der F5-Genmutationen einer Person, das Vorhandensein anderer Genveränderungen im Zusammenhang mit der Blutgerinnung und durch Risikofaktoren wie chirurgische Eingriffe, die Einnahme oraler Verhütungsmittel und eine Schwangerschaft beeinflusst. ⓘ
Zu den Symptomen von Faktor-V-Leiden gehören:
- Eine erste TVT oder PE vor dem 50.
- Wiederkehrende tiefe Venenthrombosen oder Lungenembolien.
- Venenthrombose an ungewöhnlichen Stellen im Körper, wie z. B. im Gehirn oder in der Leber.
- Eine TVT oder PE während oder direkt nach einer Schwangerschaft.
- Ungeklärter Schwangerschaftsverlust im zweiten oder dritten Trimester.
- Eine tiefe Venenthrombose oder Lungenembolie und eine starke familiäre Vorbelastung mit venösen Thromboembolien. ⓘ
Die Einnahme von Hormonen wie oralen Kontrazeptiva (OCP) und Hormonersatztherapien (HRT), einschließlich Östrogenen und östrogenähnlichen Arzneimitteln, die nach der Menopause eingenommen werden, erhöht das Risiko, eine TVT oder PE zu entwickeln. Gesunde Frauen, die OCP einnehmen, haben ein drei- bis vierfach erhöhtes Risiko, eine TVT oder PE zu entwickeln, verglichen mit Frauen, die keine OCP einnehmen. Frauen mit Faktor-V-Leiden, die OCP einnehmen, haben ein etwa 35-fach erhöhtes Risiko, eine TVT oder PE zu entwickeln, verglichen mit Frauen ohne Faktor-V-Leiden und Frauen, die keine OCP einnehmen. Ebenso haben postmenopausale Frauen, die eine Hormonersatztherapie einnehmen, ein zwei- bis dreifach höheres Risiko, eine TVT oder PE zu entwickeln, als Frauen, die keine Hormonersatztherapie einnehmen, und Frauen mit Faktor-V-Leiden, die eine Hormonersatztherapie einnehmen, haben ein 15-fach höheres Risiko. Frauen mit heterozygotem Faktor V Leiden, die eine Entscheidung über die Einnahme von OCP oder HRT treffen, sollten diese Statistiken bei der Abwägung von Risiken und Nutzen der Behandlung in Betracht ziehen. ⓘ
Pathophysiologie
Bei der normalen Blutgerinnung fungiert Faktor V als Kofaktor, der es Faktor Xa ermöglicht, Prothrombin zu aktivieren, wodurch das Enzym Thrombin entsteht. Thrombin wiederum spaltet Fibrinogen und bildet Fibrin, das zu dem dichten Geflecht polymerisiert, das den Großteil des Gerinnsels ausmacht. Aktiviertes Protein C ist ein natürliches Antikoagulans, das das Ausmaß der Gerinnung durch Spaltung und Abbau von Faktor V begrenzt. ⓘ
| SNP: Faktor V Leiden ⓘ | |
|---|---|
| Name(n). | Faktor V Leiden, Arg506Gln, R506Q, G1691A |
| Gen | Faktor V |
| Chromosom | 1 |
| Externe Datenbanken | |
| Ensembler | Menschliche SNPView |
| dbSNP | 6025 |
| HapMap | 6025 |
| SNPedia | 6025 |
| ALFRED | SI001216K |
Faktor-V-Leiden ist eine autosomal-dominant vererbte Erkrankung mit unvollständiger Penetranz, d. h. nicht jede Person, die die Mutation trägt, entwickelt die Krankheit. Die Erkrankung führt zu einer Faktor-V-Variante, die nicht so leicht durch aktiviertes Protein C abgebaut werden kann. Das Gen, das dieses Protein kodiert, wird als F5 bezeichnet. Die Mutation dieses Gens - ein Einzelnukleotid-Polymorphismus (SNP) - befindet sich im Exon 10. Es handelt sich um eine Missense-Substitution der Aminosäure R durch die Aminosäure Q, wodurch die Aminosäure des Proteins von Arginin durch Glutamin ersetzt wird. Je nach gewähltem Start befindet sich die Nukleotidvariante entweder an Position 1691 oder 1746. Sie beeinflusst auch die Aminosäureposition der Variante, die entweder 506 oder 534 ist. (Zusammen mit dem allgemeinen Fehlen eines Nomenklaturstandards bedeutet diese Varianz, dass der SNP auf verschiedene Weise bezeichnet werden kann, z. B. als G1691A, c.1691G>A, 1691G>A, c.1746G>A, p.Arg534Gln, Arg506Gln, R506Q oder rs6025). Da diese Aminosäure normalerweise die Spaltstelle für aktiviertes Protein C ist, verhindert die Mutation eine effiziente Inaktivierung von Faktor V. Wenn Faktor V aktiv bleibt, erleichtert er die Überproduktion von Thrombin, was zur Bildung von überschüssigem Fibrin und übermäßiger Gerinnung führt. ⓘ
Die übermäßige Gerinnung, die bei dieser Erkrankung auftritt, ist fast immer auf die Venen beschränkt, wo die Gerinnung eine tiefe Venenthrombose (DVT) verursachen kann. Wenn sich die venösen Gerinnsel lösen, können sie durch die rechte Seite des Herzens in die Lunge wandern, wo sie ein Lungenblutgefäß verstopfen und eine Lungenembolie verursachen. Die Bildung von Gerinnseln in den Arterien, die zu einem Schlaganfall oder Herzinfarkt führen können, ist bei dieser Erkrankung äußerst selten, ein "Mini-Schlaganfall", eine so genannte transitorische ischämische Attacke, ist jedoch häufiger. Da diese Krankheit eine unvollständige Dominanz aufweist, haben Personen, die homozygot für das mutierte Allel sind, ein höheres Risiko für die oben beschriebenen Ereignisse als Personen, die heterozygot für die Mutation sind. ⓘ
Diagnose
Der Verdacht, dass Faktor-V-Leiden die Ursache für ein thrombotisches Ereignis ist, sollte bei allen kaukasischen Patienten unter 45 Jahren oder bei Personen mit einer Familienanamnese von Venenthrombosen in Betracht gezogen werden. Es gibt verschiedene Methoden, mit denen diese Erkrankung diagnostiziert werden kann. Die meisten Labors untersuchen Risikopatienten entweder mit einem Test auf der Basis von Schlangengift (z. B. verdünnter Russellviperngift-Zeit) oder mit einem aPTT-Test. Bei beiden Methoden wird die Zeit, die das Blut braucht, um zu gerinnen, bei Vorliegen der Faktor-V-Leiden-Mutation verringert. Dazu werden zwei Tests gleichzeitig durchgeführt; ein Test wird in Anwesenheit von aktiviertem Protein C und der andere in Abwesenheit durchgeführt. Anhand der beiden Tests wird ein Verhältnis ermittelt, und die Ergebnisse zeigen dem Labor an, ob das aktivierte Protein C funktioniert oder nicht. Es gibt auch einen genetischen Test, der für diese Störung durchgeführt werden kann. Die Mutation (eine 1691G→A-Substitution) entfernt eine Spaltstelle der Restriktionsendonuklease MnlI, so dass eine PCR, eine Behandlung mit MnlI und eine anschließende DNA-Elektrophorese eine Diagnose ergeben. Andere PCR-basierte Assays wie iPLEX können ebenfalls die Zygosität und die Häufigkeit der Variante bestimmen. ⓘ
Leben mit der Faktor-V-Leiden-Mutation
Anlageträger der Faktor-V-Leiden-Mutation sollten einen thrombosefördernden Lebensstil meiden, um die Wahrscheinlichkeit einer Thrombose zu verringern. Hierzu zählen insbesondere der Verzicht auf das Rauchen, das Vermeiden von Übergewicht sowie, für junge Frauen, das Absehen von der Einnahme östrogenhaltiger oraler Kontrazeptiva. Langes Sitzen, etwa auf Flug- oder Busreisen, sollte häufiger durch Bewegungen der Beine unterbrochen werden. Solange Thrombosen vermieden werden, ist die Lebenserwartung für gewöhnlich nicht beeinträchtigt und bei ansonsten gesunden Heterozygoten keine Gabe von gerinnungshemmenden Medikamenten erforderlich. Homozygote Anlageträger hingegen können aufgrund des sehr hohen Thromboserisikos unter Umständen auf eine lebenslange Therapie angewiesen sein, insbesondere wenn weitere Risikomarker vorliegen. ⓘ
In der Schwangerschaft kann jedoch auch bei heterozygoten Frauen zur Vorbeugung von Spontanaborten und Blutgerinnseln eine Thromboseprophylaxe mit niedermolekularem Heparin angeraten sein, ebenso nach größeren Operationen mit Bettlägerigkeit, wo insbesondere eine rasche Mobilisation von großer Wichtigkeit ist. ⓘ
Da es noch keine Heilung gibt, konzentriert sich die Behandlung auf die Vorbeugung von thrombotischen Komplikationen. Antikoagulanzien werden für Menschen mit heterozygotem Faktor-V-Leiden nicht routinemäßig empfohlen, es sei denn, es liegen zusätzliche Risikofaktoren vor, sondern sie werden verabreicht, wenn ein solches Ereignis auftritt. Das einmalige Auftreten einer tiefen Venenthrombose oder einer Lungenembolie bei Menschen mit Faktor-V-Leiden rechtfertigt eine vorübergehende Behandlung mit Gerinnungshemmern, aber im Allgemeinen keine lebenslange Behandlung. Darüber hinaus kann eine vorübergehende Behandlung mit einem Gerinnungshemmer wie Heparin in Zeiten mit besonders hohem Thromboserisiko, z. B. bei größeren Operationen, erforderlich sein. Bei Menschen mit homozygotem Faktor V Leiden oder heterozygotem Faktor V Leiden mit zusätzlicher Thrombophilie sollte jedoch eine lebenslange orale Antikoagulation in Betracht gezogen werden. ⓘ
Epidemiologie
Studien haben ergeben, dass etwa 5 Prozent der Kaukasier in Nordamerika Faktor-V-Leiden haben. Die Daten deuten darauf hin, dass die Prävalenz von Faktor-V-Leiden bei Kaukasiern höher ist als bei Angehörigen amerikanischer Minderheiten. Eine Studie deutet auch darauf hin, "dass die Faktor-V-Leiden-Mutation in Populationen mit signifikanter kaukasischer Beimischung segregiert und in genetisch weit entfernten nichteuropäischen Gruppen selten ist". ⓘ
Bis zu 30 Prozent der Patienten, bei denen eine tiefe Venenthrombose oder eine Lungenembolie auftritt, haben diese Erkrankung. Das Risiko, ein Gerinnsel in einem Blutgefäß zu entwickeln, hängt davon ab, ob eine Person eine oder zwei Kopien der Faktor-V-Leiden-Mutation erbt. Wird eine Kopie der Mutation von einem Elternteil geerbt (heterozygot), erhöht sich das Risiko, ein Gerinnsel zu entwickeln, um das Vier- bis Achtfache. Menschen, die zwei Kopien der Mutation erben (homozygot), eine von jedem Elternteil, haben ein bis zu 80-mal höheres Risiko, diese Art von Blutgerinnsel zu entwickeln. Wenn man bedenkt, dass das Risiko, ein abnormales Blutgerinnsel zu entwickeln, in der Allgemeinbevölkerung im Durchschnitt bei etwa 1:1.000 pro Jahr liegt, erhöht das Vorhandensein einer Kopie der Faktor-V-Leiden-Mutation dieses Risiko auf 4:1.000 bis 8:1.000. Bei Vorhandensein von zwei Kopien der Mutation kann das Risiko sogar auf 80 von 1.000 ansteigen. Es ist unklar, ob diese Personen ein erhöhtes Risiko für wiederkehrende Venenthrombosen haben. Zwar haben nur 1 Prozent der Menschen mit Faktor-V-Leiden zwei Kopien des defekten Gens, aber diese homozygoten Personen weisen einen schwereren klinischen Zustand auf. Das Vorhandensein erworbener Risikofaktoren für Venenthrombosen - wie Rauchen, die Verwendung östrogenhaltiger (kombinierter) Formen der hormonellen Empfängnisverhütung und kürzlich durchgeführte Operationen - erhöht die Wahrscheinlichkeit, dass eine Person mit der Faktor-V-Leiden-Mutation eine TVT entwickelt, zusätzlich. ⓘ
Frauen mit Faktor-V-Leiden haben in der Schwangerschaft (und bei Einnahme östrogenhaltiger Antibabypillen oder Hormonersatzpräparaten) ein deutlich erhöhtes Risiko für Blutgerinnsel in Form von tiefen Venenthrombosen und Lungenembolien. Sie können auch ein geringfügig erhöhtes Risiko für Präeklampsie haben, ein geringfügig erhöhtes Risiko für Babys mit niedrigem Geburtsgewicht, ein geringfügig erhöhtes Risiko für Fehl- und Totgeburten aufgrund von Gerinnung in der Plazenta, der Nabelschnur oder dem Fötus (die fötale Gerinnung kann davon abhängen, ob das Baby das Gen geerbt hat) oder von Einflüssen des Gerinnungssystems auf die Entwicklung der Plazenta. Es ist zu beachten, dass viele dieser Frauen eine oder mehrere Schwangerschaften ohne Probleme durchlaufen, während bei anderen wiederholt Schwangerschaftskomplikationen auftreten und wieder andere innerhalb weniger Wochen nach der Schwangerschaft Gerinnsel entwickeln können. ⓘ

In Europa sind etwa 5 % der Bevölkerung heterozygote Träger der FVL-Mutation. Nur 0,05–0,5 % sind homozygote Träger, die je ein mutiertes Allel von Vater und Mutter geerbt haben (sofern es keine Neumutation ist). Bei Menschen nichteuropäischer Abstammung kommt die Mutation noch deutlich seltener vor. Evolutionsbiologisch bot die Mutation in früheren Zeiten bei größeren Verletzungen einen Vorteil, da sie die Wahrscheinlichkeit des Verblutens verringerte, dies ist vermutlich für ihre heutige Häufigkeit verantwortlich. Durch natürliche Selektion, Gründereffekte und Gendrift kann die Mutation in einigen kleineren Populationen auch noch deutlich gehäufter auftreten, so etwa bei 12 % der Schweden und Zyprer. ⓘ
Geschichtliche Aspekte
Ein Blutgerinnungsfaktor-V-Mangel wurde 1955 erstmals von Max-Hermann Hörder entdeckt und auf einen Blutgerinnungsfaktor-V-Inhibitor (FVI) zurückgeführt. Im Jahre 1993 wurde dann zum ersten Mal durch den schwedischen Arzt Björn Dahlbäck die Faktor-V-Leiden-Mutation (FVL-Mutation) beschrieben, welche letztlich eine verstärkte Blutgerinnungsneigung bewirkt. Dahlbäck hatte bereits 1989 bei einem jungen Mann eine ungewöhnliche Häufung von Venenthrombosen beobachtet, auch bei anderen Familienmitgliedern des Mannes waren bereits Thrombosen aufgetreten. Für eine genaue Untersuchung von Blutproben der Familie mussten zunächst Untersuchungsmethoden neu entwickelt und verfeinert werden. Schließlich gelang der Nachweis einer Punktmutation in dem für Gerinnungsfaktor V codierenden Gen, das auf dem langen Arm von Chromosom 1 (Genlocus 1q24.2) liegt. Durch die Mutation wird ein einzelnes Nukleotid an Position 1691 verändert (Adenin statt Guanin). Dahlbäck benannte diese genetische Veränderung, wie es unter Genomforschern üblich ist, nach dem Ort ihrer Entdeckung – der niederländischen Stadt Leiden – als Faktor-V-Leiden-Mutation. ⓘ
Diagnostik der FVL-Mutation
Indikation zur Untersuchung
Personen, in deren engerem Verwandtschaftskreis – hierzu gehören Großeltern, Eltern, Geschwister und eigene Kinder – bereits mehrfach ungeklärte Thrombosen aufgetreten sind, können sich einer Gerinnungsdiagnostik unterziehen. Hierzu gehört unter anderem auch die Untersuchung auf die FVL-Mutation bzw. die APC-Resistenz. Wenn bei einer Person selbst eine oder mehrere thromboembolische Erkrankungen auftraten, wird ebenfalls eine Gerinnungsdiagnostik empfohlen. Dies gilt umso mehr, wenn für das Auftreten der Thrombose keine etablierten Risikofaktoren (Übergewicht, Immobilisierung, z. B. nach Operationen oder Frakturen, Einnahme von hormonellen Kontrazeptiva etc.) vorliegen. In den letzten Jahren wurde bei Patientinnen mit wiederholten Fehlgeburten (sog. habituellen Aborten), Totgeburten ansonsten unklarer Ursache sowie bei schwerer intrauteriner Wachstumsretardierung ebenfalls ein Zusammenhang mit einer mütterlichen Thromboseneigung (Thrombophilie) festgestellt, so dass auch in diesen Fällen eine Gerinnungsuntersuchung der Mutter und gegebenenfalls eine Prophylaxe angebracht ist. ⓘ
Verfahren
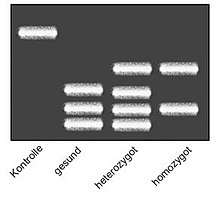
Die Punktmutation im Faktor-V-Gen von Guanin (G) zu Adenin (A) an Position 1691 lässt sich durch DNA-Sequenzierung nachweisen. Da die Methode zum Direktnachweis jedoch sehr teuer ist, wird die Mutation meist über einen Restriktionsfragmentlängenpolymorphismus (RFLP) nachgewiesen. ⓘ
Dazu wird die DNA einer Blutprobe des Patienten mit einer Polymerase-Kettenreaktion (PCR) vervielfältigt und das betreffende Gen durch eine chemische Reaktion mithilfe eines Restriktionsenzymes (MnlI) in verschieden lange Nukleinsäureketten zerschnitten. Die Länge der Nukleinsäureketten wird anschließend in einer Gelelektrophorese bestimmt. Restriktionsfragmente von PCR-Produkten, welche die FVL-Mutation tragen, weisen eine andere Größenverteilung auf als solche, die von gesunden Probanden stammt, da durch die Mutation eine Erkennungsstelle für das Restriktionsenzym entfernt wird. ⓘ
Der aktuelle Standard ist die Bestimmung über die Messung der Schmelzkurve. Hierbei bedient man sich des Verfahrens der "Real-Time-PCR". Es wird eine Polymerasekettenreaktion mit fluoreszenzmarkierten Nukleinsäuresonden durchgeführt, welche zu der ggf. von der Mutation betroffenen Sequenz komplementär sind. Der primäre Farbstoff an diesen Sonden wird mit einer bestimmten Wellenlänge angeregt und emittiert Licht einer Wellenlänge, mit der ein sekundärer Fluoreszenzfarbstoff angeregt wird, der an eine zweite Sonde gekoppelt ist, die zu einer benachbarten Gensequenz komplementär ist. Nur wenn beide Sonden tatsächlich an die DNA gebunden sind, sind sie räumlich nah genug für diese Kooperation (FRET genannt). So lässt sich im Rahmen eines Temperaturgradienten photometrisch die Schmelztemperatur des Gen-Sonden-Doppelstrangs bestimmen. Wenn die Mutation vorliegt, binden die Sonden nicht vollständig komplementär, sodass die Schmelztemperatur erniedrigt ist. Bei einem heterozygoten Genotypen entsteht entsprechend eine „doppelte“ Schmelzkurve. ⓘ
In jüngerer Zeit wird die Mutation zunehmend auch zufällig im Rahmen der personalisierten Medizin und ihren genetischen Mikrochip-Untersuchungen entdeckt, der maßgebliche Einzel-Nukleotid-Polymorphismus (SNP) trägt den Namen rs6025. ⓘ