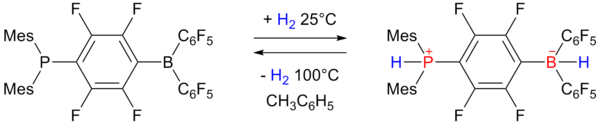Wasserstoffspeicherung
Die Wasserstoffspeicherung ist die umkehrbare Aufbewahrung von Wasserstoff, mit dem Ziel, dessen chemische und physikalische Eigenschaften für eine weitere Verwendung zu erhalten. Die Speicherung umfasst die Vorgänge der Einspeicherung oder Speicherbeladung, der zeitlich befristeten Lagerung und der Ausspeicherung oder Speicherentladung. Konventionelle Methoden der Speicherung von Wasserstoff sind:
- Druckgasspeicherung (Speicherung in Druckbehältern durch Verdichten mit Kompressoren)
- Flüssiggasspeicherung (Speicherung in verflüssigter Form durch Kühlung und Verdichten)
Alternative Formen der Speicherung von Wasserstoff nutzen die physikalische oder chemische Bindung an einen anderen Stoff:
- Absorption im Metallhydridspeicher (Speicherung als chemische Verbindung zwischen Wasserstoff und einem Metall bzw. einer Legierung)
- Adsorptionsspeicherung (adsorptive Speicherung von Wasserstoff in hochporösen Materialien)
- chemische Bindung, bei der der Wasserstoff durch eine chemische Reaktion in einen anderen Stoff überführt wird, der z. B. drucklos und bei Raumtemperatur gelagert und transportiert werden kann („Chemisch gebundener Wasserstoff“). Bei der Ausspeicherung erfolgt dann die Umkehrreaktion. Beispiele sind Hydrierung organischer Substanzen oder Bildung von Alkoholen mit CO. ⓘ
Etablierte Technologien

Komprimierter Wasserstoff
Komprimierter Wasserstoff ist eine Speicherform, bei der Wasserstoffgas unter Druck gehalten wird, um die Speicherdichte zu erhöhen. Komprimierter Wasserstoff in Wasserstofftanks mit einem Druck von 350 bar (5.000 psi) und 700 bar (10.000 psi) wird für Wasserstofftanksysteme in Fahrzeugen verwendet, die auf der Typ-IV-Kohlenstoffkomposittechnologie basieren. Automobilhersteller wie Honda oder Nissan haben diese Lösung entwickelt. ⓘ
Verflüssigter Wasserstoff
Flüssigwasserstofftanks für Autos, die zum Beispiel den BMW Hydrogen 7 produzieren. Japan verfügt über eine Lagerstätte für flüssigen Wasserstoff (LH2) im Hafen von Kobe. Wasserstoff wird verflüssigt, indem seine Temperatur auf -253 °C gesenkt wird, ähnlich wie bei verflüssigtem Erdgas (LNG), das bei -162 °C gelagert wird. Ein potenzieller Wirkungsgradverlust von nur 12,79 % kann erreicht werden, was 4,26 kW⋅h/kg von 33,3 kW⋅h/kg entspricht. ⓘ
Chemische Speicherung
Die chemische Speicherung könnte aufgrund der hohen Speicherdichten eine hohe Speicherleistung bieten. Zum Beispiel hat überkritischer Wasserstoff bei 30 °C und 500 bar nur eine Dichte von 15,0 mol/L, während Methanol eine Dichte von 49,5 mol H2/L Methanol und gesättigter Dimethylether bei 30 °C und 7 bar eine Dichte von 42,1 mol H2/L Dimethylether aufweist. ⓘ
Problematisch ist die Regeneration des Speichermaterials. Eine Vielzahl von chemischen Speichersystemen wurde untersucht. Die H2-Freisetzung kann durch Hydrolysereaktionen oder katalysierte Dehydrierungsreaktionen induziert werden. Beispiele für Speichermaterialien sind Kohlenwasserstoffe, Borhydride, Ammoniak, Alan usw. Ein vielversprechender chemischer Ansatz ist die elektrochemische Wasserstoffspeicherung, da die Freisetzung von Wasserstoff durch die angelegte Elektrizität gesteuert werden kann. Die meisten der unten aufgeführten Materialien können direkt für die elektrochemische Wasserstoffspeicherung verwendet werden. ⓘ
Wie bereits erwähnt, bieten Nanomaterialien Vorteile für Wasserstoffspeichersysteme. Nanomaterialien stellen eine Alternative dar, die die beiden Haupthindernisse von Schüttgutmaterialien, nämlich die Sorptionsgeschwindigkeit und die Freigabetemperatur, überwindet. ⓘ
Die Sorptionskinetik und die Speicherkapazität können durch die Dotierung von Katalysatoren mit Nanomaterialien verbessert werden, wie die Arbeit des Clean Energy Research Center der University of South Florida zeigt. Diese Forschungsgruppe untersuchte mit Nickel-Nanopartikeln dotiertes LiBH4 und analysierte den Gewichtsverlust und die Freisetzungstemperatur der verschiedenen Arten. Sie stellten fest, dass eine zunehmende Menge an Nanokatalysator die Freisetzungstemperatur um etwa 20 °C senkt und den Gewichtsverlust des Materials um 2-3 % erhöht. Die optimale Menge an Ni-Partikeln wurde mit 3 Mol-% ermittelt, bei der die Temperatur innerhalb der festgelegten Grenzen lag (etwa 100 °C) und der Gewichtsverlust deutlich höher war als bei den undotierten Spezies. ⓘ
Die Geschwindigkeit der Wasserstoffsorption verbessert sich auf der Nanoskala aufgrund der kurzen Diffusionsdistanz im Vergleich zu Massenmaterialien. Außerdem haben sie ein günstiges Verhältnis von Oberfläche zu Volumen. ⓘ
Die Freisetzungstemperatur eines Materials ist definiert als die Temperatur, bei der der Desorptionsprozess beginnt. Die Energie oder die Temperatur, bei der die Freisetzung einsetzt, beeinflusst die Kosten jeder chemischen Speicherstrategie. Wenn der Wasserstoff zu schwach gebunden ist, ist der für die Regeneration erforderliche Druck hoch, wodurch jegliche Energieeinsparung zunichte gemacht wird. Das Ziel für Wasserstofftreibstoffsysteme an Bord ist etwa <100 °C für die Freisetzung und <700 bar für die Wiederaufladung (20-60 kJ/mol H2). Eine modifizierte van 't Hoff-Gleichung setzt Temperatur und Partialdruck des Wasserstoffs während des Desorptionsprozesses in Beziehung. Die Änderungen an der Standardgleichung stehen im Zusammenhang mit Größeneffekten im Nanobereich. ⓘ
Dabei ist pH2 der Partialdruck des Wasserstoffs, ΔH die Enthalpie des Sorptionsprozesses (exotherm), ΔS die Entropieänderung, R die ideale Gaskonstante, T die Temperatur in Kelvin, Vm das molare Volumen des Metalls, r der Radius des Nanopartikels und γ die freie Oberflächenenergie des Partikels. ⓘ
Aus der obigen Beziehung geht hervor, dass die Enthalpie- und Entropieänderung der Desorptionsprozesse vom Radius des Nanopartikels abhängt. Darüber hinaus ist ein neuer Term enthalten, der die spezifische Oberfläche des Partikels berücksichtigt, und es kann mathematisch bewiesen werden, dass eine Verringerung des Partikelradius zu einer Verringerung der Freisetzungstemperatur für einen bestimmten Partialdruck führt. ⓘ
Hydrierung von CO2
Der derzeitige Ansatz zur CO2-Reduzierung umfasst die Abscheidung und Speicherung in Anlagen auf der ganzen Welt. Um CO2 an der Quelle zu nutzen, ist die CO2-Hydrierung ein realistischer und praktischer Ansatz. Bei der konventionellen Hydrierung werden gesättigte organische Verbindungen durch Zugabe von H2 reduziert. Ein Weg der CO2-Hydrierung ist der CO2-Methanol-Weg. Methanol kann zur Herstellung langkettiger Kohlenwasserstoffe verwendet werden. Einige Hindernisse bei der CO2-Hydrierung sind die Reinigung des abgeschiedenen CO2, die H2-Quelle aus der Wasserspaltung und der Energieaufwand für die Hydrierung. Um diese Hindernisse zu überwinden, können wir die grüne H2-Technologie weiterentwickeln und die Katalysatorforschung auf industrieller und akademischer Ebene fördern. Für industrielle Anwendungen wird CO2 häufig in Methanol umgewandelt. Bislang wurden bei der Umwandlung von CO2 in C1-Moleküle große Fortschritte erzielt. Bei der Umwandlung von CO2 in hochwertige Moleküle gibt es jedoch noch viele Hindernisse, und die Zukunft der CO2-Hydrierung hängt von den Fortschritten der Katalysatortechnologien ab. ⓘ
Metallhydride
Metallhydride wie MgH2, NaAlH4, LiAlH4, LiH, LaNi5H6, TiFeH2, Ammoniakboran und Palladiumhydrid sind Quellen für gespeicherten Wasserstoff. Auch hier sind die Probleme der prozentuale Anteil von H2, den sie enthalten, und die Reversibilität des Speichervorgangs. Bei einigen handelt es sich um Flüssigkeiten, die bei Umgebungstemperatur und -druck leicht zu brennen sind, während andere Feststoffe sind, die zu Pellets verarbeitet werden können. Diese Materialien haben eine gute Energiedichte, obwohl ihre spezifische Energie oft schlechter ist als die der führenden Kohlenwasserstoffbrennstoffe. ⓘ
LiNH2, LiBH4 und NaBH4. ⓘ
Eine alternative Methode zur Senkung der Dissoziationstemperatur ist die Dotierung mit Aktivatoren. Diese Strategie wurde bereits bei Aluminiumhydrid angewandt, aber die komplexe Synthese macht diesen Ansatz unattraktiv. ⓘ
Zu den vorgeschlagenen Hydriden für den Einsatz in einer Wasserstoffwirtschaft gehören einfache Hydride von Magnesium oder Übergangsmetallen sowie komplexe Metallhydride, die in der Regel Natrium, Lithium oder Kalzium und Aluminium oder Bor enthalten. Die für Speicheranwendungen ausgewählten Hydride bieten eine geringe Reaktivität (hohe Sicherheit) und eine hohe Wasserstoffspeicherdichte. Führende Kandidaten sind Lithiumhydrid, Natriumborhydrid, Lithiumaluminiumhydrid und Ammoniakboran. Das französische Unternehmen McPhy Energy entwickelt das erste industrielle Produkt auf der Grundlage von Magnesiumhydrid, das bereits an einige Großkunden wie Iwatani und ENEL verkauft wurde. ⓘ
Die reversible Wasserstoffspeicherung wird durch ein frustriertes Lewis-Paar dargestellt, das ein Borhydrid erzeugt. ⓘ
Das links abgebildete Phosphinboran nimmt bei einer Atmosphäre und 25 °C ein Äquivalent Wasserstoff auf und gibt es durch Erhitzen auf 100 °C wieder ab. Die Speicherkapazität beträgt 0,25 Gew.-%. ⓘ
Aluminium
Wasserstoff kann mit Aluminium durch Reaktion mit Wasser hergestellt werden. Um mit Wasser zu reagieren, muss das Aluminium jedoch von seiner natürlichen Oxidschicht befreit werden, was eine Pulverisierung, chemische Reaktionen mit ätzenden Substanzen oder Legierungen erfordert. Das Nebenprodukt der Reaktion zur Erzeugung von Wasserstoff ist Aluminiumoxid, das mit dem Hall-Héroult-Verfahren wieder in Aluminium zurückverwandelt werden kann, wodurch die Reaktion theoretisch erneuerbar ist. Dies erfordert jedoch eine Elektrolyse, die viel Energie verbraucht. ⓘ
Magnesium
Wasserstoffspeichermaterialien auf Mg-Basis können im Allgemeinen in drei Kategorien eingeteilt werden, nämlich reines Mg, Mg-Legierungen und Mg-Verbundwerkstoffe. Vor allem die mehr als 300 Arten von Wasserstoffspeicherlegierungen auf Mg-Basis haben wegen ihrer relativ besseren Gesamtleistung große Aufmerksamkeit erhalten. Die minderwertige Wasserstoffabsorptions-/Desorptionskinetik, die in der zu hohen thermodynamischen Stabilität von Metallhydrid begründet ist, macht die Mg-basierten Wasserstoffspeicherlegierungen jedoch derzeit für reale Anwendungen ungeeignet, weshalb massive Anstrengungen unternommen wurden, um diese Mängel zu beheben. Einige Methoden der Probenvorbereitung, wie Schmelzen, Pulversintern, Diffusion, mechanisches Legieren, hydrierende Verbrennungssynthese, Oberflächenbehandlung und Wärmebehandlung usw., wurden in großem Umfang eingesetzt, um die dynamische Leistung und die Lebensdauer von Wasserstoffspeicherlegierungen auf Mg-Basis zu verändern. Außerdem wurden einige intrinsische Modifizierungsstrategien, einschließlich Legierung, Nanostrukturierung, Dotierung durch katalytische Zusätze und Erwerb von Nanokompositen mit anderen Hydriden usw., hauptsächlich erforscht, um die Leistung von Wasserstoffspeicherlegierungen auf Mg-Basis intrinsisch zu verbessern. ⓘ
Von den primären Wasserstoffspeicherlegierungen, die früher entwickelt wurden, wird angenommen, dass Mg und Mg-basierte Wasserstoffspeichermaterialien die bemerkenswerte Möglichkeit der praktischen Anwendung bieten, und zwar aufgrund der folgenden Vorteile: 1) Die Ressource Mg ist reichlich vorhanden und wirtschaftlich. Das Element Mg ist reichlich vorhanden und macht ~2,35 % der Erdkruste aus, wobei es an achter Stelle steht; 2) die geringe Dichte von nur 1,74 g cm-3; 3) die hervorragende Wasserstoffspeicherkapazität. Die theoretische Wasserstoffspeicherkapazität von reinem Mg beträgt 7,6 Gew.-%, die von Mg2Ni 3,6 Gew.-%. ⓘ
Auf Alanaten basierende Systeme
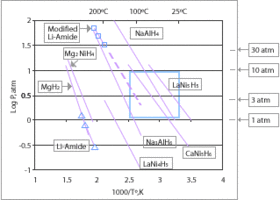
Natriumalanat (NaAlH4) ist ein komplexes Hydrid für die H2-Speicherung. 1979 wurde die Kristallstruktur erstmals durch eine Einkristall-Röntgenbeugungsstudie bestimmt. Die atomare Struktur bestand aus isolierten [AlH4]-Tetraedern, in denen die Na-Atome von acht [AlH4]-Tetraedern in einem verzerrten Quadrat umgeben sind. Die Freisetzung von Wasserstoff aus NaAlH4 ist seit den 1950er Jahren bekannt. Im Jahr 1997 entdeckte Bogdanovic, dass die TiO2-Dotierung von Materialien den Prozess bei geringer Temperatur und geringem Druck umkehrbar macht. TiO2-dotierte Materialien sind reversibel in der Wasserstoffspeicherung, NaAlH4 ist derzeit das modernste reversible Festkörper-Wasserstoffspeichermaterial, das bei niedrigen Temperaturen verwendet werden kann und 5,6 Gew.-% Wasserstoff enthält. Die chemische Reaktion ist: 3NaAlH4 ← Katalysator → Na3AlH6 + 2Al + 3H2 ← Katalysator → 3NaH + Al + 3/2H2. Die für die Umwandlung von NaAlH4 in Na3AlH6 erforderliche Wärme beträgt 37 kJ/mol. Die für die Umwandlung von Na3AlH6 in NaH erforderliche Wärme beträgt 47 kJ/mol. Grundsätzlich werden bei der ersten Stufe von NaAlH4 3,7 Gew.-% Wasserstoff bei etwa 190 °C und bei der zweiten Stufe 1,8 Gew.-% Wasserstoff bei etwa 225 °C beim Erhitzen freigesetzt. Eine weitere Dehydrierung von NaH erfolgt erst bei Temperaturen über 400 °C. Diese Temperatur ist für technische Anwendungen zu hoch und kann daher nicht in einem Brennstoffzellenfahrzeug verwendet werden. ⓘ
Lithiumalanat (LiAlH4) wurde erstmals 1947 durch Auflösen von Lithiumhydrid in einer Etherlösung von Aluminiumchlorid synthetisiert. LiAlH4 hat eine theoretische gravimetrische Kapazität von 10,5 Gew.-% H2 und dehydriert in den folgenden drei Schritten: 3LiAlH4 ↔ Li3AlH6 + 3H2 + 2Al (423-448 K; 5,3 Gew.-%H2; ∆H = -10 kJ-mol-1 H2); Li3AlH6 ↔ 3LiH + Al + 1. 5H2 (453-493 K; 2,6 Gew.-%H2; ∆H = 25 kJ-mol-1 H2); 3LiH + 3Al ↔ 3LiAl + 3/2H2 (>673 K; 2,6 Gew.-%H2; ∆H = 140 kJ-mol-1 H2). Die ersten beiden Schritte führen zu einer Gesamtmenge an freigesetztem Wasserstoff in Höhe von 7,9 Gew.-%, was für praktische Anwendungen interessant sein könnte, aber die Arbeitstemperaturen und die Desorptionskinetik sind noch weit von den praktischen Zielen entfernt. In den letzten Jahren wurden mehrere Strategien angewandt, um diese Grenzen zu überwinden, z. B. Kugelmahlen und Katalysatorzusätze. ⓘ
Kaliumalanat (KAlH4) wurde erstmals von Ashby et al. durch einstufige Synthese in Toluol, Tetrahydrofuran und Diglyme hergestellt. Was die Wasserstoffabsorptions- und -desorptionseigenschaften betrifft, wurde dieses Alanat nur wenig untersucht. Morioka et al, schlugen durch temperaturprogrammierte Desorptionsanalysen (TPD) den folgenden Dehydrierungsmechanismus vor: 3KAlH4 →K3AlH6 + 2Al + 3H2 (573 K, ∆H = 55 kJ-mol-1 H2; 2. 9 Gew.-%H2), K3AlH6 → 3KH + Al + 3/2H2 (613 K, ∆H = 70 kJ-mol-1 H2; 1,4 Gew.-%H2), 3KH → 3K + 3/2H2 (703 K, 1,4 Gew.-%H2). Diese Reaktionen waren ohne Zugabe von Katalysatoren bei relativ niedrigem Wasserstoffdruck und niedrigen Temperaturen nachweislich reversibel. Es wurde festgestellt, dass die Zugabe von TiCl3 die Arbeitstemperatur des ersten Dehydrierungsschritts um 50 K senkt, für die beiden letzten Reaktionsschritte wurden jedoch keine Veränderungen festgestellt. ⓘ
Organische Wasserstoffträger

Ungesättigte organische Verbindungen können große Mengen an Wasserstoff speichern. Diese flüssigen organischen Wasserstoffträger (Liquid Organic Hydrogen Carriers, LOHC) werden zur Speicherung hydriert und wieder dehydriert, wenn die Energie/der Wasserstoff benötigt wird. Mit LOHCs können relativ hohe gravimetrische Speicherdichten erreicht werden (etwa 6 Gew.-%), und die Gesamtenergieeffizienz ist höher als bei anderen chemischen Speichermöglichkeiten, wie z. B. der Erzeugung von Methan aus dem Wasserstoff. Sowohl für die Hydrierung als auch für die Dehydrierung von LOHCs werden Katalysatoren benötigt. Es wurde nachgewiesen, dass der Ersatz von Kohlenwasserstoffen durch Heteroatome wie N, O usw. die reversiblen De-/Hydrierungseigenschaften verbessert. ⓘ
- Hauptartikel: Chemische Wasserstoffspeicher
Neben den Möglichkeiten der Speicherung von molekularem Wasserstoff gibt es eine ganze Reihe von Möglichkeiten des Transports und der Lagerung in chemisch gebundener Form. Diese Möglichkeiten zählen nicht zur Wasserstoffspeicherung im engeren Sinne, die sich auf den technischen Prozess der Lagerung von molekularem Wasserstoff bezieht. Im Rahmen einer Wasserstoffwirtschaft wird diese Möglichkeit jedoch dazu gezählt, da hier Speicherung und Entnahme von Wasserstoff der Gegenstand des produktiven Prozesses ist. ⓘ
Cycloalkane
Die LOHC-Forschung konzentrierte sich in einem frühen Stadium auf Cycloalkane mit ihrer relativ hohen Wasserstoffkapazität (6-8 Gew.-%) und der Erzeugung von COx-freiem Wasserstoff. Heterozyklische aromatische Verbindungen (oder N-Heterozyklen) sind ebenfalls für diese Aufgabe geeignet. Eine Verbindung, die in der LOHC-Forschung eine wichtige Rolle spielt, ist N-Ethylcarbazol [de] (NEC), aber es gibt noch viele andere. Dibenzyltoluol, das in der Industrie bereits als Wärmeübertragungsflüssigkeit verwendet wird, wurde als potenzieller LOHC identifiziert. Mit einem breiten Flüssigkeitsbereich zwischen -39 °C (Schmelzpunkt) und 390 °C (Siedepunkt) und einer Wasserstoffspeicherdichte von 6,2 Gew.-% ist Dibenzyltoluol ideal als LOHC-Material geeignet. Ameisensäure wurde als vielversprechendes Wasserstoffspeichermaterial mit einer Wasserstoffkapazität von 4,4 Gew.-% vorgeschlagen. ⓘ
Zu den Cycloalkanen, die als LOHC-Materialien genannt werden, gehören Cyclohexan, Methylcyclohexan und Decalin. Die Dehydrierung von Cycloalkanen ist stark endotherm (63-69 kJ/mol H2), was bedeutet, dass dieser Prozess eine hohe Temperatur erfordert. Die Dehydrierung von Dekalin ist unter den drei Cycloalkanen thermodynamisch am günstigsten, und Methyl-Cyclohexan steht wegen der Methylgruppe an zweiter Stelle. Seit Jahrzehnten wird an der Entwicklung von Katalysatoren für die Dehydrierung von Cycloalkanen geforscht. Katalysatoren auf Nickel- (Ni), Molybdän- (Mo) und Platin- (Pt) Basis werden intensiv für die Dehydrierung untersucht. Die Verkokung ist jedoch nach wie vor eine große Herausforderung für die Langzeitstabilität des Katalysators. ⓘ
Die Zugabe eines zweiten Metalls wie W, Ir, Re, Rh und Pd usw. und/oder eines Promotors (z. B. Ca) und die Auswahl eines geeigneten Trägers (z. B. CNF und Al2O3) sind wirksam gegen Verkokung. Für Cyclohexan gibt es zwei Dehydrierungsmechanismen, den Sextett-Mechanismus und den Doublett-Mechanismus. Der Unterschied zwischen den beiden Mechanismen besteht darin, ob es sich um Zwischenprodukte während der Dehydrierung handelt. Beim Sextett-Mechanismus liegt das Cyclohexan auf der Katalysatoroberfläche und wird direkt zu Benzol dehydriert. Im Gegensatz dazu wird bei dem Doppel Mechanismus wird der Wasserstoff aufgrund der C=C-Doppelbindung schrittweise freigesetzt. ⓘ
N-Heterozyklen
Die für die Hydrierung und Dehydrierung erforderliche Temperatur sinkt bei Heterocyclen im Vergleich zu einfachen Carbocyclen erheblich. Unter allen N-Heterocyclen wurde das gesättigt-ungesättigte Paar aus Dodecahydro-N-Ethylcarbazol (12H-NEC) und NEC als vielversprechender Kandidat für die Wasserstoffspeicherung mit einem relativ hohen Wasserstoffgehalt (5,8 Gew.-%) angesehen. Die Abbildung oben rechts zeigt die Dehydrierung und Hydrierung des 12H-NEC- und NEC-Paares. Der Standardkatalysator für die Umwandlung von NEC in 12H-NEC basiert auf Ru und Rh. Die Selektivität der Hydrierung kann 97 % bei 7 MPa und 130 °C-150 °C erreichen. Obwohl N-Heterocyclen die ungünstigen thermodynamischen Eigenschaften von Cycloalkanen optimieren können, bleiben viele Probleme ungelöst, wie hohe Kosten, hohe Toxizität und kinetische Barrieren usw. ⓘ
Ionische Imidazoliumflüssigkeiten wie Alkyl(aryl)-3-methylimidazolium-N-bis(trifluormethansulfonyl)imidat-Salze können in Gegenwart klassischer Pd/C- oder Ir0-Nanopartikelkatalysatoren reversibel 6-12 Wasserstoffatome anlagern und als alternative Materialien für Wasserstoffspeicher an Bord verwendet werden. Diese Salze können bei Atmosphärendruck bis zu 30 g L-1 Wasserstoff speichern. ⓘ
Ameisensäure
Ameisensäure ist ein hochwirksames Wasserstoffspeichermaterial, obwohl ihre H2-Dichte gering ist. Kohlenmonoxidfreier Wasserstoff wurde in einem sehr breiten Druckbereich (1-600 bar) erzeugt. Ein homogenes katalytisches System auf der Basis von wasserlöslichen Ruthenium-Katalysatoren spaltet HCOOH in wässriger Lösung selektiv in H2 und CO2. Dieses Katalysatorsystem überwindet die Einschränkungen anderer Katalysatoren (z. B. geringe Stabilität, begrenzte katalytische Lebensdauer, CO-Bildung) bei der Zersetzung von Ameisensäure und macht sie zu einem brauchbaren Wasserstoffspeicher. Und das Nebenprodukt dieser Zersetzung, Kohlendioxid, kann als Wasserstoffvektor verwendet werden, indem es in einem zweiten Schritt wieder zu Ameisensäure hydriert wird. Die katalytische Hydrierung von CO2 wird seit langem untersucht, und es wurden effiziente Verfahren entwickelt. Ameisensäure enthält bei Raumtemperatur und Atmosphärendruck 53 g L-1 Wasserstoff. In reiner Ameisensäure sind 4,3 Gew.-% Wasserstoff enthalten. Reine Ameisensäure ist eine Flüssigkeit mit einem Flammpunkt von 69 °C (vgl. Benzin -40 °C, Ethanol 13 °C). 85%ige Ameisensäure ist nicht brennbar. ⓘ
Kohlenhydrate
Kohlenhydrate (polymeres C6H10O5) setzen H2 in einem Bioreformer frei, der durch den Biotransformationsweg des Enzyms Cocktail-Cell-free synthetic pathway vermittelt wird. Kohlenhydrate bieten eine hohe Wasserstoffspeicherdichte in flüssiger Form bei geringer Druckbeaufschlagung und kryogenen Beschränkungen: Er kann auch als festes Pulver gespeichert werden. Kohlenhydrate sind die am häufigsten vorkommenden erneuerbaren Bioressourcen der Welt. ⓘ
Polysaccharide (C6H10O5)n durchlaufen eine Hydrolysereaktion C6H10O5 + 7H2O → 12H2 +6CO2. Folglich beträgt die Wasserstoffspeicherdichte in Polysacchariden 14,8 Massenprozent. Kohlenhydrate sind wesentlich kostengünstiger als andere Träger. Die Wasserstofferzeugung aus Kohlenhydraten kann bei milden Bedingungen von 30-80 °C und etwa 1 atm durchgeführt werden, das Verfahren benötigt keinen teuren Hochdruckreaktor, und es wird hochreiner Wasserstoff in Mischung mit CO2 erzeugt, so dass eine zusätzliche Produktreinigung nicht erforderlich ist. Unter den milden Reaktionsbedingungen ist die Trennung von gasförmigen Produkten und wässriger Reaktion einfach und nahezu kostenlos. Außerdem sind erneuerbare Kohlenhydrate nicht brennbar und nicht toxisch. ⓘ
Im Vergleich zu anderen Wasserstoffträgern sind Kohlenhydrate aufgrund ihrer geringen Kosten, ihrer erneuerbaren Quelle und der hohen Reinheit des erzeugten Wasserstoffs sehr attraktiv. ⓘ
Ammoniak und verwandte Verbindungen
Ammoniak
Ammoniak (NH3) setzt in einem geeigneten katalytischen Reformer H2 frei. Ammoniak bietet eine hohe Wasserstoffspeicherdichte als Flüssigkeit mit geringer Druckbeaufschlagung und kryogenen Einschränkungen: Im Gemisch mit Wasser kann es auch bei Raumtemperatur und -druck flüssig gelagert werden. Ammoniak ist die am zweithäufigsten produzierte Chemikalie der Welt, und es existiert eine umfangreiche Infrastruktur für die Herstellung, den Transport und die Verteilung von Ammoniak. Ammoniak kann reformiert werden, um Wasserstoff ohne schädliche Abfälle zu erzeugen, oder es kann mit vorhandenen Brennstoffen gemischt und unter den richtigen Bedingungen effizient verbrannt werden. Da Ammoniak keinen Kohlenstoff enthält, entstehen auch keine kohlenstoffhaltigen Nebenprodukte, so dass diese Möglichkeit eine "kohlenstoffneutrale" Option für die Zukunft darstellt. Reines Ammoniak verbrennt bei den atmosphärischen Drücken, die in erdgasbefeuerten Warmwasserbereitern und Öfen herrschen, nur schlecht. Unter Kompression in einem Automotor ist es ein geeigneter Kraftstoff für leicht modifizierte Benzinmotoren. Ammoniak ist ein geeigneter alternativer Brennstoff, weil es eine Energiedichte von 18,6 MJ/kg bei NTP und kohlenstofffreie Verbrennungsnebenprodukte aufweist. ⓘ
Ammoniak steht einer breiten Anwendung als Wasserstoffspeicher in mehrfacher Hinsicht entgegen. Ammoniak ist ein giftiges Gas mit einem starken Geruch bei Standardtemperatur und -druck. Darüber hinaus sind Fortschritte bei der Effizienz und Skalierbarkeit der Ammoniakzersetzung erforderlich, um eine kommerzielle Nutzung zu ermöglichen, da Brennstoffzellenmembranen sehr empfindlich auf Ammoniakrückstände reagieren und die derzeitigen Zersetzungstechniken nur geringe Ausbeuteraten aufweisen. Als Katalysator für die Ammoniakabbaureaktion können verschiedene Übergangsmetalle eingesetzt werden, wobei Ruthenium am effektivsten ist. Diese Katalyse funktioniert durch Chemisorption, wobei die Adsorptionsenergie von N2 geringer ist als die Reaktionsenergie der Dissoziation. Die Reinigung des Wasserstoffs kann auf verschiedene Weise erfolgen. Wasserstoff kann mithilfe einer durchlässigen, wasserstoffselektiven Membran von nicht umgesetztem Ammoniak getrennt werden. Er kann auch durch die Adsorption von Ammoniak gereinigt werden, das aufgrund seiner Polarität selektiv eingefangen werden kann. ⓘ
Im September 2005 kündigten Chemiker der Technischen Universität Dänemark eine Methode zur Speicherung von Wasserstoff in Form von gesättigtem Ammoniak in einer Salztablette an. Sie behaupten, es handele sich um eine kostengünstige und sichere Speichermethode. ⓘ
positive und negative Eigenschaften von Ammoniak -Pro: Hohe theoretische Energiedichte, weit verbreitete Verfügbarkeit, kommerzielle Produktion in großem Maßstab, gutartiger Zersetzungsweg zu H2 und N2 -Nachteile: Toxizität, ätzend, hohe Zersetzungstemperatur, die zu Effizienzverlusten führt ⓘ
Hydrazin
Hydrazin zerfällt in der Zelle zu Stickstoff und Wasserstoff. Siliziumhydride und Germaniumhydride sind ebenfalls Kandidaten für Wasserstoffspeicher, da sie eine energetisch begünstigte Reaktion zur Bildung kovalent gebundener Dimere unter Verlust eines Wasserstoffmoleküls eingehen können. ⓘ
Chemische Hydride
Chemische Hydride sind irreversible Wasserstoffspeichermaterialien. Die Reaktionen zur Freisetzung von Wasserstoff aus chemischen Hydriden sind in der Regel exotherm, was die Regenerierung des Brennstoffs energieintensiv macht. NaBH4 + 2H2O → NaBO2 + 4H2 + 300 kJ. Die chemische Reaktion bietet das Potenzial für eine hohe Speicherdichte, aber die derzeitigen Systeme erzeugen eine viel geringere effektive Dichte. NaBH4 hat eine theoretische effektive Dichte von 10,8 Gew.-%, in der Realität beträgt die effektive Dichte jedoch nur 1,1 Gew.-%. Beispiele für chemische Hydridreaktionen: NaBH4 (20~35%ige Lösung, stabilisiert mit 1~3% NaOH) + 2H2O (aus Brennstoffzellenabgas) → NaBO2 (Borax in NaOH) + 4H2. 2LiH + 2H2O → 2LiOH + 2H2. ⓘ
Ein führendes chemisches Hydrid ist NH3BH3, das bei Raumtemperatur ein wachsartiger Feststoff mit einem Schmelzpunkt von 90 °C ist. Aus NH3BH3 wird bei 90 °C durch thermische Zersetzung Wasserstoff freigesetzt. NH3BH3 ist ein vielversprechendes Material für die Wasserstoffspeicherung, da es mit 19,6 % einen der höchsten theoretischen Wasserstoffgewichtsanteile und mit 151 kg H2 pro Volumen auch die höchste Wasserstoffvolumendichte aufweist. Die Wasserstofffreisetzung aus NH3BH3 erfolgt schrittweise, wobei die Anfangstemperatur für das erste Äquivalent bei 90 °C und die Temperatur für das zweite Äquivalent bei 150 °C liegt. Der restliche Wasserstoff wird bei einer Temperatur über 150 °C freigesetzt. ⓘ
Aminborane
Vor 1980 wurden mehrere Verbindungen für die Wasserstoffspeicherung untersucht, darunter komplexe Borhydride oder Aluminohydride und Ammoniumsalze. Bei diesen Hydriden ist die theoretische Wasserstoffausbeute auf etwa 8,5 Gew.-% begrenzt. Zu den Verbindungen, die nur B, N und H enthalten (sowohl positive als auch negative Ionen), gehören beispielsweise Aminborane, Borhydridammoniate, Hydrazin-Boran-Komplexe und Ammonium-Octahydrotriborate oder -Tetrahydroborate. Von diesen wurden Aminborane (und insbesondere Ammoniakboran) ausgiebig als Wasserstoffträger untersucht. In den 1970er und 1980er Jahren finanzierten die U.S. Army und die Navy Bemühungen zur Entwicklung von Wasserstoff/Deuteriumgas erzeugenden Verbindungen für den Einsatz in den chemischen HF/DF- und HCl-Lasern sowie in gasdynamischen Lasern. Frühere wasserstoffgaserzeugende Formulierungen verwendeten Aminborane und ihre Derivate. Bei der Zündung der Aminborane entstehen Bornitrid (BN) und Wasserstoffgas. Zusätzlich zu Ammoniakboran (H3BNH3) gehören auch Diborandiammoniat, H2B(NH3)2BH4, zu den Gaserzeugern. ⓘ
Physikalische Speicherung
In diesem Fall verbleibt der Wasserstoff in physikalischer Form, d. h. als Gas, superkritische Flüssigkeit, Adsorbat oder molekulare Einschlüsse. Theoretische Beschränkungen und experimentelle Ergebnisse werden berücksichtigt hinsichtlich der volumetrischen und gravimetrischen Kapazität von Glasmikrogefäßen, mikroporösen und nanoporösen Medien sowie hinsichtlich der Anforderungen an die Sicherheit und die Nachfüllzeit. ⓘ
Poröser oder geschichteter Kohlenstoff
Aktivkohle ist ein hochporöser amorpher Kohlenstoff mit einer großen scheinbaren Oberfläche. Die Wasserstoffphysisorption kann in diesen Materialien durch Vergrößerung der scheinbaren Oberfläche und Optimierung des Porendurchmessers auf etwa 7 Å erhöht werden. Diese Materialien sind von besonderem Interesse, da sie aus Abfallstoffen wie Zigarettenkippen hergestellt werden können, die sich als Ausgangsmaterial für Wasserstoffspeicher mit hoher Kapazität als sehr geeignet erwiesen haben. ⓘ
Graphen kann Wasserstoff effizient speichern. Das H2 addiert sich zu den Doppelbindungen, wodurch Graphan entsteht. Der Wasserstoff wird beim Erhitzen auf 450 °C freigesetzt. ⓘ

Es wurden Wasserstoffträger auf der Grundlage von nanostrukturiertem Kohlenstoff (wie Kohlenstoffbuckyballs und -nanoröhren) vorgeschlagen. Der Wasserstoffgehalt beträgt jedoch nur ≈3,0-7,0 Gew.-% bei 77 K, was weit von dem vom US-Energieministerium festgelegten Wert (6 Gew.-% bei nahezu Umgebungsbedingungen) entfernt ist. ⓘ
Um Kohlenstoffmaterialien als effektive Wasserstoffspeichertechnologien zu realisieren, wurden Kohlenstoffnanoröhren (CNT) mit MgH2 dotiert. Das Metallhydrid hat eine theoretische Speicherkapazität (7,6 Gew.-%), die die Anforderung des US-Energieministeriums von 6 Gew.-% erfüllt, aber aufgrund seiner hohen Freisetzungstemperatur nur begrenzte praktische Anwendungsmöglichkeiten bietet. Der vorgeschlagene Mechanismus beinhaltet die Schaffung von schnellen Diffusionskanälen durch CNTs innerhalb des MgH2-Gitters. Fulleren ist ein weiteres kohlenstoffhaltiges Nanomaterial, das in diesem Zentrum für die Wasserstoffspeicherung getestet wurde. Fulleren-Moleküle bestehen aus einer C60-Struktur mit enger Käfigbindung, die eine Hydrierung der doppelt gebundenen Kohlenstoffe ermöglicht, was zu einem theoretischen C60H60-Isomer mit einem Wasserstoffgehalt von 7,7 Gew.-% führt. Die Freisetzungstemperatur in diesen Systemen ist jedoch hoch (600 °C). ⓘ
Metallorganische Gerüste
Metallorganische Gerüste sind eine weitere Klasse von synthetischen porösen Materialien, die Wasserstoff und Energie auf molekularer Ebene speichern. MOFs sind hochkristalline anorganisch-organische Hybridstrukturen, die Metallcluster oder -ionen (sekundäre Bausteine) als Knotenpunkte und organische Liganden als Linker enthalten. Wenn Gastmoleküle (Lösungsmittel), die die Poren besetzen, durch Lösungsmittelaustausch und Erhitzen im Vakuum entfernt werden, kann die poröse Struktur von MOFs erreicht werden, ohne das Gerüst zu destabilisieren, und Wasserstoffmoleküle werden durch Physisorption an der Oberfläche der Poren adsorbiert. Im Vergleich zu herkömmlichen Zeolithen und porösen Kohlenstoffmaterialien haben MOFs eine sehr hohe Porenzahl und Oberfläche, die eine höhere Wasserstoffaufnahme in einem gegebenen Volumen ermöglichen. Daher ist das Forschungsinteresse an der Wasserstoffspeicherung in MOFs seit 2003, als der erste MOF-basierte Wasserstoffspeicher vorgestellt wurde, gestiegen. Da es unendlich viele geometrische und chemische Variationen von MOFs gibt, die auf unterschiedlichen Kombinationen von SBUs und Linkern beruhen, wird in vielen Forschungsarbeiten untersucht, welche Kombination die maximale Wasserstoffaufnahme durch unterschiedliche Materialien von Metallionen und Linkern ermöglicht. ⓘ
Faktoren, die die Wasserstoffspeicherfähigkeit beeinflussen
Temperatur, Druck und Zusammensetzung von MOFs können ihre Wasserstoffspeicherfähigkeit beeinflussen. Die Adsorptionskapazität von MOFs ist bei höheren Temperaturen geringer und bei niedrigeren Temperaturen höher. Mit zunehmender Temperatur nimmt die Physisorption ab und die Chemisorption zu. Bei MOF-519 und MOF-520 nahm die isosterische Adsorptionswärme mit steigendem Druck ab. Bei MOF-5 nahmen sowohl die gravimetrische als auch die volumetrische Wasserstoffaufnahme mit steigendem Druck zu. Die Gesamtkapazität stimmt möglicherweise nicht mit der nutzbaren Kapazität unter Druckwechsel-Bedingungen überein. So weisen MOF-5 und IRMOF-20, die die höchste volumetrische Gesamtkapazität haben, die geringste nutzbare volumetrische Kapazität auf. Die Absorptionskapazität kann durch Modifikation der Struktur erhöht werden. So ist beispielsweise die Wasserstoffaufnahme von PCN-68 höher als die von PCN-61. Poröse aromatische Gerüste (PAF-1), die als Material mit großer Oberfläche bekannt sind, können durch Dotierung eine größere Oberfläche erhalten. ⓘ
Modifizierung von MOFs
Es gibt viele verschiedene Möglichkeiten, MOFs zu modifizieren, z. B. durch MOF-Katalysatoren, MOF-Hybride, MOF mit Metallzentren und Dotierung. MOF-Katalysatoren haben eine große Oberfläche, Porosität und Wasserstoffspeicherkapazität. Die aktiven Metallzentren sind jedoch gering. MOF-Hybride haben eine größere Oberfläche, Porosität, Ladekapazität und Wasserstoffspeicherkapazität. Sie sind jedoch nicht stabil und haben keine aktiven Zentren. Die Dotierung von MOFs kann die Wasserstoffspeicherkapazität erhöhen, aber es kann zu sterischen Effekten kommen, und die Inertmetalle haben eine unzureichende Stabilität. Bei MOFs mit Metallzentren kann es zur Bildung miteinander verbundener Poren und geringer Korrosionsbeständigkeit kommen, während sie eine gute Bindungsenergie und erhöhte Stabilität aufweisen können. Diese Vor- und Nachteile der verschiedenen Arten von modifizierten MOFs zeigen, dass MOF-Hybride vielversprechender sind, da sich die Auswahl der Materialien für eine hohe Oberfläche, Porosität und Stabilität gut steuern lässt. ⓘ
Im Jahr 2006 erreichten Chemiker Wasserstoffspeicherkonzentrationen von bis zu 7,5 Gew.-% in MOF-74 bei einer niedrigen Temperatur von 77 K. 2009 erreichten Forscher mit dem MOF NOTT-112 10 Gew.-% bei 77 bar (1.117 psi) und 77 K. In den meisten Artikeln über die Wasserstoffspeicherung in MOFs wird über die Wasserstoffaufnahmekapazität bei einer Temperatur von 77 K und einem Druck von 1 bar berichtet, da diese Bedingungen allgemein verfügbar sind und die Bindungsenergie zwischen Wasserstoff und dem MOF bei dieser Temperatur im Vergleich zur thermischen Schwingungsenergie groß ist. Die Variation verschiedener Faktoren wie Oberfläche, Porengröße, Verkettung, Ligandenstruktur und Reinheit der Probe kann zu unterschiedlichen Mengen an Wasserstoffaufnahme in MOFs führen. ⓘ
Im Jahr 2020 berichteten die Forscher, dass NU-1501-Al, ein ultraporöses metallorganisches Gerüst (MOF) auf der Grundlage von dreikernigen Metallclustern, "beeindruckende gravimetrische und volumetrische Speicherleistungen für Wasserstoff und Methan" erbringt, mit einer Wasserstofflieferkapazität von 14,0 % w/w, 46,2 g/Liter. ⓘ
Kryokomprimiert
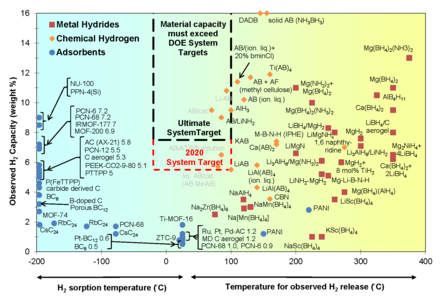
Die kryokomprimierte Speicherung von Wasserstoff ist die einzige Technologie, die die DOE-Ziele für 2015 für die volumetrische und gravimetrische Effizienz erfüllt (siehe "CcH2" auf Folie 6 in ). ⓘ
Darüber hinaus hat eine andere Studie gezeigt, dass die kryokomprimierte Speicherung interessante Kostenvorteile aufweist: Die Betriebskosten (Preis pro Kilometer) und die Kosten des Speichersystems (Preis pro Fahrzeug) sind im Vergleich zu allen anderen Technologien am niedrigsten (siehe dritte Zeile auf Folie 13 in ). Ein System mit kryokomprimiertem Wasserstoff würde beispielsweise 0,12 Dollar pro Kilometer kosten (einschließlich der Kraftstoffkosten und aller damit verbundenen Kosten), während herkömmliche Benzinfahrzeuge zwischen 0,05 und 0,07 Dollar pro Kilometer kosten. ⓘ
Wie bei der Flüssigspeicherung wird auch bei der Kryokompression kalter Wasserstoff (20,3 K und etwas darüber) verwendet, um eine hohe Energiedichte zu erreichen. Der Hauptunterschied besteht jedoch darin, dass der Tank bei der Erwärmung des Wasserstoffs aufgrund der Wärmeübertragung mit der Umgebung ("Boil-Off") auf einen viel höheren Druck gebracht wird (bis zu 350 bar im Gegensatz zu ein paar bar bei der Flüssigspeicherung). Infolgedessen dauert es länger, bis der Wasserstoff entlüftet werden muss, und in den meisten Fahrsituationen wird so viel Wasserstoff verbraucht, dass der Druck weit unter der Entlüftungsgrenze bleibt. ⓘ
Folglich wurde nachgewiesen, dass mit einem kryokomprimierten Tank eine hohe Reichweite erzielt werden kann: mehr als 650 Meilen (1.050 km) wurden mit einem vollen Tank gefahren, der auf einen wasserstoffbetriebenen Motor des Toyota Prius montiert war. Die Forschung ist noch im Gange, um das volle Potenzial dieser Technologie zu untersuchen und zu demonstrieren. ⓘ
Seit 2010 hat die BMW Group auf dem Weg zu einem kommerziellen Produkt mit einer gründlichen Validierung von Komponenten und Systemen für die kryokomprimierte Fahrzeugspeicherung begonnen. ⓘ
Clathrathydrate
Über H2, das in einem Clathrathydrat eingeschlossen ist, wurde zum ersten Mal 2002 berichtet, aber es benötigt sehr hohe Drücke, um stabil zu sein. Im Jahr 2004 wiesen Forscher nach, dass sich feste H2-haltige Hydrate bei Umgebungstemperatur und 10 bar durch Zugabe geringer Mengen an fördernden Substanzen wie THF bilden lassen. Diese Clathrate haben eine theoretische maximale Wasserstoffdichte von etwa 5 Gew.-% und 40 kg/m3. ⓘ
Glas-Kapillar-Arrays
Ein Team aus russischen, israelischen und deutschen Wissenschaftlern hat in Zusammenarbeit eine innovative Technologie auf der Grundlage von Glaskapillaranordnungen für die sichere Infusion, Speicherung und kontrollierte Freisetzung von Wasserstoff in mobilen Anwendungen entwickelt. Die C.En-Technologie hat die Ziele des US-Energieministeriums (DOE) für 2010 für Wasserstoffspeicher an Bord von Fahrzeugen erreicht. Die Ziele des DOE für 2015 können mit flexiblen Glaskapillaren und der kryokomprimierten Methode der Wasserstoffspeicherung erreicht werden. ⓘ
Glas-Mikrokugeln
Mikrohohlkugeln aus Glas (HGM) können für die kontrollierte Speicherung und Freisetzung von Wasserstoff verwendet werden. HGM mit einem Durchmesser von 1 bis 100 μm, einer Dichte von 1,0 bis 2,0 gm/cc und einer porösen Wand mit Öffnungen von 10 bis 1000 Angström kommen für die Wasserstoffspeicherung in Frage. Die Vorteile von HGM für die Wasserstoffspeicherung sind, dass sie ungiftig, leicht, billig, recycelbar, reversibel, unter atmosphärischen Bedingungen leicht zu handhaben sind, in einem Tank gelagert werden können und der Wasserstoff darin nicht explosiv ist. Jedes dieser HGM ist in der Lage, Wasserstoff bis zu 150 MPa zu speichern, ohne die Schwere und den Umfang eines großen Drucktanks. All diese Eigenschaften sind für den Einsatz in Fahrzeugen von Vorteil. Abgesehen von diesen Vorteilen werden HGMs als eine mögliche Wasserstofflösung angesehen, da die Wasserstoffdiffusionsfähigkeit eine große Temperaturabhängigkeit aufweist. Bei Raumtemperatur ist die Diffusionsfähigkeit sehr gering, und der Wasserstoff ist im HGM eingeschlossen. Der Nachteil von HGMs ist, dass die Temperatur mindestens 300 °C betragen muss, um Wasserstoff effektiv ein- und ausgasen zu können, was die Betriebskosten von HGMs für die Wasserstoffspeicherung erheblich erhöht. Die hohe Temperatur kann teilweise darauf zurückgeführt werden, dass Glas ein Isolator ist und eine niedrige Wärmeleitfähigkeit hat; dies behindert die Wasserstoffdiffusionsfähigkeit und erfordert daher eine höhere Temperatur, um die gewünschte Leistung zu erzielen. ⓘ
Um diese Technologie für die kommerzielle Nutzung wirtschaftlicher zu machen, wird daran geforscht, die Effizienz der Wasserstoffdiffusion durch die HGMs zu erhöhen. In einer von Dalai et al. durchgeführten Studie wurde versucht, die Wärmeleitfähigkeit des HGM durch Dotierung des Glases mit Kobalt zu erhöhen. Dabei erhöhten sie die Wärmeleitfähigkeit von 0,0072 auf 0,198 W/m-K bei 10 Gew.-% Co. Ein Anstieg der Wasserstoffadsorption wurde jedoch nur bis zu 2 Gew.-% Co (0,103 W/m-K) festgestellt, da das Metalloxid begann, die Poren in der Glashülle zu bedecken. Diese Studie schloss mit einer Wasserstoffspeicherkapazität von 3,31 Gew.-% bei 2 Gew.-% Co bei 200 °C und 10 bar. ⓘ
In einer Studie von Rapp und Shelby wurde versucht, die Wasserstofffreisetzungsrate durch photoinduzierte Ausgasung in dotierten HGMs im Vergleich zu herkömmlichen Heizmethoden zu erhöhen. Das Glas wurde mit optisch aktiven Metallen dotiert, die mit dem hochintensiven Infrarotlicht wechselwirken. Die Studie ergab, dass bei mit 0,5 Gew.-% Fe3O4 dotiertem Borosilikatglas 7070 die Wasserstofffreisetzung proportional zur Intensität der Infrarotlampe anstieg. Zusätzlich zu den Verbesserungen der Diffusionsfähigkeit allein durch Infrarotlicht erhöhten Reaktionen zwischen dem Wasserstoff und dem eisendotierten Glas das Fe2+/Fe3+-Verhältnis, was die Infrarotabsorption erhöhte und somit die Wasserstoffausbeute weiter steigerte. ⓘ
Durch die Fortschritte bei der Untersuchung der HGMs konnte die Effizienz bis 2020 gesteigert werden, aber die Ziele des Energieministeriums für diese Technologie sind noch nicht erreicht. Die Betriebstemperaturen sowohl für die Wasserstoffadsorption als auch für die Wasserstofffreisetzung sind das größte Hindernis für die Kommerzialisierung. ⓘ
Stationäre Wasserstoffspeicherung
Im Gegensatz zu mobilen Anwendungen stellt die Wasserstoffdichte bei stationären Anwendungen kein großes Problem dar. Wie bei mobilen Anwendungen können auch stationäre Anwendungen auf etablierte Technologien zurückgreifen:
- Komprimierter Wasserstoff (CGH2) in einem Wasserstofftank
- Flüssiger Wasserstoff in einem (LH2)-Tank für kryogenen Wasserstoff
- Slush-Wasserstoff in einem kryogenen Wasserstofftank ⓘ
Unterirdische Wasserstoffspeicherung

Bei der unterirdischen Wasserstoffspeicherung handelt es sich um die Speicherung von Wasserstoff in Kavernen, Salzstöcken und erschöpften Öl- und Gasfeldern. Große Mengen gasförmigen Wasserstoffs werden von ICI seit vielen Jahren problemlos in Kavernen gespeichert. Die unterirdische Speicherung großer Mengen flüssigen Wasserstoffs kann als Netzenergiespeicher fungieren. Der Wirkungsgrad liegt bei etwa 40 % (gegenüber 75-80 % bei der Pumpspeicherung (PHES)), und die Kosten sind etwas höher als bei der Pumpspeicherung, wenn nur eine begrenzte Anzahl von Speicherstunden benötigt wird. In einer anderen Studie, auf die sich ein Arbeitspapier der EU-Kommission bezieht, wird festgestellt, dass Wasserstoff mit 140 €/MWh für 2.000 Speicherstunden unter Verwendung eines Elektrolyseurs, eines Salzkavernenspeichers und eines Kombikraftwerks die günstigste Option für die Speicherung in großem Maßstab ist. Das europäische Projekt Hyunder wies 2013 darauf hin, dass für die Speicherung von Wind- und Solarenergie zusätzliche 85 Kavernen erforderlich sind, da diese nicht durch PHES- und CAES-Systeme abgedeckt werden können. Eine deutsche Fallstudie über die Speicherung von Wasserstoff in Salzkavernen ergab, dass für den Fall, dass der deutsche Stromüberschuss (7 % der gesamten variablen erneuerbaren Erzeugung bis 2025 und 20 % bis 2050) in Wasserstoff umgewandelt und unterirdisch gespeichert würde, diese Mengen bis 2025 etwa 15 Kavernen mit je 500.000 Kubikmetern und bis 2050 etwa 60 Kavernen erfordern würden - was etwa einem Drittel der derzeit in Deutschland betriebenen Gaskavernen entspricht. In den USA erforschen die Sandia Labs die Speicherung von Wasserstoff in erschöpften Öl- und Gasfeldern, die leicht große Mengen an erneuerbar erzeugtem Wasserstoff aufnehmen könnten, da es etwa 2,7 Millionen erschöpfte Bohrlöcher gibt. ⓘ
Power-to-Gas
Power-to-Gas ist eine Technologie, bei der elektrische Energie in einen gasförmigen Brennstoff umgewandelt wird. Es gibt zwei Methoden: Die erste besteht darin, den Strom für die Wasserspaltung zu verwenden und den dabei entstehenden Wasserstoff in das Erdgasnetz einzuspeisen; die zweite, weniger effiziente Methode dient der Umwandlung von Kohlendioxid und Wasserstoff in Methan (siehe Erdgas) durch Elektrolyse und die Sabatier-Reaktion. Eine dritte Möglichkeit ist die Kombination des Wasserstoffs aus der Elektrolyse mit einer Kohlenstoffquelle (entweder Kohlendioxid oder Kohlenmonoxid aus Biogas, aus industriellen Prozessen oder über direkt aus der Luft abgeschiedenes Kohlendioxid) durch Biomethanisierung, bei der Biomethanogene (Archaeen) Kohlendioxid und Wasserstoff verbrauchen und in einer anaeroben Umgebung Methan erzeugen. Dieser Prozess ist sehr effizient, da die Archaeen sich selbst replizieren und nur geringe Wärme (60 °C) für die Reaktion benötigen. ⓘ
Ein weiteres Verfahren wurde von SoCalGas entwickelt, um das Kohlendioxid im Rohbiogas in einem einzigen elektrochemischen Schritt in Methan umzuwandeln, was eine einfachere Methode zur Umwandlung von überschüssigem erneuerbarem Strom in speicherbares Erdgas darstellt. ⓘ
Das Vereinigte Königreich hat Untersuchungen abgeschlossen und bereitet sich auf die Einspeisung von Wasserstoff in das Gasnetz vor, das bisher mit "Stadtgas" versorgt wurde, das zu 50 % aus Wasserstoff und Methan besteht und aus Kohle gewonnen wird. Die Wirtschaftsprüfungsgesellschaft KPMG hat festgestellt, dass die Umstellung des Vereinigten Königreichs auf Wasserstoffgas 150 bis 200 Milliarden Pfund billiger sein könnte als die Umstellung der britischen Haushalte auf eine elektrische Heizung, die mit kohlenstoffärmeren Quellen betrieben wird. ⓘ
Überschüssiger Strom oder Strom, der außerhalb der Spitzenzeiten von Windgeneratoren oder Solaranlagen erzeugt wird, kann dann zum Lastausgleich im Energienetz verwendet werden. Der Brennstoffzellenhersteller Hydrogenics und der Erdgasversorger Enbridge haben sich zusammengetan, um ein solches Power-to-Gas-System in Kanada zu entwickeln. ⓘ
Pipeline-Speicherung von Wasserstoff, bei der ein Erdgasnetz für die Speicherung von Wasserstoff genutzt wird. Vor der Umstellung auf Erdgas wurden die deutschen Gasnetze mit Stadtgas betrieben, das zum größten Teil (60-65%) aus Wasserstoff bestand. Die Speicherkapazität des deutschen Erdgasnetzes beträgt mehr als 200.000 GW-h, was für mehrere Monate Energiebedarf ausreicht. Im Vergleich dazu beträgt die Kapazität aller deutschen Pumpspeicherkraftwerke nur etwa 40 GW-h. Der Energietransport durch ein Gasnetz erfolgt mit wesentlich geringeren Verlusten (<0,1%) als in einem Stromnetz (8%). Die Nutzung der bestehenden Erdgaspipelines für Wasserstoff wurde von NaturalHy untersucht ⓘ
Wasserstoffspeicher in Kraftfahrzeugen
Die Tragbarkeit ist eine der größten Herausforderungen in der Automobilindustrie, wo Speichersysteme mit hoher Dichte aufgrund von Sicherheitsbedenken problematisch sind. Hochdrucktanks wiegen viel mehr als der Wasserstoff, den sie aufnehmen können. Im Toyota Mirai von 2014 enthält ein voller Tank beispielsweise nur 5,7 % Wasserstoff, der Rest des Gewichts entfällt auf den Tank. ⓘ
Das US-Energieministerium hat Ziele für die Wasserstoffspeicherung an Bord von Leichtfahrzeugen festgelegt. Die Liste der Anforderungen umfasst Parameter in Bezug auf die gravimetrische und volumetrische Kapazität, die Betriebsfähigkeit, die Haltbarkeit und die Kosten. Diese Vorgaben wurden als Ziel für einen mehrjährigen Forschungsplan festgelegt, der eine Alternative zu fossilen Kraftstoffen bieten soll. Die FreedomCAR-Partnerschaft, die unter US-Präsident George W. Bush gegründet wurde, setzte Ziele für Wasserstoff-Kraftstoffsysteme für Fahrzeuge. Die Ziele von 2005 wurden nicht erreicht. Die Ziele wurden 2009 überarbeitet, um neue Daten über die Systemeffizienz zu berücksichtigen, die aus Testfahrzeugflotten gewonnen wurden. Im Jahr 2017 wurden die Ziele für 2020 und die Endziele gesenkt, wobei die Endziele auf 65 g H2 pro kg Gesamtsystemgewicht und 50 g H2 pro Liter Systemgewicht festgelegt wurden. ⓘ

Es ist wichtig zu beachten, dass sich diese Ziele auf das Wasserstoffspeichersystem beziehen, nicht auf das Wasserstoffspeichermaterial wie z.B. ein Hydrid. Die Systemdichte ist oft nur halb so hoch wie die des Arbeitsmaterials. Während also ein Material 6 Gew.-% H2 speichern kann, erreicht ein Arbeitssystem, das dieses Material verwendet, nur 3 Gew.-%, wenn man das Gewicht von Tanks, Temperatur- und Druckregelungsanlagen usw. berücksichtigt. ⓘ
Im Jahr 2010 wurden nur zwei Speichertechnologien identifiziert, die das Potenzial haben, die Ziele des DOE zu erreichen: MOF-177 übertrifft die Zielvorgabe für 2010 für die volumetrische Kapazität, während kryokomprimiertes H2 die restriktiveren Ziele für 2015 sowohl für die gravimetrische als auch die volumetrische Kapazität übertrifft (siehe Folie 6 in ). ⓘ
Das Ziel für Fahrzeuge mit Brennstoffzellenantrieb ist eine Reichweite von über 300 Meilen. Ein langfristiges Ziel des US Fuel Cell Technology Office ist die Verwendung von Nanomaterialien zur Verbesserung der maximalen Reichweite. ⓘ
Brennstoffzellen und Speicherung
Aufgrund seiner sauberen Verbrennungseigenschaften ist Wasserstoff eine saubere Kraftstoffalternative für die Autoindustrie. Wasserstoffbasierte Kraftstoffe könnten den Ausstoß von Treibhausgasen wie CO2, SO2 und NOx erheblich reduzieren. Drei Probleme für den Einsatz von Wasserstoff-Brennstoffzellen (HFC) sind die Effizienz, die Größe und die sichere Speicherung des Gases an Bord. Weitere große Nachteile dieser neuen Technologie sind die Kosten, die Betriebsfähigkeit und die Haltbarkeit, die bei den bestehenden Systemen noch verbessert werden müssen. Um diese Probleme zu lösen, wurde die Verwendung von Nanomaterialien als Alternative zu den herkömmlichen Wasserstoffspeichern vorgeschlagen. Der Einsatz von Nanomaterialien könnte ein System mit höherer Dichte bieten und die Reichweite in Richtung des vom DOE gesetzten Ziels von 300 Meilen erhöhen. Kohlenstoffhaltige Materialien wie Kohlenstoffnanoröhren und Metallhydride stehen im Mittelpunkt der Forschung. Sie werden derzeit aufgrund ihrer Vielseitigkeit, ihrer Multifunktionalität, ihrer mechanischen Eigenschaften und ihrer im Vergleich zu anderen Alternativen niedrigen Kosten für Onboard-Speichersysteme in Betracht gezogen. ⓘ
Weitere Vorteile von Nanomaterialien in Brennstoffzellen
Die Einführung von Nanomaterialien in bordeigene Wasserstoffspeichersysteme könnte ein wichtiger Wendepunkt in der Automobilindustrie sein. Die Speicherung ist jedoch nicht der einzige Aspekt der Brennstoffzelle, zu dem Nanomaterialien beitragen können. Verschiedene Studien haben gezeigt, dass die Transport- und katalytischen Eigenschaften von Nafion-Membranen, die in HFKW verwendet werden, mit TiO2/SnO2-Nanopartikeln verbessert werden können. Die erhöhte Leistung wird durch eine Verbesserung der Wasserstoffspaltungskinetik aufgrund der katalytischen Aktivität der Nanopartikel verursacht. Darüber hinaus weist dieses System einen schnelleren Transport von Protonen durch die Zelle auf, was HFCs mit Nanopartikel-Verbundmembranen zu einer vielversprechenden Alternative macht. ⓘ
Eine weitere Anwendung von Nanomaterialien bei der Wasserspaltung wurde von einer Forschungsgruppe an der Manchester Metropolitan University im Vereinigten Königreich vorgestellt, die siebgedruckte Elektroden aus einem graphenartigen Material verwendet. Ähnliche Systeme wurden mit photoelektrochemischen Techniken entwickelt. ⓘ
Wasserstoffspeicherung heute und in Zukunft
Das Forschungsgebiet der Wasserstoffspeichermaterialien ist riesig und umfasst Zehntausende von veröffentlichten Artikeln. Anhand der im Zeitraum 2000 bis 2015 im Web of Science gesammelten und mit der bibliometrischen Software VantagePoint® verarbeiteten Artikel wurde ein szientometrischer Überblick über die Forschung im Bereich Wasserstoffspeichermaterialien erstellt. Der Literatur zufolge durchlief die Wasserstoffenergie in den 2000er Jahren eine Art Hype-Zyklus. Die Forschung auf dem Gebiet der Wasserstoffspeichermaterialien nahm von 2000 bis 2010 in zunehmendem Maße zu. Danach setzte sich das Wachstum fort, allerdings mit abnehmenden Raten, und 2015 wurde ein Plateau erreicht. Betrachtet man die Produktion der einzelnen Länder, so lässt sich eine Unterteilung vornehmen zwischen Ländern, deren Produktion nach 2010 konstant oder leicht rückläufig war, wie die Länder der Europäischen Union, die USA und Japan, und solchen, deren Produktion bis 2015 weiter anstieg, wie China und Südkorea. Die Länder mit den meisten Veröffentlichungen waren China, die EU und die USA, gefolgt von Japan. China blieb während des gesamten Zeitraums führend und hatte einen höheren Anteil an Veröffentlichungen zu Wasserstoffspeichermaterialien an seinem gesamten Forschungsoutput. ⓘ
Unter den Materialklassen waren metallorganische Gerüste die am meisten erforschten Materialien, gefolgt von einfachen Hydriden. Es wurden drei typische Verhaltensweisen festgestellt:
- Neue Materialien, die hauptsächlich nach 2004 erforscht wurden, wie MOFs und Borhydride;
- Klassische Materialien, die während des gesamten Zeitraums mit einer wachsenden Zahl von Veröffentlichungen vertreten sind, wie z. B. einfache Hydride, und
- Materialien mit stagnierender oder rückläufiger Forschung bis zum Ende des Zeitraums, wie AB5-Legierungen und Kohlenstoff-Nanoröhren. ⓘ
Die derzeitigen Physisorptionstechnologien sind jedoch noch weit davon entfernt, kommerziell genutzt zu werden. Die experimentellen Studien werden für kleine Proben unter 100 g durchgeführt. Die beschriebenen Technologien erfordern in der Regel hohen Druck und/oder niedrige Temperaturen. Daher betrachten wir diese Techniken beim derzeitigen Stand der Technik nicht als eigenständige neue Technologie, sondern als eine Art wertvolle Ergänzung zu den derzeitigen Kompressions- und Verflüssigungsmethoden. ⓘ
Physisorptionsprozesse sind reversibel, da keine Aktivierungsenergie beteiligt ist und die Wechselwirkungsenergie sehr gering ist. In Materialien wie metallorganischen Gerüsten, porösen Kohlenstoffen, Zeolithen, Clathraten und organischen Polymeren wird Wasserstoff an der Oberfläche der Poren physisorptiert. Bei diesen Materialklassen hängt die Wasserstoffspeicherkapazität hauptsächlich von der Oberfläche und dem Porenvolumen ab. Die Haupteinschränkung bei der Verwendung dieser Sorbentien als H2-Speichermaterialien ist die schwache van der Waals-Wechselwirkungsenergie zwischen Wasserstoff und der Oberfläche der Sorbentien. Daher haben viele der auf Physisorption basierenden Materialien hohe Speicherkapazitäten bei der Temperatur von flüssigem Stickstoff und hohem Druck, aber ihre Kapazitäten werden bei Umgebungstemperatur und -druck sehr gering. ⓘ
LOHC, flüssige organische Wasserstoffspeichersysteme, sind eine vielversprechende Technik für die zukünftige Wasserstoffspeicherung. LOHC sind organische Verbindungen, die durch chemische Reaktionen Wasserstoff aufnehmen und abgeben können. Diese Verbindungen zeichnen sich dadurch aus, dass sie in einem zyklischen Prozess mit beträchtlichen Mengen an Wasserstoff beladen und entladen werden können. Im Prinzip kann jede ungesättigte Verbindung (organische Moleküle mit C-C-Doppel- oder Dreifachbindungen) bei der Hydrierung Wasserstoff aufnehmen. Diese Technik gewährleistet, dass bei der Wasserstoffspeicherung die Freisetzung von Verbindungen in die Atmosphäre vollständig vermieden wird. Daher sind LOHCs ein attraktiver Weg, um Wind- und Sonnenenergie für Mobilitätsanwendungen in Form von flüssigen energietragenden Molekülen mit ähnlicher Speicherdichte und Handhabbarkeit wie die heutigen fossilen Brennstoffe bereitzustellen. ⓘ
Problemstellung
Wegen seiner chemischen und physikalischen Eigenschaften unterscheidet sich der Umgang mit Wasserstoff von den bisher genutzten Energieträgern. ⓘ
- Wasserstoff bildet beim Austreten ein entzündliches Gemisch mit der Umgebungsluft, bei einem Anteil von 4 % bis 75 %. Ein explosives Gemisch (Knallgas) bildet Wasserstoff erst bei einem Anteil von 18 %. Weil Wasserstoff eine hohe Diffusionsneigung hat und Gemischwolken aus Wasserstoff und Luft eine geringere Dichte als gewöhnliche Luft haben, verflüchtigt es sich in offener Umgebung in der Regel, bevor es ein explosives Gemisch bilden kann, oder es brennt in heißen Umgebungen bereits bei der Konzentration von 4 % ab.
- Wasserstoff hat im Vergleich zu vielen Kohlenwasserstoffen eine niedrige Verbrennungsenthalpie und damit eine niedrige volumenbezogene Energiedichte (ca. 1/3 von Erdgas). Das erfordert zum Speichern äquivalenter Energiemengen einen dreimal so großen Tank oder einen dreimal so hohen Druck wie für Erdgas. Auf Grund der geringen molaren Masse ergibt sich jedoch eine vergleichsweise hohe massenbezogene Energiedichte (z. B. mehr als die doppelte massenbezogene Energiedichte von Erdgas).
- Durch seine geringe Molekülgröße diffundiert Wasserstoff relativ gut durch eine Vielzahl von Materialien, sodass viele Materialien für die Tankhülle ungeeignet sind. Durch hohe Temperaturen und hohen Innendruck wird der Diffusionsprozess verstärkt. Durch Wasserstoffversprödung werden metallische Tankhüllen zusätzlich belastet. Bei Hüllen aus Kunststoff tritt dieser Effekt nicht auf.
- Bei der kryogenen Wasserstoffverflüssigung kommt es durch unvermeidbare thermische Isolationsverluste zum Verdampfen/Ausgasen. Damit der Druck in den Behältern nicht zu hoch steigt, wird das Wasserstoffgas mittels eines Überdruckventils abgelassen. Kann dieses entstehende Wasserstoffgas nicht genutzt werden, entstehen erhebliche Verluste. Beispielsweise leert sich der halbvolle Flüssigwasserstofftank des BMW Hydrogen7 bei Nichtbenutzung in 9 Tagen.
- Nicht nur zur Herstellung von Wasserstoff, sondern auch zur Speicherung werden große Energiemengen benötigt (Kompression ca. 12 %, Verflüssigung ca. 20 %). Daher ist die Wasserstoffspeicherung trotz vieler Vorteile derzeit (2021) oftmals unwirtschaftlich. ⓘ
Arten der Wasserstoffspeicherung
Druckwasserstoffspeicherung

Die Probleme der Speicherung in Druckbehältern gelten heute als gelöst. Waren für den Kfz-Bereich um das Jahr 2000 noch Drucktanks mit 200 bis 350 bar üblich, so sind es 2011 schon 700- und 800-bar-Tanks mit höherer Kapazität. Das komplette Wasserstoff-Tanksystem für einen Pkw soll nur noch 125 kg wiegen. Der Energieaufwand für die Komprimierung auf 700 bar beträgt ca. 12 % des Energieinhaltes des Wasserstoffs. Die heute im kommerziellen Einsatz befindlichen Drucktanks entsprechen allen Sicherheitsanforderungen der Fahrzeughersteller und sind vom TÜV abgenommen. Der immer wieder genannte Schwund durch Diffusion ist und war noch nie ein tatsächliches Problem, da die relative Verlustmenge theoretisch zwar höher ist als bei anderen Gasen, jedoch praktisch keinerlei Relevanz hat, da die Mengen extrem gering sind. ⓘ
Ein Sonderfall der Druckwasserstoffspeicherung mit sehr hoher Speicherkapazität ist die Speicherung in unterirdischen Gasspeichern (z. B. Salzkavernen-Speicher) ähnlich den Speichern im Erdgasnetz. Ebenso können speziell erstellte Rohrleitungen als Speicher dienen. → Siehe : Wasserstoffrohrleitung ⓘ
Flüssigwasserstoffspeicherung

Für große Mengen werden Flüssiggasspeicher eingesetzt. Weil oberhalb des kritischen Punktes (−240 °C, 1,3 MPa = 13,0 bar) keine Druckverflüssigung mehr möglich ist, wird der Wasserstoff zur Verflüssigung stark gekühlt und verdichtet (LH2). ⓘ
Der Energieaufwand dazu lässt sich in folgende Anteile gliedern, jeweils bezogen auf den gespeicherten Energieinhalt:
- 28…46 % für die Verflüssigung je nach Menge und angewandter Methode
- 6 % Transport zwischen Verflüssigungsstation und Tankstelle (Diesel- und Ottokraftstoffe 0,2 %)
- Bis zu 3 % je Tag durch boil-off Verluste (s. u.)
- Verdampfungsverluste beim Umfüllen ⓘ
Der Druck stellt dann für die Gestaltung des Tanks kein Problem mehr dar. Ein großer Aufwand muss aber bei der Wärmedämmung des Tanks und der Leitungen betrieben werden. Vorteilhaft ist die geringere Reaktivität bei tiefen Temperaturen und die um den Faktor 800 höhere Dichte des flüssigen Wasserstoffs im Vergleich zu gasförmigem Wasserstoff bei Umgebungsdruck. Trotzdem benötigt flüssiger Wasserstoff je Gewichtseinheit viel Platz. Er hat mit 71 kg/m³ eine nur minimal höhere Dichte als kleinporig geschäumtes Polystyrol (in einen 20-Liter-Eimer passen nur 1,42 kg Flüssigwasserstoff, das entspricht etwa einem Zehntel dessen von Benzin). Nachteilig ist, dass durch die sehr niedrige Temperatur im Inneren des Tanks auch bei guter Wärmedämmung ein Wärmestrom aus der Umgebung nicht zu vermeiden ist. Dieser führt zu einer teilweisen Verdampfung des Wasserstoffs. Um einen Druckaufbau zu vermeiden, muss dieser Wasserstoff, bei unstetiger oder Nicht-Abnahme des entstehenden Wasserstoffgases, abgelassen werden (sogenannte Boil-Off-Verluste). Durch weitere Maßnahmen (boil off management) lassen sich die Verluste durch Verdunstung minimieren, bei stationären Anwendungen z. B. durch Kopplung mit einem Blockheizkraftwerk (BHKW). ⓘ
Für den Einsatz in Automobilen wurden Tankroboter entwickelt, die die Kopplung und das Betanken übernehmen. Der Energieaufwand zur Verflüssigung fällt nur einmalig an, späteres Umfüllen benötigt relativ wenig Energie, erzeugt aber zusätzliche Ausgasungsverluste. Auch der Transport von der Fabrik mit Tanklastzügen zu Tankstellen/Lagertanks kostet durch das große Volumen und die geringe Energiedichte bis 6 % der eingesetzten Energie – ein Vielfaches gegenüber der Verteilung von flüssigen Kraftstoffen (0,2 %). ⓘ
Transkritische Speicherung (cryo compressed)
Bei beengten Platzverhältnissen ermöglicht die Kombination der oben genannten Varianten wesentlich höhere Speicherdichten von bis zu 100 kg/m³. Dabei erfolgt die Speicherung wie bei der Druckgasspeicherung oberhalb der kritischen Temperatur und des kritischen Druckes bei bis zu 1000 bar. Damit entspricht der Speicherdruck der Druckgasspeicherung, die Speichertemperatur liegt jedoch mit −220 °C (53 K) über der von Flüssigwasserstoff. Dem Vorteil der hohen Speicherdichte steht der notwendige Aufwand für den Drucktank und die thermische Dämmung gegenüber. ⓘ
Metallhydridspeicher
Eine andere Möglichkeit zur Druckverringerung des molekularen Wasserstoffes ist die Lösung in anderen Speichermitteln. Wegen seiner weitgehend elektrisch und magnetisch neutralen Eigenschaften verwendet man kein flüssiges Lösungsmittel, sondern feste Speicherstoffe wie Metallhydride. Der Wasserstoff wird in den Lücken des Metallgitters eingelagert. Dieser Vorgang ist temperaturabhängig, die Speicherfähigkeit sinkt bei hohen Temperaturen, so dass der Wasserstoff bei Erwärmung des Speichers wieder abgegeben/ausgespeichert wird. Ein Kubikmeter Metallhydrid enthält mehr Wasserstoffatome als ein Kubikmeter verflüssigter Wasserstoff. In Metallhydridspeichern kann fünfmal so viel Energie gespeichert werden wie in Bleiakkumulatoren gleichen Gewichts. Sie erwiesen sich aber für eine breite Anwendung als zu teuer, so dass sie nur in U-Booten verwendet werden, wo der Preis keine Rolle spielt. Kritisch für die Auswahl der Materialien sind Absorptions- und Desorptionstemperatur und -druck, bei welchen Wasserstoff gespeichert und wieder abgegeben wird, und das hohe Gewicht des Tanks. ⓘ
Forscher der Université Catholique de Louvain (Katholische Universität Löwen) in Belgien und der Universität Aarhus in Dänemark stellten 2011 eine neue hochporöse Form von Magnesiumborhydrid vor, die Wasserstoff chemisch gebunden und physikalisch adsorbiert speichern kann. Magnesiumborhydrid (Mg(BH4)2) gibt Wasserstoff bereits bei relativ niedrigen Temperaturen ab und speichert einen hohen Gewichtsanteil Wasserstoff (ca. 15 %). ⓘ
Im Februar 2021 veröffentlichte das Fraunhofer-Institut für Fertigungstechnik und Angewandte Materialforschung IFAM in Dresden eine Variante dieser Speicherform, die „Powerpaste“ genannt wird. Hierbei wird Magnesiumhydrid verwendet, um den Wasserstoff bei Raumtemperatur und Umgebungsdruck in Kartuschen zu speichern und bedarfsgerecht wieder freizusetzen. Das Material ist bis zu 250 °C stabil. Weitere Bestandteile sind Ester und Metallsalze. In dieser Form eignet sich die Speicherung besonders für Kleinfahrzeuge wie z. B. Roller, aber auch der Einsatz in Brennstoffzellen-PKW und Hybridfahrzeugen oder Drohnen ist möglich. Dabei wird nur die Hälfte des benötigten Wasserstoffs aus der Powerpaste zur Verfügung gestellt – die andere Hälfte stammt aus einem weiteren Wassertank. In der Kombination entsteht gasförmiger Wasserstoff. Das Institut verspricht eine deutlich höhere Energiedichte als bei herkömmlichen 700 bar-Drucktanks und die zehnfache Energiespeicherdichte wie bei Batterien. Des Weiteren werden Vorteile bei der Infrastruktur hervorgehoben: die Paste ist fließfähig und pumpbar, kann jedoch auch an jeder beliebigen Tankstelle in Kartuschen angeboten werden. Derzeit wird eine Produktionsanlage im Fraunhofer-Projektzentrum für Energiespeicher und Systeme ZESS aufgebaut, die Ende 2021 für ein Pilotprojekt in Betrieb gehen und bis zu vier Tonnen pro Jahr produzieren soll. Nicht betrachtet wurden dabei die Entsorgung des beim Entladungsprozess anfallenden Magnesiumhydroxids bzw. dessen Recyclings. Auch zu Kosten-, Umwelt- und Energiebilanz macht das Institut noch keine Angaben. ⓘ
Adsorptive Speicherung
Durch Anlagerung an die Oberfläche eines hochporösen Materials lässt sich prinzipiell die volumenbezogene Speicherdichte gegenüber Druckwasserstoff bei gleicher Temperatur und gleichem Druck erhöhen. Mögliche Materialien für die adsorptive Wasserstoffspeicherung sind beispielsweise Zeolithe, Metal Organic Frameworks, Carbon Nanotubes oder Aktivkohle. Da bei Raumtemperatur nur sehr wenig Wasserstoff adsorbiert, ist es aus thermodynamischen Gründen erforderlich, Adsorptionsspeicher bei niedrigeren Temperaturen zu betreiben. In einem Großteil der aktuellen Arbeiten zu diesem Thema wird die Aufnahmefähigkeit bei −196 °C (der Temperatur von Flüssigstickstoff) untersucht. Die Abkühlung auf −196 °C zieht einen erheblichen Energiebedarf nach sich. Infolge der sehr niedrigen Temperaturen kommt es darüber hinaus wie bei Flüssigwasserstoff zu einem permanenten Wärmestrom ins Innere des Behälters, was zu Verlusten während der Lagerung führt. Infolgedessen weist Wasserstoffspeicherung durch Adsorption bei niedrigen Temperaturen nur eine sehr geringe Energieeffizienz auf. Um die Verluste zu reduzieren wird gegenwärtig auch nach Materialien gesucht, die bei höheren Temperaturen (z. B. −78 °C; der Temperatur von Trockeneis) eingesetzt werden können. Die Energiedichten sind in diesen Fällen jedoch deutlich geringer und auch wenn höhere Wirkungsgrade erzielt werden können, sind die Verluste immer noch erheblich. ⓘ
Metal Organic Framework
Metall-organische Gerüste (engl. metal-organic frameworks, MOF) sind poröse Materialien mit wohlgeordneter kristalliner Struktur. Sie bestehen aus Komplexen mit Übergangsmetallen (meist Cu-, Zn-, Ni- oder Co) als „Knoten“ und organischen Molekülen (Liganden) als Verbindung („Linker“) zwischen den Knoten. Durch Verwendung geeigneter Knoten und Linker sowie durch Imprägnierung mit anderen Gastspezies können die MOF für die Wasserstoffspeicherung optimiert werden. Die MOF bilden ein aktives Forschungsfeld und werden als eine der vielversprechendsten Technologien zur Wasserstoffspeicherung angesehen. ⓘ
Zeolithe
Zeolithe sind eine weitere Klasse von potentiellen Trägerstoffen, die für die adsorptive Wasserstoffspeicherung vorgeschlagen wurden. Dabei handelt es sich um Alumosilikate mit definierten Porenstrukturen, die eine große innere Oberfläche aufweisen an der Stoffe wie Wasserstoff adsorbieren könnten. ⓘ
Kohlenstoffträger
Verschiedene Hochoberflächenformen von Kohlenstoff wurden ebenfalls als Träger untersucht. Die mit Aktivkohle erzielbaren Speicherdichten sind jedoch sehr gering, so dass verstärkt an Kohlenstoffnanoröhren gearbeitet wurde. Auch auf Kohlenstoffnanoröhren ist die Aufnahmekapazität aber wohl noch so gering, dass die Energiedichte für eine technisch sinnvolle Umsetzung nicht ausreicht. ⓘ
Andere adsorptive Trägermaterialien
Weitere Trägermaterialien wie TiO2-Nanoröhren oder SiC-Nanoröhren werden in der Fachliteratur auf ihre Eignung als Wasserstoffträger untersucht. Die Aufnahmefähigkeit ist dabei wohl etwas höher als bei kohlenstoffbasierten Trägern. Es werden Werte von etwa 2 Gew.-% Wasserstoff bei 60 bar angegeben. ⓘ
Methanol
Geeignet als Wasserstoffträger sind insbesondere Alkohole, z. B. Methanol. Methanol kann durch Reaktion von Wasserstoff mit CO bzw. CO2 hergestellt werden. Mittels Methanol-Reformierung kann man daraus wieder ein wasserstoffreiches Gasgemisch erzeugen. Dieses enthält allerdings erhebliche Anteile von Kohlenstoffmonoxid bzw. -dioxid. Insbesondere Kohlenstoffmonoxid kann bei der Verwendung in der Niedertemperatur-Brennstoffzelle jedoch Probleme verursachen, weshalb bei Brennstoffzellen-Anwendung von Methanol-Reformatgas beispielsweise die gegenüber Kohlenstoffmonoxid tolerantere Hochtemperatur-Polymerelektrolytmembran-Brennstoffzelle (HT-PEMFC) verwendet wird. Vorteile von Methanol sind die leichte Lagerung und Transport, für die keine Kühlung nötig ist, sowie die hohe Energiedichte. Es könnte in vielen Bereichen z. B. im Chemie- oder Verkehrssektor eingesetzt werden. Verglichen mit Methan als Speichermedium entfällt außerdem auch das Risiko von sehr klimaschädlichen Leckagen. ⓘ
Einsatz

Bei den Verfahren zur technischen Speicherung von Wasserstoff in elementarer Form sind Druckbehälter erforderlich, wofür oft eine metallische Außenhülle verwendet wird. Das gilt auch für Flüssiggasspeicher und Metallhydridspeicher, die einen temperaturabhängigen Innendruck aufweisen. Für die Hochdruckspeicherung bei 700 bar finden auch kohlenstofffaserverstärkte Kunststoffe Verwendung, um das Gewicht des Tanks niedrig zu halten. ⓘ
Für große Mengen in stationären Systemen sind derzeit Flüssiggasspeicher in Verwendung. Für kleine Mengen werden Druckspeicher bis 700 bar eingesetzt. Metallhydridspeicher werden dort verwendet wo das Speichergewicht keine große Rolle spielt, etwa auf Schiffen. Für Fahrzeuge und Flugzeuge werden wegen des geringen Gewichtes heute ausschließlich Drucktanks verwendet: Toyota setzt ihn in seinem Brennstoffzellen-Fahrzeug FCHV-adv ein und erreicht damit eine Reichweite von 830 km. Das Fahrzeug befindet sich bereits im kommerziellen Einsatz und kann geleast werden. ⓘ
Volkswagen baut einen 700-bar-Wasserstofftank im Tiguan HyMotion ein, Mercedes im A-Klasse F-Cell „plus“ und Opel im HydroGen4. ⓘ
Bei Bussen werden inzwischen auch Drucktanks verwendet, wie z. B. im Citaro Fuel Cell Hybrid von Mercedes. ⓘ
Firmen, die in die Forschung und Produktion von Wasserstoffspeichern involviert sind, sind z. B. in Deutschland die Linde AG, in Norwegen und Island StatoilHydro und in den USA Quantum Fuel Technologies Worldwide. ⓘ
Unfallgefahr
Die heute industriell eingesetzte Technik berücksichtigt die Hochentzündlichkeit des Wasserstoffes sowie seine Eigenschaft, explosives Knallgas zu bilden. Leitungen und Tanks sind entsprechend ausgelegt, so dass im täglichen Gebrauch keine größeren Risiken entstehen als z. B. durch die Verwendung von Benzin. ⓘ
Wasserstofffahrzeuge mit Drucktanks können problemlos in Parkhäusern und Tiefgaragen geparkt werden. Es existiert keine gesetzliche Bestimmung, die das einschränkt. Fahrzeuge mit Flüssigwasserstoffspeichern dürfen wegen der unvermeidlichen Ausgasung nicht in geschlossenen Räumen abgestellt werden. ⓘ
Energiedichten im Vergleich
Auf die Masse bezogen (in kWh/kg)
- Wasserstoff: 33,3
- Wasserstoff-Speicher mit Perhydro-N-Ethylcarbazol: 1,9
- Erdgas: 13,9
- Benzin: 11,1–11,6 (40,1–41,8 MJ/kg)
- Diesel: 11,8–11,9 (42,8–43.1 MJ/kg)
- Methanol: 6,2
- LOHC (N-Ethylcarbazol): 1,93
- Li-Ionen-Batterie: 0,2 (ca., abhängig vom Typ)
(Quelle:) ⓘ
Auf das Volumen bezogen (in kWh/l)
- Wasserstoffgas (Normaldruck): 0,003
- Wasserstoffgas (20 MPa / 200 bar): 0,53
- Wasserstoffgas (70 MPa / 700 bar): 1,855
- Wasserstoffspeicherung mit Perhydro-N-Ethylcarbazol: 2,0
- Wasserstoff (flüssig, −253 °C): 2,36
- Erdgas (unter Druck bei 20 MPa): 2,58
- Methanol: 4,99
- Benzin: 8,2–8,6
- Diesel: 9,7
- LOHC (N-Ethylcarbazol): 1,89
- Li-Ionen-Batterie: 0,25–0,675 ⓘ