Wasserstoffherstellung
Unter Wasserstofferzeugung versteht man die Familie der industriellen Verfahren zur Erzeugung von Wasserstoffgas. Ab 2020 wird der größte Teil des Wasserstoffs (∼95 %) aus fossilen Brennstoffen durch Dampfreformierung von Erdgas und anderen leichten Kohlenwasserstoffen, partielle Oxidation von schwereren Kohlenwasserstoffen und Kohlevergasung hergestellt. Weitere Methoden der Wasserstofferzeugung sind die Vergasung von Biomasse, die CO2-freie Methanpyrolyse und die Elektrolyse von Wasser. Die letztgenannten Verfahren, die Methanpyrolyse und die Wasserelektrolyse, können direkt mit einer beliebigen Stromquelle, z. B. mit Sonnenenergie, betrieben werden. ⓘ
Die Herstellung von Wasserstoff spielt in jeder Industriegesellschaft eine wichtige Rolle, da Wasserstoff für viele wichtige chemische Prozesse benötigt wird. Im Jahr 2020 wurden weltweit etwa 87 Millionen Tonnen Wasserstoff für verschiedene Verwendungszwecke produziert, z. B. bei der Ölraffination, bei der Herstellung von Ammoniak (NH3) (durch das Haber-Verfahren) und Methanol (CH3OH) (durch Reduktion von Kohlenmonoxid [CO]) sowie als Kraftstoff im Verkehrswesen. Der weltweite Markt für die Wasserstofferzeugung wurde 2021 auf 135,94 Milliarden US-Dollar geschätzt und wird bis 2030 voraussichtlich auf 219,2 Milliarden US-Dollar anwachsen, mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 5,4 % von 2021 bis 2030. ⓘ

Mit Wasserstoffherstellung wird die Bereitstellung von molekularem Wasserstoff (H2) bezeichnet. Als Rohstoffe können Wasser (H2O), Erdgas, das vor allem aus Methan (CH4) besteht, andere Kohlenwasserstoffe, Kohle, Biomasse sowie andere wasserstoffhaltige Verbindungen eingesetzt werden. Als Energiequelle dient chemische Energie oder von außen zugeführte elektrische, thermische oder solare Energie. ⓘ
Methoden der Wasserstoffproduktion

Es gibt vier Hauptquellen für die kommerzielle Herstellung von Wasserstoff: Erdgas, Erdöl, Kohle und Elektrolyse, auf die 48 %, 30 %, 18 % bzw. 4 % der weltweiten Wasserstoffproduktion entfallen. Fossile Brennstoffe sind die wichtigste Quelle für industriellen Wasserstoff. Kohlendioxid kann für die Wasserstoffproduktion mit einem Wirkungsgrad von 70-85 % aus Erdgas und mit unterschiedlichem Wirkungsgrad aus anderen Kohlenwasserstoffen abgetrennt werden. Wasserstoff in großen Mengen wird in der Regel durch die Dampfreformierung von Methan oder Erdgas hergestellt. ⓘ
Dampf-Methan-Reformierung
Bei der Dampfreformierung wird aus Kohlenwasserstoffen in zwei Prozessschritten Wasserstoff erzeugt. Als Rohstoffe können verwendet werden: Erdgas, Biomasse, aber auch langkettigere Kohlenwasserstoffe aus Erdöl wie etwa die Mittelbenzinfraktion. Dieses Verfahren ist etabliert und wird in Anlagen mit Kapazitäten von bis zu 100.000 m³/h umgesetzt. ⓘ
Im ersten Schritt werden langkettige Kohlenwasserstoffe in einem Pre-Reformer unter Zugabe von Wasserdampf bei einer Temperatur von etwa 450 bis 500 °C und einem Druck von etwa 25 bis 30 bar zu Methan, Wasserstoff, Kohlenstoffmonoxid sowie Kohlenstoffdioxid aufgespalten. Diese Vorstufe vermeidet eine zu starke Verkokung des Reformerkatalysators. Im zweiten Schritt wird im Reformer das Methan bei einer Temperatur von 800 bis 900 °C und einem Druck von etwa 25 bis 30 bar an einem Nickelkatalysator mit Wasser zu Kohlenstoffmonoxid und Wasserstoff umgesetzt. Dem zweiten Schritt ist in der Regel eine Raffinationsanlage zur Gasaufbereitung vorgeschaltet, da Katalysatoren äußerst empfindlich auf Schwefel- und Halogenverbindungen, insbesondere Chlor (Katalysatorgifte), reagieren. ⓘ
- allgemeine Gleichung:
- Beispiel Methan: ; ⓘ
Das durch unvollständige Umsetzung erzeugte Zwischenprodukt Kohlenstoffmonoxid wird anschließend noch mit Hilfe der Wassergas-Shift-Reaktion an einem Eisen(III)-oxidkatalysator zu Kohlenstoffdioxid und Wasserstoff umgesetzt. Um im abschließenden Schritt Reinstwasserstoff zu gewinnen, nutzt man in der Praxis häufig Druckwechsel-Adsorptionsanlagen oder Lauge-Absorptionsgaswäschen, die Nebenprodukte wie CO, CO2 und CH4 bis auf einige wenige ppm herausfiltern. ⓘ
Die Dampfreformierung ist die wirtschaftlichste und am weitesten verbreitete (~90 %) Methode, Wasserstoff zu erzeugen. Aufgrund der Verwendung fossiler Energieträger wird dabei aber genauso viel von dem Treibhausgas Kohlenstoffdioxid CO2 freigesetzt wie bei deren Verbrennung. Durch Verwendung von Biomasse kann die Klimabilanz verbessert werden, da dann nur das Kohlenstoffdioxid freigesetzt wird, das die Pflanzen zuvor beim Wachsen aus der Atmosphäre aufgenommen haben. ⓘ
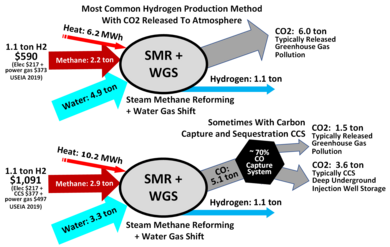
Die Dampf-Methan-Reformierung (SMR) ist ein Verfahren zur Herstellung von Wasserstoff aus Erdgas, das hauptsächlich aus Methan (CH4) besteht. Sie ist derzeit die billigste Quelle für industriellen Wasserstoff. Nahezu 50 % des weltweiten Wasserstoffs werden mit dieser Methode hergestellt. Das Verfahren besteht darin, das Gas in Gegenwart von Dampf und einem Nickelkatalysator auf 700-1.100 °C zu erhitzen. Die dabei entstehende endotherme Reaktion spaltet die Methanmoleküle auf und bildet Kohlenmonoxid und molekularen Wasserstoff (H2). Das Kohlenmonoxidgas kann dann mit Wasserdampf über Eisenoxid oder andere Oxide geleitet werden und eine Wasser-Gas-Shift-Reaktion durchlaufen, um weitere Mengen an H2 zu erhalten. Der Nachteil dieses Verfahrens besteht darin, dass als Nebenprodukte in großem Umfang CO2, CO und andere Treibhausgase in die Atmosphäre freigesetzt werden. Je nach Qualität des Ausgangsmaterials (Erdgas, reiche Gase, Naphtha usw.) entstehen bei der Herstellung einer Tonne Wasserstoff auch 9 bis 12 Tonnen CO2, ein Treibhausgas, das abgeschieden werden kann. ⓘ
Bei diesem Prozess reagiert Hochtemperaturdampf (H2O) mit Methan (CH4) in einer endothermen Reaktion, um Synthesegas zu erzeugen. ⓘ
Im Wesentlichen wird das Sauerstoffatom (O) aus dem zusätzlichen Wasser (Dampf) herausgelöst, um CO zu CO2 zu oxidieren. Diese Oxidation liefert auch Energie, um die Reaktion aufrechtzuerhalten. Die zusätzliche Wärme, die zum Antrieb des Prozesses benötigt wird, wird im Allgemeinen durch die Verbrennung eines Teils des Methans bereitgestellt. ⓘ
Andere Produktionsmethoden aus fossilen Brennstoffen
Pyrolyse von Methan

Die Pyrolyse von Methan ist ein Verfahren zur Herstellung von Wasserstoff aus Erdgas. Die Abtrennung des Wasserstoffs erfolgt in einem Schritt durch Durchströmen eines geschmolzenen Metallkatalysators in einer "Blasensäule". Es handelt sich um ein "treibhausgasfreies" Verfahren für eine potenziell kostengünstige Wasserstofferzeugung, das auf seine Eignung zur Maßstabsvergrößerung und zum Betrieb in großem Maßstab geprüft wird. Das Verfahren wird bei höheren Temperaturen (1065 °C oder 1950 °F) durchgeführt. Andere Formen der Methanpyrolyse, wie z. B. die thermokatalytische Zersetzung von Methan, können jedoch je nach gewähltem Katalysator bei einer niedrigeren Temperatur zwischen 600 °C und 1000 °C betrieben werden. ⓘ
Der feste Kohlenstoff in Industriequalität kann dann als Ausgangsmaterial für die Herstellung verkauft oder auf einer Deponie entsorgt werden, er wird nicht in die Atmosphäre freigesetzt und verschmutzt das Grundwasser in Deponien nicht. ⓘ
Partielle Oxidation
Die Wasserstofferzeugung aus schweren Kohlenwasserstoffen, die für die katalytische Dampfreformierung ungeeignet sind, wird durch partielle Oxidation erreicht. Ein Kraftstoff-Luft- oder Kraftstoff-Sauerstoff-Gemisch wird teilweise verbrannt, wobei ein wasserstoff- und kohlenmonoxidreiches Synthesegas entsteht. Durch die Wasser-Gas-Shift-Reaktion werden dann aus Kohlenmonoxid (und Wasser) mehr Wasserstoff und Kohlendioxid gewonnen. Kohlendioxid kann beigemischt werden, um das Verhältnis von Wasserstoff zu Kohlenmonoxid zu senken. ⓘ
Die partielle Oxidationsreaktion findet statt, wenn ein unterstöchiometrisches Brennstoff-Luft-Gemisch oder Brennstoff-Sauerstoff-Gemisch in einem Reformer oder Partialoxidationsreaktor teilweise verbrannt wird. Man unterscheidet zwischen thermischer Partialoxidation (TPOX) und katalytischer Partialoxidation (CPOX). Die chemische Reaktion hat die allgemeine Form:
- CnHm + n/2 O2 → n CO + m/2 H2 ⓘ
Idealisierte Beispiele für Heizöl und Kohle, die die Zusammensetzung C12H24 bzw. C24H12 annehmen, sind wie folgt:
- C12H24 + 6 O2 → 12 CO + 12 H2
- C24H12 + 12 O2 → 24 CO + 6 H2 ⓘ
Meist wird noch Wasser zugesetzt, um sowohl die extremen Temperaturen als auch die Rußbildung in den Griff zu bekommen, sodass man von einer autothermen Reformierung mit wenig Wasser sprechen müsste. Die partielle Oxidation gilt als technisch ausgereift. ⓘ
In kohlereichen Ländern wie China oder Südafrika kann als Ausgangsstoff für dieses Verfahren auch Kohle genutzt werden, die vorher zermahlen und mit Wasser zu einer Suspension vermischt wird. ⓘ
Plasma-Reformierung
Das von dem norwegischen Unternehmen Kværner entwickelte Verfahren trennt Kohlenwasserstoffe in einem Plasmabrenner bei 1600 °C vollständig in Aktivkohle (reinen Kohlenstoff) und Wasserstoff.
- allgemeine Reaktionsgleichung:
- Reaktionsgleichung für Methan: ⓘ
Eine 1992 in Kanada erbaute Pilotanlage erreichte einen Wirkungsgrad von nahezu 100 % – allerdings nur unter der Voraussetzung, dass die dabei entstehende Abwärme vollständig genutzt wird. Der Energiegehalt der Reaktionsprodukte dieses Verfahrens verteilt sich etwa 48 % auf Wasserstoff, etwa 40 % auf Aktivkohle und etwa 10 % auf Heißdampf. ⓘ
Eine Variante dieses Prozesses wird 2009 vorgestellt, bei der in einem Plasmakonverter Wasserstoff, Wärme und Kohlenstoff aus Methan und Erdgas gewonnen werden. ⓘ
Aus Kohle
Für die Herstellung von Wasserstoff aus Kohle wird die Kohlevergasung eingesetzt. Bei der Kohlevergasung werden mit Hilfe von Dampf und Sauerstoff die molekularen Bindungen in der Kohle aufgebrochen und ein gasförmiges Gemisch aus Wasserstoff und Kohlenmonoxid gebildet. Kohlendioxid und Schadstoffe lassen sich aus dem durch Kohlevergasung gewonnenen Gas leichter entfernen als aus der Kohleverbrennung. Eine weitere Methode der Umwandlung ist die Verkohlung von Kohle bei niedrigen und hohen Temperaturen. ⓘ
Kokereigas aus der Pyrolyse (sauerstofffreie Erhitzung) von Kohle enthält etwa 60 % Wasserstoff, der Rest besteht aus Methan, Kohlenmonoxid, Kohlendioxid, Ammoniak, molekularem Stickstoff und Schwefelwasserstoff (H2S). Wasserstoff kann durch das Druckschwingungsadsorptionsverfahren von anderen Verunreinigungen getrennt werden. Japanische Stahlunternehmen haben dieses Verfahren zur Herstellung von Wasserstoff angewandt. ⓘ
Aus Petrolkoks
Petrolkoks kann auch durch Kohlevergasung in wasserstoffreiches Synthesegas umgewandelt werden. Das erzeugte Synthesegas besteht hauptsächlich aus Wasserstoff, Kohlenmonoxid und H2S, das aus dem Schwefel im Kokseinsatz stammt. Die Vergasung ist eine Option zur Erzeugung von Wasserstoff aus fast jeder Kohlenstoffquelle. ⓘ
Aus Wasser
Methoden zur Erzeugung von Wasserstoff ohne den Einsatz fossiler Brennstoffe beruhen auf dem Prozess der Wasserspaltung, d. h. der Aufspaltung des Wassermoleküls (H2O) in seine Bestandteile Sauerstoff und Wasserstoff. Wenn die Energiequelle für die Wasserspaltung erneuerbar oder kohlenstoffarm ist, wird der erzeugte Wasserstoff manchmal auch als grüner Wasserstoff bezeichnet. Die Umwandlung kann auf verschiedene Weise erfolgen, aber alle Methoden sind im Allgemeinen teurer als die auf fossilen Brennstoffen basierenden Produktionsmethoden. ⓘ
Elektrolyse

Im Jahr 2020 werden weltweit etwa 8 GW Elektrolysekapazität installiert sein, was etwa 4 % der globalen Wasserstoffproduktion entspricht. ⓘ
Bei der Elektrolyse wird Wasser mithilfe von Strom in Wasserstoff und Sauerstoff aufgespalten. Die Elektrolyse von Wasser hat einen Wirkungsgrad von 70-80 % (mit einem Umwandlungsverlust von 20-30 %), während die Dampfreformierung von Erdgas einen thermischen Wirkungsgrad von 70-85 % hat. Es wird erwartet, dass der elektrische Wirkungsgrad der Elektrolyse bis zum Jahr 2030 82-86 % erreichen wird, wobei gleichzeitig die Haltbarkeit beibehalten wird, da die Fortschritte in diesem Bereich rasant zunehmen. ⓘ
Die Wasserelektrolyse kann bei einer Temperatur von 50-80 °C betrieben werden, während für die Methanreformierung mit Dampf Temperaturen zwischen 700-1.100 °C erforderlich sind. Der Unterschied zwischen den beiden Verfahren liegt in der verwendeten Primärenergie, entweder Elektrizität (bei der Elektrolyse) oder Erdgas (bei der Methandampfreformierung). Aufgrund der Verwendung von Wasser, einer leicht verfügbaren Ressource, haben die Elektrolyse und ähnliche Wasserspaltungsmethoden das Interesse der wissenschaftlichen Gemeinschaft geweckt. Mit dem Ziel, die Kosten der Wasserstofferzeugung zu senken, wurden erneuerbare Energiequellen für die Elektrolyse erschlossen. ⓘ
Es gibt drei Haupttypen von Elektrolysezellen: Festoxid-Elektrolysezellen (SOEC), Polymer-Elektrolyt-Membran-Zellen (PEM) und alkalische Elektrolysezellen (AEC). Alkalische Elektrolyseure sind in der Regel kostengünstiger (sie verwenden in der Regel Nickelkatalysatoren), aber weniger effizient; PEM-Elektrolyseure hingegen sind teurer (sie verwenden in der Regel teure Katalysatoren aus Platingruppenmetallen), aber effizienter und können mit höheren Stromdichten arbeiten, so dass sie möglicherweise billiger sind, wenn die Wasserstoffproduktion groß genug ist. ⓘ
SOECs arbeiten bei hohen Temperaturen, in der Regel bei etwa 800 °C (1.470 °F). Bei diesen hohen Temperaturen kann ein erheblicher Teil der benötigten Energie als thermische Energie (Wärme) bereitgestellt werden, was als Hochtemperaturelektrolyse bezeichnet wird. Die Wärmeenergie kann aus verschiedenen Quellen stammen, z. B. aus industrieller Abwärme, Kernkraftwerken oder konzentrierten solarthermischen Anlagen. Dies hat das Potenzial, die Gesamtkosten des erzeugten Wasserstoffs zu senken, da weniger elektrische Energie für die Elektrolyse benötigt wird. PEM-Elektrolysezellen arbeiten in der Regel bei Temperaturen unter 100 °C (212 °F). Diese Zellen haben den Vorteil, dass sie vergleichsweise einfach sind und für sehr unterschiedliche Spannungen ausgelegt werden können, was sie ideal für den Einsatz mit erneuerbaren Energiequellen wie photovoltaischen Solarzellen macht. AECs funktionieren optimal bei hohen Elektrolytkonzentrationen (KOH oder Kaliumkarbonat) und hohen Temperaturen, oft nahe 200 °C (392 °F). ⓘ
Industrielle Leistung und Effizienz
Der Wirkungsgrad moderner Wasserstoffgeneratoren wird anhand des Energieverbrauchs pro Standardvolumen an Wasserstoff (MJ/m3) gemessen, wobei von einer Standardtemperatur und einem Standarddruck des H2 ausgegangen wird. Je weniger Energie ein Generator verbraucht, desto höher ist sein Wirkungsgrad; ein Elektrolyseur mit 100 % Wirkungsgrad würde 39,4 Kilowattstunden pro Kilogramm (142 MJ/kg) Wasserstoff verbrauchen, was 12.749 Joule pro Liter (12,75 MJ/m3) entspricht. Bei der praktischen Elektrolyse wird in der Regel ein rotierender Elektrolyseur verwendet, bei dem die Zentrifugalkraft dazu beiträgt, Gasblasen vom Wasser zu trennen. Ein solcher Elektrolyseur kann bei einem Druck von 15 bar 50 Kilowattstunden pro Kilogramm (180 MJ/kg) verbrauchen, und weitere 15 Kilowattstunden (54 MJ), wenn der Wasserstoff für die Verwendung in Wasserstoffautos komprimiert wird. ⓘ
Die herkömmliche alkalische Elektrolyse hat einen Wirkungsgrad von etwa 70 %, es gibt jedoch fortschrittliche alkalische Wasserelektrolyseure mit einem Wirkungsgrad von bis zu 82 %. Unter Berücksichtigung der Nutzung des höheren Wärmewertes (da ineffiziente Wärme in das System zurückgeführt werden kann, um den für den Katalysator erforderlichen Dampf zu erzeugen) liegt der durchschnittliche Wirkungsgrad der PEM-Elektrolyse bei etwa 80 % bzw. 82 % bei den modernsten alkalischen Elektrolyseuren. ⓘ
Es wird erwartet, dass der Wirkungsgrad der PEM-Elektrolyse bis 2030 auf etwa 86 % ansteigen wird. Der theoretische Wirkungsgrad von PEM-Elektrolyseuren wird auf bis zu 94 % vorausgesagt. ⓘ

Ab 2020 liegen die Kosten für Wasserstoff durch Elektrolyse bei etwa 3-8 $/kg. Betrachtet man die industrielle Produktion von Wasserstoff und verwendet die derzeit besten Verfahren für die Wasserelektrolyse (PEM oder alkalische Elektrolyse), die einen effektiven elektrischen Wirkungsgrad von 70-82 % haben, so erfordert die Herstellung von 1 kg Wasserstoff (der eine spezifische Energie von 143 MJ/kg oder etwa 40 kWh/kg hat) 50-55 kWh Strom. Bei Stromkosten von 0,06 $/kWh, wie sie in den Wasserstoffproduktionszielen des Energieministeriums für 2015 festgelegt sind, betragen die Wasserstoffkosten 3 $/kg. Der Zielpreis des US-Energieministeriums für Wasserstoff im Jahr 2020 liegt bei 2,30 $/kg, was Stromkosten von 0,037 $/kWh erfordert, was angesichts der jüngsten PPA-Ausschreibungen für Wind- und Solarenergie in vielen Regionen erreichbar ist. Der Bericht von IRENA.ORG ist ein umfassender Tatsachenbericht über die derzeitige industrielle Wasserstoffproduktion, die etwa 53 bis 70 kWh pro kg verbraucht und auf etwa 45 kWh/kg H2 sinken könnte. Die thermodynamische Energie, die für Wasserstoff durch Elektrolyse benötigt wird, liegt bei 33 kWh/kg, was höher ist als die Dampfreformierung mit Kohlenstoffabscheidung und höher als die Methanpyrolyse. Einer der Vorteile der Elektrolyse gegenüber Wasserstoff aus der Methandampfreformierung (SMR) besteht darin, dass der Wasserstoff vor Ort erzeugt werden kann, was bedeutet, dass die kostspielige Lieferung per LKW oder Pipeline entfällt. ⓘ
Die Methandampfreformierung kostet im Durchschnitt zwischen 1 und 3 $/kg. Dies macht die Herstellung von Wasserstoff durch Elektrolyse in vielen Regionen bereits wettbewerbsfähig, wie von Nel Hydrogen und anderen dargelegt, einschließlich eines Artikels der IEA, der die Bedingungen untersucht, die zu einem Wettbewerbsvorteil für die Elektrolyse führen könnten. ⓘ
Chemisch unterstützte Elektrolyse
Neben der Verringerung der für die Elektrolyse erforderlichen Spannung durch Erhöhung der Temperatur der Elektrolysezelle ist es auch möglich, den in einem Elektrolyseur erzeugten Sauerstoff elektrochemisch zu verbrauchen, indem ein Brennstoff (wie Kohlenstoff/Kohle, Methanol, Ethanol, Ameisensäure, Glycerin usw.) in die Sauerstoffseite des Reaktors eingebracht wird. Dadurch wird die benötigte elektrische Energie reduziert und die Kosten für Wasserstoff können auf weniger als 40 bis 60 % gesenkt werden, wobei die restliche Energie auf diese Weise bereitgestellt wird. Darüber hinaus hat die kohlenstoff-/kohlenwasserstoffunterstützte Wasserelektrolyse (CAWE) das Potenzial, eine weniger energieintensive, sauberere Methode zur Nutzung chemischer Energie in verschiedenen Kohlenstoffquellen wie Kohle mit niedrigem und hohem Schwefelgehalt, Biomasse, Alkoholen und Methan (Erdgas) zu bieten, bei der das erzeugte reine CO2 leicht ohne Abtrennung abgeschieden werden kann. ⓘ
Radiolyse
Nukleare Strahlung kann durch Radiolyse Wasserbindungen aufbrechen. In der Mponeng-Goldmine, Südafrika, fanden Forscher Bakterien in einer natürlich vorkommenden Zone mit hoher Strahlung. Die bakterielle Gemeinschaft, die von einem neuen Phylotyp von Desulfotomaculum dominiert wurde, ernährte sich hauptsächlich von radioaktiv erzeugtem Wasserstoff. ⓘ
Thermolyse
Wasser dissoziiert spontan bei etwa 2500 °C, aber diese Thermolyse findet bei Temperaturen statt, die für die üblichen Prozessleitungen und -ausrüstungen zu hoch sind, was zu einem eher geringen Kommerzialisierungspotenzial führt. ⓘ
Thermochemischer Kreislauf
Thermochemische Zyklen kombinieren ausschließlich Wärmequellen (Thermo) mit chemischen Reaktionen, um Wasser in seine Wasserstoff- und Sauerstoffkomponenten aufzuspalten. Der Begriff Kreislauf wird verwendet, weil neben Wasser, Wasserstoff und Sauerstoff auch die chemischen Verbindungen, die in diesen Prozessen verwendet werden, ständig recycelt werden. Wird teilweise Strom als Input verwendet, wird der resultierende thermochemische Kreislauf als Hybridkreislauf bezeichnet. ⓘ
Der Schwefel-Jod-Zyklus (S-I-Zyklus) ist ein thermochemischer Kreislaufprozess, der mit einem Wirkungsgrad von etwa 50 % Wasserstoff aus Wasser erzeugt. Der Schwefel und das Jod, die in diesem Prozess verwendet werden, werden zurückgewonnen und wiederverwendet und nicht durch den Prozess verbraucht. Der Zyklus kann mit jeder Quelle sehr hoher Temperaturen (ca. 950 °C) betrieben werden, z. B. mit konzentrierenden Solarenergiesystemen (CSP), und gilt als gut geeignet für die Erzeugung von Wasserstoff durch Hochtemperatur-Kernreaktoren, weshalb er im Hochtemperatur-Testreaktor in Japan untersucht wird. Es gibt noch weitere hybride Zyklen, die sowohl hohe Temperaturen als auch Elektrizität nutzen, wie z. B. der Kupfer-Chlor-Zyklus. Er wird als hybrider thermochemischer Zyklus eingestuft, weil er in einem der Reaktionsschritte eine elektrochemische Reaktion nutzt, bei 530 °C arbeitet und einen Wirkungsgrad von 43 % hat. ⓘ
Ferrosilizium-Verfahren
Ferrosilizium wird vom Militär verwendet, um schnell Wasserstoff für Ballons zu erzeugen. Für die chemische Reaktion werden Natriumhydroxid, Ferrosilizium und Wasser verwendet. Der Generator ist so klein, dass er in einen Lastwagen passt und nur wenig Strom benötigt. Die Materialien sind stabil und nicht brennbar und erzeugen erst nach dem Mischen Wasserstoff. Ein schwerer Stahldruckbehälter wird mit Natriumhydroxid und Ferrosilizium gefüllt, verschlossen und mit einer kontrollierten Menge Wasser gefüllt; durch das Auflösen des Hydroxids wird das Gemisch auf etwa 93 °C erhitzt und die Reaktion gestartet; es entstehen Natriumsilikat, Wasserstoff und Dampf. ⓘ
Photobiologische Wasserspaltung

Biologischer Wasserstoff kann in einem Algen-Bioreaktor hergestellt werden. In den späten 1990er Jahren wurde entdeckt, dass die Algen, wenn ihnen Schwefel entzogen wird, von der Sauerstoffproduktion, d. h. der normalen Photosynthese, auf die Produktion von Wasserstoff umschalten. Es scheint, dass die Produktion nun wirtschaftlich durchführbar ist, da die Grenze von 7-10 % Energieeffizienz (Umwandlung von Sonnenlicht in Wasserstoff) überschritten wurde, mit einer Wasserstoffproduktionsrate von 10-12 ml pro Liter Kultur pro Stunde. ⓘ
Photokatalytische Wasserspaltung
Die Umwandlung von Sonnenenergie in Wasserstoff durch Wasserspaltung ist eine der interessantesten Möglichkeiten, saubere und erneuerbare Energiesysteme zu schaffen. Wenn dieser Prozess jedoch durch Photokatalysatoren unterstützt wird, die direkt im Wasser suspendiert sind, anstatt ein photovoltaisches und ein elektrolytisches System zu verwenden, erfolgt die Reaktion in nur einem Schritt und kann effizienter gestaltet werden. ⓘ
Biowasserstoff-Routen
Biomasse und Abfallströme können im Prinzip durch Biomassevergasung, Dampfreformierung oder biologische Umwandlung wie biokatalysierte Elektrolyse oder fermentative Wasserstofferzeugung in Biowasserstoff umgewandelt werden. ⓘ
Unter den Methoden der Wasserstofferzeugung wie Methandampfreformierung, thermisches Cracken, Kohle- und Biomassevergasung und -pyrolyse, Elektrolyse und Photolyse sind die biologischen Verfahren umweltfreundlicher und weniger energieintensiv. Darüber hinaus kann eine Vielzahl von Abfällen und geringwertigen Materialien, wie z. B. landwirtschaftliche Biomasse, als erneuerbare Quelle für die Erzeugung von Wasserstoff auf biochemischem Wege genutzt werden. Derzeit wird Wasserstoff jedoch hauptsächlich aus fossilen Brennstoffen, insbesondere Erdgas, hergestellt, die keine erneuerbaren Quellen sind. Wasserstoff ist nicht nur der sauberste Brennstoff, sondern wird auch in einer Reihe von Industriezweigen verwendet, insbesondere in der Düngemittel-, Petrochemie- und Lebensmittelindustrie. Daher ist es logisch, alternative Quellen für die Wasserstoffproduktion zu untersuchen. Die wichtigsten biochemischen Technologien zur Herstellung von Wasserstoff sind die Dunkel- und die Photogärung. Bei der Dunkelfermentation werden Kohlenhydrate durch fermentative Mikroorganismen, darunter streng anaerobe und fakultativ anaerobe Bakterien, in Wasserstoff umgewandelt. Theoretisch können maximal 4 mol H2/mol Glukose erzeugt werden, und neben Wasserstoff werden bei diesem Prozess Zucker in flüchtige Fettsäuren und Alkohole als Nebenprodukte umgewandelt. Photofermentative Bakterien sind in der Lage, aus VFAs Wasserstoff zu erzeugen. Daher können die bei der Dunkelfermentation gebildeten Stoffwechselprodukte als Ausgangsmaterial für die Photofermentation verwendet werden, um die Gesamtausbeute an Wasserstoff zu erhöhen. ⓘ
Fermentative Wasserstofferzeugung
Biowasserstoff kann in Bioreaktoren hergestellt werden. Bei diesem Prozess verbrauchen Bakterien Kohlenwasserstoffe und produzieren Wasserstoff und CO2. Das CO2 und der Wasserstoff können getrennt werden. ⓘ
Die fermentative Wasserstofferzeugung ist die fermentative Umwandlung organischer Substrate in Biowasserstoff, die durch eine vielfältige Gruppe von Bakterien unter Verwendung von Multienzym-Systemen in drei Schritten ähnlich der anaeroben Umwandlung erfolgt. Dunkle Fermentationsreaktionen benötigen keine Lichtenergie, so dass sie in der Lage sind, den ganzen Tag und die ganze Nacht hindurch Wasserstoff aus organischen Verbindungen zu produzieren. Die Photofermentation unterscheidet sich von der Dunkelfermentation, da sie nur in Gegenwart von Licht abläuft. Zum Beispiel kann die Photofermentation mit Rhodobacter sphaeroides SH2C eingesetzt werden, um niedermolekulare Fettsäuren in Wasserstoff umzuwandeln. ⓘ
Die fermentative Wasserstofferzeugung kann durch direkte Biophotolyse durch Grünalgen, indirekte Biophotolyse durch Cyanobakterien, Photofermentation durch anaerobe photosynthetische Bakterien und Dunkelfermentation durch anaerobe fermentative Bakterien erfolgen. In der Literatur wird beispielsweise über Studien zur Wasserstoffproduktion mit H. salinarium, einem anaeroben photosynthetischen Bakterium, in Verbindung mit einem Hydrogenasedonor wie E. coli berichtet. Enterobacter aerogenes ist ein weiterer Wasserstoffproduzent. ⓘ
Enzymatische Wasserstofferzeugung
Es wurden verschiedene enzymatische Wege zur Erzeugung von Wasserstoff aus Zuckern entwickelt. ⓘ
Biokatalysierte Elektrolyse

Neben der Dunkelfermentation ist die Elektrohydrogenese (Elektrolyse mit Hilfe von Mikroben) eine weitere Möglichkeit. Mit mikrobiellen Brennstoffzellen können Abwässer oder Pflanzen zur Stromerzeugung genutzt werden. Die biokatalysierte Elektrolyse ist nicht mit der biologischen Wasserstofferzeugung zu verwechseln, da bei letzterer nur Algen verwendet werden und die Algen den Wasserstoff sofort selbst erzeugen, während dies bei der biokatalysierten Elektrolyse erst nach dem Durchlauf durch die mikrobielle Brennstoffzelle geschieht und eine Vielzahl von Wasserpflanzen verwendet werden kann. Dazu gehören Rohrglanzgras, Schnurgras, Reis, Tomaten, Lupinen und Algen. ⓘ

Nanogalvanisches Aluminiumlegierungspulver
Ein Pulver aus einer Aluminiumlegierung, das 2017 vom U.S. Army Research Laboratory entwickelt wurde, ist aufgrund seiner einzigartigen nanoskaligen galvanischen Mikrostruktur in der Lage, bei Kontakt mit Wasser oder einer wasserhaltigen Flüssigkeit Wasserstoffgas zu erzeugen. Berichten zufolge erzeugt es Wasserstoff mit 100 Prozent der theoretischen Ausbeute, ohne dass Katalysatoren, Chemikalien oder externe Energiezufuhr erforderlich sind. ⓘ
Auswirkungen auf die Umwelt
Ab 2020 wird der meiste Wasserstoff aus fossilen Brennstoffen hergestellt, was zu Kohlendioxidemissionen führt. Dies wird oft als grauer Wasserstoff bezeichnet, wenn die Emissionen in die Atmosphäre gelangen, und als blauer Wasserstoff, wenn die Emissionen durch Kohlenstoffabscheidung und -speicherung (CCS) aufgefangen werden. Blauer Wasserstoff hat Schätzungen zufolge einen um 20 % größeren Treibhausgasfußabdruck als die Verbrennung von Gas oder Kohle zur Wärmeerzeugung und einen um 60 % größeren Fußabdruck als die Verbrennung von Diesel zur Wärmeerzeugung, wenn man von den Methanleckraten in den USA vor und in der Mitte des Flusses ausgeht und die Produktion über Dampf-Methan-Reformer (SMR) erfolgt, die mit einer Kohlendioxidabscheidung nachgerüstet wurden. Der Einsatz von autothermen Reformern (ATR) mit integrierter Kohlendioxidabscheidung ermöglicht höhere Abscheidungsraten bei zufriedenstellender Energieeffizienz, und Lebenszyklusbewertungen haben ergeben, dass die Treibhausgasemissionen solcher Anlagen im Vergleich zu SMR mit Kohlendioxidabscheidung geringer sind. Die Anwendung der ATR-Technologie mit integrierter Kohlendioxidabscheidung in Europa hat nachweislich einen geringeren Treibhausgas-Fußabdruck als die Verbrennung von Erdgas, z. B. im Rahmen des H21-Projekts mit einer gemeldeten Verringerung von 68 % aufgrund der geringeren Kohlendioxidintensität von Erdgas in Verbindung mit einem für die Kohlendioxidabscheidung besser geeigneten Reaktortyp. ⓘ
Wasserstoff, der mit der neueren, umweltfreundlichen Technologie der Methanpyrolyse hergestellt wird, wird oft als türkisfarbener Wasserstoff bezeichnet. Hochwertiger Wasserstoff wird direkt aus Erdgas hergestellt, und der damit verbundene umweltfreundliche feste Kohlenstoff wird nicht in die Atmosphäre freigesetzt und kann dann für industrielle Zwecke verkauft oder in Deponien gelagert werden. ⓘ
Wasserstoff, der aus erneuerbaren Energiequellen hergestellt wird, wird oft als grüner Wasserstoff bezeichnet. Es gibt zwei praktische Möglichkeiten zur Herstellung von Wasserstoff aus erneuerbaren Energiequellen. Die eine ist die Power-to-Gas-Produktion, bei der elektrischer Strom zur Herstellung von Wasserstoff durch Elektrolyse von Wasser verwendet wird, und die andere ist die Verwendung von Deponiegas zur Herstellung von Wasserstoff in einem Dampfreformer. Wasserstoff ist ein erneuerbarer Brennstoff, wenn er aus erneuerbaren Energiequellen wie Wind- oder Sonnenenergie gewonnen wird. Wasserstoff, der durch Elektrolyse aus Kernenergie gewonnen wird, wird manchmal als eine Untergruppe des grünen Wasserstoffs betrachtet, kann aber auch als rosa Wasserstoff bezeichnet werden. Das Kernkraftwerk Oskarshamn hat im Januar 2022 eine Vereinbarung über die kommerzielle Lieferung von rosa Wasserstoff in der Größenordnung von Kilogramm pro Tag getroffen. ⓘ
Ab 2020 werden die Produktionskosten für grauen und blauen Wasserstoff auf 1-1,80 $/kg und für grünen Wasserstoff auf 2,50-6,80 $ geschätzt. ⓘ
Verwendung von Wasserstoff
Wasserstoff wird für die Umwandlung von schweren Erdölfraktionen in leichtere mittels Hydrocracking verwendet. Er wird auch in anderen Prozessen wie der Aromatisierung, der Hydrodesulfurierung und der Herstellung von Ammoniak nach dem Haber-Verfahren verwendet, dem wichtigsten industriellen Verfahren zur Herstellung von synthetischem Stickstoffdünger für den Anbau von 47 % der Nahrungsmittel weltweit. ⓘ
Wasserstoff kann in Brennstoffzellen zur lokalen Stromerzeugung oder potenziell als Kraftstoff im Verkehr eingesetzt werden. ⓘ
Wasserstoff wird als Nebenprodukt der industriellen Chlorproduktion durch Elektrolyse hergestellt. Obwohl teure Technologien erforderlich sind, kann Wasserstoff gekühlt, komprimiert und gereinigt werden, um ihn in anderen Prozessen vor Ort zu verwenden oder über Rohrleitungen, Flaschen oder Lastwagen an Kunden zu verkaufen. Die Entdeckung und Entwicklung kostengünstigerer Methoden zur Herstellung von Wasserstoff in großen Mengen ist für den Aufbau einer Wasserstoffwirtschaft von Bedeutung. ⓘ
Wasserstoff wird vor allem in der chemischen Industrie, beispielsweise für die Herstellung von Stickstoffdünger oder beim Cracken von Kohlenwasserstoffen in Erdölraffinerien eingesetzt. Bedeutung hat er als Zwischenstufe bei chemischen Verfahren zur Herstellung von synthetischen Kraftstoffen wie Gas-to-Liquid (GtL), Coal-to-Liquid (CtL) und Biomass-to-Liquid (BtL), die unter anderem die Erzeugung eines wasserstoffreichen Synthesegases erfordern. Angesichts der zunehmenden Bedeutung der erneuerbaren Energien werden Energiespeicher notwendig, damit Produktions- und Bedarfszeiten aufeinander abgestimmt werden können. Eine Option zur Stromspeicherung könnte die Elektrolyse von Wasser zu den Gasen Wasserstoff und Sauerstoff (O2) sein, welche gespeichert und später wieder verstromt werden könnten. Im Rahmen einer sogenannten Wasserstoffwirtschaft könnte der Wasserstoff auch direkt genutzt werden. ⓘ
Herstellungsverfahren
Nachfolgend werden Wasserstoffherstellungsverfahren erläutert, die teils im industriellen Maßstab eingesetzt werden, sich aber teilweise noch in der Entwicklung befinden. Unterschieden wird dabei zwischen Verfahren, die Kohlenwasserstoffe einsetzen, solchen, die Biomasse verwenden, und solchen, die Wasser spalten: ⓘ
Verwendung von Kohlenwasserstoffen
Bei der Verwendung von Kohlenwasserstoffen, aber auch Kohle und Biomasse, liefert der Rohstoff die für den Prozess notwendige Energie. Auch der Wasserstoff kann teilweise bereits im Rohstoff gebunden vorliegen oder wird in Form von Wasser hinzugefügt. Eine Ausnahme ist das Kværner-Verfahren, bei dem die benötigte Energie hauptsächlich von außen zugeführt wird. ⓘ
Autotherme Reformierung

Die autotherme Reformierung ist eine Kombination aus Dampfreformierung und partieller Oxidation, durch die der Wirkungsgrad optimiert wird. Dabei kann beispielsweise Methanol wie auch jeder andere Kohlenwasserstoff beziehungsweise jedes Kohlenwasserstoffgemisch (Erdgas, Benzin, Diesel usw.) verwendet werden. Die beiden Verfahren werden so miteinander kombiniert, dass sich der Vorteil der Oxidation (Bereitstellung von Wärmeenergie) mit dem Vorteil der Dampfreformierung (höhere Wasserstoffausbeute) optimierend ergänzt. Dies geschieht durch genaue Dosierung der Luft- und Wasserdampfzufuhr. An die hier eingesetzten Katalysatoren werden besonders hohe Ansprüche gestellt, da sie sowohl die Dampfreformierung mit der Wassergas-Shift-Reaktion als auch die partielle Oxidation begünstigen müssen. ⓘ
Biomasse
Biomasse besteht meist hauptsächlich aus Kohlenhydraten und kann in ähnlichen Verfahren umgesetzt werden wie Kohlenwasserstoffe. Eine weitere Option könnte die anaerobe Fermentation mit Hilfe von Mikroorganismen sein. ⓘ
Fermentation
Unter Laborbedingungen kann Wasserstoff mit anaeroben Mikroorganismen direkt aus Biomasse gewonnen werden. Werden hierfür Mischkulturen verwendet, muss die Wasserstoffproduktion vom letzten Glied der anaeroben Nahrungskette, der Methanproduktion (Methanogenese), entkoppelt werden. Die Freisetzung von molekularem Wasserstoff durch Mikroorganismen wird aus Gründen der Reaktionskinetik nur bei sehr niedrigem Wasserstoffpartialdruck begünstigt. Daher muss durch Bioreaktoraufbau und -betrieb dieser Druck trotz Abwesenheit methanogener Mikroorganismen oder sulfatreduzierender bzw. wasserstoffverwertender Bakterien niedrig gehalten werden. ⓘ
Die fermentative Wasserstoffproduktion ist jedoch energetisch relativ ungünstig. Nach Thauer (1976) können auf dem beschriebenen Weg maximal 33 % der Verbrennungswärme aus Glucose in Wasserstoff gespeichert werden. Im Vergleich dazu können durch Methangärung 85 % der Energie aus Glucose in das Gärprodukt überführt werden. ⓘ
Wasserspaltung
Chloralkali-Elektrolyse
Bei der Chloralkali-Elektrolyse entstehen Wasserstoff und Chlor als Nebenprodukte. Vorrangig dient sie aber der Gewinnung von Natron- und Kalilauge aus Lösungen von Chloriden (z. B. Kochsalz (NaCl)). An den beiden Elektroden finden diese Reaktionen statt:
Das Verfahren wird seit Jahrzehnten großtechnisch angewendet. Es ist dort wirtschaftlich sinnvoll, wo ein Bedarf an Laugen (und gegebenenfalls Chlor) besteht, lohnt sich aber allein zum Zweck der Wasserstoffherstellung nicht. ⓘ
Thermochemische Verfahren
Thermische Dissoziation ⓘ
Die thermische Dissoziation bezeichnet den Zerfall von Molekülen in ihre einzelnen Atome durch Wärmeeinwirkung. Oberhalb einer Temperatur von 1.700 °C vollzieht sich die direkte Spaltung von Wasserdampf in Wasserstoff und Sauerstoff. Dies geschieht zum Beispiel in Solaröfen. Die entstehenden Gase können mit keramischen Membranen voneinander getrennt werden. Diese Membranen sind für Wasserstoff, jedoch nicht für Sauerstoff durchlässig. Das Problem dabei ist, dass sehr hohe Temperaturen auftreten und nur teure, hitzebeständige Materialien dafür in Frage kommen. Aus diesem Grund ist dieses Verfahren noch nicht konkurrenzfähig. ⓘ
Thermochemisches Verfahren ⓘ
Ein Absenken der Temperatur bei der thermischen Wasserspaltung auf unter 900 °C kann über gekoppelte chemische Reaktionen erreicht werden. Bereits in den 1970er Jahren wurden für die Einkopplung der Wärme von Hochtemperaturreaktoren verschiedene thermochemische Kreisprozesse vorgeschlagen, die zum Teil auch für die Nutzung konzentrierter Solarstrahlung geeignet sind. Die höchsten Systemwirkungsgrade sowie das größte Potenzial für Verbesserungen weist aus heutiger Sicht ein verbesserter Schwefelsäure-Iod-Prozess auf: Iod (I) und Schwefeldioxid (SO2) reagieren bei 120 °C mit Wasser zu Iodwasserstoff (HI) und Schwefelsäure (H2SO4). Nach der Separation der Reaktionsprodukte wird Schwefelsäure bei 850 °C in Sauerstoff und Schwefeldioxid gespalten, aus Iodwasserstoff entsteht bei 300 °C Wasserstoff und das Ausgangsprodukt Iod. Den hohen thermischen Wirkungsgraden der thermochemischen Kreisprozesse (bis zu 50 %) müssen jedoch die heute noch weitgehend ungelösten material- und verfahrenstechnischen Schwierigkeiten gegenübergestellt werden. ⓘ
Metalloxid-Verfahren ⓘ
Viele Metalloxide spalten bei sehr hohen Temperaturen Sauerstoff ab, und das entstehende Metall reagiert bei niedrigeren Temperaturen mit Wasser, wobei das Oxid unter Erzeugung von Wasserstoff zurückgewonnen wird. Mehr als 300 Varianten dieser thermochemischen Prozesse sind bekannt. Einige davon, zum Beispiel das Zink-Zinkoxid-Verfahren oder das Cer(IV)-oxid-Cer(III)-oxid-Verfahren, werden als technologisch vielversprechend untersucht (siehe auch Hydrosol-Projekt): Beispiel (M: Metall; M(II): Metall der Oxidationsstufe II; O: Sauerstoff; H: Wasserstoff):
- Spaltschritt: M(II)Oreduziert + H2O → M(IV)O2 oxidiert + H2
- Regenerationsschritt: M(IV)O2 oxidiert → M(II)Oreduziert + 1/2 O2 ⓘ
Photokatalytische Wasserspaltung
Die Photokatalyse benutzt das Sonnenlicht und einen Katalysator zum Herstellen von Wasserstoff. Der Vorteil der Photokatalyse gegenüber anderen Techniken wie der Elektrolyse besteht darin, dass die Ladungstrennung und Spaltung des Wassers von einem Material an der gleichen Grenzfläche durchgeführt werden kann, wodurch Übertragungsverluste minimiert und Materialeinsparungen erzielt werden können. ⓘ
Photobiologische Herstellung
Bei der photobiologischen Herstellung von Wasserstoff kann ebenfalls das Sonnenlicht als Energiequelle genutzt werden. Die entsprechenden Katalysatoren werden dabei von lebenden Organismen erzeugt. Bakterien müssen dazu in Wasserstoffbioreaktoren kultiviert werden. Durch Beeinflussung der von ihnen betriebenen Photosynthese wird Energie nicht in Biomasse gespeichert, sondern zur Spaltung von Wasser in Wasserstoff und Sauerstoff verwendet. Dieses Verfahren könnte CO2-neutral bzw. nahezu CO2-neutral sein. Bisher ist jedoch noch keine wirtschaftliche Umsetzung möglich. ⓘ






