Seeohren
| Haliotis | |
|---|---|

| |
| Lebende Abalone im Aquarium mit Epipodium und Tentakeln, vorderes Ende nach rechts. | |
| Wissenschaftliche Klassifizierung | |
| Königreich: | Animalia |
| Stamm: | Weichtiere (Mollusca) |
| Klasse: | Gastropoda |
| Unterklasse: | Vetigastropoda |
| Ordnung: | Lepetellida |
| Überfamilie: | Haliotoidea |
| Familie: | Haliotidae Rafinesque, 1815 |
| Gattung: | Haliotis Linnaeus, 1758 |
| Typusart | |
| Haliotis asinina Linnaeus, 1758
| |
| Synonyme | |
| |
Haliotis, im Volksmund Abalone genannt, ist die einzige Gattung der Familie Haliotidae. ⓘ
Diese Gattung umfasste einst sechs Untergattungen. Diese Untergattungen sind zu alternativen Darstellungen von Haliotis geworden. Die Gattung umfasst kleine bis sehr große, essbare, pflanzenfressende Meeresschnecken, marine Gastropoden. Die Zahl der weltweit anerkannten Arten liegt zwischen 30 und 130, wobei über 230 Taxa auf Artniveau beschrieben wurden. Die umfassendste Behandlung der Familie hält 56 Arten für gültig, mit 18 zusätzlichen Unterarten. ⓘ
Andere gebräuchliche Namen sind Ohrmuscheln, Seeohren und, selten, Hammelfisch oder Muttonshells in Teilen Australiens, Ormer im Vereinigten Königreich, Perlemoen in Südafrika, und der Maori-Name für drei Arten in Neuseeland ist pāua. ⓘ
| Seeohren ⓘ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Seeohr in seitlicher Ansicht im Aquarium | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Haliotidae | ||||||||||||
| Rafinesque, 1815 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Haliotis | ||||||||||||
| Linnaeus, 1758 |

Beschreibung

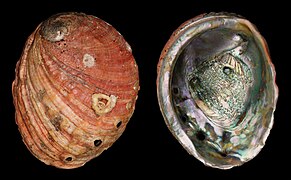
Die Schalen der Abalone haben eine niedrige, offene, spiralförmige Struktur und sind dadurch gekennzeichnet, dass sie mehrere offene Atmungsporen in einer Reihe nahe dem äußeren Rand der Schale aufweisen. Die dicke innere Schicht der Schale besteht aus Perlmutt, das bei vielen Abalone-Arten stark irisierend ist und eine Reihe kräftiger, veränderlicher Farben hervorbringt, die die Schalen für den Menschen als dekorative Objekte, für Schmuck und als Quelle für farbiges Perlmutt attraktiv machen. ⓘ
Die Schale der Abalone ist konvex, rundlich bis oval und kann stark gewölbt oder stark abgeflacht sein. Die Schale der meisten Arten ist ohrförmig und weist eine kleine, flache Spitze und zwei bis drei Quirle auf. Der letzte Wirtel, der so genannte Körperwirtel, ist ohrförmig, d. h. die Schale ähnelt einem Ohr, daher auch der Name "Ohrmuschel". Haliotis asinina hat eine etwas andere Form, da sie länglicher und aufgeblähter ist. Die Schale von Haliotis cracherodii cracherodii ist ebenfalls ungewöhnlich, denn sie hat eine eiförmige Form, ist ungelocht, weist eine vorstehende Spitze auf und hat stachelige Rippen. ⓘ
Eine Mantelspalte in der Schale drückt eine Rille in die Schale, in der sich die für die Gattung charakteristische Reihe von Löchern (bekannt als Tremata) befindet. Bei diesen Löchern handelt es sich um Atmungsöffnungen, durch die das Wasser aus den Kiemen entweicht und Spermien und Eier in die Wassersäule abgegeben werden. Sie bilden das so genannte Selenizone, das sich beim Wachstum der Schale bildet. Diese Reihe von acht bis 38 Löchern befindet sich in der Nähe des vorderen Randes. Nur eine kleine Anzahl ist im Allgemeinen offen. Die älteren Löcher werden nach und nach verschlossen, wenn die Schale wächst und sich neue Löcher bilden. Daher ist die Anzahl der Tremata nicht charakteristisch für die jeweilige Art. Jede Art hat eine bestimmte Anzahl von offenen Löchern in der Selenizone, die zwischen vier und 10 liegt. Diese Zahl ist nicht festgelegt und kann innerhalb einer Art und zwischen verschiedenen Populationen variieren. Abalones haben kein Operculum. Die Öffnung der Schale ist sehr weit und perlmuttartig. ⓘ
Die Außenseite der Schale ist gestreift und stumpf. Die Farbe der Schale ist von Art zu Art sehr unterschiedlich, was möglicherweise auf die Ernährung der Tiere zurückzuführen ist. Das schillernde Perlmutt, das die Innenseite der Schale auskleidet, variiert in der Farbe von silbrig-weiß über rosa, rot und grün-rot bis hin zu tiefblau, grün und violett. ⓘ
Das Tier weist gefranste Kopflappen auf. Die Seitenlappen sind ebenfalls gefranst und zirrenförmig. Der abgerundete Fuß ist sehr groß. Die Radula hat kleine mittlere Zähne, die seitlichen Zähne sind einzeln und balkenförmig. Es sind etwa 70 Uncini mit gezähnten Haken vorhanden, von denen die ersten vier sehr groß sind. Der Weichkörper ist um den Kolumellarmuskel gewickelt, der nicht an der Kolumella, sondern in der Mitte der Innenwand der Schale ansetzt. Die Kiemen sind symmetrisch und beide gut entwickelt. ⓘ
Diese Schnecken klammern sich mit ihrem breiten muskulösen Fuß fest an felsige Oberflächen in sublitoralen Tiefen, obwohl einige Arten wie Haliotis cracherodii früher in der Gezeitenzone verbreitet waren. Abalones erreichen die Geschlechtsreife mit einer relativ geringen Größe. Ihre Fruchtbarkeit ist hoch und nimmt mit ihrer Größe zu (von 10.000 bis 11 Millionen Eiern auf einmal). Die Spermatozoen sind fadenförmig und an einem Ende spitz, das vordere Ende ist ein abgerundeter Kopf. ⓘ
Die Larven sind lecithotrophe Tiere. Die erwachsenen Tiere sind Pflanzenfresser und ernähren sich mit ihrer Rhipidoglossar-Radula von Makroalgen, bevorzugt von Rot- oder Braunalgen. Die Größe variiert zwischen 20 mm (Haliotis pulcherrima) und 200 mm (Haliotis rufescens), wobei Haliotis rufescens mit 30 cm der größte Vertreter der Gattung ist. ⓘ
Nach Gewicht besteht etwa ein Drittel des Tieres aus essbarem Fleisch, ein Drittel aus Innereien und ein Drittel aus der Schale. ⓘ
Weltweit gibt es 66 Haliotis-Arten. Haliotis gigantea bildet bizarr geformte Perlen aus, die blau, grün, grau oder bronzefarben schimmern. Wie auch bei anderen Mollusken sind diese Farben – die unterhalb von 15 Meter Wassertiefe kaum mehr zu sehen sind – Abfallprodukte des Eiweißstoffwechsels, die der Mantelrand beim Wachsen der Schale in dieser deponiert. ⓘ
Die größte Art ist mit 30 cm Durchmesser das Rote Seeohr (H. rufescens), das an der Westküste der Vereinigten Staaten vorkommt. ⓘ

Das ohrförmige Gehäuse hat am Rand eine Spiralreihe von kleinen Öffnungen, die in der Wachstumsphase nach und nach verschlossen werden. Die letzten fünf bis neun Löcher bleiben geöffnet. Durch diese kann das von Wimpern ins Innere der Mantelhöhle gestrudelte Meerwasser wieder hinausgelangen und die Schnecke auch Abfallprodukte entsorgen. ⓘ
Die Tiere zeigen im inneren Bau noch Anklänge einer Rechts-Links-Symmetrie. Andererseits greift bei ihnen, im Gegensatz zu beweglicheren Schnecken, der spiralige Bau auch auf den Fuß über: Zwar haben sie noch zwei Rückziehmuskeln, doch einer ist wesentlich stärker ausgeprägt als der andere. ⓘ
Der kräftige, ovale Fuß der Schnecken, mit dem sie sich in Küstennähe an Felsen anhaften, gilt besonders in Ostasien als begehrte Delikatesse. Dieser Umstand trug wesentlich dazu bei, dass mehrere Arten der Seeohren inzwischen vom Aussterben bedroht sind. ⓘ
Struktur und Eigenschaften der Schale
Die Schale der Abalone ist außerordentlich widerstandsfähig und besteht aus mikroskopisch kleinen Kalziumkarbonatplatten, die wie Ziegelsteine aufeinander gestapelt sind. Zwischen den Schichten der Kacheln befindet sich eine klebrige Proteinsubstanz. Wenn die Schale der Abalone getroffen wird, gleiten die Ziegel, anstatt zu zerbrechen, und das Protein dehnt sich aus, um die Energie des Schlags zu absorbieren. Materialwissenschaftler auf der ganzen Welt untersuchen diese Kachelstruktur, um Erkenntnisse über stärkere Keramikprodukte wie Körperpanzer zu gewinnen. Der Staub, der beim Schleifen und Schneiden von Abalone-Schalen entsteht, ist gefährlich; es müssen geeignete Schutzmaßnahmen getroffen werden, um Menschen vor dem Einatmen dieser Partikel zu schützen. Im Internet gibt es zahlreiche Diskussionen zu diesem Thema. ⓘ
Arten
Die Anzahl der anerkannten Arten innerhalb der Gattung Haliotis schwankte im Laufe der Zeit und hängt von der Quelle ab, die herangezogen wird. Die Zahl der anerkannten Arten reicht von 30 bis 130. Diese Liste stellt einen Kompromiss dar, indem sie die "WoRMS"-Datenbank verwendet und einige Arten hinzufügt, so dass sie insgesamt 57 beträgt. Die meisten Abalone-Arten wurden nicht auf ihren Erhaltungszustand hin untersucht. Diejenigen, die überprüft wurden, zeigen, dass die Abalone im Allgemeinen in ihrem Bestand zurückgeht und weltweit geschützt werden muss. ⓘ
| Arten | Verbreitungsgebiet | Erhaltungszustand ⓘ |
|---|---|---|
| Haliotis alfredensis Bartsch, 1915 | Südafrika | Nicht bewertet |
| Haliotis arabiensis Owen, Regter & Van Laethem, 2016 | Vor Jemen und Oman | Nicht bewertet |
| Haliotis asinina Linnaeus, 1758 | Philippinen; Indonesien; Australien; Japan; Thailand; Vietnam | Nicht bewertet |
| Haliotis australis Gmelin, 1791 | Neuseeländisch | Nicht bewertet |
| † Haliotis benoisti Cossmann, 1896 | Aquitanien, Frankreich | ausgestorben |
| Haliotis brazieri Angas, 1869 | Ostaustralien | Nicht bewertet |
| Haliotis clathrata Reeve, 1846 | Seychellen; Komoren; Madagaskar; Mauritius; Kenia | Nicht bewertet |
| Haliotis coccoradiata Reeve, 1846 | Ostaustralien | Nicht bewertet |
| Haliotis corrugata Wood, 1828 | Kalifornien, USA; Baja California, Mexiko | Gefährdete Art National Marine Fisheries Service; gefährdet (weltweit) und gefährdet (Kalifornien) California Department of Fish and Wildlife |
| Haliotis cracherodii Leach, 1814 | Kalifornien, USA; Baja California, Mexiko | CR IUCN; gefährdet (weltweit, Nation: USA, Staat: Kalifornien) California Department of Fish and Wildlife; als gefährdet gelistet National Marine Fisheries Service |
| Haliotis cyclobates Péron & Lesueur, 1816 | Südaustralien | Nicht bewertet |
| Haliotis dalli Henderson, 1915 | Galapagos-Inseln | Nicht bewertet |
| Haliotis discus Reeve, 1846 | Japan; Südkorea | Nicht bewertet |
| Haliotis dissona (Iredale, 1929) | Australien; Neukaledonien | Nicht bewertet |
| Haliotis diversicolor Reeve, 1846 | Japan; Australien; Südostasien | Nicht bewertet |
| Haliotis drogini Owen & Reitz, 2012 | Nicht bewertet | |
| Haliotis elegans Koch & Philippi, 1844 | Westaustralien | Nicht bewertet |
| Haliotis exigua Dunker, R.W., 1877 | Japan | Nicht bewertet |
| Haliotis fatui Geiger, 1999 | Tonga Marianen | Nicht bewertet |
| † Haliotis flemingi Powell, 1938 | Neuseeländisch | ausgestorben |
| Haliotis fulgens Philippi, 1845 | Kalifornien, USA; Baja California, Mexiko | Gefährdet (Global, Staat: Kalifornien California Department of Fish and Wildlife); Bedenkliche Art NMFS |
| Haliotis geigeri Owen, 2014 | São Tomé & Príncipe Inseln | Nicht bewertet |
| Haliotis gigantea Gmelin, 1791 | Japan | Nicht bewertet |
| Haliotis glabra Gmelin, 1791 | Philippinen; Vietnam | Nicht bewertet |
| Haliotis iris Gmelin, 1791 | Neuseeland; Vanuatu | Nicht bewertet |
| Haliotis jacnensis Reeve, 1846 | Japan; Nikobaren; Ryukyu-Inseln; Pazifische Inseln; | Nicht bewertet |
| Haliotis kamtschatkana Jonas, 1845 | Westliches Nordamerika |
Gefährdet IUCN; Gefährdet (Alaska, British Columbia), Gefährdet (weltweit, USA), stark gefährdet (Kalifornien); Bedrohte Art NMFS |
| Haliotis laevigata Donovan, 1808 | Südaustralien; Tasmanien | Nicht bewertet |
| † Haliotis lomaensis Anderson, 1902 | ausgestorben | |
| Haliotis madaka (Habe, 1977) | Japan; Südkorea | Nicht bewertet |
| Haliotis mariae Wood, 1828 | Oman; Jemen | Nicht bewertet |
| Haliotis marmorata Linnaeus, 1758 | Liberia; Elfenbeinküste; Ghana | Nicht bewertet |
| † Haliotis (Marinauris) matihetihensis (Eagle, 1999) | ausgestorben | |
| † Haliotis mathesonensis (Adler, 1996) | ausgestorben | |
| † Haliotis matihetihensis (Adler, 1999) | ausgestorben | |
| Haliotis melculus (Iredale, 1927) | Australien (Neusüdwales, Queensland) | Nicht bewertet |
| Haliotis midae Linnaeus, 1758 | Südafrika | Nicht bewertet |
| Haliotis mykonosensis Owen, Hanavan & Hall, 2001 | Griechenland; Türkei; Tunesien | Nicht bewertet |
| Haliotis ovina Gmelin, 1791 | Thailand; Vietnam; südlicher Teil des Pazifiks; Andamanen; Malediven; Ryukyu-Inseln | Nicht bewertet |
| Haliotis parva Linnaeus, 1758 | Südafrika; Angola | Nicht bewertet |
| Haliotis planata G. B. Sowerby II, 1882 | Ryukyu-Inseln; Sri Lanka; Indonesien; Fidschi; Andamanensee | Nicht bewertet |
| Haliotis pourtalesii Dall, 1881 | Golf von Mexiko; östliches Südamerika; nördliches Kolumbien | Nicht bewertet |
| † Haliotis powelli C. A. Fleming, 1952 | ausgestorben | |
| Haliotis pulcherrima Gmelin, 1791 | Polynesien | Nicht bewertet |
| Haliotis queketti E.A. Smith, 1910 | Südafrika; Somalia | Daten mangelhaft IUCN |
| Haliotis roei Gray, 1826 | Australien | Nicht bewertet |
| Haliotis rubiginosa Reeve, 1846 | Lord Howe Insel; Malakula Insel | Nicht bewertet |
| Haliotis rubra Leach, 1814 | Süd- und Ostaustralien | Nicht bewertet |
| Haliotis rufescens Swainson, 1822 | Westliches Nordamerika | Anscheinend sicher (weltweit, USA); stark gefährdet (Kanada) |
| Haliotis rugosa Lamarck, 1822 | Südafrika; Madagaskar; Mauritius; Rotes Meer | Nicht bewertet |
| Haliotis scalaris (Leach, 1814) | Süd- und Westaustralien | Nicht bewertet |
| Haliotis semiplicata Menke, 1843 | Westaustralien | Nicht bewertet |
| Haliotis sorenseni Bartsch, 1940 | Kalifornien, USA; Baja California, Mexiko | Vom Aussterben bedroht (weltweit, USA, Kalifornien); vom Aussterben bedroht NMFS |
| Haliotis spadicea Donovan, 1808 | Südafrika | Nicht bewertet |
| Haliotis speciosa Reeve, 1846 | Östliches Südafrika | Nicht bewertet |
| Haliotis squamosa Gray, 1826 | Madagaskar; Ostaustralien; Okinawa | Nicht bewertet |
| † Haliotis stalennuyi Owen & Berschauer, 2017 | ausgestorben | |
| Haliotis stomatiaeformis Reeve, 1846 | Malta; Pazifische Inseln | Nicht bewertet |
| Haliotis supertexta Lischke, 1870 | Japan; Sao Tome | Nicht bewertet |
| Haliotis thailandis Dekker & Patamakanthin, 2001 | Andamanisches Meer | Nicht bewertet |
| Haliotis tuberculata Linnaeus, 1758 | Irland (eingeführt); Kanalinseln; Azoren; Kanarische Inseln; Japan; Madeira; Bretagne; Großbritannien | Nicht bewertet |
| Haliotis unilateralis Lamarck, 1822 | Golf von Aqaba; Ostafrika; Seychellen; | Nicht bewertet |
| Haliotis varia Linnaeus, 1758 | Maskarenen-Becken; Rotes Meer; Sri Lanka; Westpazifik; | Nicht bewertet |
| Haliotis virginea Gmelin, 1791 | Neuseeland; Chatham Inseln; Auckland Inseln; Campbell Insel; Fidschi | Nicht bewertet |
| † Haliotis volhynica Eichwald, 1829 | ausgestorben | |
| † Haliotis waitemataensis Powell, 1938 | ausgestorben | |
| Haliotis walallensis Stearns, 1899 | Westliches Nordamerika | Nicht bewertet |
Eine Schale von Haliotis varia Form dohrniana ⓘ
Haliotis walallensis ⓘ
Nutzung durch den Menschen

In Japan ist das Muskelfleisch der Seeohren, die dort fälschlicherweise als Muscheln angesehen werden, eine begehrte Delikatesse. Sowohl Haliotis gigantea (jap. 雌貝(鮑), megai (awabi), wörtlich: „weibliche Muschel(-Seeohr)“) als auch die rund um Japan häufig vorkommende Haliotis japonica (syn. Sulculus diversicolor supertexta syn. Haliotis diversicolor supertexta, japanisch 床臥/常節, Tokobushi) werden verzehrt, wobei deren Fleisch vor allem als Sashimi (roh) gegessen wird. Des Weiteren werden sie getrocknet und in lange dünne Streifen geschnitten, um sie als Teil eines Noshi, eines traditionellen Geschenkabzeichens, zu verwenden. Möglich ist auch das Erhitzen im Ganzen (lebend, von beiden Seiten) oder nach Präparation in Einzelteilen. In Südkorea werden die Seeohren auch gedämpft, ein Prozess, der über eine Stunde dauert, bis die Seeohren ihre Zähigkeit verlieren. ⓘ
H. rufescens und einige weitere Arten werden kommerziell in Seeohr-Farmen gezüchtet, insbesondere in Australien, China, Japan und entlang der Westküste der USA. Kommerziell betriebene Fischereien existieren in Kalifornien, Mexiko, Japan und Südafrika. ⓘ
Seeohren werden zudem zur Gewinnung von Perlmutt verwendet. ⓘ

Paua in der Kunst
Wegen des perlmuttrigen Inneren der Schale werden Seeohren für die Herstellung von Schmuck verwendet. Insbesondere in der Kultur der Māori werden Paua, Haliotis iris, zu Schmuck verarbeitet. Dies reicht von Halsschmuck bis zu den Augen in geschnitzten Figuren, Tiki, oder an den Verzierungen der Versammlungshäuser auf einem Marae. ⓘ