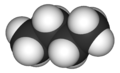
Butan
|
| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
Butan | |||
| Systematische IUPAC-Bezeichnung
Tetracarban (nie empfohlen) | |||
| Andere Bezeichnungen
Butylhydrid;<ref Quartan; Kältemittel 3-11-0
| |||
| Bezeichnungen | |||
3D-Modell (JSmol)
|
|||
Beilstein-Referenz
|
969129 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
1148 | ||
| KEGG | |||
| MeSH | Butan | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1011 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C4H10 | ||
| Molekulare Masse | 58,124 g-mol-1 | ||
| Erscheinungsbild | Farbloses Gas | ||
| Geruch | benzin- oder erdgasähnlich | ||
| Dichte | 2,48 kg/m3 (bei 15 °C (59 °F)) | ||
| Schmelzpunkt | -140 bis -134 °C; -220 bis -209 °F; 133 bis 139 K | ||
| Siedepunkt | -1 bis 1 °C; 30 bis 34 °F; 272 bis 274 K | ||
Löslichkeit in Wasser
|
61 mg/L (bei 20 °C (68 °F)) | ||
| log P | 2.745 | ||
| Dampfdruck | ~170 kPa bei 283 K | ||
Henry'sches Gesetz
Konstante (kH) |
11 nmol Pa-1 kg-1 | ||
| Konjugierte Säure | Butan | ||
Magnetische Suszeptibilität (χ)
|
-57,4-10-6 cm3/mol | ||
| Thermochemie | |||
Wärmekapazität (C)
|
98,49 J/(K-mol) | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-126,3--124,9 kJ/mol | ||
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
-2,8781--2,8769 MJ/mol | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H220 | ||
Sicherheitshinweise
|
P210 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | -60 °C (-76 °F; 213 K) | ||
Selbstentzündung
temperatur |
405 °C (761 °F; 678 K) | ||
| Explosionsgrenzen | 1.8–8.4% | ||
| NIOSH (US-Grenzwerte für Gesundheitsgefährdung): | |||
PEL (Zulässig)
|
keine | ||
REL (Empfohlen)
|
TWA 800 ppm (1900 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
1600 ppm | ||
| Verwandte Verbindungen | |||
Verwandte Alkane
|
| ||
Verwandte Verbindungen
|
Perfluorobutan | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Butan (/ˈbjuːteɪn/) oder n-Butan ist ein Alkan mit der Formel C4H10. Butan ist bei Raumtemperatur und atmosphärischem Druck ein Gas. Butan ist ein hochentzündliches, farbloses, leicht verflüssigtes Gas, das bei Raumtemperatur schnell verdampft. Der Name Butan stammt von der Wurzel but- (von Buttersäure, benannt nach dem griechischen Wort für Butter) und der Endung -ane. Entdeckt wurde es 1912 von dem Chemiker Dr. Walter Snelling. Es wurde 1864 von Edmund Ronalds, der als erster seine Eigenschaften beschrieb, in Rohbenzin gelöst gefunden. ⓘ
Butan gehört zu einer Gruppe von verflüssigten Erdölgasen (LP-Gase). Zu den anderen gehören Propan, Propylen, Butadien, Butylen, Isobutylen und Mischungen davon. Butan hat eine geringere Energiedichte, verbrennt aber sauberer als Benzin und Kohle. ⓘ
Butan, auch n-Butan ist ein gasförmiges farbloses Alkan, das die geradkettige Form der beiden strukturisomeren Butane (CH3–CH2–CH2–CH3) darstellt. Das verzweigte Isomer wird als Isobutan oder systematisch als Methylpropan bezeichnet. Es hat die Halbstrukturformel CH(CH3)3. ⓘ
Dichte
Die Dichte von Butan hängt stark von der Temperatur und dem Druck in der Lagerstätte ab. Die Dichte der flüssigen Phase beträgt beispielsweise 571,8±1 kg/m3 (bei einem Druck von bis zu 2MPa und einer Temperatur von 27±0,2 °C), während die Dichte von flüssigem Butan 625,5±0,7 kg/m3 beträgt (bei einem Druck von bis zu 2MPa und einer Temperatur von -13±0,2 °C). ⓘ

Geschichte
Butan und Propan wurden im Jahr 1912 von dem amerikanischen Chemiker Dr. Walter Snelling gleichzeitig entdeckt. Snelling identifizierte diese Gase als Bestandteile von Benzin und fand heraus, dass sie in volumenreduziertem, verflüssigtem Zustand in Druckbehältern gelagert werden können, wenn sie abgekühlt werden. ⓘ
Isomere
| Allgemeiner Name | normales Butan unverzweigtes Butan n-Butan |
Isobutan i-Butan ⓘ |
| IUPAC-Bezeichnung | Butan | Methylpropan |
| Molekulares Diagramm |

|
|
| Skelett Diagramm |

|
Die Drehung um die zentrale C-C-Bindung führt bei n-Butan zu zwei verschiedenen Konformationen (trans und gauche). ⓘ
Reaktionen

Wenn reichlich Sauerstoff vorhanden ist, verbrennt Butan unter Bildung von Kohlendioxid und Wasserdampf; wenn der Sauerstoff begrenzt ist, kann auch Kohlenstoff (Ruß) oder Kohlenmonoxid entstehen. Butan ist dichter als Luft. ⓘ
Wenn genügend Sauerstoff vorhanden ist:
- 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Wenn der Sauerstoff begrenzt ist:
- 2 C4H10 + 9 O2 → 8 CO + 10 H2O ⓘ
Nach Gewicht enthält Butan etwa 49,5 MJ/kg (13,8 kWh/kg; 22,5 MJ/lb; 21.300 Btu/lb) oder nach Flüssigkeitsvolumen 29,7 Megajoule pro Liter (8,3 kWh/l; 112 MJ/U.S. gal; 107.000 Btu/U.S. gal). ⓘ
Die maximale adiabatische Flammentemperatur von Butan mit Luft beträgt 2.243 K (1.970 °C; 3.578 °F). ⓘ
n-Butan ist das Ausgangsmaterial für das katalytische Verfahren von DuPont zur Herstellung von Maleinsäureanhydrid:
- 2 CH3CH2CH2CH3 + 7 O2 → 2 C2H2(CO)2O + 8 H2O ⓘ
n-Butan wird wie alle Kohlenwasserstoffe durch freie Radikale chloriert, wobei sowohl 1-Chlor- und 2-Chlorbutan als auch stärker chlorierte Derivate entstehen. Die relativen Geschwindigkeiten der Chlorierung lassen sich teilweise durch die unterschiedlichen Bindungsdissoziationsenergien von 425 und 411 kJ/mol für die beiden Arten von C-H-Bindungen erklären. ⓘ
Verwendungen
Normales Butan kann zum Mischen von Benzin, als Brenngas, als Lösungsmittel für die Duftextraktion, entweder allein oder in einem Gemisch mit Propan, und als Ausgangsstoff für die Herstellung von Ethylen und Butadien, einem Hauptbestandteil von synthetischem Gummi, verwendet werden. Isobutan wird in erster Linie von Raffinerien zur Verbesserung (Erhöhung) der Oktanzahl von Motorenbenzin verwendet. ⓘ
Bei der Beimischung von Benzin ist n-Butan der Hauptbestandteil, der zur Beeinflussung des Reid-Dampfdrucks (RVP) verwendet wird. Da Winterkraftstoffe zum Starten von Motoren einen viel höheren Dampfdruck benötigen, erhöhen Raffinerien den RVP, indem sie dem Kraftstoff mehr Butan beimischen. n-Butan hat eine relativ hohe Research-Oktanzahl (ROZ) und Motor-Oktanzahl (MOZ), die 93 bzw. 92 beträgt. ⓘ
Wird es mit Propan und anderen Kohlenwasserstoffen gemischt, kann das Gemisch im Handel als Flüssiggas (LPG) bezeichnet werden. Es wird als Benzinbestandteil, als Ausgangsstoff für die Herstellung von petrochemischen Grundstoffen beim Steamcracken, als Brennstoff für Feuerzeuge und als Treibmittel in Aerosolsprays wie Deodorants verwendet. ⓘ
Reine Formen von Butan, insbesondere Isobutan, werden als Kühlmittel verwendet und haben die ozonschichtschädigenden Halomethane in Kühlschränken, Gefriergeräten und Klimaanlagen weitgehend ersetzt. Der Betriebsdruck von Butan ist niedriger als der von Halomethanen wie Freon-12 (R-12), so dass R-12-Systeme, z. B. in Autoklimaanlagen, bei einer Umstellung auf reines Butan schlecht funktionieren. Stattdessen wird eine Mischung aus Isobutan und Propan verwendet, um eine mit R-12 vergleichbare Leistung des Kühlsystems zu erreichen. ⓘ
Butan wird auch als Feuerzeugbenzin für Feuerzeuge oder Butanfackeln verwendet und in Flaschen als Brennstoff zum Kochen, Grillen und für Campingkocher verkauft. Der Weltmarkt für Butan-Kanister wird von südkoreanischen Herstellern beherrscht. Im 20. Jahrhundert stellte die deutsche Firma Braun ein kabelloses Haarstylinggerät her, das Butan als Wärmequelle zur Dampferzeugung verwendete. ⓘ
Als Brennstoff wird Butan oft mit kleinen Mengen von Mercaptanen gemischt, die dem unverbrannten Gas einen unangenehmen Geruch verleihen, der von der menschlichen Nase leicht wahrgenommen werden kann. Auf diese Weise lassen sich Butanlecks leicht erkennen. Schwefelwasserstoff und Mercaptane sind zwar giftig, aber in so geringen Mengen vorhanden, dass die Erstickungs- und Brandgefahr durch das Butangas weit vor der Toxizität zum Problem wird. Das meiste handelsübliche Butan enthält auch etwas verunreinigendes Öl, das durch Filtration entfernt werden kann und ansonsten eine Ablagerung an der Zündstelle hinterlässt und schließlich den gleichmäßigen Gasfluss blockieren kann. ⓘ
Das als Lösungsmittel für die Duftextraktion verwendete Butan enthält diese Verunreinigungen nicht, und Butangas kann in schlecht belüfteten Bereichen Gasexplosionen verursachen, wenn Lecks unbemerkt bleiben und durch Funken oder Flammen entzündet werden. Gereinigtes Butan wird als Lösungsmittel bei der industriellen Extraktion von Cannabisölen verwendet. ⓘ
Butangasflasche, die zum Kochen verwendet wird ⓘ
Auswirkungen und Gesundheitsprobleme
Das Einatmen von Butan kann zu Euphorie, Schläfrigkeit, Bewusstlosigkeit, Erstickung, Herzrhythmusstörungen, Blutdruckschwankungen und vorübergehendem Gedächtnisverlust führen, wenn es direkt aus einem Behälter mit hohem Druck eingenommen wird, und kann zum Tod durch Ersticken und Kammerflimmern führen. Es dringt in den Blutkreislauf ein und führt innerhalb von Sekunden zu einer Intoxikation. Butan ist die am häufigsten missbrauchte flüchtige Substanz im Vereinigten Königreich und war im Jahr 2000 die Ursache für 52 % der lösungsmittelbedingten Todesfälle. Wenn Butan direkt in den Rachen gesprüht wird, kann sich der Flüssigkeitsstrahl durch Ausdehnung schnell auf -20 °C abkühlen und einen anhaltenden Kehlkopfspasmus verursachen. Das "Sudden sniffer's death"-Syndrom, das erstmals 1970 von Bass beschrieben wurde, ist mit 55 % der bekannten Todesfälle die häufigste Einzelursache für lösungsmittelbedingte Todesfälle. ⓘ
Eigenschaften
Butan ist bei Raumtemperatur und Normaldruck gasförmig und hat einen Schmelzpunkt von −138 °C und einen Siedepunkt von −0,5 °C. Butan ist schwerer als Luft und wirkt in hohen Konzentrationen narkotisierend bis erstickend. In Wasser ist Butan nahezu unlöslich (90 mg/l). Butan hat einen Flammpunkt von −60 °C und eine Zündtemperatur von 365 °C. Der Explosionsbereich von -Butan liegt in Luft zwischen der unteren Explosionsgrenze (UEG) von 1,4 Vol.-% (33 g·m−3) und der oberen Explosionsgrenze (OEG) von 9,4 Vol.-% (231 g·m−3). Der Heizwert liegt bei 12,69 kWh·kg−1, dies entspricht 32,31 kWh·m−3. Das Volumen ist als Normkubikmeter bei einer Temperatur von 0 °C und einem Druck von 101,325 kPa zu verstehen. ⓘ
Bromwasser und Kaliumpermanganatlösung werden durch Butan nicht entfärbt. Mit den Halogenen Chlor und Brom reagiert Butan – wie andere Alkane auch – gewöhnlich nicht. Unter Lichteinfluss bildet sich jedoch photochemisch durch eine Radikalkettenreaktion ein Gemisch verschiedener Chlorbutane bzw. Brombutane. ⓘ
Vorkommen
Butan ist ein sogenanntes Flüssiggas, das bei der Erdöldestillation anfällt. Es kommt im Erdöl und im Erdgas vor. ⓘ
Verwendung
Butan wird zur Herstellung von 1,3-Butadien und Maleinsäureanhydrid und seit dem FCKW-Verbot als Treibgas in Sprays verwendet. (Lebensmittelzusatzstoff E 943a) Im Gemisch mit wechselnden Anteilen Methylpropan und / oder Propan wird Butan als Brenngas („Flüssiggas“) zum Heizen und Kochen in Tanks und Gasflaschen sowie in Feuerzeugen eingesetzt. Als Treibstoff für Busse und Autos dient butanhaltiges Flüssiggas ebenfalls. ⓘ
Gebrauch als Droge
Butan wird als Droge verwendet. Die Wirkung ist mit ähnlichen Schnüffelstoffen zu vergleichen und wird primär von Jugendlichen gesucht. ⓘ
Beim Konsum kann es zu einer Sauerstoffunterversorgung kommen, da sich das dichtere Butan in der Lunge absetzt und somit das nutzbare Lungenvolumen abnimmt. Es kann zu Übelkeit, Erbrechen und im schlimmsten Fall zu erheblichen Hirnschädigungen führen. Lebensgefahr besteht bei Erhöhung des Gehirndrucks. Durch Senkung der Krampfschwelle kann die Krampfanfälligkeit gesteigert werden. Psychische Abhängigkeit ist möglich. In geschlossenen Räumen und Fahrzeugen kann es zudem zu einem hochexplosiven Gas-Luft-Gemisch kommen. ⓘ