Salinität
| Teil einer Serie über ⓘ |
| Salzgehalt des Wassers |
|---|
 |
| Salzgehalte |
|
Süßwasser (< 0,05%) Brackwasser (0,05-3%) Salzwasser (3-5%) Sole (> 5% bis zu 26%-28% max) |
| Wasserkörper |
|
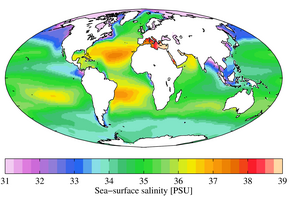

Der Salzgehalt (/səˈlɪnɪti/) ist der Salzgehalt oder die Menge des in einem Gewässer gelösten Salzes, auch Salzwasser genannt (siehe auch Bodensalzgehalt). Sie wird gewöhnlich in g/L oder g/kg (Gramm Salz pro Liter/Kilogramm Wasser; letzteres ist dimensionslos und entspricht ‰) gemessen. ⓘ
Der Salzgehalt ist ein wichtiger Faktor bei der Bestimmung vieler Aspekte der Chemie Der Salzgehalt ist ein wichtiger Faktor, der viele Aspekte der Chemie natürlicher Gewässer und der biologischen Prozesse in diesen Gewässern bestimmt, und er ist eine thermodynamische Zustandsvariable, die zusammen mit der Temperatur und dem Druck die physikalischen Eigenschaften wie die Dichte und die Wärmekapazität des Wassers bestimmt. ⓘ
Eine Konturlinie mit konstantem Salzgehalt wird als Isohaline oder manchmal auch als Isohale bezeichnet. ⓘ
Die Salinität kann mit Hilfe eines Salinometers bestimmt werden. Dabei wird ausgenutzt, dass die elektrische Leitfähigkeit des Wassers proportional zum Salzgehalt ist. In der Ozeanographie ist die Salinität eine wichtige Kenngröße bei der Bestimmung von Wassermassen und Meeresströmungen. ⓘ
Definitionen
Der Salzgehalt in Flüssen, Seen und im Meer ist konzeptionell einfach, aber technisch schwierig zu definieren und genau zu messen. Konzeptionell ist der Salzgehalt die Menge des gelösten Salzes im Wasser. Salze sind Verbindungen wie Natriumchlorid, Magnesiumsulfat, Kaliumnitrat und Natriumbicarbonat, die sich in Ionen auflösen. Die Konzentration der gelösten Chloridionen wird manchmal auch als Chlorinität bezeichnet. In der Praxis werden gelöste Stoffe als solche definiert, die einen sehr feinen Filter passieren können (historisch gesehen einen Filter mit einer Porengröße von 0,45 μm, heutzutage jedoch meist 0,2 μm). Der Salzgehalt kann in Form eines Massenanteils ausgedrückt werden, d. h. die Masse des gelösten Materials in einer Masseneinheit der Lösung. ⓘ
Meerwasser hat in der Regel einen Massensalzgehalt von etwa 35 g/kg, obwohl in Küstennähe, wo Flüsse in den Ozean münden, niedrigere Werte üblich sind. Flüsse und Seen können eine große Bandbreite an Salzgehalten aufweisen, die von weniger als 0,01 g/kg bis zu einigen g/kg reichen, obwohl es viele Orte gibt, an denen höhere Salzgehalte zu finden sind. Das Tote Meer hat einen Salzgehalt von mehr als 200 g/kg. Regenwasser hat, bevor es den Boden berührt, in der Regel einen TDS-Wert von 20 mg/L oder weniger. ⓘ
Unabhängig davon, welche Porengröße bei der Definition verwendet wird, schwankt der resultierende Salzgehalt einer bestimmten Probe natürlichen Wassers nicht um mehr als ein paar Prozent (%). Physikalische Ozeanographen, die im abyssalen Ozean arbeiten, sind jedoch oft mit der Präzision und der Vergleichbarkeit von Messungen verschiedener Forscher zu unterschiedlichen Zeitpunkten auf fast fünf signifikante Stellen beschäftigt. Ein in Flaschen abgefülltes Meerwasserprodukt, das als IAPSO-Standard-Meerwasser bekannt ist, wird von Ozeanographen verwendet, um ihre Messungen mit ausreichender Präzision zu standardisieren, um diese Anforderung zu erfüllen. ⓘ
Zusammensetzung
Mess- und Definitionsschwierigkeiten ergeben sich daraus, dass natürliches Wasser ein komplexes Gemisch aus vielen verschiedenen Elementen aus unterschiedlichen Quellen (nicht alle aus gelösten Salzen) in unterschiedlichen molekularen Formen enthält. Die chemischen Eigenschaften einiger dieser Formen hängen von Temperatur und Druck ab. Viele dieser Formen lassen sich nur schwer mit hoher Genauigkeit messen, und eine vollständige chemische Analyse ist in jedem Fall nicht praktikabel, wenn mehrere Proben analysiert werden. Verschiedene praktische Definitionen des Salzgehalts resultieren aus unterschiedlichen Versuchen, diesen Problemen mit unterschiedlicher Genauigkeit Rechnung zu tragen und dabei dennoch einigermaßen einfach zu handhaben zu sein. ⓘ
Aus praktischen Gründen wird die Salinität in der Regel auf die Summe der Massen einer Teilmenge dieser gelösten chemischen Bestandteile bezogen (so genannte Lösungssalinität) und nicht auf die unbekannte Masse der Salze, die zu dieser Zusammensetzung geführt haben (eine Ausnahme bildet die Herstellung von künstlichem Meerwasser). Für viele Zwecke kann diese Summe auf eine Reihe von acht Hauptionen in natürlichen Gewässern beschränkt werden, obwohl bei Meerwasser mit höchster Genauigkeit zusätzlich sieben Nebenionen einbezogen werden. Die Hauptionen dominieren die anorganische Zusammensetzung der meisten (aber bei weitem nicht aller) natürlichen Gewässer. Zu den Ausnahmen gehören einige Grubenseen und Wässer aus einigen hydrothermalen Quellen. ⓘ
Die Konzentrationen gelöster Gase wie Sauerstoff und Stickstoff werden in der Regel nicht in die Beschreibung des Salzgehalts einbezogen. Kohlendioxid, das in gelöster Form teilweise in Karbonate und Bikarbonate umgewandelt wird, wird jedoch häufig mit einbezogen. Silizium in Form von Kieselsäure, das im pH-Bereich der meisten natürlichen Gewässer in der Regel als neutrales Molekül auftritt, kann für bestimmte Zwecke ebenfalls einbezogen werden (z. B. bei der Untersuchung der Beziehung zwischen Salzgehalt und Dichte). ⓘ
Meerwasser
Der Begriff "Salzgehalt" wird von Ozeanographen in der Regel mit einer Reihe von spezifischen Messverfahren in Verbindung gebracht. In dem Maße, wie sich die vorherrschenden Techniken weiterentwickeln, verändern sich auch die Beschreibungen des Salzgehalts. Vor den 1980er Jahren wurde der Salzgehalt weitgehend mit Titrationstechniken gemessen. Durch Titration mit Silbernitrat konnte die Konzentration der Halogenidionen (hauptsächlich Chlor und Brom) bestimmt werden, um die Chlorinität zu ermitteln. Die Chlorinität wurde dann mit einem Faktor multipliziert, um alle anderen Bestandteile zu berücksichtigen. Die sich daraus ergebenden "Knudsen-Salinitäten" werden in Einheiten von Teilen pro Tausend (ppt oder ‰) ausgedrückt. ⓘ
Die Verwendung von Messungen der elektrischen Leitfähigkeit zur Schätzung des Ionengehalts des Meerwassers führte zur Entwicklung der so genannten praktischen Salinitätsskala 1978 (PSS-78). Die mit PSS-78 gemessenen Salinitäten haben keine Einheiten. Das Suffix psu oder PSU (für practical salinity unit) wird manchmal den PSS-78-Messwerten hinzugefügt. Die Hinzufügung von PSU als Einheit nach dem Wert ist formal nicht korrekt und es wird dringend davon abgeraten". ⓘ
Im Jahr 2010 wurde eine neue Norm für die Eigenschaften von Meerwasser mit der Bezeichnung Thermodynamische Gleichung des Meerwassers 2010 (TEOS-10) eingeführt, die die absolute Salinität als Ersatz für die praktische Salinität und die konservative Temperatur als Ersatz für die potenzielle Temperatur vorsieht. Diese Norm enthält eine neue Skala, die so genannte Skala der Referenzzusammensetzung des Salzgehalts. Die absoluten Salinitäten auf dieser Skala werden als Massenanteil in Gramm pro Kilogramm Lösung ausgedrückt. Die Salinitäten auf dieser Skala werden durch die Kombination von Messungen der elektrischen Leitfähigkeit mit anderen Informationen bestimmt, die regionale Veränderungen in der Zusammensetzung des Meerwassers berücksichtigen können. Sie können auch durch direkte Dichtemessungen bestimmt werden. ⓘ
Eine Meerwasserprobe von den meisten Orten mit einer Chlorinität von 19,37 ppt hat eine Knudsen-Salinität von 35,00 ppt, eine praktische PSS-78-Salinität von etwa 35,0 und eine absolute TEOS-10-Salinität von etwa 35,2 g/kg. Die elektrische Leitfähigkeit dieses Wassers beträgt bei einer Temperatur von 15 °C 42,9 mS/cm. ⓘ
Auf globaler Ebene ist es sehr wahrscheinlich, dass der vom Menschen verursachte Klimawandel zu den seit den 1950er Jahren beobachteten Veränderungen des Salzgehalts an der Oberfläche und im Untergrund beigetragen hat, und die Prognosen für die Veränderungen des Salzgehalts an der Oberfläche im 21. ⓘ
Seen und Flüsse
Limnologen und Chemiker definieren den Salzgehalt häufig als Masse des Salzes pro Volumeneinheit, ausgedrückt in mg pro Liter oder g pro Liter. Es wird impliziert, wenn auch oft nicht angegeben, dass dieser Wert nur bei einer bestimmten Referenztemperatur genau gilt. Die auf diese Weise angegebenen Werte sind in der Regel bis auf 1 % genau. Limnologen verwenden auch die elektrische Leitfähigkeit oder "Referenzleitfähigkeit" als Stellvertreter für den Salzgehalt. Diese Messung kann um Temperatureffekte korrigiert werden und wird in der Regel in der Einheit μS/cm angegeben. ⓘ
Ein Fluss- oder Seewasser mit einem Salzgehalt von etwa 70 mg/L hat bei 25 °C in der Regel eine spezifische Leitfähigkeit zwischen 80 und 130 μS/cm. Das tatsächliche Verhältnis hängt von den vorhandenen Ionen ab. Die tatsächliche Leitfähigkeit ändert sich in der Regel um etwa 2 % pro Grad Celsius, so dass die gemessene Leitfähigkeit bei 5 °C möglicherweise nur im Bereich von 50-80 μS/cm liegt. ⓘ
Direkte Dichtemessungen werden auch zur Schätzung des Salzgehalts verwendet, insbesondere in stark salzhaltigen Seen. Manchmal wird die Dichte bei einer bestimmten Temperatur als Ersatz für den Salzgehalt verwendet. In anderen Fällen wird eine empirische Beziehung zwischen Salzgehalt und Dichte, die für ein bestimmtes Gewässer entwickelt wurde, verwendet, um den Salzgehalt von Proben anhand einer gemessenen Dichte zu schätzen. ⓘ
| Salzgehalt des Wassers ⓘ | |||
|---|---|---|---|
| Süßwasser | Brackwasser | Salzwasser | Salzwasser |
| < 0.05% | 0.05 – 3% | 3 – 5% | > 5% |
| < 0.5 ‰ | 0.5 – 30 ‰ | 30 – 50 ‰ | > 50 ‰ |
Klassifizierung von Gewässern nach ihrem Salzgehalt
| Thalassische Reihe ⓘ |
| > 300 ‰ |
| hyperhalin |
| 60–80 ‰ |
| metahalin |
| 40 ‰ |
| mixoeuhalin |
| 30 ‰ |
| polyhalin |
| 18 ‰ |
| mesohalin |
| 5 ‰ |
| oligohalin |
| 0.5 ‰ |
Die Meeresgewässer sind die des Ozeans, ein anderer Begriff dafür ist euhaline Meere. Der Salzgehalt von euhalinen Meeren liegt bei 30 bis 35 ‰. Brackische Meere oder Gewässer haben einen Salzgehalt zwischen 0,5 und 29 ‰ und metahaline Meere zwischen 36 und 40 ‰. Alle diese Gewässer werden als thalassisch bezeichnet, da ihr Salzgehalt aus dem Ozean stammt, und als homoiohalin, wenn der Salzgehalt im Laufe der Zeit nur wenig schwankt (im Wesentlichen konstant). Die Tabelle auf der rechten Seite, modifiziert von Por (1972), folgt dem "Venedig-System" (1959). ⓘ
Im Gegensatz zu homoiohalinen Umgebungen gibt es bestimmte poikilohaline Umgebungen (die auch thalassisch sein können), in denen die Schwankungen des Salzgehalts biologisch signifikant sind. Der Salzgehalt von poikilohalinem Wasser kann zwischen 0,5 und mehr als 300 ‰ liegen. Das wichtigste Merkmal ist, dass diese Gewässer dazu neigen, ihren Salzgehalt über einen biologisch bedeutsamen Bereich jahreszeitlich oder auf einer anderen ungefähr vergleichbaren Zeitskala zu verändern. Vereinfacht ausgedrückt handelt es sich um Gewässer mit recht variablem Salzgehalt. ⓘ
Stark salzhaltiges Wasser, aus dem Salze auskristallisieren (oder kurz davor sind), wird als Sole bezeichnet. ⓘ
Ökologische Überlegungen
Der Salzgehalt ist ein ökologischer Faktor von erheblicher Bedeutung, da er die Arten von Organismen beeinflusst, die in einem Gewässer leben. Ebenso beeinflusst der Salzgehalt die Arten von Pflanzen, die entweder in einem Gewässer oder an Land, das von einem Gewässer (oder Grundwasser) gespeist wird, wachsen können. Eine Pflanze, die an salzige Bedingungen angepasst ist, wird als Halophyt bezeichnet. Ein Halophyt, der den Restnatriumkarbonat-Salzgehalt toleriert, wird Glaswurz, Salzkraut oder Barillapflanze genannt. Organismen (meist Bakterien), die unter sehr salzigen Bedingungen leben können, werden als extremophil oder speziell halophil bezeichnet. Ein Organismus, der eine große Bandbreite an Salzgehalten aushalten kann, ist euryhalin. ⓘ
Es ist teuer, Salz aus dem Wasser zu entfernen, und der Salzgehalt ist ein wichtiger Faktor für die Wassernutzung (z. B. Trinkbarkeit). In Seen und Flüssen in den Vereinigten Staaten wurde ein Anstieg des Salzgehalts beobachtet, der auf Streusalz und andere salzhaltige Enteisungsmittel im Abfluss zurückzuführen ist. ⓘ
Der Salzgehalt in den Ozeanen ist eine treibende Kraft für die weltweite Ozeanzirkulation, bei der Dichteänderungen aufgrund von Änderungen des Salzgehalts und Temperaturänderungen an der Meeresoberfläche zu Änderungen des Auftriebs führen, die das Sinken und Steigen von Wassermassen bewirken. Es wird angenommen, dass Veränderungen des Salzgehalts der Ozeane zu globalen Veränderungen des Kohlendioxidgehalts beitragen, da salzhaltigeres Wasser weniger kohlendioxidlöslich ist. Darüber hinaus ist die Hydrographie während der Eiszeiten so beschaffen, dass eine mögliche Ursache für die verringerte Zirkulation die Bildung geschichteter Ozeane ist. In solchen Fällen ist es schwieriger, Wasser durch die thermohaline Zirkulation zu subduzieren. ⓘ
Der Salzgehalt ist nicht nur eine treibende Kraft für die Ozeanzirkulation, sondern auch Veränderungen in der Ozeanzirkulation wirken sich auf den Salzgehalt aus, insbesondere im subpolaren Nordatlantik, wo zwischen 1990 und 2010 ein erhöhter Beitrag von grönländischem Schmelzwasser durch einen verstärkten Transport von salzigem Atlantikwasser nach Norden ausgeglichen wurde. Allerdings sind die Gewässer des Nordatlantiks seit Mitte der 2010er-Jahre aufgrund des verstärkten Zustroms von grönländischem Schmelzwasser frischer geworden. ⓘ
Geschichte der Salinitätsbestimmung
Mit der Salinitätsbestimmung will man herausfinden, wie viel Salz in einer Menge von Wasser gelöst ist. Der Salzgehalt ist zusammen mit dem Druck und der Temperatur für die Dichte beziehungsweise die potentielle Dichte des Wassers verantwortlich. Damit haben unterschiedliche Salzgehalte großen Einfluss auf die Meeresströmungen. ⓘ
Verdunstung
Die ursprünglichste Methode ist die Verdunstung von Wasser und die Wägung dessen, was nicht verdunstet ist. Das Problem ist, dass Wasser dabei in Salzkristallen eingeschlossen werden kann. Um dieses Wasser aus den Salzkristallen zu lösen, sind hohe Temperaturen notwendig. Durch die hohe Temperatur zerfallen jedoch einige Salze (z. B. MgCO3 → MgO + CO2). Schon Robert Boyle stellte im 17. Jahrhundert fest, dass die Trocknung und Wägung von Meerwasser zu wenig reproduzierbaren Ergebnissen für die Konzentration von gelösten Substanzen führte. ⓘ
Im 19. Jahrhundert wurde das Marcet-Prinzip oder auch das Gesetz der konstanten Proportionen formuliert. Es besagt: Ungeachtet wie stark sich die Salinität von Ort zu Ort unterscheidet, die Anteile der wichtigsten Ionen (engl. Major Ions) im Wasser des offenen Ozeans sind fast konstant. ⓘ
Anfang des 20. Jahrhunderts kamen neue Methoden zur Bestimmung des Salzgehaltes auf. ⓘ
Salinität, S‰ (Knudsen, 1902)
Um reproduzierbare Ergebnisse zu bekommen, wurde eine erste strikte Definition eingeführt. „Salinität ist definiert als das Gewicht in Gramm der gelösten anorganischen Stoffe in einem Kilogramm Seewassers, nachdem alle Bromide und Iodide mit der gleichen Menge an Chloriden ersetzt wurden und alle Kohlenstoff-Verbindungen oxidiert wurden.“ D. h. alle Kohlenstoffverbindungen gasen als CO2 aus. Dazu wurde das Seewasser, HCl und gesättigtes Chlorwasser getrocknet, für 72 Stunden bei 480 °C erhitzt und schließlich das rückständige Chlorid titriert. ⓘ
Diese Methode brachte nun zwar reproduzierbare Ergebnisse, war aber sehr umständlich und zur Anwendung auf See nur sehr bedingt geeignet. ⓘ
Chlorinität, Cl‰ (Sørensen und Knudsen, 1902)
Durch das Gesetz der konstanten Proportionen ist es möglich, aus dem Gehalt eines Salzes den Gehalt der restlichen Salze recht genau abzuschätzen. Mit Hilfe der Mohr-Titration konnte die Menge der Halogeniden in Seewasser bestimmt werden. Bei der Anwendung mit Seewasser fällt neben Silberchlorid noch Silberbromid und Silberiodid aus, welches nun gewogen werden kann. Damit die Ergebnisse präzise sind, wird die Silbernitrat-Lösung gegen sogenanntes Standard-Seewasser mit bekannter Chlorinität geeicht. Um nun aus der ermittelten Chlorinität die Salinität zu berechnen, maß Sørensen die Salinität von neun Seewasserproben direkt und bestimmte außerdem die Chlorinität. Die daraus abgeleitete Korrelation war: Salinität [‰] = 1,805 · Chlorinität [‰] + 0,030 ⓘ
Diese Methode ist sehr genau und auch auf See wesentlich besser anwendbar als die von 1902. ⓘ
Chlorinität, Cl‰ (UNESCO, 1962)
Wie die Addition eines konstanten Wertes in der obigen Korrelation schon vermuten lässt, gab es jedoch ein Problem. Die neun Proben stammten zum Teil aus der Ostsee. Die Ostsee hat jedoch eine andere Ionenkomposition als der offene Ozean. Dieser Fehler wurde durch eine neue Kalibrierung nach nun 60 Jahren korrigiert: Salinität [‰] = 1,80655 · Chlorinität [‰] ⓘ
Schwankungen der Salinität in Gewässern
Kurzfristige Schwankungen
Durch den Einfluss von Wetter und Gezeiten unterliegt die Salinität natürlichen Schwankungen. Zum einen das Ansteigen der Salinität durch Verdunstung bei Ebbe in ufernahen Bereichen (Wattenmeer, Gezeitentümpel) bis hin zur Ausbildung von Salzwiesen, zum Beispiel durch längere Sonnenperioden nach Sturmfluten. Bei Vorliegen einer wasserundurchlässigen Bodenschicht kann sich in Marschgebieten stark salzhaltiges flaches Grundwasser bilden, das auf der Insel Læsø im Kattegat eine Salinität von bis zu 15 Prozent erreicht. Eine Herabsetzung der Salinität kann sich durch Süßwassereintrag in Flussmündungen, in Schmelzwasserzonen und bei starkem Regen ergeben. ⓘ
Auch wenn Meerwasser gefriert, bleibt Salz zurück. Zwar befindet sich das Salz nach dem Gefrieren zunächst im Eis, ein Großteil diffundiert aber heraus und gelangt wieder ins Meerwasser, dessen Salzgehalt dadurch steigt.[Beleg?] ⓘ
Großräumige Unterschiede
Der Salzgehalt an der Wasseroberfläche unterscheidet sich typischerweise von Meer zu Meer. Im Ostseeraum, wo die Niederschläge (mit eingerechnet die Landfläche, aus der die Ostsee gespeist wird) wesentlich größer sind als die Verdunstung, wird das Oberflächenwasser verdünnt. Je weiter man nach Osten kommt, desto geringer ist die Oberflächensalinität. Die Verdünnung des Oberflächenwassers führt zu einer stabilen Wasserschichtung, wo salzarmes Ostseewasser über salzreicherem, aus der Nordsee stammendem Wasser liegt. ⓘ
Das Gegenteil passiert im Mittelmeer – dort ist die Verdunstung größer als die Niederschlagsmenge. Das Salz bleibt im Wasser zurück, sein Gehalt steigt. Tritt das Mittelmeerwasser bei Gibraltar aus dem Mittelmeer aus, sinkt es trotz seiner hohen Temperatur in mittlere Tiefen ab. Es kann anhand seines hohen Salzgehaltes quasi im ganzen Nordatlantik identifiziert werden. ⓘ
Salzgehalte
| Chlorid | 55,04 ⓘ |
| Natrium | 30,61 |
| Sulfat | 7,68 |
| Magnesium | 3,69 |
| Calcium | 1,16 |
| Kalium | 1,10 |
| Hydrogencarbonat | 0,41 |
| Bromid | 0,19 |
| Borat | 0,07 |
| Strontium | 0,04 |
Die wichtigsten gelösten Salzionen des Meerwassers haben in den Weltmeeren den gleichen Anteil an der Salinität, sie sind konservativ. Das heißt, auch bei unterschiedlicher Salinität ist der Anteil der Ionen zueinander der gleiche. Dies liegt daran, dass sie nach ihrem Eintrag ins Meer nicht mehr nennenswert von biologischen oder geochemischen Prozessen beeinflusst werden. Eine einfache begriffliche Einteilung lautet: „Wasser kann polyhalin sein (über 10 Promille Salze – nur Meerestiere), mesohalin (1,0 bis 10 Promille Salze – spezielle Brackwasserfauna) oder oligohalin (0,1 bis 1,0 Promille Salze – schon Süßwassertiere)“ ⓘ
Einordnung
- Süßwasser weist eine Salinität von unter 0,1 % auf (d. h. unter 1 g/kg.)
- Beim Brackwasser liegt die Salinität zwischen 0,1 % und 1,0 %.
- Ab einer Salinität über 1,0 % spricht man von Salzwasser. ⓘ
Zum Vergleich:
- Der durchschnittliche Salzgehalt der Ozeane liegt bei ca. 3,5 % (35 g/kg).
- Eine isotonische Kochsalzlösung enthält 0,9 % (9 g/kg) Kochsalz.
- Eine gesättigte Kochsalzlösung enthält 35,6 % (356 g/kg) Natriumchlorid bei 0 °C (359 g/kg bei 25 °C). ⓘ
Ozeane
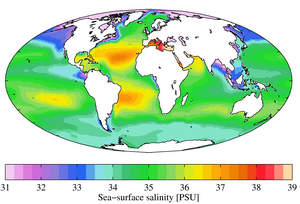
- Atlantik: 3,54 %
- Indischer Ozean: 3,48 %
- Pazifik: 3,45 % ⓘ
Weitere Meere
- Ostsee: 0,8 % im Durchschnitt (westliche Ostsee 1,3 %, Finnischer und Bottnischer Meerbusen < 0,5 %)
- Kieler Bucht: 1,5 %
- Finnischer und Bottnischer Meerbusen: 0,1 %
- Nordsee: 3,5 %
- Flussmündungen: 1,5 % – 2,5 %
- Nördliche Nordsee: 3,2 % – 3,5 %
- Mittelmeer: 3,74 %
- Schwarzes Meer 1,7 % – 1,8 %
- Persischer Golf: 4 %
- Rotes Meer: 4 %
- Asowsches Meer: 0,2 % – 1,1 %
Bei den anderen Nebenmeeren liegt die Salinität zwischen 3 % und 4 %. ⓘ
Binnenseen
- Kaspisches Meer: 1,3 %
- Mono Lake: 7,3 %
- Qarunsee: 11,8 %
- Totes Meer: 28 % (Durchschnitt)
- Totes Meer: 32,66 % in einer Tiefe von 50 Metern
- Aralsee: 0,9 % (1960)
- Kleiner Aralsee: 2 % (2003)
- Großer Aralsee: 7,5 % (2003)
- Assalsee: 34,8 % (Durchschnitt)
- Assalsee: 38,8 % in einer Tiefe von 20 Metern
- Don-Juan-See: 44,2 % (welthöchster Wert für ein Gewässer) ⓘ