Rabiesvirus
| Tollwut-Lyssavirus ⓘ | |
|---|---|

| |
| Koloriertes Transmissionselektronenmikroskopbild, das das Tollwutvirus (in rot) zeigt, das kultivierte Zellen infiziert | |
| Klassifizierung des Virus | |
| (ohne Rangfolge): | Virus |
| Bereich: | Riboviria |
| Königreich: | Orthornaviren |
| Phylum: | Negarnaviricota |
| Klasse: | Monjiviricetes |
| Ordnung: | Mononegavirales |
| Familie: | Rhabdoviridae |
| Gattung: | Lyssavirus |
| Spezies: | Tollwut-Lyssavirus
|
| Mitgliedsviren | |
| |
| Synonyme | |
| |
Das Tollwutvirus, wissenschaftlicher Name Rabies Lyssavirus, ist ein neurotropes Virus, das bei Menschen und Tieren Tollwut verursacht. Tollwut kann durch den Speichel von Tieren und seltener durch Kontakt mit menschlichem Speichel übertragen werden. Das Tollwut-Lyssavirus hat, wie viele Rhabdoviren, ein extrem breites Wirtsspektrum. In freier Wildbahn wurde es bei vielen Säugetierarten gefunden, während im Labor festgestellt wurde, dass Vögel, aber auch Zellkulturen von Säugetieren, Vögeln, Reptilien und Insekten infiziert werden können. Die Tollwut wird aus mehr als 150 Ländern auf allen Kontinenten, mit Ausnahme der Antarktis, gemeldet. Die Hauptlast der Krankheit wird aus Asien und Afrika gemeldet, aber in den letzten 10 Jahren wurden auch in Europa einige Fälle gemeldet, insbesondere bei zurückkehrenden Reisenden. ⓘ
Das Tollwut-Lyssavirus hat eine zylindrische Morphologie und gehört zur Gattung der Lyssaviren aus der Familie der Rhabdoviridae. Diese Viren sind umhüllt und haben ein einzelsträngiges RNA-Genom mit negativem Sinn. Die genetische Information ist in einem Ribonukleoproteinkomplex verpackt, in dem die RNA durch das virale Nukleoprotein fest gebunden ist. Das RNA-Genom des Virus kodiert für fünf Gene, deren Reihenfolge stark konserviert ist. Diese Gene kodieren für Nukleoprotein (N), Phosphoprotein (P), Matrixprotein (M), Glykoprotein (G) und die virale RNA-Polymerase (L). Die vollständigen Genomsequenzen sind zwischen 11.615 und 11.966 nt lang. ⓘ
Alle Transkriptions- und Replikationsvorgänge finden im Zytoplasma innerhalb einer spezialisierten "Virusfabrik", dem Negri-Körper (benannt nach Adelchi Negri), statt. Diese haben einen Durchmesser von 2-10 µm und sind typisch für eine Tollwutinfektion und wurden daher als eindeutiger histologischer Nachweis einer solchen Infektion verwendet. ⓘ
| Tollwutvirus ⓘ | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
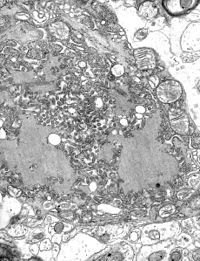
TEM-Aufnahme einer infizierten Zelle. | ||||||||||||||||||||
| Systematik | ||||||||||||||||||||
| ||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||
| ||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||
| Rabies lyssavirus | ||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||
| RABV | ||||||||||||||||||||
| Links | ||||||||||||||||||||
|
Das Rabiesvirus, wissenschaftlich Rabies lyssavirus, gemeinhin auch Tollwutvirus genannt, ist ein das Nervensystem angreifendes Virus, das in Tieren und Menschen die Tollwut auslöst. Die Folge ist eine akute lebensbedrohliche Enzephalitis (Gehirnentzündung), die normalerweise tödlich verläuft. Die Übertragung kann über den Speichel von Tieren erfolgen. Das Rabiesvirus ist ein behülltes Virus von zylindrischer Form. ⓘ
Struktur

Rhabdoviren haben eine spiralförmige Symmetrie, so dass ihre infektiösen Partikel eine annähernd zylindrische Form haben. Sie zeichnen sich durch ein extrem breites Wirtsspektrum aus, das von Pflanzen über Insekten bis zu Säugetieren reicht; Viren, die den Menschen infizieren, haben eher eine ikosaedrische Symmetrie und nehmen Formen an, die regelmäßigen Polyedern ähneln. ⓘ
Das Tollwutgenom kodiert für fünf Proteine: Nukleoprotein (N), Phosphoprotein (P), Matrixprotein (M), Glykoprotein (G) und Polymerase (L). Alle Rhabdoviren haben zwei Hauptstrukturkomponenten: einen spiralförmigen Ribonukleoproteinkern (RNP) und eine ihn umgebende Hülle. Im RNP ist die genomische RNA von dem Nukleoprotein fest umschlossen. Zwei weitere virale Proteine, das Phosphoprotein und das große Protein (L-Protein oder Polymerase), sind mit dem RNP assoziiert. Das Glykoprotein bildet etwa 400 trimere Spikes, die dicht auf der Oberfläche des Virus angeordnet sind. Das M-Protein ist sowohl mit der Hülle als auch mit dem RNP assoziiert und könnte das zentrale Protein der Rhabdovirus-Assemblierung sein. ⓘ
Das Rabies-Lyssavirus hat eine kugelförmige Gestalt mit einer Länge von etwa 180 nm und einem Querschnittsdurchmesser von etwa 75 nm. Ein Ende ist abgerundet oder kegelförmig und das andere Ende ist plan oder konkav. Die Lipoproteinhülle trägt knubbelartige Stacheln, die aus Glykoprotein G bestehen. Die Stacheln bedecken das ebene Ende des Virions (Viruspartikel) nicht. Unter der Hülle befindet sich die Membran- oder Matrixproteinschicht (M), die am planaren Ende eingewachsen sein kann. Der Kern des Virions besteht aus schraubenförmig angeordnetem Ribonukleoprotein. ⓘ

Organisation des Genoms
Das Rhabdovirus-Virion ist eine umhüllte, stäbchen- oder kugelförmige Struktur, die fünf Proteinarten enthält. Das Nukleoprotein (N) umhüllt die RNA in einem Verhältnis von einem Proteinmonomer zu neun Nukleotiden und bildet ein Nukleokapsid mit helikaler Symmetrie. Mit dem Nukleokapsid assoziiert sind Kopien des P- (Phosphoprotein) und des L-Proteins (large). Das L-Protein ist sehr bekannt, sein Gen nimmt etwa die Hälfte des Genoms ein. Seine Größe wird durch die Tatsache gerechtfertigt, dass es sich um ein multifunktionelles Protein handelt. Das M-Protein (Matrix) bildet eine Schicht zwischen dem Nukleokapsid und der Hülle, und Trimere des G-Proteins (Glykoprotein) bilden Spikes, die aus der Hülle herausragen. Die Genome aller Rhabdoviren kodieren für diese fünf Proteine, und im Fall des Tollwut-Lyssavirus sind es alle. ⓘ
| Symbol | Bezeichnung | UniProt | Funktion |
|---|---|---|---|
| N | Nukleoprotein | P16285 | Umhüllt die RNA. |
| P | Phosphoprotein | P16286 | L-Cofaktor und verschiedene regulatorische Funktionen. Hat viele Isoformen aus verschiedenen Initiationen. |
| M | Matrix | P16287 | Hält das Nukleoprotein kondensiert. Wichtig für den Zusammenbau; spielt eine Rolle bei der Regulierung. |
| G | Glykoprotein | P16288 | Spike. Nutzt muskuläre nAChR, NCAM und p75NTR als Rezeptoren. |
| L | Großes Strukturprotein | P16289 | RNA-Replikase vom Typ Mononegavirales. |
Replikation
Rabiesviren heften sich über spezifische Rezeptoren (Nikotinischer Acetylcholinrezeptor, Neurales Zelladhäsionsmolekül 1) an der Zelloberfläche an und werden durch ein sich ausbildendes Endosomvesikel durch Endozytose aufgenommen. Im Innern des Endosoms induziert der saure pH die Fusion von Endosommembran und Virushülle. Dadurch gelangt das Kapsid in das Zytosol, zerfällt und gibt das Genom frei. Sowohl die Rezeptorbindung als auch die Membranfusion werden durch das Glykoprotein G katalysiert, das eine wichtige Rolle in der Pathogenese spielt (so sind Mutanten ohne G nicht infektiös). ⓘ
Nach dem Eindringen in die Wirtszelle wird die Transkription des viralen Genomes durch die L Polymerase eingeleitet, um mehr virale Proteine herzustellen. Dabei ist P ein essentieller Cofactor für die Polymerase L. Die virale Polymerase erkennt nur Ribonukleoprotein und kann freie RNA nicht als Vorlage verwenden um mRNA herzustellen. Die Transkription ist durch cis-Elemente auf dem viralen Genom sowie durch das Protein M reguliert. Letzteres ist nicht nur essentiell für die Knospung (engl.: budding) des Virus von der Membran, sondern reguliert auch die Balance zwischen mRNA-Produktion und Replikation des viralen Genoms. ⓘ
Später produziert die Polymerase RNA mit positiver Polarität in voller Länge. Diese komplementären RNA-Stränge werden als Matrizen benutzt, um neue RNA-Genome mit negativer Polarität herzustellen. Diese werden mit Protein N in Ribonukleoprotein verpackt und können neue Viren formen. ⓘ
Infektion

Im September 1931 fand Joseph Lennox Pawan aus Trinidad Negri-Körperchen im Gehirn einer Fledermaus mit ungewöhnlichen Gewohnheiten. 1932 entdeckte Pawan erstmals, dass infizierte Vampirfledermäuse die Tollwut auf Menschen und andere Tiere übertragen können. ⓘ
Von der Eintrittswunde aus wandert das Tollwut-Lyssavirus schnell entlang der Nervenbahnen des peripheren Nervensystems. Der retrograde axonale Transport des Tollwut-Lyssavirus in das zentrale Nervensystem (ZNS) ist der entscheidende Schritt der Pathogenese bei einer natürlichen Infektion. Der genaue molekulare Mechanismus dieses Transports ist nicht bekannt, obwohl eine Bindung des P-Proteins des Tollwut-Lyssavirus an das Dynein-Protein der leichten Kette DYNLL1 nachgewiesen wurde. P wirkt auch als Interferon-Antagonist und schwächt so die Immunantwort des Wirts. ⓘ
Vom ZNS aus breitet sich das Virus weiter in andere Organe aus. Die Speicheldrüsen in den Geweben des Mundes und der Wangen nehmen hohe Konzentrationen des Virus auf, so dass es durch projektilartigen Speichelfluss weiter übertragen werden kann. Die Todesfälle können zwischen zwei Tagen und fünf Jahren nach der Erstinfektion auftreten. Dies hängt jedoch weitgehend von der Tierart ab, die als Reservoir dient. Die meisten infizierten Säugetiere sterben innerhalb von Wochen, während Stämme einer Art wie der Afrikanischen Gelbmanguste (Cynictis penicillata) eine Infektion jahrelang asymptomatisch überleben können. ⓘ
Das Virus ist im Speichel eines tollwütigen Tieres vorhanden und der Infektionsweg führt fast immer über einen Biss. Aber auch kleinste Verletzungen der Haut und Schleimhäute können das Eindringen des Virus per Schmierinfektion oder Kontaktinfektion ermöglichen. In vitro ist eine Übertragung durch Schleimhäute vorgekommen. Möglicherweise geschah eine Übertragung in dieser Form bei Menschen, die von Fledermäusen bevölkerte Höhlen erforschten. Außer bei der Organtransplantation (ein Fall mit drei Todesopfern in den USA zu Beginn des Jahres 2004 und ein Fall mit drei Todesopfern in Deutschland Anfang 2005), ist die Übertragung von Mensch zu Mensch bislang nicht beobachtet worden. ⓘ
Vom ZNS breitet sich das Virus auch in andere Organe aus; so tritt es im Speichel von infizierten Tieren auf und kann sich dadurch weiterverbreiten. Oftmals tritt eine erhöhte Aggressivität mit verstärktem Beißverhalten auf, welches die Wahrscheinlichkeit, das Virus weiter zu verbreiten, erhöht. ⓘ
Anzeichen und Symptome
Die ersten Symptome der Tollwut können denen einer Grippe sehr ähnlich sein, einschließlich allgemeiner Schwäche oder Unwohlsein, Fieber oder Kopfschmerzen. Diese Symptome können tagelang andauern. Es kann auch zu Unwohlsein oder einem Kribbeln oder Juckreiz an der Bissstelle kommen, das sich innerhalb weniger Tage zu Symptomen wie zerebralen Störungen, Angst, Verwirrung und Unruhe entwickelt. Im weiteren Verlauf der Krankheit kann es zu Delirium, abnormalem Verhalten, Halluzinationen und Schlaflosigkeit kommen. Das Tollwut-Lyssavirus kann im Körper seines Wirts auch inaktiv sein und erst nach längerer Zeit aktiv werden. ⓘ
Antigenität
Nach dem Eindringen des Virus in den Körper und auch nach einer Impfung bildet der Körper virusneutralisierende Antikörper, die das Virus binden und inaktivieren. Es hat sich gezeigt, dass bestimmte Regionen des G-Proteins am stärksten antigenisch sind und zur Bildung von virusneutralisierenden Antikörpern führen. Diese antigenen Stellen oder Epitope werden in die Regionen I-IV und Minor Site a eingeteilt. Frühere Arbeiten haben gezeigt, dass die antigenen Stellen II und III am häufigsten von natürlichen neutralisierenden Antikörpern angegriffen werden. Darüber hinaus wurde nachgewiesen, dass ein monoklonaler Antikörper mit neutralisierender Funktion auf die antigene Stelle I abzielt. Andere Proteine, wie das Nukleoprotein, sind nachweislich nicht in der Lage, die Produktion von neutralisierenden Antikörpern gegen das Virus auszulösen. Die Epitope, die neutralisierende Antikörper binden, sind sowohl linear als auch konformationell. ⓘ
Entwicklung
Alle heute existierenden Tollwutviren scheinen sich innerhalb der letzten 1500 Jahre entwickelt zu haben. Es gibt sieben Genotypen des Tollwut-Lyssavirus. In Eurasien sind die Fälle auf drei von ihnen zurückzuführen - Genotyp 1 (klassische Tollwut) und in geringerem Maße die Genotypen 5 und 6 (europäische Fledermaus-Lyssaviren Typ 1 und 2). Der Genotyp 1 entwickelte sich im 17. Jahrhundert in Europa und verbreitete sich im Zuge der europäischen Entdeckung und Kolonisierung nach Asien, Afrika und Amerika. ⓘ
Die Fledermaustollwut in Nordamerika scheint seit 1281 n. Chr. aufzutreten (95 % Konfidenzintervall: 906-1577 n. Chr.). ⓘ
Das Tollwutvirus hat offenbar einen evolutionären Wirtswechsel von Chiroptera (Fledermäusen) zu einer Spezies der Carnivora (z. B. Waschbär oder Stinktier) vollzogen, der auf ein homologes Rekombinationsereignis vor Hunderten von Jahren zurückzuführen ist. Bei diesem Rekombinationsereignis wurde das Gen verändert, das für das Glykoprotein des Virus kodiert, das für die Erkennung und Bindung an den Rezeptor erforderlich ist. ⓘ
Anwendung
Das Tollwut-Lyssavirus wird in der Forschung zum viralen neuronalen Tracing verwendet, um synaptische Verbindungen und die Richtung der synaptischen Übertragung festzustellen. ⓘ
Systematik
Die Lyssaviren umfassen das üblicherweise mit Tollwut assoziierte Rabiesvirus, verschiedene Fledermaus-Lyssaviren sowie das Mokola-Virus (engl. Mokola lyssavirus). Zusammen mit dem Erreger der Vesikulärstomatitis und weiteren bilden sie die Rhabdoviridae Familie. Rhabdoviridae haben charakteristischerweise ein breites Wirtsspektrum, das von Pflanzen über Insekten bis zu Wirbeltieren reichen kann. ⓘ
Behandlung
Der Impfstoff gegen das Tollwutvirus wird meistens nach einer Infektion verabreicht. ⓘ
Hirnforschung
Eine nicht pathogene Variante des Tollwutvirus wird seit kurzer Zeit als viraler Vektor genutzt, um Gehirnbereiche und deren Verbindungen zueinander zu kartieren. Dieser Forschungsbereich ermöglicht es, die Verschaltung bestimmter Bereiche (z. B. des sensorischen, motorischen Kortex mit anderen Arealen) anzufärben und daraufhin hochauflösende Karten zu erstellen. Diese moderne Form der Neuroanatomie ermöglicht es einzelnen Verbindungen über lange Strecken zu verfolgen und deren axonalen Verbindungen im Detail zu rekonstruieren. ⓘ
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis des Rabiesvirus namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist. Die Meldepflicht betrifft in erster Linie die Leitungen von Laboren (§ 8 IfSG). ⓘ
In der Schweiz ist der positive und negative laboranalytische Befund zum Rabiesvirus für Laboratorien meldepflichtig und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. ⓘ