Redox-Flow-Batterie
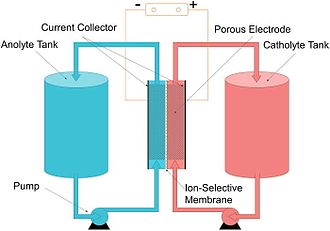
Eine Flow-Batterie oder Redox-Flow-Batterie (nach Reduktion-Oxidation) ist eine Art elektrochemische Zelle, bei der die chemische Energie durch zwei chemische Komponenten bereitgestellt wird, die in Flüssigkeiten gelöst sind, die auf getrennten Seiten einer Membran durch das System gepumpt werden. Der Ionenaustausch (begleitet vom Stromfluss) findet durch die Membran statt, während die beiden Flüssigkeiten in ihrem jeweiligen Raum zirkulieren. Die Zellspannung wird chemisch durch die Nernst-Gleichung bestimmt und liegt in praktischen Anwendungen zwischen 1,0 und 2,43 Volt. ⓘ
Eine Durchflussbatterie kann wie eine Brennstoffzelle (bei der der verbrauchte Brennstoff entnommen und dem System neuer Brennstoff zugeführt wird) oder wie eine wiederaufladbare Batterie (bei der eine elektrische Stromquelle die Regeneration des Brennstoffs antreibt) verwendet werden. Obwohl sie technische Vorteile gegenüber herkömmlichen wiederaufladbaren Batterien hat, wie z. B. potenziell trennbare Flüssigkeitstanks und eine nahezu unbegrenzte Lebensdauer, sind die derzeitigen Implementierungen vergleichsweise weniger leistungsfähig und erfordern eine anspruchsvollere Elektronik. ⓘ
Die Energiekapazität ist eine Funktion des Elektrolytvolumens und die Leistung eine Funktion der Elektrodenoberfläche. ⓘ
Konstruktionsprinzip
Die energiespeichernden Elektrolyte werden außerhalb der Zelle in getrennten Tanks gelagert. Damit ist die Redox-Flow-Zelle mit den Tanks für die Elektrolyte – wie die Brennstoffzelle mit den Tanks für den Brennstoff und das Oxidationsmittel – ein elektrochemischer Energiespeicher, bei dem Energiemenge und Leistung unabhängig voneinander skaliert werden können. Die Tanks könnten manuell befüllt und der Akkumulator somit durch einen Stoffwechsel geladen werden. Durch den Austausch der Elektrolytflüssigkeiten können diese auch in räumlich getrennten Akkumulatoren geladen und entladen werden; somit braucht nicht der gesamte Akkumulator mit Wandlertechnik und Gehäuse, sondern nur der eigentliche Energieträger zwischen der Lade- und Entladestation ausgetauscht zu werden. In der Praxis werden die Systeme aber mit möglichst geschlossenen Kreisläufen ausgeführt. ⓘ
Die eigentliche galvanische Zelle wird durch eine Membran in zwei Halbzellen geteilt. An der Membran fließt der Elektrolyt vorbei. Die Halbzelle wird durch eine Elektrode abgegrenzt, an der die eigentliche chemische Reaktion in Form einer Reduktion oder Oxidation abläuft. Die Membran ist je nach Zelltyp ein mikroporöser Separator, der alle Ionen passieren lässt, eine selektive Anionen- oder Kationentauschermembran oder eine Größenausschlussmembran, die Polymer zurückhält und kleine Ionen passieren lässt. Die Membran soll die Vermischung der beiden Elektrolyte verhindern. ⓘ
Die Elektroden bestehen aufgrund ihres hohen elektrochemischen Spannungsfensters in wässrigen Lösungen meistens aus Graphit. Für eine möglichst hohe spezifische Leistung werden als Elektrodenmaterial Graphitfilze mit hoher spezifischer Oberfläche eingesetzt. ⓘ
Eine Durchflussbatterie ist eine wiederaufladbare Brennstoffzelle, in der ein Elektrolyt, der ein oder mehrere gelöste elektroaktive Elemente enthält, durch eine elektrochemische Zelle fließt, die chemische Energie reversibel direkt in Elektrizität umwandelt. Elektroaktive Elemente sind "Elemente in Lösung, die an einer Elektrodenreaktion teilnehmen können oder an der Elektrode adsorbiert werden können". Der zusätzliche Elektrolyt wird extern gelagert, in der Regel in Tanks, und in der Regel durch die Zelle (oder Zellen) des Reaktors gepumpt, obwohl auch Schwerkraftsysteme bekannt sind. Durchflussbatterien können schnell "aufgeladen" werden, indem die Elektrolytflüssigkeit ausgetauscht wird (ähnlich wie beim Nachfüllen von Kraftstofftanks für Verbrennungsmotoren) und gleichzeitig das verbrauchte Material für die Wiederaufladung zurückgewonnen wird. In vielen Durchflussbatterien werden aufgrund der niedrigen Kosten und der ausreichenden elektrischen Leitfähigkeit Elektroden aus Kohlenstofffilz verwendet, obwohl diese Elektroden aufgrund ihrer geringen inhärenten Aktivität gegenüber vielen Redoxpaaren die Leistungsdichte etwas einschränken. ⓘ
Mit anderen Worten, eine Durchflussbatterie ist eine elektrochemische Zelle mit der Eigenschaft, dass die ionische Lösung (Elektrolyt) außerhalb der Zelle (statt in der Zelle um die Elektroden herum) gelagert wird und in die Zelle eingespeist werden kann, um Strom zu erzeugen. Die Gesamtmenge an Strom, die erzeugt werden kann, hängt vom Volumen des Elektrolyts in den Tanks ab. ⓘ
Für Durchflussbatterien gelten die Konstruktionsprinzipien der elektrochemischen Technik. ⓘ
Typen
Es wurden verschiedene Arten von Durchflusszellen (Batterien) entwickelt, darunter anorganische Durchflussbatterien und organische Durchflussbatterien. In jeder Kategorie lassen sich die Durchflussbatterien in Volldurchflussbatterien, Halbdurchflussbatterien und membranlose Durchflussbatterien unterteilen. Der grundlegende Unterschied zwischen herkömmlichen Batterien und Durchflusszellen besteht darin, dass die Energie bei herkömmlichen Batterien im Elektrodenmaterial gespeichert wird, während sie bei Durchflusszellen im Elektrolyten gespeichert wird. Die Patentklassifikationen für Durchflussbatterien sind bis 2021 noch nicht vollständig entwickelt. Die kooperative Patentklassifikation betrachtet RFBs als eine Unterklasse von regenerativen Brennstoffzellen (H01M8/18), obwohl es angemessener ist, Brennstoffzellen als eine Unterklasse von Durchflussbatterien zu betrachten. ⓘ
Anorganische Durchflussbatterien
Anorganische Vollstrom-RFBs
Die Redoxzelle (Reduktions-Oxidations-Zelle) ist eine reversible Zelle, in der sich redoxaktive Spezies in einem flüssigen (flüssigen oder gasförmigen) Medium befinden. Redox-Flow-Batterien sind wiederaufladbare (sekundäre) Zellen. Da sie den heterogenen Elektronentransfer und nicht die Festkörperdiffusion oder Interkalation nutzen, ähneln sie eher den Brennstoffzellen als den herkömmlichen Batterien (wie Blei-Säure- oder Lithium-Ionen-Batterien). Der Hauptgrund dafür, dass Brennstoffzellen nicht als Batterien angesehen werden, liegt darin, dass Brennstoffzellen ursprünglich (in den 1800er Jahren) als Mittel zur Erzeugung von Elektrizität direkt aus Brennstoffen (und Luft) durch einen nicht verbrennungsbedingten elektrochemischen Prozess entwickelt wurden. Später, insbesondere in den 1960er und 1990er Jahren, wurden wiederaufladbare Brennstoffzellen (d. h. H
2/O
2, wie die regenerativen Brennstoffzellen des Helios-Prototyps der NASA) entwickelt. ⓘ
Beispiele für Redox-Flow-Batterien sind die Vanadium-Redox-Flow-Batterie, die Polysulfid-Bromid-Batterie (Regenesys), die Eisen-Redox-Flow-Batterie (IRFB) und die Uran-Redox-Flow-Batterie. Redox-Brennstoffzellen sind auf dem Markt weniger verbreitet, obwohl viele Systeme vorgeschlagen wurden. ⓘ
Vanadium-Redox-Durchflussbatterien sind derzeit die am meisten vermarkteten Durchflussbatterien, da sie trotz begrenzter Energie- und Leistungsdichten Vorteile gegenüber anderen chemischen Systemen bieten. Da sie Vanadium an beiden Elektroden verwenden, kommt es zu keiner Kreuzkontamination. Die begrenzte Löslichkeit von Vanadiumsalzen macht diesen Vorteil in der Praxis jedoch wieder zunichte. Noch wichtiger für den kommerziellen Erfolg von VRFBs ist die nahezu perfekte Übereinstimmung des Spannungsfensters der Kohlenstoff/Wassersäure-Grenzfläche mit dem Arbeitsspannungsbereich der Vanadium-Redox-Kopplungen. Dies gewährleistet die Langlebigkeit der kostengünstigen Kohlenstoffelektroden und die geringe Auswirkung von Nebenreaktionen, wie z. B. die Entwicklung von H2 und O2, was zu einer rekordverdächtig langen kalendarischen (viele Jahre) und zyklischen (15.000-20.000 Zyklen) Lebensdauer führt, was wiederum zu rekordverdächtig niedrigen Energiekosten (LCOE, d. h. die Systemkosten geteilt durch die nutzbare Energie, die zyklische Lebensdauer und den Wirkungsgrad) führt. Die lange Lebensdauer von Durchflussbatterien ermöglicht die Amortisation ihrer relativ hohen Kapitalkosten (aufgrund von Vanadium, Kohlenstofffilzen, Bipolarplatten und Membranen). Die nivellierten Energiekosten für VRFBs liegen in der Größenordnung von einigen Dutzend $-Cent oder €-Cent pro kWh, viel niedriger als bei Festkörperbatterien und nicht so weit entfernt von den Zielen von 0,05 $ und 0,05 €, die von US- und EU-Regierungsstellen genannt werden. Zu den größten Herausforderungen für eine breite Umsetzung gehören: geringe Vorkommen und hohe Kosten von V2O5 (> 30 $/kg), dem Rohstoff für VRFB, parasitäre Reaktionen, einschließlich Wasserstoff- und Sauerstoffentwicklung, und Ausfällung von V2O5 während des Zyklus. Dies ist die Hauptantriebskraft für die Entwicklung alternativer Durchflussbatterietechnologien. ⓘ
Herkömmliche Durchflussbatterien haben sowohl eine geringe spezifische Energie (was sie für vollelektrische Fahrzeuge zu schwer macht) als auch eine geringe spezifische Leistung (was sie für die stationäre Energiespeicherung zu teuer macht). Für Wasserstoff-Brom-Durchflussbatterien wurde jedoch eine hohe Leistung von 1,4 W/cm2 und für Wasserstoff-Bromat-Durchflussbatterien eine hohe spezifische Energie (530 Wh/kg auf der Tankebene) nachgewiesen. ⓘ
Anorganische Semi-Flow-RFBs
Die Hybrid-Flow-Batterie verwendet eine oder mehrere elektroaktive Komponenten, die als feste Schicht abgeschieden werden. Der größte Nachteil ist der Verlust an entkoppelter Energie und Leistung, wie er bei Vollstrombatterien durch die Verwendung einer Festkörperelektrode entsteht. Die Zelle enthält eine Batterieelektrode und eine Brennstoffzellenelektrode. Bei diesem Typ ist die Energie durch die Elektrodenfläche begrenzt. Zu den hybriden Durchflussbatterien gehören die Zink-Brom-, die Zink-Cerium-, die lösliche Bleisäure- und die Eisen-Salz-Durchflussbatterie. Weng et al. berichteten über eine wiederaufladbare Vanadium-Metallhydrid-Hybrid-Durchflussbatterie mit einer experimentellen OCV von 1,93 V und einer Betriebsspannung von 1,70 V, relativ hohe Werte unter den wiederaufladbaren Durchflussbatterien mit wässrigen Elektrolyten. Diese Hybridbatterie besteht aus einer positiven Elektrode aus Graphitfilz, die in einer gemischten Lösung aus VOSO
4und H
2SO
4 arbeitet, und einer negativen Metallhydrid-Elektrode in wässriger KOH-Lösung. Die beiden Elektrolyte mit unterschiedlichem pH-Wert sind durch eine bipolare Membran getrennt. Das System zeigte eine gute Reversibilität und hohe Wirkungsgrade bei Coulomb (95 %), Energie (84 %) und Spannung (88 %). Sie berichteten über weitere Verbesserungen dieses Redoxpaares durch eine höhere Stromdichte, die Einbeziehung größerer 100 cm2-Elektroden und den Betrieb von 10 großen Zellen in Reihe. Vorläufige Daten unter Verwendung einer schwankenden simulierten Leistungsaufnahme testeten die Machbarkeit der Speicherung im kWh-Maßstab. Im Jahr 2016 wurde eine Mn(VI)/Mn(VII)-Zn-Hybrid-Durchflussbatterie mit hoher Energiedichte vorgeschlagen. ⓘ
Ein Prototyp einer Zink-Polyiodid-Durchflussbatterie wies eine Energiedichte von 167 Wh/l (Wattstunden pro Liter) auf. Ältere Zink-Bromid-Zellen erreichen 70 Wh/l. Zum Vergleich: Lithium-Eisenphosphat-Batterien speichern 233 Wh/l. Die Zink-Polyiodid-Batterie gilt als sicherer als andere Durchflussbatterien, da sie keine säurehaltigen Elektrolyte enthält, nicht entflammbar ist und einen Betriebsbereich von -20 bis 50 °C (-4 bis 122 °F) hat, der keine umfangreichen Kühlkreisläufe erfordert, die zusätzliches Gewicht und Platz beanspruchen würden. Ein ungelöstes Problem ist die Ablagerung von Zink auf der negativen Elektrode, das die Membran durchdringen und die Effizienz verringern kann. Wegen der Bildung von Zn-Dendriten können Zn-Halogenid-Batterien nicht mit hoher Stromdichte (> 20 mA/cm2) betrieben werden und haben daher eine begrenzte Leistungsdichte. Die Zugabe von Alkohol zum Elektrolyten der ZnI-Batterie kann dieses Problem lösen. Die Nachteile der Zn/I RFB liegen in den hohen Kosten der Iodidsalze (> $20/kg), der begrenzten Flächenkapazität der Zn-Abscheidung, die auch zu einem Verlust der entkoppelten Energie und Leistung führt, und der Zn-Dendritenbildung. ⓘ
Wenn die Batterie vollständig entladen ist, enthalten beide Tanks die gleiche Elektrolytlösung: eine Mischung aus positiv geladenen Zinkionen (Zn2+
) und negativ geladenen Jodid-Ionen (I-
). Im geladenen Zustand enthält der eine Tank ein weiteres negatives Ion, Polyiodid (I-
3). Die Batterie erzeugt Strom, indem sie Flüssigkeit aus externen Tanks in den Stapelbereich der Batterie pumpt, wo die Flüssigkeiten gemischt werden. Innerhalb des Stacks passieren die Zinkionen eine selektive Membran und wandeln sich auf der negativen Seite des Stacks in metallisches Zink um. Um die Energiedichte der Zink-Jodid-Durchflussbatterie weiter zu erhöhen, werden Bromid-Ionen (Br
-) als Komplexbildner verwendet, um das freie Jod zu stabilisieren, so dass Jod-Bromid-Ionen (I
2Br-
) als Mittel zur Freisetzung von Iodidionen für die Ladungsspeicherung. ⓘ
Protonenflussbatterien (PFB) integrieren eine Metallhydrid-Speicherelektrode in eine reversible Protonenaustauschmembran (PEM)-Brennstoffzelle. Während des Ladevorgangs verbindet die PFB Wasserstoffionen, die bei der Spaltung von Wasser entstehen, mit Elektronen und Metallteilchen in einer Elektrode der Brennstoffzelle. Die Energie wird in Form eines Metallhydrids im festen Zustand gespeichert. Bei der Entladung entstehen Strom und Wasser, wenn der Prozess umgekehrt wird und die Protonen mit dem Sauerstoff der Umgebung kombiniert werden. Es können Metalle verwendet werden, die weniger teuer als Lithium sind und eine höhere Energiedichte als Lithiumzellen aufweisen. ⓘ
Organische Durchflussbatterien
Im Vergleich zu anorganischen Redox-Flow-Batterien wie Vanadium-Redox-Flow-Batterien und Zn-Br2-Batterien, die bereits seit Jahrzehnten entwickelt werden, kamen 2009 organische Redox-Flow-Batterien auf den Markt. Die Attraktivität der organischen Redox-Flow-Batterien liegt vor allem in den abstimmbaren Redox-Eigenschaften der aktiven Komponenten. Ab 2021 weisen organische RFB eine geringe Lebensdauer auf (d. h. Kalender- oder Zykluslebensdauer oder beides). Aus diesem Grund wurden bisher nur anorganische RFB im kommerziellen Maßstab demonstriert. ⓘ
Organische Redox-Flow-Batterien können weiter in wässrige (AORFBs) und nicht-wässrige (NAORFBs) unterteilt werden. AORFBs verwenden Wasser als Lösungsmittel für Elektrolytmaterialien, während NAORFBs organische Lösungsmittel verwenden. AORFBs und NAORFBs können weiter unterteilt werden in rein organische und hybride Systeme. Erstere verwenden ausschließlich organische Elektrodenmaterialien, während letztere anorganische Materialien als Anode oder Kathode verwenden. Bei der Energiespeicherung in größerem Maßstab bieten AORFBs aufgrund der geringeren Lösungsmittelkosten und der höheren Leitfähigkeit ein größeres kommerzielles Potenzial und bieten zudem Sicherheitsvorteile gegenüber Elektrolyten auf Wasserbasis. NAORFBs bieten stattdessen ein viel größeres Spannungsfenster und nehmen weniger Platz in Anspruch. ⓘ
pH-neutrale AORFBs
pH-neutrale AORFBs werden bei pH7-Bedingungen betrieben und verwenden in der Regel NaCl als Trägerelektrolyt. Bei pH-neutralen Bedingungen sind organische und metallorganische Moleküle stabiler als bei korrosiven sauren und alkalischen Bedingungen. So ist beispielsweise K4[Fe(CN)], ein in AORFBs häufig verwendeter Katholyt, in alkalischen Lösungen nicht stabil, wohl aber bei pH-neutralen Bedingungen. ⓘ
In AORFBs wurden Methylviologen als Anolyt und 4-Hydroxy-2,2,6,6-tetramethylpiperidin-1-oxyl als Katholyt bei pH-neutralen Bedingungen sowie NaCL und eine kostengünstige Anionenaustauschmembran verwendet. Dieses MV/TEMPO-System hat die höchste Zellspannung, 1,25 V, und möglicherweise die niedrigsten Kapitalkosten ($180/kWh), die für AORFBs berichtet wurden. Die wässrigen Flüssigelektrolyte wurden als "Drop-in"-Ersatz für die derzeitigen Systeme konzipiert, ohne dass die bestehende Infrastruktur ersetzt werden muss. Eine 600-Milliwatt-Testbatterie war über 100 Zyklen hinweg stabil und hatte einen Wirkungsgrad von nahezu 100 % bei Stromdichten von 20 bis 100 mA/cm2, wobei die optimale Leistung bei 40-50 mA lag, bei der etwa 70 % der ursprünglichen Batteriespannung erhalten blieben. Neutrale AORFBs können umweltfreundlicher sein als saure oder alkalische AORFBs, während ihre elektrochemische Leistung mit der von korrosiven RFBs vergleichbar ist. Die MV/TEMPO-AORFB hat eine Energiedichte von 8,4 Wh/L, wobei die Begrenzung auf der TEMPO-Seite liegt. Flussbatterien auf Viologenbasis wurden hauptsächlich von der Gruppe von Liu an der Utah State University entwickelt. Im Jahr 2019 berichtete die Gruppe über eine ultraleichte Sulfonat-Viologen/Ferrocyanid-AORFB, die über 1000 Zyklen hinweg stabil ist und eine Energiedichte von 10 Wh/L aufweist, die bisher stabilste AORFB mit hoher Energiedichte. ⓘ
Saure AORFBs
Chinone und ihre Derivate sind die Grundlage vieler organischer Redoxsysteme. In einer Studie wurden 1,2-Dihydrobenzochinon-3,5-disulfonsäure (BQDS) und 1,4-Dihydrobenzochinon-2-sulfonsäure (BQS) als Kathoden und herkömmliches Pb/PbSO4 als Anolyt in einer hybriden sauren AORFB verwendet. Chinone nehmen zwei Einheiten elektrischer Ladung auf, im Vergleich zu einer in einem herkömmlichen Katholyt, was bedeutet, dass eine solche Batterie doppelt so viel Energie in einem gegebenen Volumen speichern könnte. ⓘ
Ein weiteres Chinon. 9,10-Anthrachinon-2,7-disulfonsäure (AQDS), wurde untersucht. AQDS unterliegt einer schnellen, reversiblen Zwei-Elektronen/Zwei-Protonen-Reduktion an einer Glaskohlenstoffelektrode in Schwefelsäure. Eine wässrige Durchflussbatterie mit kostengünstigen Kohlenstoffelektroden, die das Chinon/Hydrochinon-Paar mit dem Br
2/Br-
Redoxpaar kombiniert, ergibt eine galvanische Spitzenleistungsdichte von über 6.000 W/m2 bei 13.000 A/m2. Die Speicherkapazität blieb pro Zyklus zu mehr als 99 % erhalten. Die volumetrische Energiedichte betrug über 20 Wh/L. Durch die Verwendung von Anthrachinon-2-sulfonsäure und Anthrachinon-2,6-disulfonsäure auf der negativen Seite und 1,2-Dihydrobenzochinon-3,5-disulfonsäure auf der positiven Seite wird die Verwendung von gefährlichem Br2 vermieden. Die Batterie soll 1.000 Zyklen lang halten, ohne sich zu zersetzen. Dieses System scheint zwar robust zu sein, hat aber eine niedrige Zellspannung (ca. 0,55 V) und eine geringe Energiedichte (< 4 Wh/L). ⓘ
Die als Elektrolyt verwendete Bromwasserstoffsäure wurde durch eine weniger toxische alkalische Lösung (1 M KOH) und Ferrocyanid ersetzt. Der höhere pH-Wert ist weniger korrosiv und ermöglicht die Verwendung kostengünstiger Polymertanks. Der erhöhte elektrische Widerstand in der Membran wurde durch eine erhöhte Spannung kompensiert. Die Zellenspannung betrug 1,2 V. Der Wirkungsgrad der Zelle lag bei über 99 %, während der Wirkungsgrad bei der Hin- und Rückfahrt 84 % betrug. Die Batterie hatte eine erwartete Lebensdauer von mindestens 1.000 Zyklen. Ihre theoretische Energiedichte betrug 19 Wh/L. Die chemische Stabilität von Ferrocyanid in einer KOH-Lösung mit hohem pH-Wert ohne Bildung von Fe(OH)2 oder Fe(OH)3 muss vor dem Scale-up noch überprüft werden. ⓘ
Die Integration von Anolyt und Katholyt in ein und dasselbe Molekül wurde untersucht. Solche bifunktionalen Analyten oder Kombi-Moleküle ermöglichen die Verwendung desselben Materials in beiden Tanks. In dem einen Tank ist es ein Elektronendonator, während es in dem anderen Tank ein Elektronenempfänger ist. Dies hat entscheidende Vorteile, wie z. B. die Verringerung des Effekts von Crossover. So sind Chinon-Diaminoanthrachinon und Moleküle auf Indigo-Basis sowie TEMPO/Phenazin-Kombinationsmoleküle potenzielle Elektrolyte für die Entwicklung von symmetrischen Redox-Flow-Batterien (SRFB). ⓘ
Bei einem anderen Ansatz wurde ein Blatter-Radikal als Donor/Empfänger verwendet. Es überstand in Tests 275 Lade- und Entladezyklen, obwohl es nicht wasserlöslich war. ⓘ
Alkalische AORFBs
Chinonmoleküle wurden als Anolyte in alkalischen AROFBs verwendet. Ein weiterer Anolyt-Kandidat ist Fluorenon, das zur Erhöhung seiner Wasserlöslichkeit überarbeitet wurde. Eine Demonstrationszelle mit reversibler Keton-(De-)Hydrierung wurde 120 Tage lang über 1 111 Ladezyklen bei Raumtemperatur ohne Katalysator betrieben, wobei eine Kapazität von 97 % erhalten blieb. Die Zelle bietet mehr als die doppelte Energiedichte von Systemen auf Vanadiumbasis. Die größte Herausforderung für alkalische AORFBs ist das Fehlen eines stabilen Katholyten, was ihre Energiedichte unter 5 Wh/L hält. Alle berichteten alkalischen AORFBs verwenden aufgrund des Stabilitätsproblems von Ferrocyanid in alkalischen Lösungen einen überschüssigen Kaliumferrocyanid-Katholyten. ⓘ
Metallorganische Durchflussbatterien verwenden organische Liganden, um die Eigenschaften der redoxaktiven Metalle zu verbessern. Bei den Liganden kann es sich um Chelate wie EDTA handeln, die es dem Elektrolyten ermöglichen, sich in neutralen oder alkalischen Bedingungen zu befinden, in denen Metall-Aqua-Komplexe sonst ausfallen würden. Indem sie die Koordination von Wasser an das Metall blockieren, können organische Liganden metallkatalysierte Wasserspaltungsreaktionen hemmen, was zu wässrigen Systemen mit höherer Spannung führt. Die Verwendung von Chrom, das an 1,3-Propandiamintetraacetat (PDTA) koordiniert ist, führte beispielsweise zu Zellpotenzialen von 1,62 V gegenüber Ferrocyanid und einem Rekord von 2,13 V gegenüber Brom. Metallorganische Durchflussbatterien können auch als Durchflussbatterien mit Koordinationschemie bezeichnet werden, was die Technologie hinter der Gridstar Flow-Technologie von Lockheed Martin darstellt. ⓘ
Oligomere RFBs
RFB mit oligomeren Redox-Spezies wurden vorgeschlagen, um den Crossover der elektroaktiven Spezies zu verringern und gleichzeitig kostengünstige Membranen zu verwenden. Solche redoxaktiven Oligomere werden als Redoxmere bezeichnet. Ein System verwendet organische Polymere und eine Kochsalzlösung mit einer Zellulosemembran. Der Prototyp durchlief 10.000 Ladezyklen und behielt dabei eine beträchtliche Kapazität. Die Energiedichte betrug 10 Wh/l. Die Stromdichte erreichte 100 Milliampere/cm2. ⓘ
Bei einer anderen oligomeren RFB werden Viologen- und TEMPO-Redoxymere in Kombination mit kostengünstigen Dialysemembranen verwendet. Funktionalisierte Makromoleküle (ähnlich wie Acrylglas oder Styropor), die in Wasser gelöst sind, bilden das aktive Elektrodenmaterial. Die größenselektive nanoporöse Membran funktioniert wie ein Sieb und lässt sich viel einfacher und kostengünstiger herstellen als herkömmliche ionenselektive Membranen. Sie hält die großen, spaghettiartigen Polymermoleküle zurück, während sie kleine Gegenionen passieren lässt. Das Konzept könnte das Problem der hohen Kosten der herkömmlichen Nafion-Membran lösen, aber die Entwicklung und Synthese eines redoxaktiven Polymers mit hoher Wasserlöslichkeit ist nicht trivial. Bislang haben RFB mit oligomeren Redox-Spezies keine konkurrenzfähige bereichsspezifische Leistung gezeigt. Es ist nicht klar, ob die niedrige Betriebsstromdichte ein intrinsisches Merkmal großer Redox-Moleküle ist oder nicht. ⓘ
Membranlose Batterie
Eine membranlose Batterie beruht auf einer laminaren Strömung, bei der zwei Flüssigkeiten durch einen Kanal gepumpt werden, wo sie elektrochemische Reaktionen eingehen, um Energie zu speichern oder freizusetzen. Die Lösungen fließen parallel zueinander und vermischen sich kaum. Die Strömung trennt die Flüssigkeiten auf natürliche Weise und macht eine Membran überflüssig. ⓘ
Membranen sind oft die teuersten und unzuverlässigsten Komponenten von Batterien, da sie durch wiederholten Kontakt mit bestimmten Reagenzien korrodieren können. Der Verzicht auf eine Membran ermöglicht die Verwendung einer flüssigen Bromlösung und von Wasserstoff: Diese Kombination ist problematisch, wenn Membranen verwendet werden, da sie Bromwasserstoffsäure bilden, die die Membran zerstören kann. Beide Materialien sind kostengünstig erhältlich. Bei der Konstruktion wird ein kleiner Kanal zwischen zwei Elektroden verwendet. Flüssiges Brom fließt durch den Kanal über eine Graphitkathode und Bromwasserstoffsäure fließt unter einer porösen Anode hindurch. Gleichzeitig strömt Wasserstoffgas über die Anode. Die chemische Reaktion kann umgekehrt werden, um die Batterie wieder aufzuladen - eine Premiere für eine membranlose Konstruktion. Eine solche membranlose Durchflussbatterie, die im August 2013 veröffentlicht wurde, erreichte eine maximale Leistungsdichte von 0,795 mW/cm2, dreimal so viel Leistung wie andere membranlose Systeme - und eine Größenordnung höher als Lithium-Ionen-Batterien. ⓘ
Im Jahr 2018 wurde eine membranlose Redox-Flow-Batterie im Makromaßstab demonstriert, die in der Lage ist, dieselben Elektrolytströme über mehrere Zyklen hinweg wiederaufzuladen und zu rezirkulieren. Die Batterie basiert auf nicht mischbaren organischen Katolyt- und wässrigen Anolyt-Flüssigkeiten, die eine hohe Kapazitätserhaltung und Coulombsche Effizienz während des Zyklus aufweisen. ⓘ
Nano-Netz
Durch die Anordnung des Lithium-Schwefel-Systems in einem Netzwerk von Nanopartikeln entfällt die Notwendigkeit, dass sich die Ladung in und aus den Partikeln bewegt, die in direktem Kontakt mit einer leitenden Platte stehen. Stattdessen ermöglicht das Nanopartikelnetzwerk den Stromfluss durch die Flüssigkeit. Dadurch kann mehr Energie gewonnen werden. ⓘ
Andere Redox-Flow-Batterien
Zu den anderen Durchflussbatterien gehören die Zink-Cerium-Hybrid-Durchflussbatterie, die Zink-Brom-Hybrid-Durchflussbatterie und die Wasserstoff-Brom-Batterie. ⓘ
Andere Durchflussbatterien
Halbfest
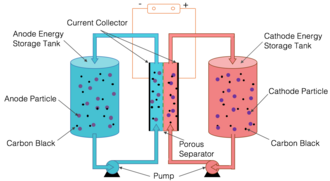
In einer halbfesten Durchflusszelle bestehen die positiven und negativen Elektroden aus Partikeln, die in einer Trägerflüssigkeit suspendiert sind. Die positiven und negativen Suspensionen werden in separaten Tanks gelagert und durch separate Rohre in einen Stapel benachbarter Reaktionskammern gepumpt, wo sie durch eine Barriere, z. B. eine dünne, poröse Membran, getrennt sind. Das Konzept kombiniert die Grundstruktur von Wasserdurchflussbatterien, bei denen Elektrodenmaterial in einem flüssigen Elektrolyten suspendiert wird, mit der Chemie von Lithium-Ionen-Batterien sowohl in kohlenstofffreien Suspensionen als auch in Aufschlämmungen mit leitfähigem Kohlenstoffnetz. Die kohlenstofffreie halbfeste Redox-Flow-Batterie wird manchmal auch als Solid Dispersion Redox Flow Battery bezeichnet. Das Auflösen eines Materials verändert sein chemisches Verhalten erheblich. Durch das Suspendieren von Feststoffteilen bleiben die Eigenschaften des Feststoffs jedoch erhalten. Das Ergebnis ist eine zähflüssige Suspension, die wie Melasse fließt. ⓘ
Redox-fokussierte Feststoffe
Eine weitere neuere Entwicklung sind Flussbatterien mit redoxspezifischen Feststoffen (ROTS), die auch als Solid Energy Booster (SEB) bezeichnet werden. ⓘ
In diesen Batterien kommen entweder Posolyt oder Negolyt oder beides (auch Redoxflüssigkeiten genannt) mit einem oder mehreren festen elektroaktiven Materialien in Kontakt, die in Tanks außerhalb des Stromstapels gelagert werden. Die Redoxflüssigkeiten bestehen aus einem oder mehreren Redoxpaaren, deren Redoxpotentiale mit dem Redoxpotential des festen elektroaktiven Materials flankieren. Solche RFB mit festen Energieverstärkern (Solid Energy Boosters, SEB) kombinieren den Vorteil der hohen spezifischen Energie herkömmlicher Batterien (wie Lithium-Ionen-Batterien) mit dem entkoppelten Energie-Leistungs-Vorteil von Durchflussbatterien. SEB(ROTS)-RFBs haben im Vergleich zu halbfesten RFBs mehrere Vorteile, z. B. müssen keine viskosen Aufschlämmungen gepumpt werden, es gibt keine Ausfällungen/Verstopfungen, eine höhere bereichsspezifische Leistung, eine längere Lebensdauer und einen größeren chemischen Gestaltungsspielraum. ⓘ
Chemische Stoffe
Für Durchflussbatterien wurde ein breites Spektrum an Chemikalien erprobt. ⓘ
| Koppeln | Max. Zellspannung (V) | Durchschnittliche Leistungsdichte der Elektroden (W/m2) | Durchschnittliche Energiedichte der Flüssigkeit | Zyklen ⓘ |
|---|---|---|---|---|
| Wasserstoff-Lithium-Bromat | 1.1 | 15,000 | 750 Wh/kg | |
| Wasserstoff-Lithiumchlorat | 1.4 | 10,000 | 1400 Wh/kg | |
| Brom-Wasserstoff | 1.07 | 7,950 | ||
| Eisen-Zinn | 0.62 | < 200 | ||
| Eisen-Titan | 0.43 | < 200 | ||
| Eisen-Chrom | 1.07 | < 200 | ||
| Eisen-Eisen | 1.21 | < 1000 | 20 Wh/L | 10,000 |
| Organisch (2013) | 0.8 | 13,000 | 21,4 Wh/L | 10 |
| Organisch (2015) | 1.2 | 7,1 Wh/L | 100 | |
| MV-TEMPO | 1.25 | 8,4 Wh/L | 100 | |
| Sulfonat-Viologen (NH4)4[Fe(CN)6] | 0.9 | > 500 | 10 Wh/L | 1,000 |
| Metallorganisches Ferrocyanid | 1.62 | 2,000 | 21,7 Wh/L | 75 |
| Metallorganisches Brom | 2.13 | 3,000 | 35 Wh/L | 10 |
| Vanadium-Vanadium (Sulfat) | 1.4 | ~800 | 25 Wh/L | |
| Vanadium-Vanadium (Bromid) | 50 Wh/L | 2,000 | ||
| Natrium-Brom-Polysulfid | 1.54 | ~800 | ||
| Natrium-Kalium | ||||
| Schwefel-Sauerstoff-Salz | ||||
| Zink-Brom | 1.85 | ~1,000 | 75 Wh/kg | > 2,000 |
| Blei-Säure (Methansulfonat) | 1.82 | ~1,000 | ||
| Zink-Cerium (Methansulfonat) | 2.43 | < 1,200–2,500 | ||
| Zn-Mn(VI)/Mn(VII) | 1.2 | 60 Wh/L |
Vorteile
Redox-Durchflussbatterien, und in geringerem Maße auch Hybrid-Durchflussbatterien, haben die folgenden Vorteile
- flexibles Layout (aufgrund der Trennung der Leistungs- und Energiekomponenten)
- lange Zyklenlebensdauer (da es keine Phasenübergänge von fest nach fest gibt)
- schnelle Reaktionszeiten
- keine Notwendigkeit einer "Ausgleichsladung" (Überladung einer Batterie, um sicherzustellen, dass alle Zellen gleichmäßig geladen sind)
- keine schädlichen Emissionen. ⓘ
Einige Typen bieten auch eine einfache Bestimmung des Ladezustands (durch die Abhängigkeit der Spannung von der Ladung), geringen Wartungsaufwand und Toleranz gegenüber Überladung/Überentladung. ⓘ
Sie sind sicher, weil
- sie in der Regel keine brennbaren Elektrolyte enthalten
- die Elektrolyte können außerhalb des Stromnetzes gelagert werden. ⓘ
Diese technischen Vorzüge machen Redox-Flow-Batterien zu einer gut geeigneten Option für die Energiespeicherung in großem Maßstab. ⓘ
Nachteile
Die beiden Hauptnachteile sind
- geringe Energiedichte (man benötigt große Elektrolytbehälter, um nützliche Energiemengen zu speichern)
- niedrige Lade- und Entladeraten (im Vergleich zu anderen industriellen Elektrodenverfahren). Dies bedeutet, dass die Elektroden und Membranseparatoren groß sein müssen, was die Stromkosten erhöht. ⓘ
Durchflussbatterien haben in der Regel einen höheren Energiewirkungsgrad als Brennstoffzellen, aber einen geringeren als Lithium-Ionen-Batterien. ⓘ
Anwendungen
Durchflussbatterien werden normalerweise für relativ große (1 kWh - 10 MWh) stationäre Anwendungen in Betracht gezogen. Diese sind für:
- Lastausgleich - hier wird die Batterie an ein Stromnetz angeschlossen, um überschüssigen Strom in Schwachlastzeiten zu speichern und Strom in Spitzenlastzeiten abzugeben. Das allgemeine Problem, das den Einsatz der meisten chemischen Durchflussbatterien in dieser Anwendung einschränkt, ist ihre geringe Flächenleistung (Betriebsstromdichte), die sich in hohen Stromkosten niederschlägt.
- Speicherung von Energie aus erneuerbaren Quellen wie Wind- oder Solarenergie zur Entladung in Zeiten des Spitzenbedarfs.
- Peak Shaving, bei dem Bedarfsspitzen durch die Batterie gedeckt werden.
- USV, bei der die Batterie eingesetzt wird, wenn die Hauptstromversorgung ausfällt, um eine ununterbrochene Versorgung zu gewährleisten.
- Energieumwandlung - weil alle Zellen denselben Elektrolyt (dieselben Elektrolyte) verwenden. Daher kann der Elektrolyt (die Elektrolyte) mit einer bestimmten Anzahl von Zellen geladen und mit einer anderen Anzahl entladen werden. Da die Batteriespannung proportional zur Anzahl der verwendeten Zellen ist, kann die Batterie als sehr leistungsfähiger Gleichspannungswandler fungieren. Wenn die Anzahl der Zellen kontinuierlich geändert wird (auf der Eingangs- und/oder Ausgangsseite), kann die Leistungsumwandlung auch AC/DC, AC/AC oder DC-AC sein, wobei die Frequenz durch die des Schaltgeräts begrenzt wird.
- Elektrofahrzeuge - Da Durchflussbatterien durch Austausch des Elektrolyts schnell "aufgeladen" werden können, können sie für Anwendungen eingesetzt werden, bei denen das Fahrzeug genauso schnell Energie aufnehmen muss wie ein Fahrzeug mit Verbrennungsmotor. Ein häufiges Problem der meisten RFB-Chemien in EV-Anwendungen ist ihre geringe Energiedichte, die sich in einer geringen Reichweite niederschlägt. Durchflussbatterien auf der Basis von hochlöslichen Halogenaten sind eine bemerkenswerte Ausnahme.
- Autonomes Stromversorgungssystem - Ein Beispiel hierfür sind Mobilfunk-Basisstationen, die nicht über ein Stromnetz verfügen. Die Batterie kann zusammen mit Solar- oder Windenergiequellen eingesetzt werden, um deren schwankende Leistung auszugleichen, und zusammen mit einem Generator, um die Batterie möglichst effizient zu nutzen und Kraftstoff zu sparen. ⓘ
Aufgrund der Eigenschaften wird die Redox-Flow-Zelle primär im Bereich von Erprobungen und Prototypen eingesetzt. So werden Redox-Flow-Zellen etwa in Form des Vanadium-Redox-Akkumulators als Reservequelle für Mobilfunk-Basisstationen oder Pufferbatterie für Windkraftanlagen eingesetzt. ⓘ
Ein System dieser Art mit 4 MW Leistung und einer Speicherfähigkeit von 6 MWh wird seit 2012 in einer japanischen Windkraftanlage eingesetzt. ⓘ
Der Vanadium-Redox-Akkumulator des Hybridkraftwerks Pellworm hat eine Speicherfähigkeit von 1,6 MWh und eine Lade-/Entladeleistung von 200 kW. ⓘ
In einem praxisnahen Forschungsprojekt (Applikationszentrum) erforscht das Fraunhofer ICT in Pfinztal seit Ende September 2018 die Pufferung stark schwankender Windenergie einer 2-MW-Windkraftanlage mit einer 20-MWh-Redox-Flow-Batterie. Zusätzlich wird bis 2021 eine 500-kW-Solaranlage installiert. Ziel ist es, eine kontinuierliche Stromversorgung der Stromverbraucher zu den Hauptbedarfszeiten zu erreichen. ⓘ
Für den modernen kontextorientierten experimentellen Chemieunterricht wurden bereits mehrfach schulisch anwendbare Modellexperimente entwickelt. ⓘ
Seit 2017 bietet die US-amerikanische Firma ESS Inc. Redoxflow-Batterien für industrielle Anwendungen an. ⓘ
Allgemeines
Im Vergleich zu einem Akkumulator ohne Stoffaustausch liegt eine aufwändigere Konstruktion vor, die neben Tank und Rohrleitungen mindestens zwei Pumpen für die Umwälzung der Elektrolyte samt den dafür nötigen Steuer- und Kontrolleinrichtungen benötigt. Daher eignen sich Flussbatterien nicht so gut für kleine Verbraucher. Der Einsatz im Bereich der Elektromobilität ist Thema von Forschungen. Der bisher am häufigsten eingesetzte und wichtigste Typ der Flussbatterie ist der Vanadium-Redox-Akkumulator. Darüber hinaus gibt es noch weitere Typen wie den Polysulfid-Bromid-Akkumulator, Natriumchlorid-Redox-Akkumulator, Zink-Brom-Akkumulator und Uran-Redox-Akkumulator. ⓘ
Da die in einem Lösungsmittel gelösten chemischen Verbindungen in von der Zelle getrennten und beliebig groß ausgeführten Tanks gespeichert werden, ist die gespeicherte Energiemenge nicht von der Zellengröße abhängig. Die Redox-Flow-Batterie ist durch die elektrochemische Reversibilität mit dem Akkumulator und der Reversiblen Brennstoffzelle verwandt. Die Zellenspannung ist durch die Nernst-Gleichung gegeben und liegt bei praktisch realisierbaren Systemen bei 1 V bis 2,2 V. ⓘ
Forschung
Geschichte
Die Grundlagen für Redox-Flow-Zellen wurden Mitte des 20. Jahrhunderts in Deutschland von Walther Kangro an der Technischen Universität Braunschweig erarbeitet, als erstmals die Möglichkeiten der Energiespeicherung mit Redox-Paaren geprüft wurden. In den 1970er Jahren beschäftigte sich die NASA mit der Entwicklung der Technik. Die reine Vanadium-Lösung wurde 1978 erstmals vorgeschlagen und in den 1980ern an der University of New South Wales von Maria Skyllas-Kazacos und ihren Mitarbeitern entwickelt. Diese Lösung wurde 1986 patentiert und ist bisher am verbreitetsten. Sie erfuhr eine Weiterentwicklung zur Vanadium-Bromid-basierten Zelle, die doppelt so hohe Energiedichten erlaubt. ⓘ
Neuere Forschung
Im Januar 2014 stellten Forscher der Harvard University eine Redox-Flow-Zelle auf Basis von organischen Chinonen vor, die ohne Einsatz seltener und damit vergleichsweise teurer Substanzen auskommt. Bei Prototypen wurden Leistungsdichten von 600 Milliwatt pro Quadratzentimeter gemessen. Derzeit wird an der Langzeitstabilität solcher Zellen geforscht. ⓘ
2015 wurde in der Fachzeitschrift Energy and Environmental Science ein Redox-Flow-Konzept auf Basis von Eisen und Zink präsentiert. Durch die Nutzung der günstigen Materialien Eisen und Zink soll mittelfristig ein Systempreis von unter 100 US-Dollar Kapitalkosten/kWh möglich sein, womit diese Akkumulatoren konkurrenzfähig zu Pumpspeicher- und Druckluftspeicherkraftwerken wären. Bisher liegen Redox-Flow-Zellen bei 300 bis 800 US-Dollar/kWh. Die Leistungsdichte läge bei rund 680 Milliwatt pro Quadratzentimeter. ⓘ
Eine weitere Neuerung stellte 2015 die Friedrich-Schiller-Universität in Jena vor, eine Polymer-basierte Redox-Flow-Batterie (pRFB), die vollständig auf Metalle als Aktivmaterial verzichtet. Dieser neue Batterietyp setzt organische Polymere (ähnlich Plexiglas oder Styropor), die eine redoxaktive Einheit tragen, für Anode und Kathode ein. Als Lösungsmittel werden keine korrosiven Säuren benötigt, eine einfache Kochsalzlösung ist ausreichend. Der Einsatz der wässrigen Polymerlösungen ermöglicht darüber hinaus die Nutzung von Dialysemembranen zur Trennung von Anode und Kathode, die wesentlich einfacher und günstiger herstellbar sind als klassische Ionentauschermembranen. Während die großen Makromoleküle (Polymere) nach dem Prinzip eines „Siebes“ zurückgehalten werden, können die kleinen Kochsalzionen die Membran ungehindert passieren und den zellinternen Stromkreis schließen. ⓘ
Aktuell wird u. a. die Eignung von Lignin als Anolyt untersucht. Lignin gilt aufgrund seiner chemischen Eigenschaften in Kombination mit seiner Umweltfreundlichkeit, seiner weiten Verfügbarkeit und seiner niedrigen Kosten als vielversprechender Rohstoff für metallfreie Redox-Flow-Batterien zur Energiespeicherung. Im März 2018 wird über eine erzielte Stromdichte von 20 mA/cm² und einen Polarisationswiderstand von 15 Ω/cm² auf Basis von Ligninsulfonat berichtet. Es wird für möglich gehalten, dass Flowzellen auf Ligninbasis zukünftig bei einem Speicherwirkungsgrad von 90 % Speicherkosten von ca. 3 ct/kWh aufweisen werden. ⓘ
Im Oktober 2020 wurde von einer Forschergruppe der TU Graz das redoxaktive 2-Methoxyhydrochinon – durch Oxidation des aus Ligninsulfonat zugänglichen Vanillins erhältlich – als organischer Elektrolyt in einer wässrig-organischen RFB beschrieben. In 0,5 M Phosphorsäure H3PO4 als Lösungsmittel konnten über 250 Lade-Entlade-Zyklen ohne nennenswerte Effizienzeinbußen realisiert werden. ⓘ
Ebenfalls 2020 wurde ein Redox-System auf Eisenbasis entwickelt. Eisen-Redox-Flow-Systeme sollen eine Betriebsdauer von bis zu zwölf Stunden und eine unbegrenzte Anzahl von Zyklen innerhalb einer Betriebsdauer von 20 bis 25 Jahren erreichen, was sie geeignet machen würde, als Nachtspeicher für Solarkraftwerke zu fungieren. ⓘ
Auch ein System mit Mangan anstelle von Vanadium wurde beschrieben. Im Jahr 2022 stellten Forscher der Utah State University ein Redox-Flow-System mit einer Anode aus Viologenen vor, das eine Energiedichte von mehr als 40 Wattstunden pro Liter Elektrolyt bei Kosten von unter 100 USD je kWh erreichen und nach 1000 Ladezyklen noch 100 % seiner Kapazität behalten soll. ⓘ
Technik
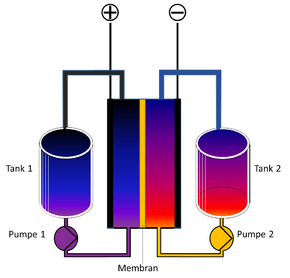
Eigenschaften
Die Redox-Flow-Zelle kann je nach Baugröße und Typ Leistungen von einigen 100 Watt bis zu mehreren Megawatt bereitstellen und hat einen Wirkungsgrad im Bereich von 75 bis 80 Prozent. Zudem hat das System eine geringe Selbstentladung und eine hohe Standzeit. Letztere basiert darauf, dass das Elektrodenmaterial bei der Reaktion des Elektrolyten selbst chemisch nicht reagiert und damit nicht degeneriert. Demgegenüber ist die Energiedichte vergleichsweise gering; üblicherweise sind beim Vanadium-Redox-Akkumulator auf Sulfatbasis ca. 25 Wh pro Liter Elektrolytflüssigkeit, auf Bromidbasis ca. 50 Wh pro Liter Elektrolytflüssigkeit zu erzielen. Unter idealen Laborbedingungen können auch geringfügig höhere Werte erreicht werden. ⓘ
Dieselkraftstoff weist mit ca. 10 kWh pro Liter eine ca. 400-fache Energiedichte gegenüber dem Elektrolyt von Vanadium-Redox-Akkumulatoren auf, handelsübliche Bleiakkumulatoren erzielen eine Energiedichte von rund 42 Wh/kg, bezogen auf die gesamte Masse des Akkumulators. Bezogen nur auf den Elektrolyt des Bleiakkumulators, der ca. 50 % des Akkus ausmacht, ergibt sich ein Wert um 80 Wh pro Liter Elektrolytflüssigkeit bei einem Bleiakkumulator. Im Vergleich zu einem Pumpspeicherwerk mit einer auf eine Höhendifferenz von 100 m normierten Energiedichte von 0,272 Wh/(l 100m) ist die Energiedichte jedoch deutlich höher. ⓘ
In der folgenden Tabelle wurden einige Redox-Flow-Batterietypen mit der Zellspannung und der Energiedichte pro Liter Elektrolytflüssigkeit zusammengestellt:
| Type | Zellspannung (V) | Energiedichte pro Liter Elektrolytflüssigkeit (Wh/l) ⓘ |
|---|---|---|
| Vanadium-Redox-Akkumulator | 1,25 | 15 – 25 |
| Polysulfid-Bromid-Akkumulator | 1,54 | 25 – 50 |
| Zink-Brom-Akkumulator | 1,85 | 50 – 80 |