Propen
|
| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
Propen | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
Beilstein-Referenz
|
1696878 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
852 | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1077 In Flüssiggas: 1075 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C3H6 | ||
| Molekulare Masse | 42,081 g-mol-1 | ||
| Erscheinungsbild | Farbloses Gas | ||
| Dichte | 1,81 kg/m3, Gas (1,013 bar, 15 °C) 1,745 kg/m3, Gas (1,013 bar, 25 °C) 613,9 kg/m3, flüssig | ||
| Schmelzpunkt | |||
| Siedepunkt | |||
Löslichkeit in Wasser
|
0,61 g/m3 | ||
Magnetische Suszeptibilität (χ)
|
-31,5-10-6 cm3/mol | ||
| Viskosität | 8,34 µPa-s bei 16,7 °C | ||
| Struktur | |||
Dipolmoment
|
0,366 D (Gas) | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H220 | ||
Sicherheitshinweise
|
P210, P377, P381, P403 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | |||
| Sicherheitsdatenblatt (SDS) | Externes SDB | ||
| Verwandte Verbindungen | |||
Verwandte Alkene;
verwandte Gruppen |
Ethylen, Isomere des Butylens; Allyl, Propenyl | ||
Verwandte Verbindungen
|
Propan, Propyne Propadien, 1-Propanol 2-Propanol | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Propylen, auch bekannt als Propen, ist eine ungesättigte organische Verbindung mit der chemischen Formel . Es hat eine Doppelbindung und ist das zweiteinfachste Mitglied der Alkenklasse der Kohlenwasserstoffe. Es ist ein farbloses Gas mit einem schwachen erdölartigen Geruch. ⓘ
Propen [proˈpeːn] (Propylen [propyˈleːn]) ist ein farbloses brennbares Gas. Es wird durch thermische Spaltung (Steamcracken) der bei der Erdölverarbeitung anfallenden Leichtbenzine erhalten. ⓘ
Herstellung
Dampfkracken
Die vorherrschende Technologie zur Herstellung von Propylen ist das Steamcracken. Die gleiche Technologie wird auch bei der Umwandlung von Ethan in Ethylen angewandt. Diese beiden Umwandlungsverfahren sind die Nummer 2 und Nummer 1 in der chemischen Industrie, gemessen an ihrem Umfang. Bei diesem Verfahren wird Propan dehydriert. Das Nebenprodukt ist Wasserstoff:
- CH3CH2CH3 → CH3CH=CH2 + H2 ⓘ
Die Ausbeute an Propen beträgt etwa 85 Mio. %. Die Nebenprodukte werden in der Regel als Brennstoff für die Propandehydrierungsreaktion verwendet. Das Dampfkracken ist eines der energieintensivsten industriellen Verfahren. ⓘ
Das Ausgangsmaterial ist Naphtha oder Propan, insbesondere im Nahen Osten, wo Propan aus der Öl- und Gasförderung im Überfluss vorhanden ist. Propen kann durch fraktionierte Destillation aus Kohlenwasserstoffgemischen abgetrennt werden, die durch Cracken und andere Raffinerieverfahren gewonnen werden; der Anteil von Propen in Raffineriequalität beträgt etwa 50 bis 70 %. In den Vereinigten Staaten ist Schiefergas eine wichtige Quelle für Propan. ⓘ
Alternativ kann Propen durch thermisch-katalytische Behandlung von Propan unter Wasserstoffabspaltung dargestellt werden:
Dieses Verfahren wird unter anderem von BASF Sonatrach in Tarragona angewandt. ⓘ
Der wichtigste Prozess der Propan-Dehydrierung ist der Oleflex-Prozess von UOP, auf dem 55 % der weltweiten Kapazität basiert. Bei ihm wird ein propanhaltiges Gas auf 600–700 °C vorgeheizt und in einem Fließbett-Dehydrierreaktor an einem Platin-Katalysator mit Aluminiumoxid als Träger dehydriert. ⓘ
Technologie der Olefinumwandlung
Bei der Phillips-Triolefin- oder Olefinumwandlungstechnologie wird Propylen mit Ethylen und 2-Butenen umgewandelt. Es werden Rhenium- und Molybdän-Katalysatoren verwendet:
- CH2=CH2 + CH3CH=CHCH3 → 2 CH2=CHCH3 ⓘ
Die Technologie basiert auf einer Olefin-Metathese-Reaktion, die bei der Phillips Petroleum Company entdeckt wurde. Es werden Propenausbeuten von etwa 90 Gew.-% erzielt. ⓘ
Verwandt ist das Methanol-zu-Olefinen/Methanol-zu-Propen-Verfahren. Dabei wird Synthesegas (Syngas) in Methanol umgewandelt, und das Methanol wird anschließend in Ethylen und/oder Propen umgewandelt. Bei dem Verfahren fällt Wasser als Nebenprodukt an. Synthesegas wird durch die Reformierung von Erdgas oder durch die dampfinduzierte Reformierung von Erdölprodukten wie Naphtha oder durch die Vergasung von Kohle erzeugt. ⓘ
Fluidkatalytisches Kracken
Beim katalytischen Wirbelschicht-Cracken (FCC) wird die herkömmliche FCC-Technologie unter erschwerten Bedingungen (höheres Katalysator-Öl-Verhältnis, höhere Dampfeinspritzraten, höhere Temperaturen usw.) eingesetzt, um die Menge an Propen und anderen leichten Produkten zu maximieren. Eine Hochtemperatur-FCC-Anlage wird in der Regel mit Gasölen (Paraffinen) und Rückständen beschickt und erzeugt etwa 20-25 m% Propen im Einsatzmaterial sowie größere Mengen an Motorenbenzin und Destillatnebenprodukten. Diese Hochtemperaturverfahren sind teuer und haben einen hohen Kohlenstoff-Fußabdruck. Aus diesen Gründen wird alternativen Wegen zur Propylenherstellung weiterhin Aufmerksamkeit geschenkt. ⓘ
Markt und Forschung
Die Propenproduktion ist von 2000 bis 2008 bei etwa 35 Millionen Tonnen (nur Europa und Nordamerika) stagniert, hat aber in Ostasien, vor allem in Singapur und China, zugenommen. Die weltweite Gesamtproduktion von Propen ist derzeit etwa halb so hoch wie die von Ethylen. ⓘ
Der Einsatz gentechnisch veränderter Enzyme wurde erforscht, hat aber keinen kommerziellen Wert. ⓘ
Verwendungen
Propen ist nach Ethylen das zweitwichtigste Ausgangsprodukt in der petrochemischen Industrie. Es ist das Rohmaterial für eine Vielzahl von Produkten. Die Polypropylenhersteller verbrauchen fast zwei Drittel der Weltproduktion. Zu den Endanwendungen von Polypropylen gehören Folien, Fasern, Behälter, Verpackungen und Verschlüsse. Propen wird auch für die Herstellung wichtiger Chemikalien wie Propylenoxid, Acrylnitril, Cumol, Butyraldehyd und Acrylsäure verwendet. Im Jahr 2013 wurden weltweit etwa 85 Millionen Tonnen Propen verarbeitet. ⓘ
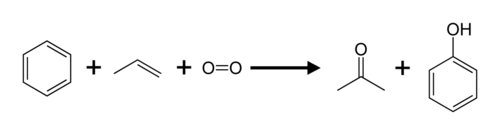
Propen und Benzol werden über das Cumol-Verfahren in Aceton und Phenol umgewandelt. ⓘ
Propen wird auch zur Herstellung von Isopropanol (Propan-2-ol), Acrylnitril, Propylenoxid und Epichlorhydrin verwendet. Die industrielle Herstellung von Acrylsäure erfolgt durch die katalytische Teiloxidation von Propen. Propen ist auch ein Zwischenprodukt bei der einstufigen selektiven Oxidation von Propan zu Acrylsäure. In der Industrie und in Werkstätten wird Propen als alternativer Brennstoff zu Acetylen beim autogenen Schweißen und Schneiden, beim Hartlöten und beim Erhitzen von Metall zum Biegen verwendet. Es ist zu einem Standard in BernzOmatic-Produkten und anderen MAPP-Ersatzstoffen geworden, da echtes MAPP-Gas nicht mehr verfügbar ist. ⓘ
Propen wird als Gas für das Brennschneiden und Ähnliches verwendet und ist ein Kältemittel in industriellen Kälteanlagen (R-1270). Weiterhin ist es einer der wichtigsten Grundstoffe der chemischen Industrie und dient zur Herstellung von Folgeprodukten wie zum Beispiel:
- Aceton
- Acrolein (Propenal)
- Acrylnitril
- Acrylsäure
- Allylverbindungen
- Butanal
- 1-Butanol
- Polypropylen
- Propylenoxid
- 1,2-Propandiol, 1,3-Propandiol
- Thymol ⓘ
Reaktionen
Propen ähnelt anderen Alkenen insofern, als es bei Raumtemperatur relativ leicht Additionsreaktionen eingeht. Die relative Schwäche seiner Doppelbindung erklärt seine Neigung, mit Stoffen zu reagieren, die diese Umwandlung bewirken können. Zu den Reaktionen des Alkens gehören: 1) Polymerisation, 2) Oxidation, 3) Halogenierung und Hydrohalogenierung, 4) Alkylierung, 5) Hydratisierung, 6) Oligomerisierung und 7) Hydroformylierung. ⓘ
Komplexe von Übergangsmetallen
Grundlegend für die Hydroformylierung, die Alkenmetathese und die Polymerisation sind Metall-Propylen-Komplexe, die bei diesen Prozessen als Zwischenprodukte dienen. Propylen ist prochiral, d. h. die Bindung eines Reagens (z. B. eines Metallelektrophils) an die C=C-Gruppe führt zu einem von zwei Enantiomeren. ⓘ
Polymerisation
Der größte Teil des Propens wird durch Kettenwachstumspolymerisation zu Polypropylen, einem sehr wichtigen thermoplastischen Grundstoff, verarbeitet. In Gegenwart eines geeigneten Katalysators (in der Regel ein Ziegler-Natta-Katalysator) polymerisiert Propen. Es gibt mehrere Möglichkeiten, dies zu erreichen, z. B. die Verwendung von hohem Druck, um den Katalysator in einer Lösung von flüssigem Propen zu suspendieren, oder das Durchleiten von gasförmigem Propen durch einen Wirbelschichtreaktor. ⓘ
Verbrennung
Propen verbrennt auf ähnliche Weise wie andere Alkene. In Gegenwart von ausreichend oder überschüssigem Sauerstoff verbrennt Propen unter Bildung von Wasser und Kohlendioxid. ⓘ
- 2 C3H6 + 9 O2 → 6 CO2 + 6 H2O ⓘ
Umweltverträglichkeit
Propen ist ein Verbrennungsprodukt aus Waldbränden, Zigarettenrauch, Kraftfahrzeug- und Flugzeugabgasen. Es ist eine Verunreinigung in einigen Heizgasen. Die beobachteten Konzentrationen liegen im Bereich von 0,1-4,8 Teilen pro Milliarde (ppb) in der Landluft, 4-10,5 ppb in der Stadtluft und 7-260 ppb in industriellen Luftproben. ⓘ
In den Vereinigten Staaten und einigen europäischen Ländern wurde ein Grenzwert von 500 Teilen pro Million (ppm) für die berufsbedingte Exposition (8-stündiger zeitlich gewichteter Durchschnitt) festgelegt. Es gilt als flüchtige organische Verbindung (VOC) und seine Emissionen werden von vielen Regierungen reguliert, sind aber von der US-Umweltschutzbehörde (EPA) nicht als gefährliche Luftschadstoffe im Rahmen des Clean Air Act aufgeführt. Da es eine relativ kurze Halbwertszeit hat, wird nicht erwartet, dass es sich bioakkumuliert. ⓘ
Propen hat eine geringe akute Toxizität beim Einatmen und gilt nicht als krebserregend. Studien zur chronischen Toxizität an Mäusen ergaben keine signifikanten Hinweise auf schädliche Wirkungen. Bei Menschen, die kurzzeitig 4.000 ppm ausgesetzt waren, traten keine spürbaren Auswirkungen auf. Propen ist aufgrund seines Potenzials, Sauerstoff als erstickendes Gas zu verdrängen, und aufgrund seiner hohen Entflammbarkeit/Explosionsgefahr gefährlich. ⓘ
Bio-Propylen ist das biobasierte Propylen. Es wurde aus verschiedenen Gründen, wie z. B. dem Kohlenstoff-Fußabdruck, untersucht. Die Herstellung aus Glukose wurde in Betracht gezogen. Fortschrittlichere Wege zur Lösung dieser Probleme konzentrieren sich auf Elektrifizierungsalternativen zum Steamcracken. ⓘ
Lagerung und Handhabung
Propen ist brennbar. Propen wird in der Regel als Flüssigkeit unter Druck gelagert, obwohl es auch als Gas bei Umgebungstemperatur in zugelassenen Behältern sicher gelagert werden kann. ⓘ
Vorkommen in der Natur
Propen wird im interstellaren Medium durch Mikrowellenspektroskopie nachgewiesen. Am 30. September 2013 gab die NASA außerdem bekannt, dass die Raumsonde Cassini Orbiter, die Teil der Cassini-Huygens-Mission ist, mittels Spektroskopie geringe Mengen von natürlich vorkommendem Propen in der Atmosphäre des Titan entdeckt hat. ⓘ
Gewinnung und Darstellung
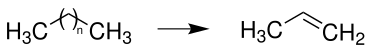
Steamcracking
Propen wird vorwiegend durch Steamcracken von längerkettigen Alkanen (C5-C10) synthetisiert:
Eigenschaften
Chemische Eigenschaften
In Wasser ist Propen nur schwach löslich; das Gas ist brennbar. Aufgrund seiner Doppelbindung ist Propen ein ungesättigter Kohlenwasserstoff und neigt deshalb zu Additionsreaktionen, unter anderem mit Wasserstoff und Halogenen. ⓘ
Beispiele: Propen reagiert mit Brom zu 1,2-Dibrompropan:
Propen reagiert mit Wasserstoff zu Propan:
Damit die Additionsreaktion ablaufen kann, werden z. B. Platin- oder Palladiumkatalysatoren verwendet. ⓘ
Bei der (säurekatalysierten) Addition von Wasser entsteht 2-Propanol:
Hexafluorpropen ist die vollständig fluorierte Form des Propens. ⓘ
Durch Polymerisation von Propen entsteht der weitverbreitete thermoplastische Kunststoff Polypropylen. ⓘ
Sicherheitstechnische Kenngrößen
Propen bildet mit Luft leicht entzündliche Gemische. Der Explosionsbereich liegt zwischen 1,8 Vol.‑% (32 g/m3) als untere Explosionsgrenze (UEG) und 11,2 Vol.‑% (200 g/m3) als obere Explosionsgrenze (OEG).) Der maximale Explosionsdruck beträgt 9,4 bar. Die Grenzspaltweite wurde mit 0,91 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Die Zündtemperatur beträgt 485 °C. Der Stoff fällt somit in die Temperaturklasse T1. ⓘ
Sicherheitshinweise
Propen ist wenig giftig, wirkt aber bei hoher Konzentration narkotisierend und erstickend. Da Propen eine größere Dichte als Luft hat und brennbar ist, bilden sich mit Luft leicht explosionsfähige Gemische, indem sich das Propen in Bodennähe ansammelt. ⓘ
Unfälle mit Propen
Beim Tanklastzugunglück von Los Alfaques platzte am 11. Juli 1978 der mit 23 Tonnen Propen beladene Tank eines Tankwagens südlich von Sant Carles de la Ràpita (Provinz Tarragona, Spanien). Das Propen ergoss sich über den benachbarten Campingplatz Los Alfaques und entzündete sich dort. Bei diesem Unfall wurden 217 Menschen getötet und über 300 zum Teil schwer verletzt. ⓘ
In Düsseldorf ist am 2. Juli 2013 ein Gütertankwagen mit Propen-Gas entgleist. Eine Explosion konnte verhindert werden. Tote und Verletzte gab es nicht. ⓘ
Beim Eisenbahnunfall von Hitrino in Bulgarien entgleiste und explodierte am 10. Dezember 2016 ein mit verflüssigtem Propen beladener Güterzug, wobei mehrere Menschen starben und Dutzende Gebäude zerstört wurden. ⓘ