Mesomerie
Als Mesomerie (auch Resonanz oder Resonanzstruktur) wird in der Chemie das Phänomen bezeichnet, dass die Bindungsverhältnisse in manchen Molekülen oder mehratomigen Ionen nicht durch eine einzige Strukturformel, sondern nur durch mehrere Grenzformeln dargestellt werden können. Keine dieser Grenzformeln beschreibt die Bindungsverhältnisse und damit die Verteilung der Elektronen in ausreichender Weise. Die tatsächliche Elektronenverteilung im Molekül bzw. Ion liegt zwischen den von den Grenzformeln angegebenen Elektronenverteilungen. Dies wird durch den Mesomeriepfeil (Resonanzpfeil) mit dem Symbol ↔ dargestellt. Der Mesomeriepfeil darf nicht mit dem Doppelpfeil Gleichgewichtspfeil ⇌ verwechselt werden, der ein chemisches Gleichgewicht kennzeichnet. Der Begriff der Mesomerie wurde 1933 von Christopher Kelk Ingold eingeführt. ⓘ
Der wirkliche Zustand eines Moleküls, also der Zwischenzustand zwischen den Grenzstrukturen, wird als mesomerer Zustand bezeichnet. ⓘ
Die Energiedifferenz zwischen den Grenzstrukturen und dem tatsächlichen mesomeren Zustand, die in vielen Fällen abgeschätzt werden kann, wird als Mesomerieenergie oder Resonanzenergie bezeichnet. Je mehr mesomere Grenzstrukturen ein Molekül oder Ion besitzt, desto stabiler ist es. Im Rahmen der Valenzstrukturtheorie (VB-Theorie) lassen sich die Eigenenergien der einzelnen Grenzstrukturen sowie deren Gewicht (d. h. deren Anteil an der Gesamtwellenfunktion) berechnen. ⓘ

In der Chemie ist Resonanz, auch Mesomerie genannt, eine Methode zur Beschreibung von Bindungen in bestimmten Molekülen oder polyatomaren Ionen durch die Kombination mehrerer beitragender Strukturen (oder Formen, auch bekannt als Resonanzstrukturen oder kanonische Strukturen) zu einer Resonanzhybridstruktur (oder Hybridstruktur) in der Valenzbindungstheorie. Sie ist besonders wertvoll für die Analyse von delokalisierten Elektronen, bei denen die Bindung nicht durch eine einzige Lewis-Struktur ausgedrückt werden kann. ⓘ
Überblick
Im Rahmen der Valenzbindungstheorie ist die Resonanz eine Erweiterung der Vorstellung, dass die Bindung in einer chemischen Verbindung durch eine Lewis-Struktur beschrieben werden kann. Für viele chemische Spezies ist eine einzige Lewis-Struktur, die aus Atomen besteht, die der Oktettregel gehorchen, möglicherweise formale Ladungen tragen und durch Bindungen positiver ganzzahliger Ordnung verbunden sind, ausreichend, um die chemische Bindung zu beschreiben und experimentell ermittelte Moleküleigenschaften wie Bindungslängen, -winkel und Dipolmomente zu erklären. In manchen Fällen kann jedoch mehr als eine Lewis-Struktur gezeichnet werden, und die experimentellen Eigenschaften sind mit keiner der Strukturen vereinbar. In solchen Fällen werden mehrere Strukturen zusammen als Mittelwert betrachtet, und das Molekül wird durch ein Resonanzhybrid dargestellt, bei dem mehrere Lewis-Strukturen gemeinsam zur Beschreibung der wahren Struktur verwendet werden.
Bei NO2-, dem Nitritanion, sind beispielsweise die beiden N-O-Bindungslängen gleich lang, obwohl keine einzige Lewis-Struktur zwei N-O-Bindungen mit der gleichen formalen Bindungsordnung aufweist. Die gemessene Struktur stimmt jedoch mit einer Beschreibung als Resonanzhybrid der beiden oben gezeigten Hauptstrukturen überein: Sie hat zwei gleiche N-O-Bindungen mit einer Länge von 125 pm, die zwischen einer typischen N-O-Einfachbindung (145 pm in Hydroxylamin, H2N-OH) und einer N-O-Doppelbindung (115 pm im Nitroniumion, [O=N=O]+) liegt. Nach den beigetragenen Strukturen ist jede N-O-Bindung ein Mittelwert aus einer formalen Einfachbindung und einer formalen Doppelbindung, was zu einer echten Bindungsordnung von 1,5 führt. Durch diese Mittelwertbildung wird die Lewis-Beschreibung der Bindungen in NO2- mit der experimentellen Tatsache in Einklang gebracht, dass das Anion äquivalente N-O-Bindungen aufweist.
Das Resonanzhybrid stellt das eigentliche Molekül als "Durchschnitt" der beitragenden Strukturen dar, wobei die Bindungslängen und Teilladungen Zwischenwerte im Vergleich zu den Werten annehmen, die für die einzelnen Lewis-Strukturen der beitragenden Strukturen erwartet werden, wenn sie als "echte" chemische Einheiten existieren würden. Die beitragenden Strukturen unterscheiden sich nur in der formalen Zuordnung der Elektronen zu den Atomen, nicht aber in der tatsächlichen physikalisch und chemisch bedeutsamen Elektronen- oder Spindichte. Während sich die beitragenden Strukturen in der formalen Bindungsordnung und in der formalen Ladungszuweisung unterscheiden können, müssen alle beitragenden Strukturen die gleiche Anzahl von Valenzelektronen und die gleiche Spin-Multiplizität aufweisen. ⓘ
Da die Delokalisierung von Elektronen die potenzielle Energie eines Systems senkt, ist jede Spezies, die durch ein Resonanzhybrid repräsentiert wird, stabiler als jede der (hypothetischen) beitragenden Strukturen. Die Differenz der potenziellen Energie zwischen der tatsächlichen Spezies und der (berechneten) Energie der beitragenden Struktur mit der niedrigsten potenziellen Energie wird als Resonanzenergie oder Delokalisierungsenergie bezeichnet. Die Größe der Resonanzenergie hängt von den Annahmen über die hypothetische "nicht stabilisierte" Spezies und die verwendeten Berechnungsmethoden ab und stellt keine messbare physikalische Größe dar, obwohl Vergleiche von Resonanzenergien, die unter ähnlichen Annahmen und Bedingungen berechnet wurden, chemisch sinnvoll sein können. ⓘ
Moleküle mit einem ausgedehnten π-System wie lineare Polyene und polyaromatische Verbindungen werden durch Resonanzhybride sowie durch delokalisierte Orbitale in der Molekülorbitaltheorie gut beschrieben. ⓘ
Resonanz vs. Isomerie
Die Resonanz ist von der Isomerie zu unterscheiden. Isomere sind Moleküle mit der gleichen chemischen Formel, die jedoch unterschiedliche chemische Spezies mit unterschiedlichen Anordnungen der Atomkerne im Raum sind. Die Resonanzträger eines Moleküls hingegen können sich nur in der Art und Weise unterscheiden, wie die Elektronen den Atomen in den Lewis-Strukturdarstellungen des Moleküls formal zugeordnet sind. Wenn von einer Molekülstruktur gesagt wird, dass sie durch eine Resonanzhybride dargestellt wird, bedeutet dies nicht, dass die Elektronen des Moleküls "mitschwingen" oder sich zwischen mehreren Positionssätzen, die jeweils durch eine Lewis-Struktur dargestellt werden, hin und her bewegen. Vielmehr bedeutet es, dass der Satz der beitragenden Strukturen eine Zwischenstruktur (ein gewichteter Durchschnitt der beitragenden Strukturen) mit einer einzigen, genau definierten Geometrie und Verteilung der Elektronen darstellt. Es ist falsch, Resonanzhybride als sich schnell umwandelnde Isomere zu betrachten, auch wenn der Begriff "Resonanz" ein solches Bild hervorrufen könnte. (Wie weiter unten beschrieben, ist der Begriff "Resonanz" ursprünglich eine Analogie der klassischen Physik für ein quantenmechanisches Phänomen und sollte daher nicht zu wörtlich genommen werden). Symbolisch wird der doppelköpfige Pfeil verwendet, um anzuzeigen, dass A und B Formen einer einzigen chemischen Spezies sind (im Gegensatz zu einem Gleichgewichtspfeil, z. B., ; siehe unten für Einzelheiten zur Verwendung). ⓘ
Eine nicht-chemische Analogie ist anschaulich: Man kann die Eigenschaften eines realen Tieres, des Narwals, anhand der Eigenschaften zweier Fabelwesen beschreiben: des Einhorns, eines Wesens mit einem einzigen Horn auf dem Kopf, und des Leviathans, eines großen, walartigen Wesens. Der Narwal ist kein Wesen, das zwischen dem Einhorn und dem Leviathan hin und her wechselt, noch haben das Einhorn und der Leviathan eine physische Existenz außerhalb der kollektiven menschlichen Vorstellung. Dennoch bietet die Beschreibung des Narwals mit den Begriffen dieser imaginären Kreaturen eine recht gute Beschreibung seiner physischen Eigenschaften. ⓘ
Aufgrund der Verwirrung mit der physikalischen Bedeutung des Wortes Resonanz, da keine Entitäten tatsächlich physikalisch "resonieren", wurde vorgeschlagen, den Begriff Resonanz zugunsten von Delokalisierung und Resonanzenergie zugunsten von Delokalisierungsenergie aufzugeben. Eine Resonanzstruktur wird zu einer beitragenden Struktur und die Resonanzhybride wird zur Hybridstruktur. Die doppelköpfigen Pfeile würden durch Kommas ersetzt, um eine Reihe von Strukturen zu veranschaulichen, da Pfeile jeglicher Art für Anfänger den Eindruck erwecken können, dass eine chemische Veränderung im Gange ist. ⓘ
Darstellung in Diagrammen
In Diagrammen werden die beitragenden Strukturen in der Regel durch Doppelpfeile (↔) getrennt. Der Pfeil ist nicht zu verwechseln mit dem nach rechts und links zeigenden Gleichgewichtspfeil (⇌). Alle Strukturen zusammen können in große eckige Klammern gesetzt werden, um zu verdeutlichen, dass sie ein einziges Molekül oder Ion darstellen und nicht verschiedene Arten in einem chemischen Gleichgewicht. ⓘ
Alternativ zur Verwendung von beitragenden Strukturen in Diagrammen kann eine Hybridstruktur verwendet werden. In einer Hybridstruktur werden die pi-Bindungen, die an der Resonanz beteiligt sind, in der Regel als Kurven
oder gestrichelte Linien dargestellt, was darauf hinweist, dass es sich um partielle und nicht um normale vollständige pi-Bindungen handelt. Bei Benzol und anderen aromatischen Ringen werden die delokalisierten pi-Elektronen manchmal als ausgefüllter Kreis dargestellt. ⓘ
Geschichte
Das Konzept tauchte erstmals 1899 in Johannes Thieles "Partial-Valence-Hypothese" auf, um die ungewöhnliche Stabilität von Benzol zu erklären, die man bei der von August Kekulé 1865 vorgeschlagenen Struktur mit abwechselnden Einfach- und Doppelbindungen nicht erwarten würde. Benzol unterliegt eher Substitutions- als Additionsreaktionen, wie sie für Alkene typisch sind. Er schlug vor, dass die Kohlenstoff-Kohlenstoff-Bindung in Benzol eine Zwischenstufe zwischen einer Einfach- und einer Doppelbindung ist. ⓘ
Der Resonanzvorschlag trug auch dazu bei, die Anzahl der Isomere von Benzolderivaten zu erklären. Kekulés Struktur würde zum Beispiel vier Dibrombenzol-Isomere vorhersagen, darunter zwei ortho-Isomere, bei denen die bromierten Kohlenstoffatome entweder durch eine Einfach- oder eine Doppelbindung verbunden sind. In Wirklichkeit gibt es nur drei Dibrombenzol-Isomere und nur eines davon ist ortho, was mit der Vorstellung übereinstimmt, dass es nur eine Art von Kohlenstoff-Kohlenstoff-Bindung gibt, die zwischen einer Einfach- und einer Doppelbindung liegt. ⓘ
Der Mechanismus der Resonanz wurde 1926 von Werner Heisenberg in einer Diskussion über die Quantenzustände des Heliumatoms in die Quantenmechanik eingeführt. Er verglich die Struktur des Heliumatoms mit dem klassischen System resonant gekoppelter harmonischer Oszillatoren. Im klassischen System erzeugt die Kopplung zwei Moden, von denen eine eine niedrigere Frequenz hat als eine der beiden ungekoppelten Schwingungen; quantenmechanisch wird diese niedrigere Frequenz als eine niedrigere Energie interpretiert. Linus Pauling verwendete diesen Mechanismus 1928 zur Erklärung der partiellen Valenz von Molekülen und entwickelte ihn in einer Reihe von Arbeiten in den Jahren 1931-1933 weiter. Der in deutschen und französischen Veröffentlichungen verbreitete alternative Begriff Mesomerie mit derselben Bedeutung wurde 1938 von C. K. Ingold eingeführt, setzte sich aber in der englischen Literatur nicht durch. Der heutige Begriff des mesomeren Effekts hat eine verwandte, aber andere Bedeutung angenommen. Der doppelköpfige Pfeil wurde von dem deutschen Chemiker Fritz Arndt eingeführt, der den deutschen Ausdruck Zwischenstufe bevorzugte. ⓘ
In der Sowjetunion wurde die Resonanztheorie - insbesondere in der von Pauling entwickelten Form - Anfang der 1950er Jahre als den marxistischen Grundsätzen des dialektischen Materialismus zuwiderlaufend angegriffen, und im Juni 1951 berief die Sowjetische Akademie der Wissenschaften unter der Leitung von Alexander Nesmejanow eine Konferenz über die chemische Struktur organischer Verbindungen ein, an der 400 Physiker, Chemiker und Philosophen teilnahmen und auf der "das pseudowissenschaftliche Wesen der Resonanztheorie entlarvt und demaskiert" wurde. ⓘ
Wichtige und weniger wichtige Beiträge
Eine beitragende Struktur kann dem eigentlichen Molekül mehr ähneln als eine andere (im Sinne von Energie und Stabilität). Strukturen mit einem niedrigen Wert der potenziellen Energie sind stabiler als solche mit hohen Werten und ähneln der eigentlichen Struktur mehr. Die stabilsten beitragenden Strukturen werden als Hauptbeitragende bezeichnet. Energetisch ungünstige und daher weniger günstige Strukturen sind Minor Contributors. Bei den Regeln, die in der groben Reihenfolge ihrer abnehmenden Bedeutung aufgeführt sind, handelt es sich bei den Hauptbeitragsleistenden im Allgemeinen um Strukturen, die ⓘ
- so weit wie möglich die Oktettregel einhalten (8 Valenzelektronen um jedes Atom statt Mangel oder Überschuss bzw. 2 Elektronen für Elemente der Periode 1);
- eine maximale Anzahl von kovalenten Bindungen aufweisen;
- ein Minimum an formal geladenen Atomen aufweisen, wobei der Abstand für ungleiche und gleichartige Ladungen minimiert bzw. maximiert wird;
- eine negative Ladung, falls vorhanden, an den elektronegativsten Atomen und eine positive Ladung, falls vorhanden, an den elektropositivsten Atomen anbringen;
- nicht wesentlich von idealisierten Bindungslängen und -winkeln abweichen (z. B. die relative Unwichtigkeit von Dewar-Resonanzträgern für Benzol);
- aromatische Substrukturen lokal beibehalten, während anti-aromatische vermieden werden (siehe Clar-Sextett und Biphenylen). ⓘ
Für die Elemente der Periode 2, Be, B, C, N, O und F, ist eine maximale Anzahl von acht Valenzelektronen strikt vorgeschrieben, ebenso wie eine maximale Anzahl von zwei für H und He und effektiv auch für Li. Die Frage der Erweiterung der Valenzschale der Elemente der dritten Periode und der schwereren Hauptgruppe ist umstritten. Eine Lewis-Struktur, in der ein Zentralatom eine Valenzelektronenzahl von mehr als acht hat, impliziert traditionell die Beteiligung von d-Orbitalen an der Bindung. Es herrscht jedoch Einigkeit darüber, dass die Beteiligung von d-Orbitalen, auch wenn sie nur einen marginalen Beitrag leisten, unbedeutend ist, und dass die Bindungen der so genannten hypervalenten Moleküle größtenteils besser durch ladungstrennende Formen erklärt werden können, die eine Bindung mit drei Zentren und vier Elektronen darstellen. Dennoch werden erweiterte Oktettstrukturen traditionell immer noch häufig für funktionelle Gruppen wie Sulfoxide, Sulfone und Phosphor-Ylide gezeichnet. Solche Darstellungen werden von der IUPAC als Formalismus betrachtet, der nicht unbedingt die tatsächliche elektronische Struktur widerspiegelt, und werden gegenüber Strukturen mit Teilbindungen, Ladungstrennung oder dativen Bindungen bevorzugt. ⓘ
Äquivalente Beiträge tragen in gleichem Maße zur tatsächlichen Struktur bei, während die Bedeutung der nicht-äquivalenten Beiträge durch das Ausmaß bestimmt wird, in dem sie mit den oben genannten Eigenschaften übereinstimmen. Eine größere Anzahl signifikanter beitragender Strukturen und ein größerer verfügbarer Raum für delokalisierte Elektronen führen zu einer Stabilisierung (Senkung der Energie) des Moleküls. ⓘ
Beispiele
Aromatische Moleküle
Bei Benzol werden die beiden Cyclohexatrien-Kekulé-Strukturen, die zuerst von Kekulé vorgeschlagen wurden, als beitragende Strukturen zur Darstellung der Gesamtstruktur herangezogen. In der Hybridstruktur auf der rechten Seite ersetzt das gestrichelte Sechseck drei Doppelbindungen und repräsentiert sechs Elektronen in einem Satz von drei Molekülorbitalen der π-Symmetrie mit einer Knotenebene in der Ebene des Moleküls. ⓘ
In Furan wechselwirkt ein einsames Paar des Sauerstoffatoms mit den π-Orbitalen der Kohlenstoffatome. Die gekrümmten Pfeile stellen die Permutation der delokalisierten π-Elektronen dar, die zu verschiedenen Beitragszahlern führt. ⓘ
Elektronenreiche Moleküle
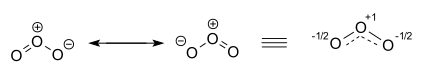
Das Ozonmolekül wird durch zwei beitragende Strukturen dargestellt. In Wirklichkeit sind die beiden terminalen Sauerstoffatome äquivalent, und die Hybridstruktur ist rechts mit einer Ladung von -1⁄2 an beiden Sauerstoffatomen und partiellen Doppelbindungen mit einer vollen und gestrichelten Linie und der Bindungsordnung 1+1⁄2 gezeichnet. ⓘ
Für hypervalente Moleküle kann die oben beschriebene Rationalisierung angewendet werden, um beitragende Strukturen zur Erklärung der Bindungen in solchen Molekülen zu erzeugen. Im Folgenden sind die beitragenden Strukturen einer 3c-4e-Bindung in Xenondifluorid dargestellt. ⓘ
Moleküle mit Elektronenmangel
Das Allylkation hat zwei beitragende Strukturen mit einer positiven Ladung an den terminalen Kohlenstoffatomen. In der Hybridstruktur ist ihre Ladung +1⁄2. Die volle positive Ladung kann auch als delokalisiert auf drei Kohlenstoffatome dargestellt werden. ⓘ
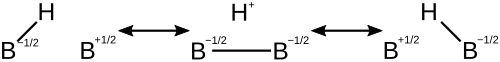
Das Diboran-Molekül wird durch beitragende Strukturen beschrieben, die jeweils einen Elektronenmangel an verschiedenen Atomen aufweisen. Dadurch wird der Elektronenmangel an den einzelnen Atomen verringert und das Molekül stabilisiert. Nachstehend sind die beitragenden Strukturen einer einzelnen 3c-2e-Bindung in Diboran dargestellt. ⓘ
Reaktive Zwischenprodukte
Reaktive Zwischenprodukte wie Carbokationen und freie Radikale weisen häufig eine stärker delokalisierte Struktur auf als ihre Ausgangsreaktanten und führen zu unerwarteten Produkten. Das klassische Beispiel ist die allylische Umlagerung. Wenn 1 Mol HCl zu 1 Mol 1,3-Butadien hinzukommt, entsteht neben dem normalerweise erwarteten Produkt 3-Chlor-1-buten auch 1-Chlor-2-buten. Isotopenmarkierungsexperimente haben gezeigt, dass sich hier die zusätzliche Doppelbindung in einem Teil des Produkts von der 1,2-Position in die 2,3-Position verschiebt. Dies und andere Beweise (z. B. NMR in supersauren Lösungen) zeigen, dass das intermediäre Carbokation eine stark delokalisierte Struktur haben muss, die sich von seinem meist klassischen (Delokalisierung ist vorhanden, aber gering) Muttermolekül unterscheidet. Dieses Kation (ein allylisches Kation) kann, wie oben gezeigt, durch Resonanz dargestellt werden. ⓘ
Diese Beobachtung einer stärkeren Delokalisierung bei weniger stabilen Molekülen ist recht allgemein. Die angeregten Zustände der konjugierten Diene werden durch die Konjugation stärker stabilisiert als ihre Grundzustände, was sie zu organischen Farbstoffen macht. ⓘ
Ein gut untersuchtes Beispiel für eine Delokalisierung, an der keine π-Elektronen beteiligt sind (Hyperkonjugation), lässt sich bei dem nicht klassischen 2-Norbornyl-Kation beobachten. Ein weiteres Beispiel ist Methan (CH+
5). Diese können als Bindungen mit drei Zentren und zwei Elektronen betrachtet werden und werden entweder durch Strukturen dargestellt, die eine Umordnung der σ-Elektronen beinhalten, oder durch eine spezielle Schreibweise, ein Y, das die drei Kerne an seinen drei Punkten hat. ⓘ
Delokalisierte Elektronen sind aus mehreren Gründen wichtig; ein wichtiger Grund ist, dass eine erwartete chemische Reaktion möglicherweise nicht stattfindet, weil die Elektronen in eine stabilere Konfiguration delokalisiert werden, was zu einer Reaktion führt, die an einem anderen Ort stattfindet. Ein Beispiel ist die Friedel-Crafts-Alkylierung von Benzol mit 1-Chlor-2-methylpropan; das Carbokation lagert sich zu einer tert-Butylgruppe um, die durch Hyperkonjugation, eine besondere Form der Delokalisierung, stabilisiert wird. Die Delokalisierung führt zu einer Verlängerung der Wellenlänge des Elektrons und damit zu einer Verringerung der Energie. ⓘ
Benzol
Bindungslängen

Vergleicht man die beiden Teilstrukturen von Benzol, so sind alle Einfach- und Doppelbindungen vertauscht. Die Bindungslängen können gemessen werden, z. B. durch Röntgenbeugung. Die durchschnittliche Länge einer C-C-Einfachbindung liegt bei 154 pm, die einer C=C-Doppelbindung bei 133 pm. In lokalisiertem Cyclohexatrien sollten die Kohlenstoff-Kohlenstoff-Bindungen abwechselnd 154 und 133 pm lang sein. Stattdessen sind alle Kohlenstoff-Kohlenstoff-Bindungen in Benzol etwa 139 pm lang, eine Bindungslänge, die zwischen Einfach- und Doppelbindung liegt. Dieser gemischte Charakter von Einfach- und Doppelbindungen (oder Dreifachbindungen) ist typisch für alle Moleküle, bei denen die Bindungen in verschiedenen Strukturen eine unterschiedliche Bindungsordnung aufweisen. Die Bindungslängen können anhand der Bindungsordnungen verglichen werden. In Cyclohexan beispielsweise ist die Bindungsordnung 1, während sie in Benzol 1 + (3 ÷ 6) = 1+1⁄2 ist. Folglich weist Benzol mehr Doppelbindungen auf und hat daher eine kürzere Bindungslänge als Cyclohexan. ⓘ
Resonanzenergie
Die Resonanz- (oder Delokalisations-) Energie ist die Energiemenge, die erforderlich ist, um die tatsächliche delokalisierte Struktur in die stabilste beitragende Struktur umzuwandeln. Die empirische Resonanzenergie kann geschätzt werden, indem die Enthalpieänderung der Hydrierung der realen Substanz mit der für die beitragende Struktur geschätzten verglichen wird. ⓘ
Die vollständige Hydrierung von Benzol zu Cyclohexan über 1,3-Cyclohexadien und Cyclohexen ist exotherm; 1 Mol Benzol liefert 208,4 kJ (49,8 kcal). ⓘ
Die Hydrierung von einem Mol Doppelbindungen liefert 119,7 kJ (28,6 kcal), wie aus dem letzten Schritt, der Hydrierung von Cyclohexen, abgeleitet werden kann. Bei Benzol werden dagegen 23,4 kJ (5,6 kcal) für die Hydrierung eines Mols Doppelbindungen benötigt. Die Differenz von 143,1 kJ (34,2 kcal) ist die empirische Resonanzenergie von Benzol. Da 1,3-Cyclohexadien auch eine kleine Delokalisierungsenergie hat (7,6 kJ oder 1,8 kcal/mol), ist die Netto-Resonanzenergie, bezogen auf das lokalisierte Cyclohexatrien, etwas höher: 151 kJ oder 36 kcal/mol. ⓘ
Diese gemessene Resonanzenergie ist auch die Differenz zwischen der Hydrierungsenergie von drei "Nicht-Resonanz"-Doppelbindungen und der gemessenen Hydrierungsenergie:
- (3 × 119,7) - 208,4 = 150,7 kJ/mol (36 kcal). ⓘ
Quantenmechanische Beschreibung in der Valenzbindungstheorie (VB)

Die Resonanz hat eine tiefere Bedeutung im mathematischen Formalismus der Valenzbindungstheorie (VB). Die Quantenmechanik verlangt, dass die Wellenfunktion eines Moleküls seiner beobachteten Symmetrie gehorcht. Wenn dies bei einer einzelnen Struktur nicht der Fall ist, wird die Resonanz herangezogen. ⓘ
Bei Benzol beispielsweise geht die Theorie der Valenzbindung von den beiden Kekulé-Strukturen aus, die einzeln nicht die sechsfache Symmetrie des realen Moleküls aufweisen. Die Theorie konstruiert die eigentliche Wellenfunktion als lineare Überlagerung der Wellenfunktionen, die die beiden Strukturen darstellen. Da beide Kekulé-Strukturen die gleiche Energie haben, tragen sie gleich viel zur Gesamtstruktur bei - die Überlagerung ist ein gleich gewichteter Durchschnitt oder eine 1:1-Linearkombination der beiden im Fall von Benzol. Die symmetrische Kombination ergibt den Grundzustand, während die antisymmetrische Kombination den ersten angeregten Zustand ergibt, wie dargestellt. ⓘ
Im Allgemeinen wird die Überlagerung mit unbestimmten Koeffizienten geschrieben, die dann durch Variationen optimiert werden, um die niedrigstmögliche Energie für den gegebenen Satz von Basiswellenfunktionen zu finden. Wenn mehr beitragende Strukturen einbezogen werden, wird die molekulare Wellenfunktion genauer und es können mehr angeregte Zustände aus verschiedenen Kombinationen der beitragenden Strukturen abgeleitet werden. ⓘ
Vergleich mit der Molekularorbitaltheorie (MO)

In der Molekülorbitaltheorie, der wichtigsten Alternative zur Valenzbindungstheorie, werden die Molekülorbitale (MO) als Summen aller Atomorbitale (AO) aller Atome approximiert; es gibt so viele MO wie AO. Jedes AOi hat einen Gewichtungskoeffizienten ci, der den Beitrag des AOs zu einem bestimmten MO angibt. Bei Benzol beispielsweise ergibt das MO-Modell 6 π-MOs, die Kombinationen der 2pz-AOs an jedem der 6 C-Atome sind. Jedes π-MO ist also über das gesamte Benzolmolekül delokalisiert, und jedes Elektron, das ein MO besetzt, ist über das gesamte Molekül delokalisiert. Diese MO-Interpretation hat das Bild des Benzolrings als Sechseck mit einem Kreis im Inneren inspiriert. Bei der Beschreibung von Benzol werden das VB-Konzept der lokalisierten σ-Bindungen und das MO-Konzept der delokalisierten π-Orbitale in den Grundkursen der Chemie häufig kombiniert. ⓘ
Die beitragenden Strukturen im VB-Modell sind besonders nützlich bei der Vorhersage der Wirkung von Substituenten auf π-Systeme wie Benzol. Sie führen zu den Modellen der beitragenden Strukturen für eine elektronenziehende Gruppe und eine elektronenfreisetzende Gruppe auf Benzol. Der Nutzen der MO-Theorie besteht darin, dass aus den Quadraten des Gewichtungskoeffizienten ci am Atom Ci eine quantitative Angabe der Ladung des π-Systems an einem Atom gewonnen werden kann. Ladung qi ≈ c2
i. Der Grund für die Quadrierung des Koeffizienten ist, dass, wenn ein Elektron durch eine AO beschrieben wird, das Quadrat der AO die Elektronendichte ergibt. Die AOs werden so angepasst (normalisiert), dass AO2 = 1 ist und qi ≈ (ciAOi)2 ≈ c2
i. In Benzol ist qi = 1 an jedem C-Atom. Bei einer elektronenziehenden Gruppe ist qi < 1 an den ortho- und para-C-Atomen und qi > 1 bei einer elektronenabgebenden Gruppe. ⓘ
Koeffizienten
Die Gewichtung der beitragenden Strukturen in Bezug auf ihren Beitrag zur Gesamtstruktur kann auf verschiedene Weise berechnet werden: mit "Ab initio"-Methoden, die von der Valenzbindungs-Theorie abgeleitet sind, oder mit den Ansätzen der Natürlichen Bindungsorbitale (NBO) von Weinhold NBO5, oder schließlich mit empirischen Berechnungen auf der Grundlage der Hückel-Methode. Eine auf der Hückel-Methode basierende Software für den Resonanzunterricht ist auf der HuLiS-Website verfügbar. ⓘ
Delokalisierung von Ladungen
Bei Ionen spricht man häufig von delokalisierter Ladung (Ladungsdelokalisation). Ein Beispiel für delokalisierte Ladung in Ionen ist die Carboxylatgruppe, bei der die negative Ladung gleichmäßig auf die beiden Sauerstoffatome zentriert ist. Die Ladungsverschiebung in Anionen ist ein wichtiger Faktor, der ihre Reaktivität (im Allgemeinen gilt: je größer die Verschiebung, desto geringer die Reaktivität) und insbesondere die Säurestärke ihrer konjugierten Säuren bestimmt. Im Allgemeinen gilt: Je stärker die Ladung eines Anions delokalisiert ist, desto stärker ist seine konjugierte Säure. Zum Beispiel ist die negative Ladung im Perchlorat-Anion (ClO-
4) zum Beispiel ist die negative Ladung gleichmäßig auf die symmetrisch angeordneten Sauerstoffatome verteilt (und ein Teil davon wird auch von dem zentralen Chloratom gehalten). Diese hervorragende Ladungsverschiebung in Verbindung mit der hohen Anzahl von Sauerstoffatomen (vier) und der hohen Elektronegativität des zentralen Chloratoms führt dazu, dass Perchlorsäure eine der stärksten bekannten Säuren mit einem pKa-Wert von -10 ist.
Das Ausmaß der Ladungsverschiebung in einem Anion kann quantitativ durch den WAPS-Parameter (gewichteter durchschnittlicher positiver Sigma-Parameter) ausgedrückt werden; für Kationen wird ein analoger WANS-Parameter (gewichteter durchschnittlicher negativer Sigma-Parameter) verwendet. ⓘ
| Verbindung | WAPS × 105 | Verbindung | WANS × 105 ⓘ |
|---|---|---|---|
| (C2F5SO2)2NH | 2.0 | Triphenylphosphin | 2.1 |
| (CF3)3COH | 3.6 | Phenyl-Tetramethylguanidin | 2.5 |
| Pikrinsäure | 4.3 | Tripropylamin | 2.6 |
| 2,4-Dinitrophenol | 4.9 | MTBD (7-Methyl-triazabicyclodecen) | 2.9 |
| Benzoesäure | 7.1 | DBU (1,8-Diazabicycloundec-7-en) | 3.0 |
| Phenol | 8.8 | TBD (Triazabicyclodecen) | 3.5 |
| Essigsäure | 16.1 | N,N-Dimethylanilin | 4.7 |
| HI | 21.9 | Pyridin | 7.2 |
| HBr | 29.1 | Anilin | 8.2 |
| HCl | 35.9 | Propylamin | 8.9 |
Die WAPS- und WANS-Werte sind in e/Å4 angegeben. Größere Werte bedeuten, dass die Ladung im entsprechenden Ion stärker lokalisiert ist. ⓘ
Salze von Carbonsäuren und vinylogen Carbonsäuren
Ein ganz ähnlicher Fall eines delokalisierten Elektrons liegt bei den Salzen von Carbonsäuren wie etwa der Ameisen- und der Essigsäure vor, auch hier führt dies zur Mesomeriestabilisierung des Carboxylat-Anions (Ameisensäure: Formiat-Anion; Essigsäure: Acetat-Anion). Durch Einschieben einer oder mehrerer C=C-Doppelbindungen erhält man Salze vinyloger Carbonsäuren. Dabei geht die Mesomerie nicht verloren. Mesomeriestabilisiertes Carboxylat-Anion (oben) und vinyloges Carboxylat-Anion (unten):
Im oberen Fall (Carboxylat-Anion) kann die Mesomerie durch die folgende Notation angedeutet werden:
Beispiele für vinyloge Carbonsäuren sind Ascorbinsäure (Vitamin C) und Vulpinsäure. ⓘ