Aldolreaktion
| Aldol-Reaktion ⓘ | |
|---|---|
| Art der Reaktion | Kupplungsreaktion |
| Bezeichner | |
| Portal für Organische Chemie | Aldol-Addition |
| RSC Ontologie-ID | RXNO:0000016 |
Die Aldol-Reaktion ist ein Verfahren zur Bildung von Kohlenstoff-Kohlenstoff-Bindungen in der organischen Chemie. Sie wurde unabhängig voneinander 1869 von dem russischen Chemiker Alexander Borodin und 1872 von dem französischen Chemiker Charles-Adolphe Wurtz entdeckt. Bei dieser Reaktion werden zwei Carbonylverbindungen (bei den ursprünglichen Experimenten wurden Aldehyde verwendet) zu einer neuen β-Hydroxycarbonylverbindung verbunden. Diese Produkte werden als Aldole bezeichnet, abgeleitet von Aldehyd + Alkohol, ein strukturelles Motiv, das in vielen der Produkte zu finden ist. Aldol-Struktureinheiten finden sich in vielen wichtigen Molekülen, ob natürlich vorkommend oder synthetisch. So wurde die Aldolreaktion beispielsweise bei der großtechnischen Herstellung des chemischen Grundstoffs Pentaerythritol und bei der Synthese des Herzmedikaments Lipitor (Atorvastatin, Kalziumsalz) eingesetzt. ⓘ
Bei der Aldolreaktion werden zwei relativ einfache Moleküle zu einem komplexeren Molekül zusammengefügt. Die erhöhte Komplexität ergibt sich daraus, dass bis zu zwei neue stereogene Zentren (am α- und β-Kohlenstoff des Aldol-Addukts, im Schema unten mit Sternchen markiert) gebildet werden. Moderne Methoden ermöglichen nicht nur Aldolreaktionen in hoher Ausbeute, sondern auch die Kontrolle sowohl der relativen als auch der absoluten Konfiguration dieser Stereozentren. Diese Fähigkeit zur selektiven Synthese eines bestimmten Stereoisomers ist von Bedeutung, da Stereoisomere unterschiedliche chemische und biologische Eigenschaften haben können. ⓘ
So sind stereogene Aldol-Einheiten besonders häufig in Polyketiden, einer Klasse von Molekülen, die in biologischen Organismen vorkommen. In der Natur werden Polyketide durch Enzyme synthetisiert, die iterative Claisen-Kondensationen durchführen. Die 1,3-Dicarbonylprodukte dieser Reaktionen können dann auf verschiedene Weise derivatisiert werden, um eine große Vielfalt interessanter Strukturen zu erzeugen. Häufig beinhaltet eine solche Derivatisierung die Reduktion einer der Carbonylgruppen, wodurch die Aldol-Untereinheit entsteht. Einige dieser Strukturen haben starke biologische Eigenschaften: das Immunsuppressivum FK506, das Antitumormittel Discodermolid oder das Antimykotikum Amphotericin B zum Beispiel. Obwohl die Synthese vieler solcher Verbindungen früher als nahezu unmöglich galt, hat die Aldol-Methode ihre effiziente Synthese in vielen Fällen ermöglicht. ⓘ
Eine typische moderne Aldol-Additionsreaktion, wie oben dargestellt, könnte die nukleophile Addition eines Keton-Enolats an einen Aldehyd beinhalten. Nach der Bildung kann das Aldolprodukt manchmal ein Wassermolekül verlieren und eine α,β-ungesättigte Carbonylverbindung bilden. Dies wird als Aldolkondensation bezeichnet. Bei der Aldolreaktion kann eine Vielzahl von Nukleophilen eingesetzt werden, darunter die Enole, Enolate und Enolether von Ketonen, Aldehyden und vielen anderen Carbonylverbindungen. Der elektrophile Partner ist in der Regel ein Aldehyd oder ein Keton (es gibt viele Variationen, z. B. die Mannich-Reaktion). Wenn das Nukleophil und das Elektrophil unterschiedlich sind, wird die Reaktion als gekreuzte Aldolreaktion bezeichnet; sind das Nukleophil und das Elektrophil gleich, wird die Reaktion als Aldol-Dimerisierung bezeichnet. ⓘ

Der Kolben auf der rechten Seite ist eine Lösung von Lithiumdiisopropylamid (LDA) in Tetrahydrofuran (THF). Der Kolben auf der linken Seite ist eine Lösung des Lithium-Enolats von tert-Butylpropionat (gebildet durch Addition von LDA an tert-Butylpropionat). Anschließend kann ein Aldehyd in den Enolatkolben gegeben werden, um eine Aldol-Additionsreaktion einzuleiten.
Beide Kolben werden in ein Trockeneis/Aceton-Kühlbad (-78 °C) getaucht, dessen Temperatur durch ein Thermoelement (der Draht links) überwacht wird. ⓘ
Der Name Aldehyd-Alkohol-Reaktion leitet sich vom Reaktionsprodukt im Falle einer Reaktion unter Aldehyden, einem β-Hydroxyaldehyd, ab. ⓘ
Mechanismen
Die Aldolreaktion kann nach zwei verschiedenen Mechanismen ablaufen. Carbonylverbindungen, wie z. B. Aldehyde und Ketone, können in Enole oder Enolether umgewandelt werden. Da diese Spezies am α-Kohlenstoff nucleophil sind, können sie besonders reaktive protonierte Carbonylverbindungen wie protonierte Aldehyde angreifen. Dies ist der "Enol-Mechanismus". Carbonylverbindungen, die Carbonsäuren sind, können auch deprotoniert werden, um Enolate zu bilden, die viel nucleophiler sind als Enole oder Enolether und Elektrophile direkt angreifen können. Das übliche Elektrophil ist ein Aldehyd, da Ketone viel weniger reaktiv sind. Dies ist der "Enolat-Mechanismus". ⓘ
Trotz der Attraktivität des Aldol-Verfahrens gibt es mehrere Probleme, die gelöst werden müssen, um das Verfahren katalytisch und effizient zu machen. Das erste Problem ist ein thermodynamisches: Die meisten Aldolreaktionen sind reversibel. Außerdem liegt das Gleichgewicht bei einfachen Aldehyd-Keton-Aldol-Reaktionen nur knapp auf der Seite der Produkte. Bei besonders harten Bedingungen (z. B.: NaOMe/MeOH/Rückfluss) kann es zur Kondensation kommen, die sich aber in der Regel mit milden Reagenzien und niedrigen Temperaturen (z. B. LDA (eine starke Base), THF, -78 °C) vermeiden lässt. Obwohl die Aldol-Addition in der Regel unter irreversiblen Bedingungen nahezu vollständig abläuft, sind die isolierten Aldol-Addukte empfindlich gegenüber einer baseninduzierten Retro-Aldol-Spaltung zur Rückführung der Ausgangsstoffe. Im Gegensatz dazu sind Retro-Aldol-Kondensationen zwar selten, aber möglich. Dies ist die Grundlage der katalytischen Strategie der Aldolasen der Klasse I in der Natur sowie zahlreicher niedermolekularer Aminkatalysatoren. ⓘ
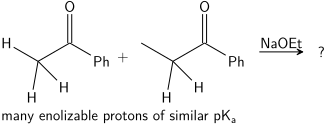
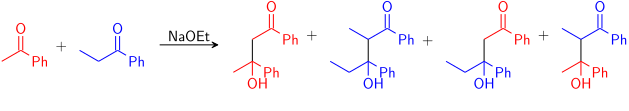
Bei einer gekreuzten bzw. gemischten Aldolreaktion reagieren zwei Carbonylverbindungen mit unterschiedlichen organischen Resten miteinander. Besitzen die Edukte ähnliche Carbonylaktivitäten, so kann ein Gemisch aus vier verschiedenen Aldolen entstehen:
Je nach Art der Reste R1 und R2 liegt – wegen der Bildung von Stereoisomeren – die Anzahl der gebildeten Aldole genau betrachtet noch höher. Die gekreuzte Aldolreaktion verläuft oft unselektiv. ⓘ
Besonders selektiv verläuft die gekreuzte Aldolreaktion, wenn man das Keton (z. B. Aceton) bei tiefer Temperatur mit Lithiumdiisopropylamid (LDA) ins Lithiumenolat überführt und mit einer zweiten Carbonylverbindung (z. B. Acetaldehyd) umsetzt:
Enol-Mechanismus
Wird ein saurer Katalysator verwendet, besteht der erste Schritt des Reaktionsmechanismus in der säurekatalysierten Tautomerisierung der Carbonylverbindung zum Enol. Die Säure dient auch dazu, die Carbonylgruppe eines anderen Moleküls durch Protonierung zu aktivieren, wodurch sie hoch elektrophil wird. Das Enol ist am α-Kohlenstoff nucleophil, so dass es die protonierte Carbonylverbindung angreifen kann, was nach Deprotonierung zum Aldol führt. Dieses wird in der Regel dehydratisiert und ergibt die ungesättigte Carbonylverbindung. Das Schema zeigt eine typische säurekatalysierte Selbstkondensation eines Aldehyds. ⓘ
Säure-katalysierter Aldol-Mechanismus ⓘ
Säure-katalysierte Dehydratisierung ⓘ
Enolat-Mechanismus
Handelt es sich bei dem Katalysator um eine moderate Base wie ein Hydroxidion oder ein Alkoxid, so erfolgt die Aldolreaktion durch einen nucleophilen Angriff des resonanzstabilisierten Enolats auf die Carbonylgruppe eines anderen Moleküls. Das Produkt ist das Alkoxidsalz des Aldolprodukts. Das Aldol selbst wird dann gebildet und kann anschließend dehydratisiert werden, um die ungesättigte Carbonylverbindung zu erhalten. Das Schema zeigt einen einfachen Mechanismus für die basenkatalysierte Aldolreaktion eines Aldehyds mit sich selbst. ⓘ
Basenkatalysierte Aldolreaktion (dargestellt mit -OCH3 als Base) ⓘ
Basenkatalysierte Dehydratisierung (häufig fälschlicherweise als Einzelschritt geschrieben, siehe E1cB-Eliminierungsreaktion) ⓘ
Obwohl in manchen Fällen nur eine katalytische Menge an Base erforderlich ist, wird üblicherweise eine stöchiometrische Menge einer starken Base wie LDA oder NaHMDS verwendet. In diesem Fall ist die Enolatbildung irreversibel, und das Aldolprodukt wird erst gebildet, wenn das Metallalkoxid des Aldolprodukts in einem separaten Aufarbeitungsschritt protoniert wird. ⓘ
Zimmerman-Traxler-Modell
Es sind verfeinerte Formen des Mechanismus bekannt. Im Jahr 1957 schlugen Howard Zimmerman und Marjorie D. Traxler vor, dass einige Aldolreaktionen "sechsgliedrige Übergangszustände mit einer Stuhlkonformation" aufweisen. Dies ist heute als Zimmerman-Traxler-Modell bekannt. E-Enolate führen zu Anti-Produkten, während Z-Enolate zu Syn-Produkten führen. Die Faktoren, die die Selektivität steuern, sind die Vorliebe für die äquatoriale Anordnung von Substituenten in sechsgliedrigen Übergangszuständen bzw. die Vermeidung von Syn-Pentan-Wechselwirkungen. E und Z beziehen sich auf die stereochemische cis-trans-Beziehung zwischen dem Enolat-Sauerstoff, der das positive Gegenion trägt, und der Gruppe mit der höchsten Priorität am Alpha-Kohlenstoff. In der Realität folgen nur einige Metalle wie Lithium zuverlässig dem Zimmerman-Traxler-Modell. Daher kann das stereochemische Ergebnis der Reaktion in einigen Fällen unvorhersehbar sein. ⓘ
Bei der Aldoladdition kann Stereoselektivität in Form von so genannter einfacher Diastereoselektivität auftreten. Das bedeutet, dass die zwei zuvor sp2-hybridisierten Kohlenstoff-Atome (des Enolats und der Carbonyl-Komponente), die im Produkt eine gemeinsame Bindung aufweisen und jeweils ein Stereozentrum bilden, zueinander dieselbe Relativkonfiguration einnehmen. Dies wird anhand des Zimmerman-Traxler-Modells des Übergangszustands erklärt, in dem eine pseudo-Sesselkonformation angenommen wird. ⓘ
Kontrolle des gekreuzten Aldol-Reaktanten
Das Problem der "Kontrolle" bei der Aldol-Addition lässt sich am besten anhand eines Beispiels veranschaulichen. Betrachten Sie das Ergebnis der folgenden hypothetischen Reaktion:
Bei dieser Reaktion werden zwei unsymmetrische Ketone mit Natriumethoxid kondensiert. Natriumethoxid ist so basisch, dass es keines der Ketone vollständig deprotonieren kann, sondern nur kleine Mengen des Natriumenolats beider Ketone bildet. Das bedeutet, dass beide Ketone nicht nur potenzielle Aldolelektrophile sind, sondern über ihr Natriumenolat auch als Nukleophile wirken können. Zwei Elektrophile und zwei Nucleophile können also zu vier möglichen Produkten führen:
Wenn man also nur eines der Kreuzprodukte erhalten möchte, muss man kontrollieren, welches Carbonyl zum nucleophilen Enol/Enolat wird und welches in seiner elektrophilen Carbonylform bleibt. ⓘ
Acidität
Am einfachsten ist die Kontrolle, wenn nur einer der Reaktanten saure Protonen hat und nur dieses Molekül das Enolat bildet. Zum Beispiel würde die Addition von Malonsäurediethylester an Benzaldehyd nur ein Produkt ergeben. Nur das Malonat hat α-Wasserstoffe und ist daher der nucleophile Partner, während der nicht enolisierbare Benzaldehyd nur das Elektrophil sein kann:
Das Malonat ist besonders leicht zu deprotonieren, da die α-Position von mehr als einem Carbonyl flankiert wird. Durch die doppelte Aktivierung wird das Enolat stabiler, so dass zu seiner Bildung keine so starke Base erforderlich ist. Durch eine Erweiterung dieses Effekts lässt sich steuern, welcher der beiden Carbonylreaktanten zum Enolat wird, auch wenn beide α-Wasserstoffe besitzen. Wenn ein Partner wesentlich saurer ist als der andere, wird das sauerste Proton von der Base abstrahiert und ein Enolat an diesem Carbonyl gebildet, während das weniger saure Carbonyl von der Base nicht beeinflusst wird. Diese Art der Kontrolle funktioniert nur, wenn der Unterschied im Säuregrad groß genug ist und kein Überschuss an Base für die Reaktion verwendet wird. Ein typisches Substrat für diese Situation ist, wenn die deprotonierbare Position durch mehr als eine carbonylartige Gruppe aktiviert ist. Gängige Beispiele sind eine CH2-Gruppe, die von zwei Carbonylen oder Nitrilen flankiert wird (siehe z. B. die Knoevenagel-Kondensation und die ersten Schritte der Malonsäureester- und Acetessigsäureester-Synthese). ⓘ
Reihenfolge der Addition
Eine gängige Lösung besteht darin, zuerst das Enolat eines Partners zu bilden und dann den anderen Partner unter kinetischer Kontrolle hinzuzufügen. Kinetische Kontrolle bedeutet, dass die Vorwärts-Aldol-Additionsreaktion deutlich schneller sein muss als die umgekehrte Retro-Aldol-Reaktion. Damit dieser Ansatz erfolgreich ist, müssen zwei weitere Bedingungen erfüllt sein: Es muss möglich sein, das Enolat eines Partners quantitativ zu bilden, und die Vorwärts-Aldol-Reaktion muss deutlich schneller sein als der Transfer des Enolats von einem Partner zum anderen. Übliche kinetische Kontrollbedingungen sind die Bildung des Enolats eines Ketons mit LDA bei -78 °C und die anschließende langsame Zugabe eines Aldehyds. ⓘ
Enolate
Bildung
Das Enolat kann unter Verwendung einer starken Base ("harte Bedingungen", Weg 1 unten) oder unter Verwendung einer Lewis-Säure und einer schwachen Base ("weiche Bedingungen", Weg 2 unten) gebildet werden:
Die stereoelektronische Voraussetzung für die Deprotonierung ist, dass die alpha-C-H-Sigma-Bindung mit dem pi*-Orbital des Carbonyls überlappen kann:
Geometrie
Zur Bildung von Enolaten wurden umfangreiche Studien durchgeführt. In den meisten Fällen ist es möglich, die gewünschte Enolatgeometrie zu erzeugen:
Bei Ketonen führen die meisten Enolisierungsbedingungen zu Z-Enolaten. Bei Estern führen die meisten Enolisierungsbedingungen zu E-Enolaten. Es ist bekannt, dass die Zugabe von HMPA die Stereoselektivität der Deprotonierung umkehrt. ⓘ
Die stereoselektive Bildung von Enolaten wurde mit dem Irland-Modell erklärt, dessen Gültigkeit allerdings etwas fragwürdig ist. In den meisten Fällen ist nicht bekannt, ob es sich bei den Zwischenprodukten um Monomere oder Oligomere handelt; dennoch bleibt das Ireland-Modell ein nützliches Instrument zum Verständnis von Enolaten. ⓘ
Im Ireland-Modell wird davon ausgegangen, dass die Deprotonierung durch einen sechsgliedrigen oder zyklischen monomeren Übergangszustand erfolgt. Der größere der beiden Substituenten am Elektrophil (im obigen Fall ist das Methyl größer als das Proton) nimmt im bevorzugten Übergangszustand eine äquatoriale Stellung ein, was zu einer Bevorzugung von E-Enolaten führt. Das Modell versagt eindeutig in vielen Fällen; wenn beispielsweise das Lösungsmittelgemisch von THF auf 23 % HMPA-THF geändert wird (wie oben zu sehen), kehrt sich die Enolatgeometrie um, was mit diesem Modell und seinem zyklischen Übergangszustand unvereinbar ist. ⓘ
Regiochemie
Wenn ein unsymmetrisches Keton einer Base ausgesetzt wird, kann es zwei regioisomere Enolate bilden (ohne Berücksichtigung der Enolatgeometrie). Zum Beispiel:
Das trisubstituierte Enolat gilt als kinetisches Enolat, während das tetrasubstituierte Enolat als thermodynamisches Enolat betrachtet wird. Der zur Bildung des kinetischen Enolats deprotonierte Alpha-Wasserstoff ist weniger gehindert und wird daher schneller deprotoniert. Im Allgemeinen sind tetrasubstituierte Olefine aufgrund der hyperkonjugativen Stabilisierung stabiler als trisubstituierte Olefine. Das Verhältnis der Enolat-Regioisomere wird stark von der Wahl der Base beeinflusst. Für das obige Beispiel kann die kinetische Kontrolle mit LDA bei -78 °C hergestellt werden, was eine Selektivität von 99:1 für das kinetische: thermodynamische Enolat ergibt, während die thermodynamische Kontrolle mit Triphenylmethyllithium bei Raumtemperatur hergestellt werden kann, was eine Selektivität von 10:90 ergibt. ⓘ
Im Allgemeinen werden kinetische Enolate durch kalte Temperaturen, Bedingungen, die zu einer relativ ionischen Metall-Sauerstoff-Bindung führen, und eine schnelle Deprotonierung mit einem leichten Überschuss einer starken, sterisch gehinderten Base begünstigt. Die große Base deprotoniert nur den leichter zugänglichen Wasserstoff, und die niedrigen Temperaturen und der Basenüberschuss tragen dazu bei, dass es nach der anfänglichen Enolatbildung nicht zu einem Gleichgewicht mit dem stabileren alternativen Enolat kommt. Thermodynamische Enolate werden durch längere Äquilibrierungszeiten bei höheren Temperaturen, durch Bedingungen, die zu einer relativ kovalenten Metall-Sauerstoff-Bindung führen, und durch die Verwendung einer geringen substöchiometrischen Menge einer starken Base begünstigt. Wenn die Base nicht ausreicht, um alle Carbonylmoleküle zu deprotonieren, können die Enolate und Carbonylgruppen Protonen miteinander austauschen und sich in ihr stabileres Isomer umwandeln. Durch die Verwendung verschiedener Metalle und Lösungsmittel lässt sich die Menge des ionischen Charakters der Metall-Sauerstoff-Bindung steuern. ⓘ
Stereoselektivität
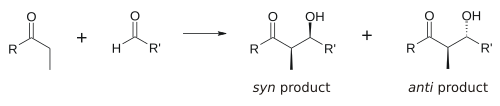
Die Aldolreaktion ist besonders nützlich, weil in einer Reaktion zwei neue stereogene Zentren gebildet werden. Die syn/anti-Konvention wird üblicherweise verwendet, um die relative Stereochemie am α- und β-Kohlenstoff zu bezeichnen. ⓘ
Die Konvention gilt, wenn Propionat (oder Nukleophile höherer Ordnung) zu Aldehyden hinzugefügt werden. Die R-Gruppe des Ketons und die R-Gruppe des Aldehyds werden in einem "Zickzack"-Muster in der Ebene des Papiers (oder des Bildschirms) ausgerichtet, und die Anordnung der gebildeten Stereozentren wird als syn oder anti bezeichnet, je nachdem, ob sie sich auf der gleichen oder auf gegenüberliegenden Seiten der Hauptkette befinden. ⓘ
Ältere Arbeiten verwenden die aus der Saccharidchemie bekannte Erythro/Threo-Nomenklatur. ⓘ
Enolat-Geometrie
Es besteht kein signifikanter Unterschied zwischen dem Grad der Stereoinduktion, der bei E- und Z-Enolaten beobachtet wird. Jede Alkengeometrie führt in erster Linie zu einer bestimmten relativen Stereochemie im Produkt, wobei E zu anti und Z zu syn führt:
Metall-Ion
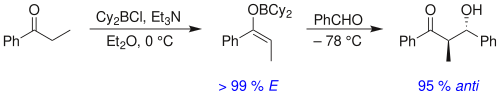
Das Enolat-Metallkation kann bei der Bestimmung des Grades der Stereoselektivität in der Aldolreaktion eine große Rolle spielen. Bor wird häufig verwendet, da seine Bindungslängen deutlich kürzer sind als die von Metallen wie Lithium, Aluminium oder Magnesium. ⓘ
So sind beispielsweise Bor-Kohlenstoff- und Bor-Sauerstoff-Bindungen 1,4-1,5 Å bzw. 1,5-1,6 Å lang, während typische Metall-Kohlenstoff- und Metall-Sauerstoff-Bindungen 1,9-2,2 Å bzw. 2,0-2,2 Å lang sind. Die Verwendung von Bor anstelle eines Metalls "strafft" den Übergangszustand und führt zu einer größeren Stereoselektivität bei der Reaktion. So ergibt die obige Reaktion ein Syn:Anti-Verhältnis von 80:20 bei Verwendung eines Lithium-Enolats im Vergleich zu 97:3 bei Verwendung eines Bibutylbor-Enolats. ⓘ
Alpha-Stereocenter am Enolat
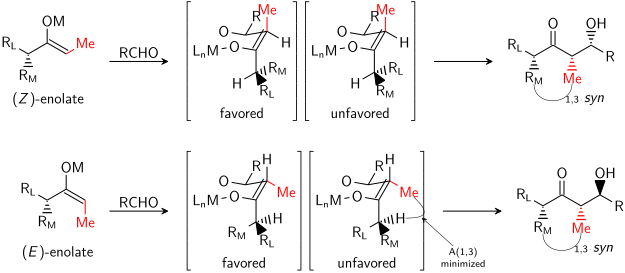
Die Aldolreaktion kann eine "substratbasierte Stereokontrolle" aufweisen, bei der die vorhandene Chiralität eines der Reaktanten das stereochemische Ergebnis der Reaktion beeinflusst. Dies wurde ausgiebig untersucht, und in vielen Fällen lässt sich der Sinn der asymmetrischen Induktion vorhersagen, wenn auch nicht das absolute Niveau der Diastereoselektivität. Wenn das Enolat ein Stereocenter in der Alpha-Position enthält, kann eine ausgezeichnete Stereokontrolle erreicht werden. ⓘ
Im Falle eines E-Enolats ist das dominierende Kontrollelement die allylische 1,3-Spannung, während im Falle eines Z-Enolats das dominierende Kontrollelement die Vermeidung von 1,3-diaxialen Wechselwirkungen ist. Das allgemeine Modell wird im Folgenden vorgestellt:
Zur Verdeutlichung wurde das Stereocenter des Enolats epimerisiert; in Wirklichkeit wäre die gegenüberliegende Diastereofacette des Aldehyds angegriffen worden. In beiden Fällen wird das 1,3-syn-Diastereomer bevorzugt. Es gibt viele Beispiele für diese Art der Stereokontrolle:
Alpha-Stereocenter am Elektrophil
Wenn Enolate Aldehyde mit einem Alpha-Stereocenter angreifen, ist ebenfalls eine ausgezeichnete Stereokontrolle möglich. Die allgemeine Beobachtung ist, dass E-Enolate eine Felkin-Diastereoselektion aufweisen, während Z-Enolate eine Anti-Felkin-Selektivität aufweisen. Das allgemeine Modell wird im Folgenden vorgestellt:
Da Z-Enolate über einen Übergangszustand reagieren müssen, der entweder eine destabilisierende Syn-Pentan-Wechselwirkung oder ein Anti-Felkin-Rotamer enthält, weisen Z-Enolate in diesem Fall eine geringere Diastereoselektivität auf. Im Folgenden werden einige Beispiele vorgestellt:
Vereinheitlichtes Modell der Stereoinduktion
Wenn sowohl das Enolat als auch der Aldehyd bereits eine Chiralität aufweisen, kann das Ergebnis der "doppelt stereodifferenzierenden" Aldolreaktion mit Hilfe eines kombinierten stereochemischen Modells vorhergesagt werden, das die Enolat-Facial-Bias, die Enolat-Geometrie und die Facial-Bias des Aldehyds berücksichtigt. Im Folgenden werden mehrere Beispiele für die Anwendung dieses Modells gegeben:
Evans' Oxazolidinon-Chemie
Eine weit verbreitete Methode ist die Evans'sche Acyloxazolidinon-Methode. Sie wurde in den späten 1970er und 1980er Jahren von David A. Evans und seinen Mitarbeitern entwickelt und funktioniert durch die vorübergehende Erzeugung eines chiralen Enolats durch Anhängen eines chiralen Hilfsstoffs. Die bereits vorhandene Chiralität des Hilfsstoffs wird dann durch eine diastereoselektive Aldolreaktion auf das Aldoladdukt übertragen. Nach der anschließenden Entfernung des Hilfsstoffs wird das gewünschte Aldol-Stereoisomer erhalten. ⓘ
Bei der Evans-Methode ist das angehängte chirale Hilfsmittel ein Oxazolidinon, und die entstehende Carbonylverbindung ist ein Imid. Eine Reihe von Oxazolidinonen ist inzwischen in beiden enantiomeren Formen leicht erhältlich. Sie sind relativ teuer. Enantiomerenreine Oxazolidinone lassen sich jedoch in zwei Syntheseschritten aus vergleichsweise preiswerten Aminosäuren ableiten, so dass großtechnische Synthesen durch eigene Herstellung wirtschaftlicher gestaltet werden können. Dies beinhaltet in der Regel eine Borhydrid-vermittelte Reduktion des Säureanteils, gefolgt von einer Kondensation/Cyclisierung des resultierenden Aminoalkohols mit einem einfachen Carbonatester wie Diethylcarbonat. ⓘ
Die Acylierung eines Oxazolidinons ist ein einfaches Verfahren, das informell als "loading done" bezeichnet wird. Z-Enolate, die zu Syn-Aldol-Addukten führen, können zuverlässig durch Bor-vermittelte weiche Enolisierung gebildet werden:
Häufig kann ein einziges Diastereomer durch eine einzige Kristallisation des Aldol-Addukts erhalten werden. Anti-Aldol-Addukte können jedoch mit der Evans-Methode nicht zuverlässig erhalten werden. Trotz der Kosten und der Einschränkung, dass nur syn-Addukte erhalten werden können, ist diese Methode aufgrund ihrer hohen Zuverlässigkeit, einfachen Anwendung und Vielseitigkeit in vielen Fällen die Methode der Wahl. Für die Spaltung des Hilfsstoffs gibt es viele Methoden:
Nach der Konstruktion des Imids können sowohl syn- als auch anti-selektive Aldol-Additionsreaktionen durchgeführt werden, die den Aufbau von drei der vier möglichen Stereoarrays ermöglichen: syn-selektiv: und anti-selektiv:
Bei den syn-selektiven Reaktionen ergeben beide Enolisierungsmethoden erwartungsgemäß das Z-Enolat; das stereochemische Ergebnis der Reaktion wird jedoch durch das Methyl-Stereocenter und nicht durch die Chiralität des Oxazolidinons gesteuert. Die beschriebenen Methoden ermöglichen den stereoselektiven Aufbau von Polyketiden, einer Klasse von Naturprodukten, die häufig das Aldol-Retron aufweisen. ⓘ
Intramolekulare Reaktion

Die intramolekulare Aldolreaktion ist die Kondensationsreaktion zweier Aldehyd- oder Ketongruppen im selben Molekül. Als Produkte werden fünf- oder sechsgliedrige α,β-ungesättigte Ketone oder Aldehyde gebildet. Diese Reaktion ist ein wichtiger Ansatz für die Bildung von Kohlenstoff-Kohlenstoff-Bindungen in organischen Molekülen mit Ringsystemen. So kann beispielsweise Hexan-2,5-dion (Verbindung A in Abbildung 1) unter stark basischen Bedingungen (z. B. Natriumhydroxid) über eine intramolekulare Aldolreaktion zum 3-Methylcyclopent-2-en-1-on (Verbindung B) cyclisieren. ⓘ
Der Mechanismus der intramolekularen Aldolreaktion beinhaltet die Bildung eines Schlüsselenzwischenprodukts, gefolgt von einem intramolekularen nukleophilen Additionsprozess. Zunächst abstrahiert das Hydroxid den α-Wasserstoff an einem terminalen Kohlenstoff, um das Enolat zu bilden. Anschließend wird durch einen nucleophilen Angriff des Enolats auf die andere Ketogruppe eine neue Kohlenstoff-Kohlenstoff-Bindung (rot) zwischen den Kohlenstoffen 2 und 6 gebildet. Schließlich wird durch die Abspaltung des Wassermoleküls, in der Regel unter Erhitzung, das zyklisierte α,β-ungesättigte Keton gebildet. ⓘ

Intramolekulare Aldolreaktionen sind in der Totalsynthese verschiedener Naturstoffe, insbesondere von Alkaloiden und Steroiden, weit verbreitet. Ein Beispiel ist die Anwendung einer intramolekularen Aldolreaktion im Ringschlussschritt für die Totalsynthese von (+)-Wortmannin durch Shigehisa, et al. (Abbildung 2). ⓘ
Variationen und Methoden
Acetat-Aldol-Reaktionen
Eine wesentliche Einschränkung des zuvor beschriebenen chiralen Hilfsansatzes besteht darin, dass die N-Acetylimide nicht selektiv reagieren. Ein früher Ansatz war die Verwendung einer temporären Thioethergruppe:
Mukaiyama-Aldol-Reaktion
Die Mukaiyama-Aldol-Reaktion ist die nukleophile Addition von Silylenolethern an Aldehyde, katalysiert durch eine Lewis-Säure wie Bortrifluorid (als Bortrifluorid-Etherat) oder Titantetrachlorid. Die Mukaiyama-Aldolreaktion folgt nicht dem Zimmerman-Traxler-Modell. Carreira hat eine besonders nützliche asymmetrische Methode mit Silylketenacetalen beschrieben, die sich durch eine hohe Enantioselektivität und einen großen Substratbereich auszeichnet. ⓘ
Die Methode funktioniert mit unverzweigten aliphatischen Aldehyden, die oft schlechte Elektrophile für katalytische, asymmetrische Prozesse sind. Dies kann auf eine schlechte elektronische und sterische Differenzierung zwischen ihren Enantioflächen zurückzuführen sein. ⓘ
Das analoge vinylogous Mukaiyama-Aldolverfahren kann ebenfalls katalytisch und asymmetrisch gemacht werden. Das unten gezeigte Beispiel funktioniert effizient für aromatische (aber nicht aliphatische) Aldehyde, und man geht davon aus, dass der Mechanismus ein chirales, metallgebundenes Dienolat umfasst. ⓘ
Crimmins Thiazolidinethion Aldol
Bei der Crimminschen Thiazolidinethion-Methode führt ein Thiazolidinethion Acetat-Aldol-Reaktionen durch und kann durch einfaches Variieren der Menge an (-)-Stein die "Evans syn"- oder "non-Evans syn"-Addukte erzeugen. Es wird angenommen, dass die Reaktion über sechsgliedrige, titangebundene Übergangszustände abläuft, analog zu den vorgeschlagenen Übergangszuständen für das Evans-Hilfsmittel. ANMERKUNG: In der unten dargestellten Struktur von Spartein fehlt ein N-Atom. ⓘ
Organokatalyse
Chirale sekundäre Aminkatalysatoren katalysieren einige Aldolreaktionen. Diese sekundären Amine bilden bei Kontakt mit Ketonen transiente Enamine, die enantioselektiv mit geeigneten Aldehyd-Elektrophilen reagieren können. Das Amin reagiert mit dem Carbonyl unter Bildung eines Enamins, das Enamin wirkt als enolähnliches Nukleophil, und anschließend wird das Amin aus dem Produkt freigesetzt - das Amin selbst ist ein Katalysator. Diese Methode der Enaminkatalyse ist eine Art der Organokatalyse, da der Katalysator vollständig auf einem kleinen organischen Molekül basiert. In einem wegweisenden Beispiel katalysierte Prolin effizient die Cyclisierung eines Triketons:
Diese Reaktion ist als Hajos-Parrish-Reaktion bekannt (auch bekannt als Hajos-Parrish-Eder-Sauer-Wiechert-Reaktion, in Anlehnung an einen zeitgenössischen Bericht von Schering über die Reaktion unter härteren Bedingungen). Unter den Hajos-Parrish-Bedingungen ist nur eine katalytische Menge an Prolin erforderlich (3 Mol-%). Es besteht keine Gefahr einer achiralen Hintergrundreaktion, da die flüchtigen Enamin-Zwischenprodukte viel nukleophiler sind als ihre Stamm-Keton-Enole. Diese Strategie bietet eine einfache Möglichkeit zur Erzeugung von Enantioselektivität in Reaktionen ohne den Einsatz von Übergangsmetallen, die den möglichen Nachteil haben, dass sie toxisch oder teuer sind. ⓘ
Prolin-katalysierte Aldolreaktionen zeigen keine nichtlinearen Effekte (die Enantioselektivität der Produkte ist direkt proportional zur Enantioreinheit des Katalysators). In Verbindung mit Isotopenmarkierungsnachweisen und Berechnungsstudien ergibt sich folgender Reaktionsmechanismus für Prolin-katalysierte Aldolreaktionen:
Diese Strategie ermöglicht die sonst schwierige Cross-Aldol-Reaktion zwischen zwei Aldehyden. Im Allgemeinen sind Cross-Aldol-Reaktionen zwischen Aldehyden schwierig, da sie leicht polymerisieren oder unselektiv reagieren können, so dass eine statistische Mischung von Produkten entsteht. Das erste Beispiel ist unten dargestellt:
Im Gegensatz zu der bei Aldol-Additionen auf Enolatbasis typischerweise beobachteten Bevorzugung von Syn-Addukten sind diese organokatalysierten Aldol-Additionen antiselektiv. In vielen Fällen sind die organokatalytischen Bedingungen mild genug, um eine Polymerisation zu vermeiden. Die Selektivität erfordert jedoch eine langsame, durch Spritzenpumpen gesteuerte Addition des gewünschten elektrophilen Partners, da beide Reaktionspartner in der Regel enolisierbare Protonen aufweisen. Wenn einer der Aldehyde keine enolisierbaren Protonen oder alpha- oder beta-Verzweigungen aufweist, kann eine zusätzliche Kontrolle erreicht werden. ⓘ
Eine elegante Demonstration der Leistungsfähigkeit asymmetrischer organokatalytischer Aldolreaktionen wurde 2004 von MacMillan und Mitarbeitern bei der Synthese von unterschiedlich geschützten Kohlenhydraten gezeigt. Während herkömmliche Synthesemethoden die Synthese von Hexosen unter Verwendung von Variationen iterativer Schutz-Schutz-Strategien bewerkstelligen, die 8-14 Schritte erfordern, kann die Organokatalyse auf viele der gleichen Substrate zugreifen, indem sie ein effizientes zweistufiges Protokoll verwendet, das die Prolin-katalysierte Dimerisierung von Alpha-Oxyaldehyden gefolgt von einer Tandem-Mukaiyama-Aldol-Cyclisierung umfasst. ⓘ
Die Aldol-Dimerisierung von alpha-Oxyaldehyden erfordert, dass das Aldol-Addukt, das selbst ein Aldehyd ist, inert gegenüber weiteren Aldol-Reaktionen ist. Frühere Untersuchungen ergaben, dass Aldehyde mit alpha-Alkyloxy- oder alpha-Silyloxy-Substituenten für diese Reaktion geeignet waren, während Aldehyde mit elektronenziehenden Gruppen wie Acetoxy nicht reaktiv waren. Das geschützte Erythrose-Produkt konnte dann durch Mukaiyama-Aldol-Addition und anschließende Lactolbildung in vier mögliche Zucker umgewandelt werden. Dies erfordert eine geeignete Diastereokontrolle bei der Mukaiyama-Aldol-Addition und eine bevorzugte Zyklisierung des Silyloxycarbenium-Ions anstelle einer weiteren Aldol-Reaktion. Am Ende wurden Glucose, Mannose und Allose synthetisiert:
Die Aldolreaktion ist ein sehr weit verbreitetes Verfahren und hat seine Anwendung sowohl im Labormaßstab als auch in der großtechnischen Produktion. ⓘ
"Direkte" Aldol-Additionen
Bei der üblichen Aldol-Addition wird eine Carbonylverbindung deprotoniert, um das Enolat zu bilden. Das Enolat wird an einen Aldehyd oder ein Keton addiert, das ein Alkoxid bildet, das dann bei der Aufarbeitung protoniert wird. Eine bessere Methode würde im Prinzip die Notwendigkeit einer mehrstufigen Sequenz zugunsten einer "direkten" Reaktion vermeiden, die in einem einzigen Prozessschritt durchgeführt werden könnte. Eine Idee besteht darin, das Enolat mit Hilfe eines Metallkatalysators zu erzeugen, der nach dem Aldol-Additionsmechanismus freigesetzt wird. Das allgemeine Problem besteht darin, dass bei der Addition ein Alkoxid entsteht, das viel basischer ist als die Ausgangsstoffe. Dieses Produkt bindet sich fest an das Metall, so dass es nicht mit weiteren Carbonylreaktanten reagieren kann. ⓘ
Ein von Evans vorgestellter Ansatz besteht darin, das Aldol-Addukt zu silylieren. Bei der Reaktion wird ein Siliciumreagenz wie TMSCl zugesetzt, das das Metall auf dem Alkoxid ersetzt und den Umsatz des Metallkatalysators ermöglicht. Die Minimierung der Anzahl der Reaktionsschritte und der Menge der verwendeten reaktiven Chemikalien führt zu einer kostengünstigen und industriell nutzbaren Reaktion. ⓘ
Biologische Aldolreaktionen
Beispiele für Aldolreaktionen in der Biochemie sind die Aufspaltung von Fructose-1,6-bisphosphat in Dihydroxyaceton und Glyceraldehyd-3-phosphat in der vierten Stufe der Glykolyse, die ein Beispiel für eine umgekehrte ("retro") Aldolreaktion ist, die durch das Enzym Aldolase A (auch bekannt als Fructose-1,6-bisphosphat-Aldolase) katalysiert wird. ⓘ
Im Glyoxylatzyklus von Pflanzen und einigen Prokaryonten erzeugt die Isocitratlyase aus Isocitrat Glyoxylat und Succinat. Nach der Deprotonierung der OH-Gruppe spaltet die Isocitratlyase das Isocitrat durch eine Aldol-Spaltungsreaktion in das Vier-Kohlenstoff-Succinat und das Zwei-Kohlenstoff-Glyoxylat. Diese Spaltung ähnelt mechanistisch der Aldolase-A-Reaktion der Glykolyse. ⓘ
Geschichte
Die Aldolreaktion wurde unabhängig voneinander von Charles Adolphe Wurtz und von Alexander Porfyrevich Borodin im Jahre 1872 entdeckt. Borodin hat hier die Dimerisierung von Acetaldehyd zu 3-Hydroxybutanal (andere Namen sind Aldol oder Acetaldol) unter sauren Bedingungen beobachtet. ⓘ
Übersichtsreaktionen
Aldoladdition und Aldolkondensation
Im Zuge einer Aldoladdition reagiert beispielsweise Acetaldehyd mit einem weiteren Molekül Acetaldehyd zu einem β-Hydroxyaldehyd – hier: 3-Hydroxybutanal, einem Aldol. Im Gegensatz dazu ist das Produkt einer Aldolkondensation derselben Edukt(e) ein α,β-ungesättigter Aldehyd – hier: Crotonaldehyd (trans-2-Butenal). Die Reaktionen können sowohl säuren- als auch basenkatalysiert ablaufen:

Die rot markierten Bindungen symbolisieren die neu geknüpften Kohlenstoff-Kohlenstoff-Bindungen der Aldoladdition und Aldolkondensation
Statt der Acetaldehyde können beliebige Ketone und Aldehyde eine solche Reaktion eingehen, wenn mindestens in einem der Edukte in α-Stellung zur Carbonylgruppe ein H-Atom steht. Das Produkt einer solchen Aldoladdition ist ein β-Hydroxyaldehyd bzw. ein β-Hydroxyketon. Bei der Aldolkondensation entsteht eine α,β-ungesättigte Carbonylverbindung (Aldehyd oder Keton). ⓘ
Biologische Bedeutung
Die Aldolreaktion und ihre Umkehrung sind bei vielen enzymatisch katalysierten biochemischen Reaktionen an der Veränderung des Kohlenstoffgerüstes von Naturstoffen beteiligt. Beispielsweise wird beim aeroben Kohlenhydratabbau am Anfang des Citratzyklus das Citrat aus Oxalessigsäure und Acetyl-CoA in einer Aldoladdition gebildet. ⓘ
Erfolgt die Biosynthese der Isoprenoide über die Mevalonsäure, dann ist dort die Verknüpfung von Acetyl-CoA und Acetacetyl-CoA zu 3-Hydroxy-3-methylglutaryl-CoA eine Aldolreaktion. Zwei Moleküle Acetyl-CoA reagieren zu Acetacetyl-CoA (Esterkondensation). Dieses wird mit einem dritten Molekül Acetyl-CoA zu 3-Hydroxy-3-methylglutaryl-CoA verknüpft (Aldolreaktion). Anschließend führt die Abspaltung von CoA und gleichzeitige Reduktion der Carboxygruppe zu Mevalonsäure.
Bei der Gluconeogenese reagieren die beiden isomeren Ketotriosen Glycerinaldehyd-3-phosphat und Dihydroxyacetonphosphat im Sinne einer Aldolreaktion zu Fructose-1,6-bisphosphat. ⓘ
Die frühere Annahme von Adolf von Baeyer und anderen, dass eine Aldolkondensation ein wichtiger Schritt der pflanzlichen Stärkesynthese ist, ist durch neuere Erkenntnisse überholt. ⓘ