Imine
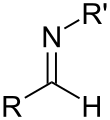
Imine sind Derivate von Aldehyden oder Ketonen, welche durch Kondensation mit Aminen entstehen. Imine sind Verbindungen, bei denen das Sauerstoff-Atom des Aldehyds oder Ketons formal durch ein Stickstoff-Atom ersetzt ist. Das Stickstoff-Atom trägt zudem noch ein Wasserstoff-Atom oder einen organischen Rest R3; im letzteren Fall spricht man auch von einem Azomethin oder einer Schiffschen Base, benannt nach Hugo Schiff (1834–1915), dem deutsch-italienischen Chemiker und Entdecker dieser Stoffklasse. Der strukturelle Aufbau ist also R1R2C=NR3. R1, R2 und R3 können unterschiedliche oder gleiche Reste sein, auch Wasserstoffatome. Aldimine (R1 oder/und R2 = H) sind N-Analoga von Aldehyden und Ketimine (R1 und R2 = Organylrest, z. B. Alkyl- oder Arylrest) N-Analoga von Ketonen. ⓘ
Ebenfalls als Imine wurden (vor allem in der älteren Literatur) heterocyclische Amine wie beispielsweise Piperidin (Pentamethylenimin) bezeichnet. Heute ist diese Bezeichnung jedoch unzulässig, da echte Imine das Vorhandensein der typischen Imin-Doppelbindungen aufweisen. ⓘ

Ein Imin (/ɪˈmiːn/ oder /ˈɪmɪn/) ist eine funktionelle Gruppe oder organische Verbindung mit einer Kohlenstoff-Stickstoff-Doppelbindung. Das Stickstoffatom kann an einen Wasserstoff oder eine organische Gruppe (R) gebunden sein. Das Kohlenstoffatom hat zwei zusätzliche Einfachbindungen. Imine sind in synthetischen und natürlich vorkommenden Verbindungen weit verbreitet und an vielen Reaktionen beteiligt. ⓘ
Struktur
Bei Ketiminen und Aldiminen sind die fünf Kernatome (C2C=NX und C(H)C=NX, X = H oder C) koplanar. Die Planarität ergibt sich aus der sp2-Hybridisierung der aneinander doppelt gebundenen Kohlenstoff- und Stickstoffatome. Der C=N-Abstand beträgt 1,29-1,31 Å für nicht konjugierte Imine und 1,35 Å für konjugierte Imine. Im Gegensatz dazu beträgt der C-N-Abstand bei Aminen und Nitrilen 1,47 bzw. 1,16 Å. Die Rotation um die C=N-Bindung ist langsam. Mit Hilfe der NMR-Spektroskopie konnten sowohl E- als auch Z-Isomere von Aldiminen nachgewiesen werden. Aufgrund von sterischen Effekten wird das E-Isomer bevorzugt. ⓘ
Nomenklatur und Klassifizierung
Der Begriff "Imin" wurde 1883 von dem deutschen Chemiker Albert Ladenburg geprägt. ⓘ
In der Regel beziehen sich Imine auf Verbindungen mit der allgemeinen Formel R2C=NR, wie unten erläutert. In der älteren Literatur bezieht sich der Begriff Imin auf das Aza-Analogon eines Epoxids. So ist Ethylenimin die dreigliedrige Ringspezies Aziridin C2H4NH. Die Beziehung von Iminen zu Aminen mit Doppel- und Einfachbindungen kann mit Imiden und Amiden in Beziehung gesetzt werden, wie bei Succinimid und Acet'am'id. ⓘ
Imine sind mit Ketonen und Aldehyden verwandt, indem der Sauerstoff durch eine NR-Gruppe ersetzt wird. Ist R = H, handelt es sich um ein primäres Imin, ist R ein Kohlenwasserstoffrest, handelt es sich um ein sekundäres Imin. Handelt es sich bei dieser Gruppe nicht um ein Wasserstoffatom, so wird die Verbindung manchmal als Schiffsche Base bezeichnet. Wenn R3 OH ist, wird das Imin als Oxim bezeichnet, und wenn R3 NH2 ist, wird das Imin als Hydrazon bezeichnet. ⓘ
Ein primäres Imin, in dem C sowohl an einen Kohlenwasserstoff als auch an ein H gebunden ist, wird als primäres Aldimin bezeichnet; ein sekundäres Imin mit solchen Gruppen wird als sekundäres Aldimin bezeichnet. Ein primäres Imin, bei dem C an zwei Kohlenwasserstoffe gebunden ist, wird als primäres Ketimin bezeichnet; ein sekundäres Imin mit solchen Gruppen wird als sekundäres Ketimin bezeichnet. ⓘ
Aziridin und seine Derivate werden manchmal auch als Imine bezeichnet. ⓘ
N-Sulfinyl-Imine sind eine besondere Klasse von Iminen, bei denen eine Sulfinylgruppe an das Stickstoffatom gebunden ist. ⓘ
Synthese von Iminen
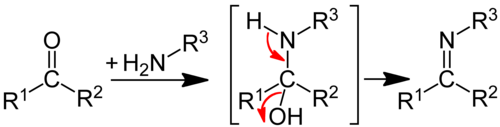
 Imin-Synthese aus einem primären Amin und einer Carbonylverbindung. ⓘ
Imin-Synthese aus einem primären Amin und einer Carbonylverbindung. ⓘ
Carbonyl-Amin-Kondensation
Imine werden in der Regel durch die Kondensation von primären Aminen mit Aldehyden oder Ketonen hergestellt. Ketone führen ähnliche Reaktionen durch, allerdings weniger häufig als Aldehyde. Was den Mechanismus betrifft, so laufen solche Reaktionen über eine nukleophile Addition ab, die zu einem hemiaminalen -C(OH)(NHR)-Zwischenprodukt führt, gefolgt von einer Abspaltung von Wasser, um das Imin zu erhalten (für einen detaillierten Mechanismus siehe Alkylimino-de-oxo-Bisubstitution). Das Gleichgewicht in dieser Reaktion begünstigt in der Regel die Carbonylverbindung und das Amin, so dass eine azeotrope Destillation oder die Verwendung eines Dehydratisierungsmittels, wie Molekularsiebe oder Magnesiumsulfat, erforderlich ist, um die Iminbildung zu begünstigen. In den letzten Jahren hat sich gezeigt, dass verschiedene Reagenzien wie Tris(2,2,2-trifluorethyl)borat [B(OCH2CF3)3], Pyrrolidin oder Titanethoxid [Ti(OEt)4] die Iminbildung katalysieren können. ⓘ
Seltener als primäre Amine wird Ammoniak zur Bildung eines primären Imins verwendet. Im Falle von Hexafluoraceton kann das hemiaminale Zwischenprodukt isoliert werden. ⓘ
Aus Nitrilen
Primäre Ketimine können über eine Grignard-Reaktion mit einem Nitril synthetisiert werden. Diese Methode ist als Moureu-Mignonac-Ketiminsynthese bekannt. Benzophenonimin kann z. B. auch durch Addition von Phenylmagnesiumbromid an Benzonitril und anschließende sorgfältige Hydrolyse (damit das Imin nicht hydrolysiert wird) synthetisiert werden:
- C6H5CN + C6H5MgBr → (C6H5)2C=NMgBr
- (C6H5)2C=NMgBr + H2O → (C6H5)2C=NH + MgBr(OH) ⓘ
Spezialisierte Methoden
Für die Synthese von Iminen gibt es mehrere andere Methoden. ⓘ
- Reaktion von organischen Aziden mit Metallcarbenoiden (hergestellt aus Diazocarbonylverbindungen).
- Kondensation von Carbonsäuren mit Nitroso-Verbindungen.
- Die Umlagerung von Trityl-N-Halogenaminen durch die Stieglitz-Umlagerung.
- Durch Reaktion von Alkenen mit Hydrazoesäure in der Schmidt-Reaktion.
- Durch die Reaktion eines Nitrils, Salzsäure und eines Arens in der Hoesch-Reaktion.
- Multikomponentensynthese von 3-Thiazolinen in der Asinger-Reaktion.
- Thermische Zersetzung von Oximen. ⓘ
Reaktionen

Hydrolyse
Die Hauptreaktion der Imine, die oft unerwünscht ist, ist ihre Hydrolyse zurück zum Amin und zur Carbonylvorstufe. ⓘ
- R2C=NR' + H2O ⇌ R2C=O + R'NH2 ⓘ
Vorstufen von Heterocyclen
Imine werden häufig als Zwischenprodukte bei der Synthese von Heterocyclen verwendet. ⓘ
- Aromatische Imine reagieren mit einem Enolether in der Povarov-Reaktion zu einem Chinolin.
- Imine reagieren thermisch mit Ketenen in [2+2]-Cycloadditionen zur Bildung von β-Lactamen in der Staudinger-Synthese. Es sind mehrere Varianten beschrieben worden.
- Imine reagieren mit Dienen in der Imin-Diels-Alder-Reaktion zu einem Tetrahydropyridin.
- Tosylimine reagieren mit α,β-ungesättigten Carbonylverbindungen zu allylischen Aminen in der Aza-Baylis-Hillman-Reaktion. ⓘ
Säure-Base-Reaktionen
Ähnlich wie die Ausgangsamine sind auch die Imine schwach basisch und protonieren reversibel zu Iminiumsalzen:
- R2C=NR' + H+ https://wikimedia.org/api/rest_v1/media/math/render/svg/286de75351feddd1cbac5e7ebd53c4e682104d56 [R2C=NHR']+ ⓘ
Alternativ dazu sind primäre Imine ausreichend sauer, um eine N-Alkylierung zu ermöglichen, wie am Beispiel des Benzophenonimins gezeigt wird:
- (C6H5)2C=NH + CH3Li → (C6H5)2C=NLi + CH4
- (C6H5)2C=NLi + CH3I → (C6H5)2C=NCH3 + LiI ⓘ
Lewis-Säure-Base-Reaktionen
Imine sind häufige Liganden in der Koordinationschemie. Besonders beliebte Beispiele sind die von Salicylaldehyd abgeleiteten Schiffschen Basenliganden, die Salenliganden. Metallkatalysierte Reaktionen von Iminen laufen über solche Komplexe ab. In klassischen Koordinationskomplexen binden die Imine die Metalle über den Stickstoff. Bei niederwertigen Metallen werden η2-Imin-Liganden beobachtet. ⓘ
Nucleophile Additionen
Ähnlich wie Ketone und Aldehyde sind primäre Imine anfällig für den Angriff durch Carbanion-Äquivalente. Diese Methode ermöglicht die Synthese von sekundären Aminen:
- R2C=NR' + R "Li → R2R "CN(Li)R'
- R2R "CN(Li)R' + H2O → R2R "CNHR' + LiOH ⓘ
Imin-Reduktionen
Imine werden durch reduktive Aminierung reduziert. Ein Imin kann durch Hydrierung zu einem Amin reduziert werden, beispielsweise bei der Synthese von m-Tolylbenzylamin:
Andere Reduktionsmittel sind Lithiumaluminiumhydrid und Natriumborhydrid. ⓘ
Die asymmetrische Reduktion von Iminen wurde durch Hydrosilylierung mit einem Rhodium-DIOP-Katalysator erreicht. Seitdem wurden zahlreiche Systeme untersucht. ⓘ
Aufgrund ihrer erhöhten Elektrophilie sind Iminiumderivate besonders anfällig für die Reduktion zu den Aminen. Solche Reduktionen können durch Transferhydrierung oder durch die stöchiometrische Wirkung von Natriumcyanoborhydrid erreicht werden. Da die von unsymmetrischen Ketonen abgeleiteten Imine prochiral sind, stellt ihre Reduktion einen Weg zu chiralen Aminen dar. ⓘ
Polymerisation
Ungehinderte Aldimine neigen zur Zyklisierung, wie die Kondensation von Methylamin und Formaldehyd zeigt, bei der das Hexahydro-1,3,5-Triazin entsteht. ⓘ
Iminpolymere (Polyimine) können aus mehrwertigen Aldehyden und Aminen synthetisiert werden. Die Polymerisationsreaktion läuft direkt ab, wenn die Aldehyd- und Aminmonomere bei Raumtemperatur miteinander vermischt werden. In den meisten Fällen können noch (geringe) Mengen an Lösungsmittel erforderlich sein. Polyimine sind aufgrund ihrer Anwendung als Vitrimere besonders interessante Materialien. Aufgrund der dynamischen kovalenten Natur der Iminbindungen können Polyimine relativ leicht recycelt werden. Außerdem sind Polyimine für ihr selbstheilendes Verhalten bekannt. ⓘ
Verschiedene Reaktionen
Ähnlich wie Pinacol-Kupplungen sind Imine anfällig für reduktive Kupplungen, die zu 1,2-Diaminen führen. ⓘ
Imine werden mit meta-Chlorperoxybenzoesäure (mCPBA) zu Oxaziridinen oxidiert. ⓘ
Imine sind Zwischenprodukte bei der Alkylierung von Aminen mit Ameisensäure in der Eschweiler-Clarke-Reaktion. ⓘ
Eine Umlagerung in der Kohlenhydratchemie, an der ein Imin beteiligt ist, ist die Amadori-Umlagerung. ⓘ
Eine Methylentransferreaktion eines Imins durch ein nicht stabilisiertes Sulfoniumylid kann ein Aziridin-System ergeben. Imine reagieren mit Dialkylphosphit in der Pudovik-Reaktion und der Kabachnik-Fields-Reaktion ⓘ
Biologische Rolle
Imine sind in der Natur weit verbreitet. Die pyridoxalphosphatabhängigen Enzyme (PLP-Enzyme) katalysieren unzählige Reaktionen mit Aldiminen (oder Schiffschen Basen). ⓘ
Eigenschaften
Imine sind weniger basisch als entsprechende Amine, da das freie Elektronenpaar des sp2-hybridisierten Stickstoffs schlechter für die Anlagerung eines Protons verfügbar ist. Bei geeigneter Substitution unterliegen Imine der Imin-Enamin-Tautomerie. ⓘ
Herstellung
Imine werden aus primären Aminen mit Aldehyden oder Ketonen gebildet; als Zwischenstufe entstehen Halbaminale, die Analoga der Halbacetale. ⓘ
Die Reaktion erfolgt durch eine nukleophile Addition zwischen einer Carbonylverbindung und einem primären Amin. Über ein Zwitterion, das nun ein positiv geladenes Stickstoff- und ein negativ geladenes Sauerstoff-Atom besitzt, wird ein instabiles Halbaminal gebildet. In drei weiteren Schritten wird zunächst ein Proton (protoniert) am Sauerstoff angelagert, und der Sauerstoff erhält eine positive Ladung. Nach der Entfernung von Wasser am Kohlenstoff und des letzten Wasserstoffatoms am Stickstoff ist ein Azomethin entstanden. Analog verläuft auch die Bildung von Enaminen. Durch die Asinger-Reaktion entstehen heterocyclische Imine (z. B. 3-Thiazoline) mit einer C=N-Doppelbindung als Teil eines fünfgliedrigen Ringsystems. ⓘ
Verwendung
Bei einigen Mehrkomponentenreaktionen (z. B. Strecker-Synthese, Ugi-Reaktion) zur Herstellung von Aminosäuren oder Aminosäure-Derivaten treten Imine als Zwischenprodukte auf oder werden als Edukte benutzt. Vom BINOL abgeleitete Heterobimetallkatalysatoren werden in der enantioselektiven Addition von Phosphornukleophilen an Imine eingesetzt. ⓘ