Achondroplasie
| Achondroplasie ⓘ | |
|---|---|
 | |
| Jason "Wee Man" Acuña, ein amerikanischer Schauspieler und Stuntman mit Achondroplasie | |
| Aussprache . |
|
| Fachgebiet | Medizinische Genetik |
| Symptome | Kurze Arme und Beine, vergrößerter Kopf, markante Stirn |
| Komplikationen | Ohrinfektionen, Hyperlordose, Rückenschmerzen, Spinalkanalstenose, Hydrozephalus |
| Ursachen | Genetisch bedingt (autosomal dominante Mutation im FGFR3-Gen) |
| Risikofaktoren | Väterliches Alter |
| Diagnostische Methode | Anhand der Symptome, bei Unklarheit Gentest |
| Differentialdiagnose | Hypochondroplasie, thanatophorische Dysplasie, Knorpel-Haar-Hypoplasie, Pseudoachondroplasie |
| Behandlung | Selbsthilfegruppen, Wachstumshormontherapie, Behandlung von Komplikationen |
| Häufigkeit | 1 von 27.500 Menschen |
Die Achondroplasie ist eine genetische Störung mit einem autosomal dominanten Vererbungsmuster, deren Hauptmerkmal der Zwergwuchs ist. Bei den Betroffenen sind Arme und Beine kurz, während der Rumpf in der Regel eine normale Länge aufweist. Die Betroffenen sind im Erwachsenenalter durchschnittlich 131 Zentimeter groß (Männer) bzw. 123 Zentimeter (Frauen). Weitere Merkmale können ein vergrößerter Kopf und eine hervorstehende Stirn sein. Zu den Komplikationen können Schlafapnoe oder wiederkehrende Ohrinfektionen gehören. Zur Achondroplasie gehört eine Skelettdysplasie der kurzen Gliedmaßen mit schwerer kombinierter Immunschwäche. ⓘ
Achondroplasie wird durch eine Mutation im Fibroblasten-Wachstumsfaktor-Rezeptor 3 (FGFR3)-Gen verursacht, die zu einer Überaktivität des Proteins führt. Achondroplasie führt zu einem gestörten endochrondralen Knochenwachstum (Knochenwachstum innerhalb des Knorpels). Die Störung wird autosomal-dominant vererbt, d. h. es ist nur eine mutierte Kopie des Gens erforderlich, damit die Krankheit auftritt. Etwa 80 % der Fälle treten bei Kindern von Eltern mit durchschnittlicher Statur auf und sind auf eine neue Mutation zurückzuführen, die meist als spontane Veränderung während der Spermatogenese entsteht. Die übrigen Fälle werden von einem Elternteil mit der Krankheit vererbt. Das Risiko einer Neumutation steigt mit dem Alter des Vaters. In Familien mit zwei betroffenen Elternteilen sterben Kinder, die beide betroffenen Gene geerbt haben, in der Regel vor der Geburt oder im frühen Säuglingsalter an Atemnot. Die Krankheit wird in der Regel anhand der klinischen Merkmale diagnostiziert, kann aber auch durch Gentests bestätigt werden. ⓘ
Zu den Behandlungsmöglichkeiten gehören Selbsthilfegruppen und eine Wachstumshormontherapie. Möglicherweise sind auch Maßnahmen zur Behandlung oder Vorbeugung von Komplikationen wie Fettleibigkeit, Hydrozephalus, obstruktive Schlafapnoe, Mittelohrentzündungen oder Spinalkanalstenose erforderlich. Achondroplasie ist die häufigste Ursache für Zwergenwuchs und betrifft etwa 1 von 27.500 Menschen. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| Q77 | Osteochondrodysplasie mit Wachstumsstörungen der Röhrenknochen und der Wirbelsäule |
| Q77.4 | Achondroplasie |
| ICD-10 online (WHO-Version 2019) | |
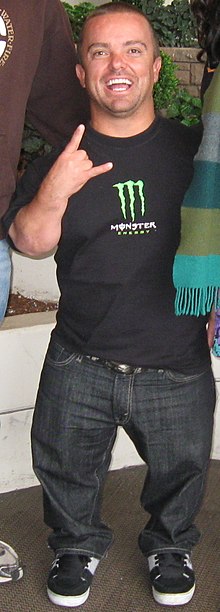
Anzeichen und Symptome
- Disproportionaler Zwergwuchs
- Verkürzung der proximalen Gliedmaßen (sogenannte rhizomelische Verkürzung)
- Kurze Finger und Zehen mit "Dreizackhänden" (kurze Hände mit Stummelfingern und einer Trennung zwischen Mittel- und Ringfinger, die auf dem Ultraschallbild des Fötus an einen Dreizack erinnert)
- Großer Kopf mit ausgeprägter Stirnwölbung
- Kleines Mittelgesicht mit einem abgeflachten Nasenrücken
- Wirbelsäulenkyphose (konvexe Krümmung) oder Lordose (konkave Krümmung)
- Varus- (O-Bein) oder Valgus-Deformitäten (Klopfknie)
- Häufige Ohrinfektionen (aufgrund von Verstopfungen der Eustachischen Röhre), Schlafapnoe (die zentral oder obstruktiv sein kann) und Hydrozephalus ⓘ
Komplikationen
Kinder
Kinder mit Achondroplasie haben oft einen verminderten Muskeltonus, was zu einer Verzögerung des Gehens und der motorischen Fähigkeiten führt. Außerdem haben die Kinder häufig krumme Beine, Skoliose, Lordose, Arthritis, Probleme mit der Beweglichkeit der Gelenke, Atemprobleme, Ohrinfektionen und engstehende Zähne. Diese Probleme können mit Operationen, Zahnspangen oder Physiotherapie behandelt werden. ⓘ
Hydrocephalus ist eine schwerwiegende Folge der Achondroplasie bei Kindern. Dieser Zustand tritt auf, wenn die Hirnflüssigkeit aufgrund der Verengung der Wirbelsäule nicht in den Schädel ein- und ausströmen kann. Diese Flüssigkeitsansammlung ist mit einem vergrößerten Kopf, Erbrechen, Lethargie, Kopfschmerzen und Reizbarkeit verbunden. Zur Behandlung dieser Erkrankung wird in der Regel eine Shunt-Operation durchgeführt, es kann aber auch eine endoskopische dritte Ventrikulostomie vorgenommen werden. ⓘ
Erwachsene
Erwachsene mit Achondroplasie haben oft Probleme mit Fettleibigkeit und Schlafapnoe. Typisch für Erwachsene ist auch ein Taubheitsgefühl oder Kribbeln in den Beinen aufgrund der Nervenkompression. ⓘ
Einige Untersuchungen haben ergeben, dass Erwachsene mit Achondroplasie auch unter psychosozialen Komplikationen leiden können, die in der Regel mit der Kleinwüchsigkeit zusammenhängen. ⓘ
Eine Schwangerschaft bei Frauen mit Achondroplasie gilt als erhöhtes Risiko. Frauen mit Achondroplasie lassen ihre Babys in der Regel per Kaiserschnitt entbinden, um Komplikationen zu vermeiden, die bei einer natürlichen Geburt auftreten könnten. Die Lebenserwartung von Menschen mit Achondroplasie liegt etwa 10 Jahre unter dem Durchschnitt. ⓘ
Ursachen
Achondroplasie wird durch eine Mutation im Fibroblasten-Wachstumsfaktor-Rezeptor 3 (FGFR3)-Gen verursacht. Dieses Gen ist hauptsächlich für die Herstellung des Proteins Fibroblasten-Wachstumsfaktor-Rezeptor 3 verantwortlich. Dieses Protein trägt zur Produktion von Kollagen und anderen strukturellen Komponenten in Geweben und Knochen bei. Wenn das FGFR3-Gen mutiert ist, stört es die Interaktion dieses Proteins mit Wachstumsfaktoren, was zu Komplikationen bei der Knochenbildung führt. Der Knorpel ist nicht in der Lage, sich vollständig zu Knochen zu entwickeln, was dazu führt, dass der Betroffene unverhältnismäßig klein ist. ⓘ
In der normalen Entwicklung hat FGFR3 eine negative regulatorische Wirkung auf das Knochenwachstum. Bei der Achondroplasie ist die mutierte Form des Rezeptors konstitutiv aktiv, was zu stark verkürzten Knochen führt. Die Wirkung ist genetisch dominant, wobei eine mutierte Kopie des FGFR3-Gens ausreicht, um Achondroplasie zu verursachen, während zwei Kopien des mutierten Gens vor oder kurz nach der Geburt unweigerlich zum Tod führen (rezessiv-tödlich) (bekannt als tödliches Allel). Dies geschieht aufgrund von Atemversagen infolge eines unterentwickelten Brustkorbs. Eine Person mit Achondroplasie hat also eine 50-prozentige Chance, den Zwergwuchs an jeden ihrer Nachkommen weiterzugeben. Menschen mit Achondroplasie werden oft von Eltern geboren, die die Krankheit aufgrund einer spontanen Mutation nicht haben. ⓘ
Achondroplasie kann durch autosomale Dominanz vererbt werden. Bei Paaren, bei denen ein Partner an Achondroplasie erkrankt ist, besteht bei jeder Schwangerschaft eine 50-prozentige Chance, dass die Krankheit an das Kind weitergegeben wird. Wenn beide Elternteile Achondroplasie haben, besteht eine 50-prozentige Chance, dass das Kind Achondroplasie hat, eine 25-prozentige Chance, dass das Kind keine Achondroplasie hat, und eine 25-prozentige Chance, dass das Kind das Gen von beiden Elternteilen erbt, was zu einer doppelten Dominanz und damit zu einer schweren oder tödlichen Knochendysplasie führt. ⓘ
Studien haben gezeigt, dass neue Genmutationen für Achondroplasie ausschließlich vom Vater vererbt werden und während der Spermatogenese auftreten; es wurde die Theorie aufgestellt, dass Spermien, die die Mutation in FGFR3 tragen, einen selektiven Vorteil gegenüber Spermien mit normalem FGFR3 haben. Die Häufigkeit von Mutationen in Spermien, die zu Achondroplasie führen, steigt mit dem Alter des Vaters und mit der Exposition gegenüber ionisierender Strahlung. Die Häufigkeit von Achondroplasie bei Kindern von Vätern, die älter als 50 Jahre sind, liegt bei 1 zu 1.875, verglichen mit 1 zu 15.000 in der Allgemeinbevölkerung. Forschungen des Urologen Harry Fisch vom Male Reproductive Center am Columbia Presbyterian Hospital aus dem Jahr 2013 deuten darauf hin, dass dieser Defekt beim Menschen ausschließlich vom Vater vererbt werden kann und mit zunehmendem Alter des Vaters immer wahrscheinlicher wird, insbesondere bei Männern, die sich nach 35 Jahren fortpflanzen. ⓘ
Es gibt zwei weitere Syndrome mit einer ähnlichen genetischen Grundlage wie die Achondroplasie: die Hypochondroplasie und die thanatophorische Dysplasie. ⓘ
Die Achondroplasie ist das Resultat einer Punktmutation im Fibroblasten-Wachstumsfaktor-Rezeptor-Gen FGFR-3 (englisch: Fibroblast Growth Factor Receptor 3). Diese Mutation führt zu einer Störung der Knorpelbildung; die Knochenwachstumszone (Epiphysenfuge) wird verfrüht verknöchert, was zur Einschränkung des Längenwachstums vor allem der Arme und Beine (Extremitäten) führt (enchondrale Ossifikation). Dadurch entsteht ein dysproportionaler Kleinwuchs, bei dem Rumpf und Kopf relativ länger als die Extremitäten sind. ⓘ
In 96 % der Fälle liegt eine G(1138)A-Punktmutation im FGFR-3-Gen vor. Dadurch kommt es zu einem Aminosäureaustausch in Position 380 des Proteins, aus Glycin wird Arginin (Gly380Arg). In 3 % der Fälle lässt sich eine G(1138)C-Punktmutation nachweisen, welche ebenfalls einen Glycin-zu-Arginin-Austausch zur Folge hat. ⓘ
Die Achondroplasie wird autosomal-dominant vererbt, das heißt, sie kann nur von selbst Betroffenen weitervererbt werden. Dies ist bei etwa 20 % der mit Achondroplasie geborenen Kindern der Fall. Bei den restlichen circa 80 % liegt eine Neumutation des FGFR3-Gens vor; der Kleinwuchs entsteht also unabhängig von der Größe der Eltern. Embryos mit homozygoter Mutation (sowohl die väterliche als auch die mütterliche Variante des Gens sind verändert) sind nicht lebensfähig und sterben kurz nach der Geburt oder bereits im Mutterleib (Thanatophore Dysplasie). ⓘ
Diagnose

Achondroplasie kann bereits vor der Geburt durch pränatalen Ultraschall festgestellt werden, obwohl die Anzeichen oft subtil sind und nicht vor der 24. Ein DNA-Test kann vor der Geburt durchgeführt werden, um die Homozygotie festzustellen, bei der zwei Kopien des mutierten Gens vererbt werden, ein tödlicher Zustand, der zu Totgeburten führt. Die postnatale Diagnose der Achondroplasie ist in der Regel unkompliziert und umfasst eine Beurteilung der körperlichen und röntgenologischen Merkmale. Zu den klinischen Merkmalen gehören Megalozephalie, kurze Gliedmaßen, vorstehende Stirn, thorakolumbale Kyphose und Hypoplasie des Mittelgesichts. Komplikationen wie Zahnfehlstellungen, Hydrocephalus und wiederholte Otitis media können beobachtet werden. Das Risiko, im Säuglingsalter zu sterben, ist aufgrund der Wahrscheinlichkeit einer Kompression des Rückenmarks mit oder ohne Obstruktion der oberen Atemwege erhöht. ⓘ
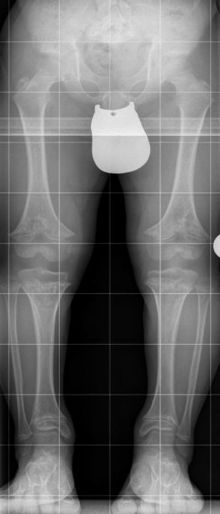
Radiologische Befunde
Eine Skelettuntersuchung ist nützlich, um die Diagnose einer Achondroplasie zu bestätigen. Der Schädel ist groß, mit einem schmalen Foramen magnum und einer relativ kleinen Schädelbasis. Die Wirbelkörper sind kurz und abgeflacht mit relativ großer Bandscheibenhöhe, und der Wirbelkanal ist kongenital verengt. Die Darmbeinflügel sind klein und quadratisch, mit einer schmalen Ischiaskerbe und einem horizontalen Acetabulumdach. Die Röhrenknochen sind kurz und dick mit metaphysärer Schröpfung und Aufweitung sowie unregelmäßigen Wachstumsplatten. Das Unterschenkelknochengewächs ist vorhanden. Die Hand ist breit mit kurzen Mittelhandknochen und Fingerknochen und einer dreizackigen Form. Die Rippen sind kurz und an den vorderen Enden schalenförmig. Wenn die röntgenologischen Merkmale nicht klassisch sind, sollte eine andere Diagnose in Betracht gezogen werden. Aufgrund der extrem deformierten Knochenstruktur sind Menschen mit Achondroplasie oft "doppelgelenkig". Die Diagnose kann mittels fetaler Ultraschalluntersuchung gestellt werden, da sich im Alter eine zunehmende Diskordanz zwischen der kurzen Oberschenkellänge und dem biparietalen Durchmesser zeigt. Die dreizackige Handkonfiguration ist zu erkennen, wenn die Finger vollständig gestreckt sind. ⓘ
Ein weiteres charakteristisches Merkmal des Syndroms ist der thorakolumbale Gibbus im Säuglingsalter. ⓘ
Die Achondroplasie führt zu einem disproportionierten Kleinwuchs. Da die unübliche Knorpelbildung insbesondere in den Röhrenknochen eine regelgerechte Entwicklung nicht möglich werden lässt, sind stark verkürzte Extremitäten bei normaler Rumpfgröße charakteristisch. Das Längenwachstum ist bei dagegen nahezu normalem Dickenwachstum gestört. ⓘ
Weitere Symptome bei betroffenen Menschen sind:
- vergleichsweise kurze Finger
- vergrößerter Abstand zwischen dem 3. und 4. Finger (Dreizackhand)
- vergleichsweise kurzer Hals und großer Kopf mit vorgewölbter Stirn und unüblicher Schädelbasis
- schmales Gesicht mit Sattelnase
- häufig Hohlkreuz (Hyperlordose) oder eine Kyphose
- angeborene Enge des Hinterhauptlochs und des gesamten Wirbelkanals (Spinalkanalstenose)
- häufig O-Beine oder X-Beine
- häufige Mittelohrentzündungen (aufgrund verengter Eustachi-Röhre)
- charakteristische Hautfalten (die Haut ist für die verkürzten Extremitäten zu weit) ⓘ
Aufgrund ihres relativ langen Rumpfes haben von Achondroplasie betroffene Menschen eine fast normale Sitzhöhe. Ausgewachsen erreichen sie eine Körpergröße zwischen 120 und 148 cm. ⓘ
Behandlung
Eine Heilung der Achondroplasie ist nicht bekannt, obwohl die Ursache für die Mutation im Wachstumsfaktorrezeptor gefunden wurde. Obwohl das menschliche Wachstumshormon von Menschen ohne Achondroplasie zur Unterstützung des Wachstums eingesetzt wird, hilft es Menschen mit Achondroplasie nicht, da hier ein anderer Hormonweg zum Tragen kommt. In der Regel werden die besten Ergebnisse im ersten und zweiten Jahr der Therapie erzielt. Nach dem zweiten Jahr der Wachstumshormontherapie nimmt das günstige Knochenwachstum ab, so dass die Therapie keine zufriedenstellende Langzeitbehandlung darstellt. Bis Dezember 2020 war die Behandlung der Achondroplasie mit menschlichem Wachstumshormon nur in Japan zugelassen. ⓘ
Ein experimentelles Medikament namens Vosoritid hat sich in Phase-3-Studien am Menschen als vielversprechend erwiesen, obwohl seine langfristigen Auswirkungen unbekannt sind. ⓘ
Durch eine Gliedmaßenverlängerung können die Beine und Arme von Menschen mit Achondroplasie verlängert werden, aber es gibt kaum einen medizinischen Konsens über diese Methode. Das Alter für die Operation kann von der frühen Kindheit bis zum Erwachsenenalter variieren. ⓘ
Die Forschung hat auch gezeigt, dass es die Ergebnisse verbessern kann, wenn Eltern von Kindern mit Achondroplasie zum Zeitpunkt der Diagnose mit Selbsthilfe- und Interessenvertretungsgruppen in Kontakt kommen. Es gibt mehrere Selbsthilfegruppen zur Unterstützung von Menschen mit Achondroplasie und ihren Familien. ⓘ
Epidemiologie
Die Achondroplasie ist eine von mehreren angeborenen Erkrankungen mit ähnlichem Erscheinungsbild, wie z. B. Osteogenesis imperfecta, multiple epiphysäre Dysplasie tarda, Achondrogenese, Osteopetrose und thanatophorische Dysplasie. Dies macht Schätzungen der Prävalenz schwierig, da sich die diagnostischen Kriterien im Laufe der Zeit ändern und subjektiv sind. In einer ausführlichen und langjährigen Studie in den Niederlanden wurde festgestellt, dass die bei der Geburt ermittelte Prävalenz nur 1,3 pro 100.000 Lebendgeburten betrug. In einer anderen Studie zur gleichen Zeit wurde eine Rate von 1 pro 10.000 festgestellt. In einer Übersichtsarbeit und Metaanalyse aus dem Jahr 2020 wurde eine weltweite Prävalenz von 4,6 pro 100 000 geschätzt. ⓘ
Forschung
Seit 2019 gibt es vorläufige Hinweise darauf, dass das experimentelle Peptidpräparat Vosoritid die Wachstumsgeschwindigkeit bei Menschen mit Achondroplasie erhöht. Das Medikament hemmt die Aktivität von FGFR3. ⓘ
Tiere
Aufgrund ihres überproportionalen Zwergwuchses werden einige Hunderassen traditionell als "achondroplastisch" eingestuft. Dies gilt für die Rassen Dackel, Basset Hound, Corgi und Bulldogge. Daten aus Ganzgenom-Assoziationsstudien bei kurzgliedrigen Hunden zeigen eine starke Assoziation dieses Merkmals mit einem Retro-Gen, das für den Fibroblasten-Wachstumsfaktor 4 (FGF4) kodiert. Daher scheint es unwahrscheinlich, dass Hunde und Menschen aus den gleichen Gründen achondroplastisch sind. Allerdings haben histologische Untersuchungen bei einigen achondroplastischen Hunderassen veränderte Zellmuster im Knorpel gezeigt, die denen beim Menschen mit Achondroplasie sehr ähnlich sind. ⓘ
Eine ähnliche Form der Achondroplasie wurde bei einem Wurf von Ferkeln einer phänotypisch normalen dänischen Sau festgestellt. Der Zwergwuchs wurde bei den Nachkommen aus diesem Wurf dominant vererbt. Die Ferkel wurden phänotypisch normal geboren, zeigten aber mit zunehmender Reife immer mehr Symptome. Es handelte sich um eine Mutation des Proteins Kollagen, Typ X, Alpha 1, das durch das COL10A1-Gen kodiert wird. Beim Menschen wurde eine ähnliche Mutation (G595E) mit der Schmidschen metaphysären Chondrodysplasie (SMCD) in Verbindung gebracht, einer relativ leichten Skelettstörung, die auch mit Zwergwuchs einhergeht. ⓘ
Das inzwischen ausgestorbene Ancon-Schaf wurde vom Menschen durch die selektive Zucht von Hausschafen mit Achondroplasie geschaffen. Der durchschnittlich große Rumpf in Kombination mit den relativ kleinen Beinen, die durch die Achondroplasie hervorgerufen werden, wurde geschätzt, weil die betroffenen Schafe dadurch weniger ausreißen konnten, ohne dass die Menge an Wolle oder Fleisch, die jedes Schaf produzierte, beeinträchtigt wurde. ⓘ
Bezeichnung
Im Jahre 1878 wurde der Begriff Achondrodysplasie durch den französischen Arzt Joseph Marie Jules Parrot geprägt.
Die Bezeichnung Achondroplasie (wörtlich: fehlende Knorpelbildung) ist rein historisch bedingt und erklärt weder die Ursache noch die Erscheinungen dieser Störung. ⓘ
Weitere Bezeichnungen, die jedoch veraltet und nicht mehr gebräuchlich sind, sind Chondrodystrophie, Chondrodystrophia fetalis, Parrot-Syndrom oder Kaufmann-Syndrom (unter Referenz auf den deutschen Pathologen Eduard Kaufmann). ⓘ
Häufigkeit
Achondroplasie ist die häufigste Form des genetisch bedingten Kleinwuchses. Sie tritt mit einer Inzidenz von 1 auf 20.000 Geburten auf. Damit gehört sie, wie alle Arten von Kleinwuchs, zu den Seltenen Krankheiten. ⓘ
Diagnose und Differentialdiagnose
Klinisch zur Abgrenzung gegenüber Hypochondroplasie und Pseudoachondroplasie sind wichtige Aspekte der große Kopf (Megalenzephalie) mit Balkonstirn und flacher Nase, Prognathie. ⓘ
Radiologische Kriterien sind:
- Verbreiterte Metaphysen bei normalen Epiphysen
- Überproportional verkürzter Humerus und Femur
- Schmales Kreuzbein, breite Beckenschaufel mit horizontalem und breitem Pfannendach
- Verschmälerter Abstand der Bogenwurzeln nach kaudal zunehmend, verkürzte Pedikel mit eventueller Spinalstenose, keilförmige Deformierung der Wirbelkörper
- Brachydaktylie mit Dreizackhand ⓘ
Therapie
Die Therapie orientiert sich an den Symptomen. Bei funktionellen Behinderungen durch die Beinachsen- und Wirbelsäulenstellung sowie bei beginnenden Lähmungen können dekomprimierende und stabilisierende Eingriffe an der Wirbelsäule vorgenommen werden. ⓘ
Derzeit befinden sich zwei Wirkstoffe in klinischen Studien zur Behandlung von Achondroplasie. Die Firma BioMarin Pharmaceutical Inc. entwickelt ein CNP-Analogon (benannt Vosoritid), welches in die Wirkkaskade des FGFR3-Rezeptors eingreift und eine erhöhte Teilungsrate der Knorpelzellen zur Folge hat. Die Firma BioClin Therapeutics, Inc. entwickelt einen FGFR3-Antikörper sowohl zur Behandlung von Blasenkrebs als auch zur Anwendung bei Achondroplasie. ⓘ