Wollschweber
| Wollschweber ⓘ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Großer Wollschweber (Bombylius major) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Bombyliidae | ||||||||||||
| Latreille, 1802 | ||||||||||||
| Unterfamilien | ||||||||||||
|
Die Wollschweber (Bombyliidae), auch Trauerschweber, Hummelschweber oder seltener Trauerfliege, sind eine Familie der Zweiflügler (Diptera) und werden den Fliegen (Brachycera) zugeordnet. Weltweit sind etwa 6000 Arten dieser Gruppe bekannt, davon 34 in Deutschland. ⓘ
Die Bombyliidae sind eine Familie von Fliegen. Ihr allgemeiner Name ist Bienenfliege. Die erwachsenen Tiere ernähren sich im Allgemeinen von Nektar und Pollen, einige sind wichtige Bestäuber. Die Larven sind im Allgemeinen Parasitoide anderer Insekten. ⓘ
Übersicht
Die Bombyliidae sind eine große Familie von Fliegen, die Hunderte von Gattungen umfasst, aber die Lebenszyklen der meisten Arten sind nur schlecht oder gar nicht bekannt. Ihre Größe reicht von sehr klein (2 mm Länge) bis sehr groß für Fliegen (Flügelspannweite von etwa 40 mm). Im Ruhezustand halten viele Arten ihre Flügel in einem charakteristischen, nach hinten gebogenen Winkel. Die erwachsenen Tiere ernähren sich im Allgemeinen von Nektar und Pollen, wobei einige von ihnen wichtige Bestäuber sind, oft mit spektakulär langen Rüsseln, die an Pflanzen wie Lapeirousia-Arten mit sehr langen, engen Blütenröhren angepasst sind. Im Gegensatz zu Schmetterlingen halten die Bienenfliegen ihren Rüssel gerade und können ihn nicht zurückziehen. In Teilen von East Anglia werden sie wegen ihrer hauerartigen Fortsätze von den Einheimischen als Beewhals bezeichnet. Viele Bombyliidae ähneln oberflächlich betrachtet den Bienen, weshalb der gebräuchliche Name für ein Mitglied der Familie Bienenfliege lautet. Möglicherweise handelt es sich bei dieser Ähnlichkeit um Bates'sche Mimikry, die den erwachsenen Tieren einen gewissen Schutz vor Fressfeinden bietet. ⓘ
Die Larvenstadien sind Räuber oder Parasitoide der Eier und Larven anderer Insekten. Die erwachsenen Weibchen legen ihre Eier in der Regel in der Nähe möglicher Wirte ab, häufig in den Höhlen von Käfern oder Wespen/Solitärbienen. Obwohl Insektenparasitoide in der Regel ziemlich wirtsspezifisch sind, oft sogar sehr wirtsspezifisch, sind einige Bombyliidae opportunistisch und befallen eine Vielzahl von Wirten. ⓘ
Zu den Bombyliidae gehören mindestens 4 500 beschriebene Arten, und sicherlich gibt es noch Tausende weiterer Arten, die beschrieben werden müssen. Die meisten Arten treten jedoch nicht oft in großer Zahl auf, und im Vergleich zu anderen großen Bestäubergruppen ist es viel unwahrscheinlicher, dass sie blühende Pflanzen in städtischen Parks oder Vorstadtgärten besuchen. Infolgedessen ist diese Familie im Verhältnis zu ihrem Artenreichtum wohl eine der am schlechtesten bekannten Insektenfamilien. Die Familie verfügt über einen lückenhaften Fossilnachweis, wobei Arten nur von einer Handvoll Lokalitäten bekannt sind. Die ältesten bekannten Arten stammen aus dem birmanischen Bernstein der mittleren Kreidezeit, der etwa 99 Millionen Jahre alt ist. ⓘ

Morphologie
Erwachsene
Obwohl die Morphologie der Bienenfliegen im Detail variiert, zeichnen sich die erwachsenen Tiere der meisten Bienenfliegen durch einige morphologische Details aus, die das Erkennen erleichtern. Die Körpermaße variieren je nach Art zwischen 1,0 mm und 2,5 cm. Die Form ist oft kompakt und das Integument ist in der Regel mit dichter und reichlicher Behaarung bedeckt. Die Färbung ist in der Regel unauffällig und es überwiegen Farben wie Braun, Schwarzgrau und helle Farben wie Weiß oder Gelb. Viele Arten sind Nachahmer der Hymenoptera Apoidea. Bei anderen Arten treten Flecken mit abgeflachten Haaren auf, die wie silbrige, vergoldete oder kupferfarbene Spiegel wirken können; diese dienen vielleicht als visuelle Signale bei der Erkennung von Artgenossen/Rivalen oder imitieren vielleicht reflektierende Oberflächenpartikel auf nackten Böden mit hohem Gehalt an Materialien wie Quarz, Glimmer oder Pyrit. ⓘ

Der Kopf ist rund, mit konvexem Gesicht, bei den Männchen oft holoptisch. Die Fühler sind vom Typ aristatisch und bestehen aus drei bis sechs Segmenten, wobei das dritte Segment größer ist als die anderen; der Griffel fehlt (Antenne mit drei Segmenten) oder besteht aus einem bis drei Geißeln (Antenne mit vier bis sechs Segmenten). Die Mundwerkzeuge sind zum Saugen modifiziert und für die Ernährung an Blüten angepasst. Die Länge variiert beträchtlich: So haben die Anthracinae kurze Mundwerkzeuge, wobei die Lippe bei den Bombyliinae in einer großen fleischigen Lippe endet; bei den Phthiriinae ist die Röhre wesentlich länger und bei den Bombyliinae mehr als viermal so lang wie der Kopf. ⓘ
Die Beine sind lang und dünn, wobei die Vorderbeine manchmal kleiner und schlanker sind als die mittleren und hinteren Beine. Typischerweise sind sie mit Borsten an der Spitze der Tibiae versehen, ohne Empodien und manchmal auch ohne Pulvilli. Die Flügel sind durchsichtig, oft hyalin oder gleichmäßig gefärbt oder mit Bändern versehen. Die Alula sind gut entwickelt, und in Ruhestellung sind die Flügel offen und waagerecht in einer V-Form gehalten, so dass die Seiten des Hinterleibs sichtbar werden. ⓘ
Der Hinterleib ist im Allgemeinen kurz und breit, subglobusförmig, zylindrisch oder kegelförmig und besteht aus sechs bis acht scheinbaren Uriten. Die übrigen Urite sind Teil der Struktur der äußeren Genitalien. Der Hinterleib der Weibchen endet oft mit stacheligen Fortsätzen, die der Eiablage dienen. Bei den Anthracinae und Bombyliinae befindet sich im achten Urit ein Divertikel, in dem die Eier vor der Ablage mit Sand vermischt werden. ⓘ

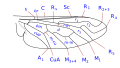
Die Flügelnervatur ist zwar innerhalb der Familie variabel, weist aber einige gemeinsame Merkmale auf, die sich im Wesentlichen in der besonderen Morphologie der Verzweigungen des radialen Sektors und der Verringerung der Gabelung der Media zusammenfassen lassen. Die Costa ist über den gesamten Rand ausgebreitet, und die Subcosta ist lang und endet oft in der distalen Hälfte des Rippenrandes. Der Radius ist fast immer in vier Äste gegliedert, wobei die Äste R 2 und R 3 miteinander verschmelzen, und zeichnet sich durch die Gewundenheit der Endabschnitte der Äste des radialen Sektors aus. Die Aderung ist im Vergleich zu anderen Asiloidea und im Allgemeinen zu anderen niederen Brachycera deutlich vereinfacht. M 1 ist immer vorhanden und konvergiert am Rand oder manchmal an R 5. M 2 ist vorhanden und erreicht den Rand oder fehlt. M 3 ist immer abwesend und mit M 4 verschmolzen. Die Diskalzelle ist normalerweise vorhanden. Der Ast M 3 +4 wird am distalen hinteren Scheitel von der Diskalzelle getrennt, so dass die mittlere Kubitalader direkt an den hinteren Rand der Diskalzelle anschließt. Die Cubital- und Analvenen sind vollständig und enden getrennt am Rand oder konvergieren über eine kurze Strecke. ⓘ
Flügeläderung Typ 3 Usiinae ⓘ
Schwebfliegen der Familie Syrphidae ahmen oft auch Hautflügler nach, und einige Syrphidae-Arten sind auf den ersten Blick nur schwer von Bombyliidae zu unterscheiden, vor allem bei Bienenfliegenarten, denen ein langer Rüssel oder lange, dünne Beine fehlen. Solche Bombyliiden lassen sich im Freiland dennoch anhand anatomischer Merkmale unterscheiden: - Sie haben in der Regel ein gleichmäßig gewölbtes oder schräges Gesicht (Schwebfliegen haben oft markante Ausbuchtungen der Gesichtshaut und/oder schnabel- bis knopfartige Gesichtsvorsprünge). ⓘ
- Die Flügel haben keine "falsche Hinterkante" und weisen oft große dunkle Bereiche mit scharfen Grenzen oder komplexen Fleckenmustern auf (die Flügel der Schwebfliegen sind oft durchsichtig oder haben sanfte Farbabstufungen, und ihre Adern gehen nach hinten in eine "falsche Kante" über, anstatt die eigentliche Hinterkante des Flügels zu erreichen). ⓘ
- Der Hinterleib und der Thorax weisen fast nie große glänzende Bereiche auf, die durch freiliegende Kutikula gebildet werden (Schwebfliegen haben oft glänzende kutikuläre Körperoberflächen). ⓘ
Larve
Bei den Larven der meisten Bienenfliegen gibt es zwei Typen. Die Larven des ersten Typs sind länglich und zylindrisch und haben ein metapneustisches oder amphipneustisches Tracheensystem, das mit einem Paar Bauchspiralen und möglicherweise einem Paar Brustspiralen ausgestattet ist. Die Tiere des zweiten Typs sind stumpf und ezephalisch und haben ein Paar Spirakeln im Bauch. ⓘ
Biologie

Erwachsene Vögel bevorzugen sonnige Bedingungen und trockene, oft sandige oder felsige Gebiete. Sie haben kräftige Flügel und sind typischerweise im Flug über Blüten oder ruhend auf dem nackten, der Sonne ausgesetzten Boden anzutreffen (siehe Video). Sie tragen wesentlich zur Fremdbestäubung von Pflanzen bei und sind die Hauptbestäuber einiger Pflanzenarten in Wüstengebieten. Im Gegensatz zu den meisten glykophagen Zweiflüglern ernähren sich die Bienenfliegen von Pollen (mit dem sie ihren Proteinbedarf decken). Ein ähnliches trophisches Verhalten ist bei den Schwebfliegen zu beobachten, einer weiteren wichtigen Familie von Dipterenbestäubern. ⓘ
Wie die Schwebfliegen sind auch die Bienenfliegen zu plötzlicher Beschleunigung oder Verlangsamung, zu nahezu schwunglosen schnellen Richtungswechseln, zu einer ausgezeichneten Positionskontrolle im Schwebeflug sowie zu einer charakteristisch vorsichtigen Annäherung an einen möglichen Futter- oder Landeplatz fähig. Bombyliiden erkennt man oft an ihrer gedrungenen Gestalt, an ihrem Schwebeverhalten und an der besonderen Länge ihrer Mundwerkzeuge und/oder Beine, wenn sie sich nach vorne in die Blüten beugen. Im Gegensatz zu den Schwebfliegen, die sich wie Bienen und andere bestäubende Insekten auf der Blüte niederlassen, fressen die Bienenfliegenarten, die einen langen Rüssel haben, im Allgemeinen, während sie weiter in der Luft schweben, ähnlich wie die Sphingidae, oder während sie die Blüte mit ihren Vorderbeinen berühren, um ihre Position zu stabilisieren - ohne vollständig zu landen oder die Schwingung der Flügel einzustellen. ⓘ
Arten mit kürzeren Rüsseln landen und laufen jedoch auf Blütenköpfen und sind im Feld viel schwieriger von Schwebfliegen zu unterscheiden. Wie bereits erwähnt, halten sich viele Bienenfliegenarten regelmäßig auf dem Boden oder in Bodennähe auf, während Schwebfliegen dies nur selten tun. Es kann daher sehr aufschlussreich sein, fütternde Individuen zu beobachten und festzustellen, ob sie sich nach einigen Minuten auf den Boden zurückziehen. Eine genaue Beobachtung ist bei fütternden Individuen oft einfacher als bei Fliegen am Boden, da letztere beim ersten Anblick von sich bewegenden Silhouetten oder sich nähernden Schatten besonders schnell die Flucht ergreifen. ⓘ
Das Paarungsverhalten ist nur bei einer Handvoll Arten beobachtet worden. Es kann von recht allgemeinem Schwärmen oder unaufgefordertem Abfangen in der Luft, wie es bei vielen Diptera üblich ist, bis hin zu Balzverhalten reichen, das ein kontextspezifisches Flugmuster und die Flügelschlagfrequenz des Männchens mit oder ohne wiederholten Rüsselkontakt zwischen Männchen und Weibchen beinhaltet. Die Männchen suchen häufig kleinere oder größere Lichtungen am Boden auf, vermutlich in der Nähe von blühenden Pflanzen oder Nistplätzen, die für die Weibchen wahrscheinlich attraktiv sind. Sie können nach jeder Fütterung oder nach der Verfolgung anderer Insekten, die über sie hinwegfliegen, zu der von ihnen gewählten Sitzstange oder dem Fleck zurückkehren, oder sie können stattdessen ihr gewähltes Gebiet überwachen, während sie einen oder mehrere Meter über dem kahlen Fleck schweben. ⓘ
Gravide Weibchen suchen Nistplätze von Wirten auf und können viele Minuten damit verbringen, z. B. die Eingänge kleinerer Höhlen im Boden zu inspizieren. Bei einigen Arten besteht dieses Verhalten aus dem Schweben und wiederholten sekundenschnellen Berührungen des Bodens mit den Vorderbeinen in der Nähe des Eingangs der Höhle, vermutlich um biochemische Anhaltspunkte über den Erbauer der Höhle zu finden, wie z. B. die Identität, die Häufigkeit des Besuchs usw. Wenn eine Höhle untersucht wird, kann die Bienenfliege landen, ihren Hinterleib in den Boden stecken und ein oder mehrere Eier am Rand oder in unmittelbarer Nähe der Höhle ablegen. In neun Unterfamilien, darunter die häufiger zu beobachtenden Bombyliinae und Anthracinae, landen die Weibchen bei der Inspektion von Wirtshöhlen oft überhaupt nicht und setzen ihre Eier durch schnelle Bewegungen des Hinterleibs in der Luft ab, während sie über dem Höhleneingang schweben. ⓘ
Dieses bemerkenswerte Verhalten hat diesen Arten den umgangssprachlichen Namen "Bomberfliegen" eingebracht. Es ist in Roy Kleukers Online-Videoclip auf YouTube zu sehen. Fliegenweibchen mit dieser bemerkenswerten Eiablagestrategie verfügen typischerweise über eine ventrale Speicherstruktur, eine so genannte Sandkammer am hinteren Ende des Hinterleibs, die mit Sandkörnern gefüllt ist, die sie vor der Eiablage gesammelt haben. Es wird angenommen, dass diese Sandkörner das Ziel des Weibchens und die Überlebenschancen des Eies verbessern, indem sie das Gewicht erhöhen, die Austrocknung des Eies verlangsamen, biochemische Signale maskieren, die ein Wirtsverhalten wie Nestreinigung oder -verlassen auslösen könnten - oder eine Kombination aus allen drei Möglichkeiten. ⓘ

Trotz der großen Anzahl von Arten dieser Familie ist die Biologie der Jungtiere der meisten Arten nur wenig bekannt. Die postembryonale Entwicklung ist vom Typ hypermetamorph, mit parasitoiden oder hyperparasitoiden Larven. Eine Ausnahme bilden die Larven der Heterotropinae, deren Biologie der der anderen Asiloidea ähnelt, mit räuberischen Larven, die keine Hypermetamorphose durchlaufen. Die Wirte der Bienenfliegen gehören zu verschiedenen Insektenordnungen, die meisten jedoch zu den holometabolen Ordnungen. Dazu gehören Hymenoptera, insbesondere die Überfamilien der Vespoidea und Apoidea, Käfer, andere Fliegen und Motten. Die Larven einiger Arten wie Villa sp. ernähren sich von Eizellen von Orthoptera. Die Larven von Bombylius major parasitieren an Solitärbienen einschließlich Andrena. Anthrax anale ist ein Parasit von Tigerkäferlarven, und A. trifasciata ist ein Parasit der Mauerbiene. Mehrere afrikanische Arten von Villa und Thyridanthrax parasitieren an den Puppen von Tsetsefliegen. Villa morio ist ein Parasit der nützlichen Schlupfwespenart Banchus femoralis. Die Larven von Dipalta sind Parasiten von Ameisenlöwen. ⓘ
Das Verhalten der bekannten Formen ähnelt dem der Larven der Nemestrinoidea: Die Larve des ersten Stadiums ist ein Planidium, während die anderen Stadien einen parasitären Habitus haben. Die Eier werden in der Regel in einen zukünftigen Wirt oder in das Nest gelegt, in dem sich der Wirt entwickelt. Das Planidium dringt in das Nest ein und verändert sich, bevor es zu fressen beginnt. ⓘ

Die Überwinterung erfolgt meist als Larve, vor dem Verpuppen bilden diese nochmals ein bewegliches Vornymphenstadium aus. Die Puppe ist ebenfalls beweglich und besitzt am Vorderende Dornen und am Hinterleib Borsten, mit denen das Herausarbeiten aus Bodennestern der Wirte erleichtert wird. Die Imaginalhäutung erfolgt erst im Freien. ⓘ
Im Bild rechts ist die Parasitierung eines Nistbrettes für Mauerbienen zu erkennen. ⓘ
Zoogeographie
Die Familie ist weltweit verbreitet (Paläarktisches Reich, Nearktisches Reich, Afrotropisches Reich, Neotropisches Reich, Australasisches Reich, Ozeanisches Reich, Indomalayisches Reich), weist aber die größte Artenvielfalt in tropischen und subtropischen Trockengebieten auf. In Europa gibt es 335 Arten, die sich auf 53 Gattungen verteilen. ⓘ
Artenlisten

Systematik


Die Systematik der Bienenfliegen ist die unsicherste von allen Familien der niederen Brachycera. Willi Hennig (1973) ordnete die Bienenfliegen aufgrund von Analogien im Verhalten der Larven in die Überfamilie der Nemestrinoidea ein und stellte die Überfamilie in die Tabanomorpha innerhalb der Unterordnung Homoeodactyla Boris Rohdendorf (1974) behandelte die Familie in einer eigenen Überfamilie (Bombyliidea) und verband sie mit der Überfamilie der Asilidea. Gegenwärtig werden die Bienenfliegen entweder innerhalb der Überfamilie Asiloidea sensu Rohdendorf (Asilidea) positioniert oder mit den von Rohdendorf abgetrennten Familien in die Überfamilie der Asiloidea aufgenommen. ⓘ
| Asiloidea |
| |||||||||||||||
Die innere Systematik der Bienenfliegen ist unsicher. In der Vergangenheit wurden 31 Unterfamilien genau definiert, aber man geht davon aus, dass die Familie polyphyletisch ist (sensu lato). In den 1980er und 90er Jahren wurde die Familie mehrfach überarbeitet: Webb (1981) stellte die Gattung Hilarimorpha schließlich in ihre eigene Familie (Hilarimorphidae). Zaitzev (1991) stellte die Gattung Mythicomyia und mehrere andere kleinere Gattungen in die Familie Mythicomyiidae, Yeates (1992, 1994) stellte die gesamte Unterfamilie Proratinae, mit Ausnahme von Apystomyia, in die Familie Scenopinidae und anschließend die Gattung Apystomyia in die Familie Hilarimorphidae. Nagatomi & Liu (1994) stellten Apystomyia in eine eigene Familie (Apystomyiidae). Nach diesen Revisionen weisen die Bienenfliegen sensu stricto eine größere morphologische Homogenität auf, aber die Monophylie der Familie bleibt weiterhin zweifelhaft. Die phylogenetische Analyse der CAD- und 28S rDNA-Gensequenzen unterstützt die Monophylie von nur acht der fünfzehn in die Studie einbezogenen Unterfamilien, wobei sich die Bombyliinae als stark polyphyletische Gruppe herausstellen. ⓘ
Insgesamt umfasst die Familie etwa 4700 beschriebene Arten, die sich auf 270 Gattungen verteilen. Die interne Gliederung variiert je nach Quelle, je nachdem, welchen Rahmen die Autoren den Stämmen und Unterfamilien zuschreiben. Zur Unterteilung der Familie wird häufig dieses Schema verwendet:
- Anthracinae
- Anthracini
- Aphoebantini
- Exoprosopini
- Prorostomatini
- Villini
- Xeramoebini
- Antoniinae
- Bombyliinae
- Acrophthalmydini
- Bombyliini
- Conophorini
- Crocidiinae
- Cythereinae
- Ecliminae
- Heterotropinae
- Lomatiinae
- Lomatiini
- Peringueyimyiini
- Mariobezziinae
- Oligodraninae
- Oniromyiinae
- Phthiriinae
- Phthiriini
- Poecilognathini
- Tomomyzinae
- Toxophorinae
- Gerontini
- Systropodini
- Toxophorini
- Usiinae
- Apolysini
- Usiini
- Xenoprosopinae ⓘ
Gattung


- Acanthogeron Bezzi, 1925
- Acreophthiria Evenhuis, 1986
- Acreotrichus Macquart, 1840
- Acrophthalmyda Bigot, 1858
- Adelidea Macquart, 1840
- Adelogenys Hesse, 1938
- Aldrichia Coquillett, 1894
- Alepidophora Cockerell, 1909
- Aleucosia Edwards, 1934
- Alomatia Cockerell, 1914
- Amiktiten Hennig, 1966
- Amictus Wiedemann, 1817
- Amphicosmus Coquillett, 1891
- Anastoechus Osten Sacken, 1877
- Anisotamia Macquart, 1840
- Milzbrand Scopoli, 1763
- Antonia Loew, 1856
- Antoniaustralia Becker, 1913
- Apatomyza Wiedemann, 1820
- Aphoebantus Löw, 1872
- Apolyse Löw, 1860
- Astrophanes Osten Sacken, 1877
- Atrichochira Hesse, 1956
- Australiphthiria Evenhuis, 1986
- Australoechus Greathead, 1995
- Balaana Lambkin & Yeates, 2003
- Beckerellus Greathead, 1995
- Bombomyia Großkopf, 1995
- Bombylella Großkopf, 1995
- Bombylisoma Róndani, 1856
- Bombylius Linnaeus, 1758, 1758
- Brachyanax Evenhuis, 1981
- Brachydemie Hull, 1973
- Bromoglycis Hull, 1971
- Brychosoma Hull, 1973
- Bryodemina Hull, 1973
- Cacoplox Hull, 1970
- Caecanthrax Großkopf, 1981
- Callostoma Macquart, 1840
- Callynthrophora Schiner, 1868
- Canariellum Strand, 1928
- Chalcochiton Löw, 1844
- Choristus Walker, 1852
- Chrysanthrax Osten Sacken, 1886
- Colossoptera Hull, 1973
- Comptosia Macquart, 1840
- Conomyza Hesse, 1956
- Cononedys Hermann, 1907
- Conophorina Becker, 1920
- Conophorus Meigen, 1803
- Corsomyza Wiedemann, 1820
- Coryprosopa Hesse, 1956
- Crocidium Löw, 1860
- Cryomyia Hull, 1973
- Cyananthrax-Maler, 1959
- Cyllenia Latreille, 1802
- Cyrtomyia Bigot, 1892
- Cytherea Fabricius, 1794
- Cyx Evenhuis, 1993
- Dasypalpus Macquart, 1840
- Desmatomyia Williston, 1895
- Desmatoneura Williston, 1895
- Deusopora Hull, 1971
- Diatropomma Bowden, 1962
- Dicranoclista Bezzi, 1924
- Diochanthrax-Saal, 1975
- Dipalta Osten Sacken, 1877
- Diplocampta Schiner, 1868
- Dischistus Löw, 1855
- Docidomyia Weiß, 1916
- Doddosia Edwards, 1934
- Dolichomyia Wiedemann, 1830
- Doliogethys Hesse, 1938
- Eclimus Löw, 1844
- Edmundiella Becker, 1915
- Efflatounia Bezzi, 1925
- Enica Macquart, 1834
- Epacmoides Hesse, 1956
- Epacmus Osten Sacken, 1886
- Eremyia Greathead, 1996\
- Eristalopsis Evenhuis, 1985
- Eucessia Coquillett, 1886
- Euchariomyia Bigot, 1888
- Euprepina Hull, 1971
- Eurycarenus Löw, 1860
- Euryphthiria Evenhuis, 1986
- Eusurbus Roberts, 1929
- Exechohypopion Evenhuis, 1991
- Exepacmus Coquillett, 1894
- Exhyalanthrax Becker, 1916
- Exoprosopa Macquart, 1840
- Geminaria Coquillett, 1894
- Geron Meigen, 1820
- Glaesamictus Hennig, 1966
- Gnumyia Bezzi, 1921
- Gonarthrus Bezzi, 1921
- Gyrocraspedum Becker, 1913
- Hallidia Hull, 1970
- Hemipenthes Löw, 1869
- Heteralonia Róndani, 1863
- Heterostylum Macquart, 1848
- Heterotropus Loew, 1873
- Hyperalonia Róndani, 1863
- Hyperusia Bezzi, 1921
- Inyo Hall & Evenhuis, 1987
- Isocnemus Bezzi, 1924
- Kapu Lambkin & Yeates, 2003
- Karakumia Paramonow, 1927
- Laminanthrax Großkopf, 1967
- Larrpana Lambkin & Yeates, 2003
- Laurella Hull, 1971
- Legnotomyia Bezzi, 1902
- Lepidanthrax Osten Sacken, 1886
- Lepidochlanus Hesse, 1938
- Lepidophora Westwood, 1835
- Ligyra Newman, 1841
- Litorhina Bowden, 1975
- Lomatia Meigen, 1822
- Lordotus Loew, 1863
- Macrocondyla Róndani, 1863
- Mallophthiria Edwards, 1930
- Mancia Coquillett, 1886
- Mandella Evenhuis, 1983
- Mariobezzia Becker, 1913
- Marleyimyia Hesse, 1956
- Marmosoma Weiß, 1916
- Megapalpus Macquart, 1834
- Megaphthiria Halle, 1976
- Melanderella Cockerell, 1909
- Meomyia Evenhuis, 1983
- Metacosmus Coquillett, 1891
- Micomitra Bowden, 1964
- Munjua Lambkin & Yeates, 2003
- Muscatheres Evenhuis, 1986
- Muwarna Lambkin & Yeates, 2003
- Myonema Roberts, 1929
- Neacreotrichus Cockerell, 1917
- Nectaropota Philippi, 1865
- Neobombylodes Evenhuis, 1978
- Neodiplocampta Curran, 1934
- Neodischistus Maler, 1933
- Neosardus Roberts, 1929
- Nomalonia Róndani, 1863
- Nothoschistus Bowden, 1985
- Notolomatia Großkopf, 1998
- Oestranthrax Bezzi, 1921
- Oestrimyza Hull, 1973
- Ogcodocera Macquart, 1840
- Oligodranes Löw, 1844
- Oncodosia Edwards, 1937
- Oniromyia Bezzi, 1921
- Othniomyia Hesse, 1938
- Pachyanthrax François, 1964
- Pachysystropus Cockerell, 1909
- Palaeoamictus Meunier, 1916
- Paläogeron Meunier, 1915
- Palintonus François, 1964
- Palirika Lambkin & Yeates, 2003
- Pantarbes Osten Sacken, 1877
- Pantostomus Bezzi, 1921
- Paracorsomyza Hennig, 1966
- Paradiplocampta-Halle, 1975
- Parachistus Greathead, 1980
- Paracosmus Osten Sacken, 1877
- Parageron Paramonow, 1929
- Paramonovius Li & Yeates, 2018
- Paranthrax Bigot, 1876
- Parasysteochus Hall, 1976
- Paratoxophora Engel, 1936
- Paravilla Maler, 1933
- Parisus Walker, 1852
- Perengueyimyia Bigot, 1886
- Petrorossia Bezzi, 1908
- Phthiria Meigen, 1803
- Pilosia Hull, 1973
- Pipunculopsis Bezzi, 1925
- Platamomyia Brèthes, 1925
- Plesiocera Macquart, 1840
- Poecilanthrax Osten Sacken, 1886
- Poecilognathus Jaennicke, 1867
- Praecytherea Théobald, 1937
- Prorachthes Loew, 1868
- Prorostoma Hesse, 1956
- Prothaplocnemis Bezzi, 1925
- Pseudopenthes Roberts, 1928
- Pteraulacodes Hesse, 1956
- Pteraulax Bezzi, 1921
- Pterobates Bezzi, 1921
- Pusilla Paramonow, 1954
- Pygocona Hull, 1973
- Reliktiphthirie Evenhuis, 1986
- Rhynchanthrax-Maler, 1933
- Satyramoeba Sack, 1909
- Semiramis Becker, 1913
- Semistoechus-Saal, 1976
- Sericosoma Macquart, 1850
- Sericothrix Hall, 1976
- Sericusia Edwards, 1937
- Sinaia Becker, 1916
- Sisyromyia Weiß, 1916
- Sisyrophanus Karsch, 1886
- Sosiomyia Bezzi, 1921
- Sparnopolius Löw, 1855
- Sphenoidoptera Williston, 1901
- Spogostylum Macquart, 1840
- Staurostichus Hull, 1973
- Stomylomyia Bigot, 1888
- Stonyx Osten Sacken, 1886
- Synthesia Bezzi, 1921
- Systoechus Löw, 1855
- Systropus Wiedemann, 1820
- Thevenetimyia Bigot, 1875
- Thraxan Yeates & Lambkin, 1998
- Thyridanthrax Osten Sacken, 1886
- Tillyardomyia Tonnoir, 1927
- Timiomyia Evenhuis, 1978
- Tithonomyia Evenhuis, 1984
- Tmemophlebia Evenhuis, 1986
- Tomomyza Wiedemann, 1820
- Tovlinius Zaitzev, 1979
- Toxophora Meigen, 1803
- Triplasius Löw, 1855
- Triploechus Edwards, 1937
- Turkmeniella Paramonov, 1940
- Usia Latreille, 1802
- Veribubo Evenhuis, 1978
- Verrallites Cockerell, 1913
- Villa Lioy, 1864
- Villoestrus Paramonow, 1931
- Walkeromyia Paramonow, 1934
- Wurda Lambkin & Yeates, 2003
- Xenoprosopa Hesse, 1956
- Xenox Evenhuis, 1984
- Xerachistus Greathead, 1995
- Xeramoeba Hesse, 1956
- Ylasoia Speiser, 1920
- Zaclava Hull, 1973
- Zinnomyia Hesse, 1955
- Zyxmyia Bowden, 1960 ⓘ
Galerie
Lepidophora auf Bidens laevis ⓘ
Großer Wollschweber an einer Schleifenblume ⓘ
Merkmale
Die Wollschweber sind meist mittelgroße Fliegen, die auffällig und hummelartig behaart sind. Einige der Arten sind dunkel gefärbt und haben schwarze, durchscheinende Flügel. Dies führte zu dem alternativen deutschen Namen Trauerschweber. Bei einigen Vertretern der Gruppe ist der Rüssel auffällig kurz oder vollständig verkümmert, andere besitzen einen sehr langen Rüssel, der zum Aufsaugen von Nektar verwendet wird. Bei der Art Bombylius medius ist der Rüssel fast so lang wie der Körper. ⓘ
Fossile Belege
Der älteste fossile Beleg dieser Familie resultiert aus kreidezeitlichem Sibirischem Bernstein. Die meisten Arten sind jedoch aus tertiären Lagerstätten, insbesondere dem eozänen Baltischen Bernstein, beschrieben. Einige Arten sind darüber hinaus aus dem etwas jüngeren Dominikanischen Bernstein bekannt. ⓘ
Arten (Auswahl)
- Gefleckter Wollschweber (Bombylius discolor)
- Großer Wollschweber (Bombylius major)
- Bombylius medius
- Hottentottenfliege (Villa hottentotta)
- Exoprosopa jacchus
- Anthrax anthrax
- Geron gibbosus
- Hemipenthes morio
- Lomatia lateralis
- Thyridanthrax perspicillaris
- Parageron incisus ⓘ