Michael-Addition
Die Michael-Reaktion oder Michael-Addition ist die nucleophile Addition eines Carbanions oder eines anderen Nucleophils an eine α,β-ungesättigte Carbonylverbindung, die eine elektronenziehende Gruppe enthält. Sie gehört zur größeren Klasse der konjugierten Additionen und wird häufig für die milde Bildung von C-C-Bindungen verwendet. Es gibt viele asymmetrische Varianten. ⓘ
In diesem Schema stellen R und R' am Nucleophil (dem Michael-Donor) elektronenziehende Substituenten wie Acyl- und Cyanogruppen dar, die den benachbarten Methylenwasserstoff sauer genug machen, um bei der Reaktion mit der Base B: ein Carbanion zu bilden. Für das Alken (den Michael-Akzeptor) ist der R"-Substituent in der Regel ein Keton, was die Verbindung zu einem Enon macht, es kann sich aber auch um eine Nitrogruppe oder ein Sulfonylmethylfluorid handeln. Das Produkt wird als Michael-Addukt bezeichnet. ⓘ
Die Michael-Addition ist eine Namensreaktion in der organischen Chemie. Benannt wurde die Reaktion nach dem amerikanischen Chemiker Arthur Michael (1853–1942), der darüber zuerst 1887 veröffentlichte. Sie wird oft zur Knüpfung von Kohlenstoff-Kohlenstoff-Einfachbindungen eingesetzt, ist aber nicht darauf beschränkt. Es lassen sich beispielsweise auch Kohlenstoff-Schwefel-, Kohlenstoff-Sauerstoff- oder Kohlenstoff-Stickstoff-Bindungen knüpfen. ⓘ
Definition
Nach der ursprünglichen Definition von Arthur Michael ist die Reaktion die Addition eines Enolats eines Ketons oder Aldehyds an eine α,β-ungesättigte Carbonylverbindung am β-Kohlenstoff. Eine neuere Definition, die von Kohler vorgeschlagen wurde, ist die 1,4-Addition eines doppelt stabilisierten Kohlenstoff-Nucleophils an eine α,β-ungesättigte Carbonylverbindung. Einige Beispiele für Nukleophile sind Beta-Ketoester, Malonate und Beta-Cyanoester. Das resultierende Produkt enthält ein äußerst nützliches 1,5-Dioxygenierungsmuster. ⓘ
Klassische Beispiele für die Michael-Reaktion sind die Reaktion zwischen Malonsäurediethylester (Michael-Donor) und Fumarsäurediethylester (Michael-Akzeptor), die Reaktion zwischen Malonsäurediethylester und Mesityloxid, die Reaktion zwischen Malonsäurediethylester und Crotonatmethylester, die Reaktion zwischen 2-Nitropropan und Methylacrylat, die Reaktion zwischen Phenylcyanacetatethylester und Acrylnitril und die Reaktion zwischen Nitropropan und Methylvinylketon. ⓘ
Die Michael-Addition ist eine wichtige atomökonomische Methode zur diastereoselektiven und enantioselektiven C-C-Bindungsbildung. Eine klassische Tandemsequenz von Michael- und Aldol-Additionen ist die Robinson-Annulation. ⓘ
Einige Autoren haben die Definition der Michael-Addition so erweitert, dass sie sich im Wesentlichen auf jede 1,4-Additionsreaktion von α,β-ungesättigten Carbonylverbindungen bezieht. Andere jedoch bestehen darauf, dass eine solche Verwendung ein Missbrauch der Terminologie ist, und beschränken die Michael-Addition auf die Bildung von Kohlenstoff-Kohlenstoff-Bindungen durch die Addition von Kohlenstoff-Nucleophilen. Die Begriffe Oxa-Michael-Reaktion und Aza-Michael-Reaktion werden für die 1,4-Addition von Sauerstoff- bzw. Stickstoff-Nucleophilen verwendet. ⓘ
Im ersten Schritt wird der Michael-Donator (hier: ein Ester) durch eine Base (hier: Hydroxidion) deprotoniert und es entsteht dabei Wasser. Im weiteren Verlauf reagiert das entstandene Anion mit dem Michael-Akzeptor (hier: ein α,β-ungesättigtes Keton). Anschließend bildet sich dann durch Protonierung und Tautomerisierung das Michael-Addukt. ⓘ
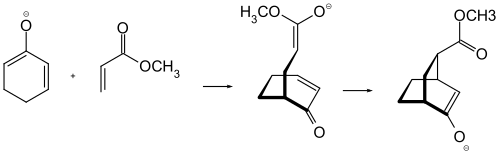
Im Falle von protischen Lösungsmitteln wird das als Primärprodukt erhaltene Enolation protoniert und eine Weiterreaktion gestoppt. Führt man jedoch die Michael-Addition in einem aprotischen Medium durch, so kann das Enolation zu weiteren Reaktionen führen. Dies kann man recht gut ausnutzen, indem man dem, bei der Michael-Reaktion entstehenden Enolation, einen weiteren und jetzt intramolekularen Michael-Akzeptor zur Verfügung stellt. Auf diese Weise ist z. B. durch die Umsetzung eines Dienolations von Cyclohexadien-Derivaten mit Acrylsäureestern die Darstellung eines komplexen Bicyclo[2.2.2]octan-Ringsystems leicht möglich. Strukturen dieses Typs sind als Ausgangsverbindung für die Synthese von komplexen Terpenen im Rahmen von Naturstoffsynthesen von Bedeutung. ⓘ
Mechanismus
Im Reaktionsmechanismus ist 1 (mit R als Alkoxygruppe) das Nukleophil:
Die Deprotonierung von 1 durch eine Base führt zum Carbanion 2, das durch seine elektronenziehenden Gruppen stabilisiert wird. Die Strukturen 2a bis 2c sind drei Resonanzstrukturen, die für diese Spezies gezeichnet werden können, wobei zwei davon Enolat-Ionen aufweisen. Dieses Nucleophil reagiert mit dem elektrophilen Alken 3 in einer konjugierten Additionsreaktion zu 4. Die Protonenabstraktion von der protonierten Base (oder dem Lösungsmittel) durch das Enolat 4 zu 5 ist der letzte Schritt. ⓘ
Der Verlauf der Reaktion wird eher von orbitalen als von elektrostatischen Überlegungen beherrscht. Das HOMO der stabilisierten Enolate hat einen großen Koeffizienten am zentralen Kohlenstoffatom, während das LUMO vieler alpha,beta-ungesättigter Carbonylverbindungen einen großen Koeffizienten am beta-Kohlenstoff hat. Somit können beide Reaktanten als weich angesehen werden. Diese polarisierten Grenzorbitale haben eine ähnliche Energie und reagieren effizient, um eine neue Kohlenstoff-Kohlenstoff-Bindung zu bilden. ⓘ
Wie die Aldol-Addition kann auch die Michael-Reaktion über ein Enol, einen Silyl-Enol-Ether bei der Mukaiyama-Michael-Addition oder in der Regel über ein Enolat-Nucleophil ablaufen. In letzterem Fall wird die stabilisierte Carbonylverbindung mit einer starken Base (harte Enolisierung) oder mit einer Lewis-Säure und einer schwachen Base (weiche Enolisierung) deprotoniert. Das resultierende Enolat greift das aktivierte Olefin mit 1,4-Regioselektivität an und bildet eine Kohlenstoff-Kohlenstoff-Bindung. Dabei wird auch das Enolat auf das Elektrophil übertragen. Da das Elektrophil viel weniger sauer ist als das Nukleophil, wird das Enolat durch raschen Protonentransfer in der Regel wieder auf das Nukleophil übertragen, wenn das Produkt enolisierbar ist; man kann jedoch den neuen Ort der Nukleophilie nutzen, wenn ein geeignetes Elektrophil anhängt. Je nach den relativen Säuregraden des Nukleophils und des Produkts kann die Reaktion basisch katalytisch sein. In den meisten Fällen ist die Reaktion bei niedriger Temperatur irreversibel. ⓘ
Asymmetrische Michael-Reaktion
In den letzten Jahren haben sich die Forscher bemüht, den Anwendungsbereich der asymmetrischen Michael-Additionen zu erweitern. Die gebräuchlichsten Methoden sind die chirale Phasentransferkatalyse, z. B. asymmetrische quaternäre Ammoniumsalze, die von den Cinchona-Alkaloiden abgeleitet sind, oder die Organokatalyse, bei der Enamin- oder Iminium-Aktivierung mit chiralen sekundären Aminen, die in der Regel von Prolin abgeleitet sind, verwendet wird. ⓘ
Bei der unten skizzierten Reaktion zwischen Cyclohexanon und β-Nitrostyrol wird die Base Prolin derivatisiert und arbeitet mit einer Protonensäure wie p-Toluolsulfonsäure zusammen:
Die Synaddition wird mit 99 % ee begünstigt. In dem Übergangszustand, von dem man annimmt, dass er für diese Selektivität verantwortlich ist, liegen das Enamin (das sich zwischen dem Prolin-Stickstoff und dem Cycloketon bildet) und das β-Nitrostyrol gemeinsam vor, wobei die Nitrogruppe an das protonierte Amin in der Prolin-Seitengruppe wasserstoffgebunden ist. ⓘ
Eine bekannte Michael-Reaktion ist die Synthese von Warfarin aus 4-Hydroxycumarin und Benzylidenaceton, die erstmals 1944 von Link beschrieben wurde:
Es gibt mehrere asymmetrische Versionen dieser Reaktion mit chiralen Katalysatoren. ⓘ
Mukaiyama-Michael-Addition
Bei der Mukaiyama-Michael-Addition ist das Nukleophil ein Silyl-Enolether und der Katalysator in der Regel Titantetrachlorid:
Geschichte
Die Forschungen, die Arthur Michael 1887 an der Tufts University durchführte, wurden durch eine Veröffentlichung von Conrad & Kuthzeit aus dem Jahr 1884 über die Reaktion von Ethyl-2,3-dibrompropionat mit Diethylsodiomalonat unter Bildung eines Cyclopropanderivats ausgelöst (heute weiß man, dass es sich um zwei aufeinander folgende Substitutionsreaktionen handelt). ⓘ
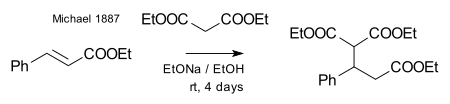
Michael konnte das gleiche Produkt erhalten, indem er das Propionat durch 2-Bromacrylsäureethylester ersetzte und erkannte, dass diese Reaktion nur funktionieren konnte, wenn man eine Additionsreaktion an die Doppelbindung der Acrylsäure annahm. Er bestätigte diese Annahme, indem er Diethylmalonat und Zimtsäureethylester miteinander reagieren ließ und dabei das erste Michael-Addukt bildete:
Im selben Jahr beanspruchte Rainer Ludwig Claisen die Priorität der Erfindung. Er und T. Komnenos hatten bereits 1883 bei der Untersuchung von Kondensationsreaktionen von Malonsäure mit Aldehyden Additionsprodukte an Doppelbindungen als Nebenprodukte beobachtet. Laut dem Biographen Takashi Tokoroyama ist dieser Anspruch jedoch unbegründet. ⓘ
Enantioselektive Michael-Addition
Zahlreiche enantioselektive Ausführungsformen der Michael-Addition sind bekannt, dazu zählen u. a. folgende Reaktionen:
- Addition von Ketonen oder Aldehyden an Nitroalkene oder Enone
- Addition von Malonestern an Nitroalkene oder Enone
- Addition von Diethylzink an Nitroalkene oder Enone
- Addition von N-Heterocyclen oder Aldehyden an Nitroalkene oder Enone
- Addition von α-Hydroxyketonen oder Aldehyden an Nitroalkene oder Enone
- Addition von Arylborsäuren ⓘ
Technische Anwendung
Die Addition von Methylmercaptan (Methanthiol) an die Kohlenstoff-Kohlenstoff-Doppelbindung von Acrolein führt zu Methylmercaptopropionaldehyd (MMP), einem Zwischenprodukt für die ökonomisch bedeutende Produktion von DL-Methionin, dessen Hydroxyanalogon (Aminogruppe des Methionins durch Hydroxygruppe ersetzt) sowie deren Salzen (vor allem Natrium- und Calciumsalzen). Von diesem Futtermittelzusatzstoffen werden mehrere 100.000 t pro Jahr hergestellt. ⓘ