Iod
| Eigenschaften ⓘ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[Kr] 4d10 5s2 5p5
53I
Periodensystem | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Allgemein | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Name, Symbol, Ordnungszahl | Iod, I, 53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategorie | Halogene | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe, Periode, Block | 17, 5, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aussehen | gasförmig: dunkel-violett, als Feststoff: grauschwarz, glänzend | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-Nummer | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EG-Nummer | 231-442-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA-InfoCard | 100.028.585 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massenanteil an der Erdhülle | 0,06 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomar | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 126,90447(3) u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (berechnet) | 140 (115) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalenter Radius | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van-der-Waals-Radius | 198 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronenkonfiguration | [Kr] 4d10 5s2 5p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ionisierungsenergie | 10.451260(25) eV ≈ 1008.39 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ionisierungsenergie | 19.13126(12) eV ≈ 1845.89 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ionisierungsenergie | 29.570(25) eV ≈ 2853.1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ionisierungsenergie | 40.357(25) eV ≈ 3893.9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ionisierungsenergie | 51.52(4) eV ≈ 4971 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Ionisierungsenergie | 74.4(4) eV ≈ 7179 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7. Ionisierungsenergie | 87.61(6) eV ≈ 8453 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physikalisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | orthorhombisch | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dichte | 4,94 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetismus | diamagnetisch (χm = −4,3 · 10−5) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzpunkt | 386,85 K (113,70 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Siedepunkt | 457,2 K (184 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molares Volumen | 25,72 · 10−6 m3·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Verdampfungsenthalpie | 41,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Schmelzenthalpie | 7,76 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
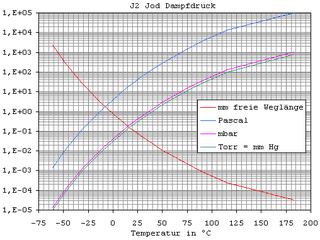
| Dampfdruck | 35 Pa bei 298 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wärmeleitfähigkeit | 0,449 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemisch | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationszustände | ±1, 3, 5, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalpotential | 0,536 V (I2 + 2 e− → 2 I−) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativität | 2,66 (Pauling-Skala) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Weitere Isotope siehe Liste der Isotope | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Schweiz: 0,1 ml·m−3 bzw. 1 mg·m−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toxikologische Daten |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Iod (standardsprachlich Jod) ist ein chemisches Element mit dem Elementsymbol I (vor der internationalen Elementsymboleinführung war es J) und der Ordnungszahl 53. Im Periodensystem steht es in der 7. Hauptgruppe bzw. der 17. IUPAC-Gruppe und gehört somit zu den Halogenen. Der Name leitet sich vom altgriechischen Wort „ioeides“ (ιο-ειδής) für „veilchenfarbig, violett“ ab. Beim Erhitzen entstehende Dämpfe sind charakteristisch violett. ⓘ
Ältere Bezeichnungen sind Jodium, Jodina und Jodine. ⓘ
Iod ist bei Raumtemperatur ein Feststoff, der schlecht wasserlöslich, aber gut löslich in wässriger Kaliumiodid-Lösung (siehe dazu: Lugolsche Lösung) und sehr gut löslich in Ethanol und anderen organischen Lösungsmitteln ist. ⓘ
In der Alltagssprache ist Jod die gebräuchliche Schreibweise, auch in der älteren chemischen und überwiegend in der aktuellen medizinischen Fachliteratur. Die Schreibweise Iod wird im Duden mit dem Hinweis auf Jod aufgeführt und auf die Fachsprachlichkeit hingewiesen. Das Elementsymbol I wird bereits seit 1970 in der IUPAC-Publikation in der chemischen Fachliteratur benutzt, in der älteren deutschsprachigen Literatur findet man durchgängig die Elementbezeichnung J. ⓘ
Iod ist ein unentbehrlicher Bestandteil des tierischen und menschlichen Organismus und wird mit der Nahrung aufgenommen. Am höchsten ist die Konzentration beim Menschen in der Schilddrüse und wird dort in den Hormonen Thyroxin und Triiodthyronin und als Diiodtyrosin genutzt. Jodmangel im Trinkwasser und der Nahrung ist in der Regel für das Auftreten des Kropfs verantwortlich. Als Vorbeugung wird der wöchentlich ein- bis mehrmalige Verzehr von Seefisch sowie die Verwendung von sogenanntem Jodsalz (Speisesalz mit Natrium- oder Kaliumiodat versetzt) empfohlen. Durch diese individuelle Jodprophylaxe und die Iodierung von Futtermitteln wird in Deutschland der Mangel an Iod in den Böden teilweise ausgeglichen. Es konnte vorübergehend erreicht werden, dass in der Gesamtjodversorgung der Bevölkerung die Vorgaben der WHO knapp eingehalten wurden. Stand 2020 weist die Jodversorgung laut Bundesinstitut für Risikobewertung eine rückläufige Tendenz auf und ist nicht optimal. ⓘ
Jod ist ein chemisches Element mit dem Symbol I und der Ordnungszahl 53. Es ist das schwerste der stabilen Halogene und liegt unter Standardbedingungen als halbglänzender, nichtmetallischer Feststoff vor, der bei 114 °C (237 °F) zu einer tiefvioletten Flüssigkeit schmilzt und bei 184 °C (363 °F) zu einem violetten Gas siedet. Das Element wurde 1811 von dem französischen Chemiker Bernard Courtois entdeckt und zwei Jahre später von Joseph Louis Gay-Lussac nach dem altgriechischen Ιώδης "violettfarbig" benannt. ⓘ
Iod kommt in vielen Oxidationsstufen vor, darunter Iodid (I-), Iodat (IO-
3) und die verschiedenen Periodat-Anionen. Es ist das am wenigsten häufig vorkommende der stabilen Halogene und das einundsechzigsthäufigste Element. Es ist der schwerste essentielle Mineralstoff. Jod ist für die Synthese von Schilddrüsenhormonen unerlässlich. Jodmangel betrifft etwa zwei Milliarden Menschen und ist die häufigste vermeidbare Ursache für geistige Behinderungen. ⓘ
Die wichtigsten Jodproduzenten sind heute Chile und Japan. Jod und seine Verbindungen werden hauptsächlich in der Ernährung verwendet. Aufgrund seiner hohen Ordnungszahl und der leichten Bindung an organische Verbindungen wird es auch als ungiftiges Radiokontrastmittel verwendet. Aufgrund seiner spezifischen Aufnahme durch den menschlichen Körper können radioaktive Jodisotope auch zur Behandlung von Schilddrüsenkrebs eingesetzt werden. Jod wird auch als Katalysator bei der industriellen Herstellung von Essigsäure und einigen Polymeren verwendet. ⓘ
Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation. ⓘ
Geschichte
1811 wurde Jod von dem französischen Chemiker Bernard Courtois entdeckt, der als Sohn eines Herstellers von Salpeter (einem wesentlichen Bestandteil des Schießpulvers) geboren wurde. Zur Zeit der Napoleonischen Kriege war der Salpeter in Frankreich sehr gefragt. Für die Herstellung von Salpeter aus französischen Salpeterlagerstätten wurde Natriumkarbonat benötigt, das aus Algen gewonnen werden konnte, die an den Küsten der Normandie und der Bretagne gesammelt wurden. Um das Natriumkarbonat zu isolieren, wurde der Seetang verbrannt und die Asche mit Wasser gewaschen. Der verbleibende Abfall wurde durch Zugabe von Schwefelsäure zerstört. Als Courtois einmal zu viel Schwefelsäure hinzufügte, stieg eine Wolke violetten Dampfs auf. Er stellte fest, dass der Dampf auf kalten Oberflächen kristallisierte und dunkle Kristalle bildete. Courtois vermutete, dass es sich bei diesem Material um ein neues Element handelte, doch fehlten ihm die finanziellen Mittel, um es weiter zu untersuchen. ⓘ
Courtois gab Proben an seine Freunde Charles Bernard Desormes (1777-1838) und Nicolas Clément (1779-1841) weiter, um die Forschung fortzusetzen. Er gab auch dem Chemiker Joseph Louis Gay-Lussac (1778-1850) und dem Physiker André-Marie Ampère (1775-1836) etwas von dem Stoff. Am 29. November 1813 machten Desormes und Clément die Entdeckung von Courtois öffentlich. Sie beschrieben die Substanz in einer Sitzung des Kaiserlichen Instituts von Frankreich. Am 6. Dezember gab Gay-Lussac bekannt, dass es sich bei der neuen Substanz entweder um ein Element oder eine Sauerstoffverbindung handelt. Gay-Lussac schlug den Namen "Jod" vor, der sich vom altgriechischen ἰοειδής (ioeidēs, "violett") ableitet und auf die Farbe des Joddampfes zurückzuführen ist. Ampère hatte einige seiner Proben dem englischen Chemiker Humphry Davy (1778-1829) übergeben, der mit der Substanz experimentierte und ihre Ähnlichkeit mit Chlor feststellte. Davy schrieb am 10. Dezember an die Royal Society of London, dass er ein neues Element entdeckt habe. Zwischen Davy und Gay-Lussac entbrannte ein Streit darüber, wer das Jod zuerst identifiziert hatte, aber beide Wissenschaftler erkannten Courtois als den ersten an, der das Element isoliert hatte. ⓘ
1873 entdeckte der französische Medizinforscher Casimir Joseph Davaine (1812-1882) die antiseptische Wirkung von Jod. Antonio Grossich (1849-1926), ein in Istrien geborener Chirurg, war einer der ersten, der die Sterilisation des Operationsfeldes einsetzte. Im Jahr 1908 führte er die Jodtinktur als Mittel zur schnellen Sterilisierung der menschlichen Haut im Operationsbereich ein. ⓘ
In den frühen Periodensystemen wurde Jod häufig mit dem Symbol J für Jod, seinem deutschen Namen, bezeichnet. ⓘ
Die pharmakologische Bedeutung iodhaltiger Zubereitungen war schon im Altertum bekannt. So wurden bereits 1500 Jahre vor unserer Zeitrechnung Kropfkranken die iodhaltigen Schilddrüsen von Schafen oder Aschen von Meeresschwämmen verordnet. ⓘ
Eigenschaften

Jod ist das vierte Halogen und gehört zur Gruppe 17 im Periodensystem, nach Fluor, Chlor und Brom; es ist das schwerste stabile Mitglied seiner Gruppe. (Das fünfte und sechste Halogen, das radioaktive Astatin und Tennessin, sind aufgrund ihrer hohen Kosten und ihrer Unzugänglichkeit in großen Mengen nicht gut erforscht, scheinen aber aufgrund relativistischer Effekte verschiedene ungewöhnliche Eigenschaften für die Gruppe aufzuweisen). Jod hat die Elektronenkonfiguration [Kr]4d105s25p5, wobei die sieben Elektronen in der fünften und äußersten Schale seine Valenzelektronen sind. Wie die anderen Halogene verfügt es über ein Elektron weniger als ein volles Oktett und ist daher ein Oxidationsmittel, das mit vielen Elementen reagiert, um seine äußere Schale zu vervollständigen, obwohl es im Einklang mit den periodischen Trends das schwächste Oxidationsmittel unter den stabilen Halogenen ist: Es hat die niedrigste Elektronegativität unter ihnen, nur 2,66 auf der Pauling-Skala (zum Vergleich: Fluor, Chlor und Brom liegen bei 3,98, 3,16 bzw. 2,96; Astatin setzt diesen Trend mit einer Elektronegativität von 2,2 fort). Das elementare Jod bildet daher zweiatomige Moleküle mit der chemischen Formel I2, bei denen sich zwei Jodatome ein Elektronenpaar teilen, um jeweils ein stabiles Oktett für sich zu erreichen; bei hohen Temperaturen dissoziieren diese zweiatomigen Moleküle reversibel ein Jodatompaar. In ähnlicher Weise ist das Iodid-Anion, I-, das stärkste Reduktionsmittel unter den stabilen Halogenen und wird am leichtesten zu zweiatomigem I2 oxidiert. (Astat geht noch weiter, da es als At- tatsächlich instabil ist und leicht zu At0 oder At+ oxidiert wird). ⓘ
Die Farbe der Halogene wird mit absteigender Gruppe dunkler: Fluor ist sehr blassgelb, Chlor ist grünlich-gelb, Brom ist rötlich-braun und Jod ist violett. ⓘ
Elementares Jod ist schwer löslich in Wasser, wobei sich ein Gramm bei 20 °C in 3450 ml und bei 50 °C in 1280 ml auflöst; durch Zugabe von Kaliumjodid kann die Löslichkeit durch Bildung von Triiodidionen und anderen Polyiodiden erhöht werden. Unpolare Lösungsmittel wie Hexan und Tetrachlorkohlenstoff bieten eine höhere Löslichkeit. Polare Lösungen, wie z. B. wässrige Lösungen, sind braun, was die Rolle dieser Lösungsmittel als Lewis-Basen widerspiegelt; unpolare Lösungen hingegen sind violett, die Farbe des Ioddampfes. Beim Lösen von Iod in polaren Lösungsmitteln bilden sich Ladungstransferkomplexe, die die Farbe verändern. In Tetrachlorkohlenstoff und gesättigten Kohlenwasserstoffen ist Iod violett, in Alkoholen und Aminen, die Ladungstransfer-Addukte bilden, dagegen tiefbraun. ⓘ

Die Schmelz- und Siedepunkte von Jod sind die höchsten unter den Halogenen, was der steigenden Tendenz in der Gruppe entspricht, da Jod die größte Elektronenwolke unter den Halogenen hat, die am leichtesten polarisiert ist, was dazu führt, dass seine Moleküle die stärksten van-der-Waals-Wechselwirkungen unter den Halogenen haben. Ebenso ist Jod das am wenigsten flüchtige Halogen, obwohl der Feststoff immer noch violetten Dampf abgibt. Aufgrund dieser Eigenschaft wird Jod häufig zur Demonstration der direkten Sublimation von einem Feststoff zu einem Gas verwendet, was zu dem Missverständnis führt, dass es bei Atmosphärendruck nicht schmilzt. Da Jod den größten Atomradius unter den Halogenen hat, besitzt es die niedrigste erste Ionisierungsenergie, die geringste Elektronenaffinität, die niedrigste Elektronegativität und die geringste Reaktivität unter den Halogenen. ⓘ

Die Interhalogenbindung in Jod ist die schwächste aller Halogene. Daher wird 1 % einer Probe gasförmigen Iods bei Atmosphärendruck bei 575 °C in Iodatome dissoziiert. Für eine ähnliche Dissoziation von Fluor, Chlor und Brom sind Temperaturen von mehr als 750 °C erforderlich. Die meisten Bindungen zu Jod sind schwächer als die entsprechenden Bindungen zu den leichteren Halogenen. Gasförmiges Iod besteht aus I2-Molekülen mit einer I-I-Bindungslänge von 266,6 pm. Die I-I-Bindung ist eine der längsten bekannten Einfachbindungen. Sie ist sogar noch länger (271,5 pm) im festen orthorhombischen kristallinen Jod, das die gleiche Kristallstruktur wie Chlor und Brom aufweist. (Der Rekord wird von Jods Nachbar Xenon gehalten: die Xe-Xe-Bindungslänge beträgt 308,71 pm.) Innerhalb des Jodmoleküls kommt es also zu bedeutenden elektronischen Wechselwirkungen mit den beiden nächstgelegenen Nachbarn jedes Atoms, und diese Wechselwirkungen führen bei Jod in der Masse zu einem glänzenden Aussehen und halbleitenden Eigenschaften. Jod ist ein zweidimensionaler Halbleiter mit einer Bandlücke von 1,3 eV (125 kJ/mol): In der Ebene seiner kristallinen Schichten ist es ein Halbleiter, in der senkrechten Richtung ein Isolator. ⓘ
Isotope
Von den siebenunddreißig bekannten Isotopen des Jods kommt nur eines in der Natur vor, Jod-127. Die anderen sind radioaktiv und haben Halbwertszeiten, die zu kurz sind, um ursprünglich zu sein. Als solches ist Jod sowohl monoisotop als auch mononuklidisch und sein Atomgewicht ist sehr genau bekannt, da es eine Naturkonstante ist. ⓘ
Das langlebigste der radioaktiven Isotope des Jods ist Jod-129 mit einer Halbwertszeit von 15,7 Millionen Jahren, das durch Betazerfall in stabiles Xenon-129 zerfällt. Ein Teil des Jods-129 entstand zusammen mit dem Jod-127 vor der Entstehung des Sonnensystems, ist aber inzwischen vollständig zerfallen, so dass es sich um ein ausgestorbenes Radionuklid handelt, das aufgrund seiner Mobilität in der Umwelt dennoch für die Datierung der Geschichte des frühen Sonnensystems oder sehr alter Grundwässer nützlich ist. Sein früheres Vorhandensein lässt sich anhand eines Überschusses seiner Tochter Xenon-129 feststellen. Spuren von Jod-129 sind auch heute noch vorhanden, da es ebenfalls ein kosmogenes Nuklid ist, das aus der Spallation von Xenon in der Atmosphäre durch kosmische Strahlung entsteht: Diese Spuren machen 10-14 bis 10-10 des gesamten Jods auf der Erde aus. Es entsteht auch bei Atomtests unter freiem Himmel und ist aufgrund seiner sehr langen Halbwertszeit, der längsten aller Spaltprodukte, nicht gefährlich. Auf dem Höhepunkt der thermonuklearen Tests in den 1960er und 1970er Jahren machte Jod-129 nur etwa 10-7 des gesamten Jods auf der Erde aus. Die angeregten Zustände von Jod-127 und Jod-129 werden häufig in der Mössbauer-Spektroskopie verwendet. ⓘ
Die anderen Jod-Radioisotope haben viel kürzere Halbwertszeiten, nicht länger als ein paar Tage. Einige von ihnen werden in der Medizin in der Schilddrüse eingesetzt, wo das in den Körper gelangende Jod gespeichert und konzentriert wird. Jod-123 hat eine Halbwertszeit von dreizehn Stunden und zerfällt durch Elektroneneinfang in Tellur-123, wobei Gammastrahlung freigesetzt wird; es wird in der nuklearmedizinischen Bildgebung eingesetzt, einschließlich der Einzelphotonen-Emissions-Computertomographie (SPECT) und der Röntgen-Computertomographie (Röntgen-CT). Jod-125 hat eine Halbwertszeit von 59 Tagen und zerfällt durch Elektroneneinfang in Tellur-125, wobei es niederenergetische Gammastrahlung aussendet. Als zweitlängstes Jod-Radioisotop wird es in biologischen Tests, in der nuklearmedizinischen Bildgebung und in der Strahlentherapie als Brachytherapie zur Behandlung von Prostatakrebs, Aderhautmelanomen und Gehirntumoren eingesetzt. Jod-131 schließlich, mit einer Halbwertszeit von acht Tagen, zerfällt im Beta-Zustand in einen angeregten Zustand von stabilem Xenon-131, das sich dann unter Aussendung von Gammastrahlung in den Grundzustand umwandelt. Es ist ein häufiges Spaltprodukt und daher in großen Mengen im radioaktiven Fallout vorhanden. Es kann dann über kontaminierte Lebensmittel aufgenommen werden und reichert sich auch in der Schilddrüse an. Beim Zerfall kann es die Schilddrüse schädigen. Das Hauptrisiko einer hohen Jod-131-Belastung ist das mögliche Auftreten von radiogenem Schilddrüsenkrebs im späteren Leben. Zu den weiteren Risiken gehören die Möglichkeit von nicht krebsartigen Wucherungen und Schilddrüsenentzündungen. ⓘ
Das übliche Mittel zum Schutz vor den negativen Auswirkungen von Jod-131 ist die Sättigung der Schilddrüse mit stabilem Jod-127 in Form von Kaliumjodidtabletten, die zur optimalen Prophylaxe täglich eingenommen werden. Jod-131 kann aber auch aus diesem Grund zu medizinischen Zwecken in der Strahlentherapie eingesetzt werden, wenn nach der Jodaufnahme durch das Gewebe eine Gewebezerstörung erwünscht ist. Jod-131 wird auch als radioaktiver Tracer verwendet. ⓘ
Von Iod sind bisher 36 Isotope und 10 Kernisomere bekannt. Von diesen ist nur ein Isotop stabil, so dass natürlich vorkommendes Iod zu 100 % aus dem einzigen stabilen Isotop 127I besteht. Iod ist daher ein Reinelement (anisotop). Von den instabilen Isotopen besitzt der Betastrahler 129I mit 15.700.000 Jahren eine sehr lange Halbwertszeit. Daneben gibt es vier Isotope mit mehr als einem Tag Halbwertszeit: 124I (4,2 Tage), 125I (59 Tage), 126I (13 Tage) und 131I (8,0 Tage). Instabile Iodisotope entstehen z. B. bei der Kernspaltung und stellen bei ihrer Freisetzung in die Luft eine Gesundheitsgefahr dar, weil sie sich in der Schilddrüse anreichern können. Iod-135 ist bei der Xenonvergiftung relevant, da es Mutternuklid des Neutronengiftes Xenon-135 ist. Daher stammt auch der in englischen Publikationen zu findende Name Iodine Pit – Jodgrube – für das Phänomen. ⓘ
Physikalische Eigenschaften
Iod ist unter Normalbedingungen ein Feststoff, der grauschwarze, metallisch glänzende Schuppen bildet, deren Dichte 4,94 g·cm−3 beträgt. Iod geht beim Schmelzen (Schmelzpunkt 113,70 °C) in eine braune, elektrisch leitfähige Flüssigkeit über. Es siedet bei 184,2 °C unter Bildung eines violetten Dampfes, der aus I2-Molekülen besteht. Iod sublimiert schon bei Zimmertemperatur, so dass ein Schmelzen nur unter rascher und starker Temperaturerhöhung möglich ist. ⓘ
Kristallines Iod ⓘ
Kristall- und Molekülstruktur
Iod besitzt die Eigenschaften eines Halbleiters. Diese Eigenschaften sind auf das Vorhandensein eines Schichtgitters zurückzuführen, in dem einzelne Ebenen aus I2-Molekülen (Bindungslänge 271,5 pm) bestehen. Der Abstand der Ebenen in einem orthorhombischen Schichtkristall beträgt 441,2 pm und entspricht damit dem Van-der-Waals-Abstand zwischen zwei Iod-Atomen (430 pm). Das Ergebnis der Messung des kürzesten Abstands zwischen zwei Iod-Molekülen liegt mit 349,6 pm deutlich darunter. ⓘ
3-D-Modell der Elementarzelle ⓘ
Chemische Eigenschaften
Iod reagiert weitaus weniger heftig mit anderen Elementen wie Phosphor, Aluminium, Eisen und Quecksilber als Chlor und Brom. Mit Wasserstoff reagiert Iod zu Iodwasserstoff, welcher beim leichten Erwärmen jedoch schnell wieder in die Elemente zerfällt. ⓘ
- Iod und Wasserstoff stehen mit Iodwasserstoff im Gleichgewicht. Bei erhöhter Temperatur wird dieses nach links verschoben. ⓘ
Mit Ammoniak findet aufgrund der damit verbundenen Volumenzunahme eine explosionsartige Reaktion statt. ⓘ
- Drei Mol Iod und zwei Mol Ammoniak reagieren zu sechs Mol Iodwasserstoff und einem Mol Stickstoff. ⓘ
Mit Ammoniaklösung bildet Iod Triiodstickstoff (NI3). ⓘ
Eine interessante Eigenschaft des Iods äußert sich darin, Polyiodidverbindungen einzugehen. Dabei verbinden sich gelöste I2-Moleküle jeweils mit einem Iodid-Anion zum einfach negativ geladenen I3−-Anion. Eine Eigenschaft dieser Polyiodidverbindung ist, dass sie sich in Stärke-Helices einlagert. Diese Einlagerungsverbindungen rufen bereits in geringen Konzentrationen eine intensive Blaufärbung hervor (empfindlicher und spezifischer Iod-Stärke-Nachweis). ⓘ
Iod-Kationen
Von Iod sind verschiedene Kationen bekannt. So entsteht das blaue Diiod-Kation I2+, wenn Iod durch in Schwefelsäure gelöstes Schwefeltrioxid (65%iges Oleum: H2SO4 · 2 SO3) oxidiert wird:
Zur Oxidation kann ebenso Antimon(V)-fluorid bzw. Tantalpentafluorid in flüssigem Schwefeldioxid verwendet werden:
Es gelang jedoch bisher nicht, Verbindungen mit dem unsolvatisierten, das heißt lösungsmittelfreien Monoiod-Kation I+ herzustellen. Selbst in Verbindung mit einer extrem schwachen Lewis-Base wie dem Perchlorat-Anion ClO4− findet man kovalent gebundenes Iod vor. In der Gasphase kann man das I+-Ion bei Abwesenheit eines Gegenions jedoch nachweisen. ⓘ
Chemie und Verbindungen
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
Jod ist recht reaktiv, aber viel weniger reaktiv als die anderen Halogene. Während Chlorgas beispielsweise Kohlenmonoxid, Stickstoffoxid und Schwefeldioxid halogeniert (zu Phosgen, Nitrosylchlorid bzw. Sulfurylchlorid), ist dies bei Iod nicht der Fall. Außerdem führt die Jodierung von Metallen in der Regel zu niedrigeren Oxidationsstufen als die Chlorierung oder Bromierung; so reagiert beispielsweise Rheniummetall mit Chlor zu Rheniumhexachlorid, mit Brom jedoch nur zu Rheniumpentabromid, und mit Jod kann nur Rheniumtetraiodid gebildet werden. Da Iod jedoch die niedrigste Ionisierungsenergie unter den Halogenen hat und am leichtesten oxidierbar ist, hat es eine bedeutendere kationische Chemie und seine höheren Oxidationsstufen sind etwas stabiler als die von Brom und Chlor, zum Beispiel in Iodheptafluorid. ⓘ
Komplexe mit Ladungstransfer
Das Iodmolekül I2 löst sich in CCl4 und aliphatischen Kohlenwasserstoffen und ergibt hellviolette Lösungen. In diesen Lösungsmitteln liegt das Maximum der Absorptionsbande im Bereich von 520-540 nm und wird einem Übergang von π* zu σ* zugeordnet. Wenn I2 mit Lewis-Basen in diesen Lösungsmitteln reagiert, ist eine Blauverschiebung des I2-Peaks zu beobachten, und es entsteht ein neuer Peak (230 - 330 nm), der auf die Bildung von Addukten zurückzuführen ist, die als Ladungstransferkomplexe bezeichnet werden. ⓘ
Jodwasserstoff
Die einfachste Jodverbindung ist Jodwasserstoff (HI). Es handelt sich um ein farbloses Gas, das mit Sauerstoff zu Wasser und Iod reagiert. Obwohl es für Jodierungsreaktionen im Labor nützlich ist, wird es im Gegensatz zu den anderen Halogenwasserstoffen nicht in großem Umfang industriell verwendet. Kommerziell wird es in der Regel durch Reaktion von Jod mit Schwefelwasserstoff oder Hydrazin hergestellt:
2 I2 + N2H4 4 HI + N2 Bei Raumtemperatur ist es ein farbloses Gas, wie alle Halogenwasserstoffe mit Ausnahme von Fluorwasserstoff, da Wasserstoff keine starken Wasserstoffbrückenbindungen mit dem großen und nur schwach elektronegativen Jodatom eingehen kann. Es schmilzt bei -51,0 °C und siedet bei -35,1 °C. Es handelt sich um eine endotherme Verbindung, die bei Raumtemperatur exotherm dissoziieren kann, wobei der Prozess jedoch sehr langsam verläuft, wenn kein Katalysator vorhanden ist: Die Reaktion zwischen Wasserstoff und Iod bei Raumtemperatur zu Iodwasserstoff verläuft nicht vollständig. Die Dissoziationsenergie der H-I-Bindung ist mit 295 kJ/mol ebenfalls die kleinste unter den Halogenwasserstoffen. ⓘ
Wässriger Jodwasserstoff wird als Jodwasserstoffsäure bezeichnet, die eine starke Säure ist. Jodwasserstoff ist außerordentlich gut in Wasser löslich: Ein Liter Wasser löst 425 Liter Jodwasserstoff, und in der gesättigten Lösung kommen auf ein Molekül Jodwasserstoff nur vier Wassermoleküle. Handelsübliche so genannte "konzentrierte" Jodwasserstoffsäure enthält in der Regel 48-57 Massenprozent HI; die Lösung bildet ein Azeotrop mit Siedepunkt 126,7 °C bei 56,7 g HI pro 100 g Lösung. Daher kann Iodwasserstoffsäure nicht über diesen Punkt hinaus durch Verdampfen von Wasser konzentriert werden. ⓘ
Im Gegensatz zu Fluorwasserstoff ist wasserfreier, flüssiger Iodwasserstoff als Lösungsmittel schwierig zu handhaben, da sein Siedepunkt niedrig ist, er einen kleinen Flüssigkeitsbereich hat, seine Dielektrizitätskonstante niedrig ist und er nicht nennenswert in H2I+ und HI-
2-Ionen dissoziiert - letztere sind aufgrund des sehr schwachen Wasserstoffs viel weniger stabil als die Bifluorid-Ionen (HF-
2), da die Wasserstoffbrückenbindung zwischen Wasserstoff und Iod sehr schwach ist, obwohl seine Salze mit sehr großen und schwach polarisierenden Kationen wie Cs+ und NR+
4 (R = Me, Et, Bun) noch isoliert werden können. Wasserfreier Iodwasserstoff ist ein schlechtes Lösungsmittel, das nur kleinmolekulare Verbindungen wie Nitrosylchlorid und Phenol oder Salze mit sehr niedrigen Gitterenergien wie Tetraalkylammoniumhalogenide lösen kann. ⓘ
Andere binäre Iodide
Fast alle Elemente im Periodensystem bilden binäre Jodide. Die Ausnahmen sind deutlich in der Minderheit und haben jeweils eine der folgenden drei Ursachen: extreme Trägheit und mangelnde Bereitschaft, an chemischen Reaktionen teilzunehmen (die Edelgase); extreme nukleare Instabilität, die chemische Untersuchungen vor dem Zerfall und der Transmutation erschwert (viele der schwersten Elemente jenseits von Wismut); und eine Elektronegativität, die höher ist als die des Iods (Sauerstoff, Stickstoff und die ersten drei Halogene), so dass die daraus resultierenden binären Verbindungen formal keine Iodide, sondern eher Oxide, Nitride oder Halogenide des Iods sind. (Nichtsdestotrotz wird Stickstofftriiodid als Iodid bezeichnet, da es den anderen Stickstofftrihalogeniden ähnelt.) ⓘ
Angesichts der Größe des Iodidanions und der schwachen Oxidationskraft von Iod sind hohe Oxidationsstufen bei binären Iodiden nur schwer zu erreichen; die höchsten bekannten Oxidationsstufen sind die Pentaiodide von Niob, Tantal und Protactinium. Iodide können durch Reaktion eines Elements oder seines Oxids, Hydroxids oder Karbonats mit Iodwasserstoffsäure hergestellt werden, die dann bei mäßig hohen Temperaturen und entweder unter niedrigem Druck oder mit wasserfreiem Iodwasserstoffgas dehydriert wird. Diese Methoden funktionieren am besten, wenn das Iodidprodukt gegenüber der Hydrolyse stabil ist; andernfalls kommen die oxidative Hochtemperatur-Iodierung des Elements mit Iod oder Iodwasserstoff, die Hochtemperatur-Iodierung eines Metalloxids oder eines anderen Halogenids durch Iod, ein flüchtiges Metallhalogenid, Kohlenstofftetraiodid oder ein organisches Iodid in Frage. So reagiert beispielsweise Molybdän(IV)-oxid mit Aluminium(III)-iodid bei 230 °C zu Molybdän(II)-iodid. Ein Beispiel für einen Halogenaustausch ist die Reaktion von Tantal(V)-chlorid mit überschüssigem Aluminium(III)-iodid bei 400 °C, wobei Tantal(V)-iodid entsteht:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ 3TaCl5 + \underset{(Überschuss)}{5AlI3} -> 3TaI5 + 5AlCl3 <span title="Aus: Englische Wikipedia, Abschnitt "Other binary iodides"" class="plainlinks">[https://en.wikipedia.org/wiki/Iodine#Other_binary_iodides <span style="color:#dddddd">ⓘ</span>]</span>}}
Niedere Iodide können entweder durch thermische Zersetzung oder Disproportionierung oder durch Reduktion des höheren Iodids, z. B. mit Wasserstoff oder einem Metall, hergestellt werden:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ TaI5{} + Ta -> [\text{Wärmegradient}] [\ce{630^\circ C\ ->\ 575^\circ C}] Ta6I14 <span title="Aus: Englische Wikipedia, Abschnitt "Other binary iodides"" class="plainlinks">[https://en.wikipedia.org/wiki/Iodine#Other_binary_iodides <span style="color:#dddddd">ⓘ</span>]</span>}}
Die meisten Iodide der Gruppen 1, 2 und 3 sowie die Lanthaniden und Actiniden in den Oxidationsstufen +2 und +3 sind meist ionisch, während Nichtmetalle eher kovalente molekulare Iodide bilden, ebenso wie Metalle in den hohen Oxidationsstufen ab +3 und darüber. Die ionischen Iodide MIn haben in der Regel die niedrigsten Schmelz- und Siedepunkte unter den Halogeniden MXn desselben Elements, da die elektrostatischen Anziehungskräfte zwischen den Kationen und Anionen für das große Iodidanion am geringsten sind. Im Gegensatz dazu haben kovalente Iodide eher die höchsten Schmelz- und Siedepunkte unter den Halogeniden desselben Elements, da Iod das polarisierbarste der Halogene ist und mit den meisten Elektronen am meisten zu den van-der-Waals-Kräften beitragen kann. Ausnahmen gibt es natürlich bei den Zwischenstufen der Iodide, bei denen die eine Tendenz der anderen weicht. In ähnlicher Weise ist die Wasserlöslichkeit von überwiegend ionischen Iodiden (z. B. Kalium und Calcium) die größte unter den ionischen Halogeniden dieses Elements, während die Löslichkeit von kovalenten Iodiden (z. B. Silber) die niedrigste ist. Insbesondere Silberjodid ist in Wasser sehr unlöslich und seine Bildung wird häufig als qualitativer Test für Jod verwendet. ⓘ
Anorganische Verbindungen, in denen das Iod in der Oxidationsstufe −1 und damit als Anion vorliegt, werden Iodide genannt. Diese leiten sich von der gasförmigen Wasserstoffverbindung Iodwasserstoff (HI) ab. Eine wässrige Lösung davon bezeichnet man als Iodwasserstoffsäure. In wässriger Lösung gibt sie sehr leicht das Proton (pKs –10) ab und wirkt daher stärker sauer als Bromwasserstoff (pKs –8,9) oder Chlorwasserstoff (pKs –6,2) in Wasser. ⓘ
Besonders bekannt sind die Iodide der Alkalimetalle, vor allem Natriumiodid und Kaliumiodid. Iodide sind in der Regel gut wasserlöslich, Ausnahmen sind viele Schwermetalliodide wie z. B. Silberiodid, Quecksilber(I)-iodid, Quecksilber(II)-iodid und Blei(II)-iodid. ⓘ
Iodide wirken als starke Reduktionsmittel. Lufteinwirkung bewirkt eine allmähliche Braunverfärbung bei Iodiden, Kupfer(II)-Salzlösungen verursachen das Ausfällen von Cu(I)-Iodid und Freisetzen von Iod. Silberiodid ist nur bei Lichtausschluss stabil, bei Belichtung oxidiert Ag(I) das Iodid zu Iod und Silberkristallkeimen (Schwarzfärbung bei Photonegativen). ⓘ
Jodhalogenide
Die Halogene bilden zahlreiche binäre, diamagnetische Interhalogenverbindungen mit den Stöchiometrien XY, XY3, XY5 und XY7 (wobei X schwerer ist als Y), und Jod ist keine Ausnahme. Jod bildet alle drei möglichen zweiatomigen Interhalogene, ein Trifluorid und ein Trichlorid, sowie ein Pentafluorid und, eine Ausnahme unter den Halogenen, ein Heptafluorid. Zahlreiche kationische und anionische Derivate sind ebenfalls charakterisiert, wie z. B. die weinroten oder leuchtend orangefarbenen Verbindungen von ICl+
2 und die dunkelbraunen oder violettschwarzen Verbindungen von I2Cl+. Darüber hinaus sind auch einige Pseudohalogenide bekannt, wie Iodcyanid (ICN), Iodthiocyanat (ISCN) und Iodazid (IN3). ⓘ

Jodmonofluorid (IF) ist bei Raumtemperatur instabil und disproportioniert sehr leicht und irreversibel zu Jod und Jodpentafluorid, so dass es nicht in reiner Form gewonnen werden kann. Es kann durch Reaktion von Iod mit Fluorgas in Trichlorfluormethan bei -45 °C, mit Iodtrifluorid in Trichlorfluormethan bei -78 °C oder mit Silber(I)fluorid bei 0 °C synthetisiert werden. Jodmonochlorid (ICl) und Jodmonobromid (IBr) sind dagegen mäßig stabil. Ersteres, eine flüchtige rotbraune Verbindung, wurde unabhängig voneinander von Joseph Louis Gay-Lussac und Humphry Davy in den Jahren 1813-1814 entdeckt, nicht lange nach den Entdeckungen von Chlor und Jod, und es ahmt das Zwischenhalogen Brom so gut nach, dass Justus von Liebig Brom (das er gefunden hatte) mit Jodmonochlorid verwechselte. Jodmonochlorid und Jodmonobromid können einfach durch Reaktion von Jod mit Chlor oder Brom bei Raumtemperatur hergestellt und durch fraktionierte Kristallisation gereinigt werden. Beide sind sehr reaktiv und greifen sogar Platin und Gold an, nicht jedoch Bor, Kohlenstoff, Cadmium, Blei, Zirkonium, Niob, Molybdän und Wolfram. Ihre Reaktion mit organischen Verbindungen hängt von den Bedingungen ab. Jodchloriddampf neigt dazu, Phenol und Salicylsäure zu chlorieren, da bei der homolytischen Dissoziation von Jodchlorid Chlor und Jod entstehen und ersteres reaktiver ist. Iodchlorid in Tetrachlormethanlösung führt jedoch zur Iodierung als Hauptreaktion, da nun eine heterolytische Spaltung der I-Cl-Bindung stattfindet und I+ als Elektrophil das Phenol angreift. Allerdings neigt Iodmonobromid auch in Tetrachlormethanlösung zur Bromierung von Phenol, da es in Lösung dazu neigt, in seine Elemente zu dissoziieren, und Brom reaktiver ist als Iod. In flüssiger Form dissoziieren Iodmonochlorid und Iodmonobromid in I
2X+
und IX-
2-Anionen (X = Cl, Br); sie sind daher bedeutende Stromleiter und können als ionisierende Lösungsmittel verwendet werden. ⓘ
Jodtrifluorid (IF3) ist ein instabiler gelber Feststoff, der sich oberhalb von -28 °C zersetzt. Es ist daher wenig bekannt. Seine Herstellung ist schwierig, da Fluorgas dazu neigt, das Iod bis zum Pentafluorid zu oxidieren; es ist eine Reaktion bei niedriger Temperatur mit Xenondifluorid erforderlich. Jodtrichlorid, das im festen Zustand als planares Dimer I2Cl6 vorliegt, ist ein hellgelber Feststoff, der durch Reaktion von Jod mit flüssigem Chlor bei -80 °C synthetisiert wird; bei der Reinigung ist Vorsicht geboten, da es leicht in Jodmonochlorid und Chlor dissoziiert und daher als starkes Chlorierungsmittel wirken kann. Flüssiges Iodtrichlorid leitet Elektrizität, was möglicherweise auf eine Dissoziation zu ICl+
2 und ICl-
4-Ionen hinweist. ⓘ
Jodpentafluorid (IF5), eine farblose, flüchtige Flüssigkeit, ist das thermodynamisch stabilste Jodfluorid und kann durch Reaktion von Jod mit Fluorgas bei Raumtemperatur hergestellt werden. Es ist ein Fluorierungsmittel, aber mild genug, um in Glasapparaturen gelagert zu werden. Auch hier ist im flüssigen Zustand eine geringe elektrische Leitfähigkeit vorhanden, die auf die Dissoziation zu IF+
4 und IF-
6. Das fünfeckige bipyramidale Iodheptafluorid (IF7) ist ein äußerst starkes Fluorierungsmittel, das unter den Interhalogenen nur von Chlortrifluorid, Chlorpentafluorid und Brompentafluorid übertroffen wird: Es reagiert mit fast allen Elementen auch bei niedrigen Temperaturen, fluoriert Pyrexglas unter Bildung von Iod(VII)-oxyfluorid (IOF5) und setzt Kohlenmonoxid in Brand. ⓘ
Jodoxide und Oxosäuren

Jodoxide sind aufgrund der starken I-O-Bindungen, die sich aus dem großen Elektronegativitätsunterschied zwischen Jod und Sauerstoff ergeben, die stabilsten aller Halogenoxide und sind am längsten bekannt. Das stabile, weiße, hygroskopische Jodpentoxid (I2O5) ist seit seiner Entstehung im Jahr 1813 durch Gay-Lussac und Davy bekannt. Es lässt sich am einfachsten durch Dehydratisierung von Iodsäure (HIO3) herstellen, deren Anhydrid es ist. Es oxidiert Kohlenmonoxid bei Raumtemperatur schnell und vollständig zu Kohlendioxid und ist daher ein nützliches Reagenz zur Bestimmung der Kohlenmonoxidkonzentration. Es oxidiert auch Stickstoffoxid, Ethylen und Schwefelwasserstoff. Es reagiert mit Schwefeltrioxid und Peroxydisulfuryldifluorid (S2O6F2) unter Bildung von Salzen des Iodylkations [IO2]+ und wird durch konzentrierte Schwefelsäuren zu Iodosylsalzen mit [IO]+ reduziert. Es kann durch Fluor, Bromtrifluorid, Schwefeltetrafluorid oder Chlorylfluorid fluoriert werden, wobei Iodpentafluorid entsteht, das auch mit Iodpentoxid reagiert und Iod(V)oxyfluorid, IOF3, ergibt. Es sind noch einige andere, weniger stabile Oxide bekannt, insbesondere I4O9 und I2O4; ihre Strukturen sind nicht bestimmt worden, aber vernünftige Vermutungen lauten IIII(IVO3)3 bzw. [IO]+[IO3]-. ⓘ
|
+ Standard-Reduktionspotentiale für wässrige I-Spezies |
E°(Paar) | a(H+) = 1 (Säure) |
E°(Paar) | a(OH-) = 1 (Base) ⓘ |
|---|---|---|---|---|
| I2/I- | +0.535 | I2/I- | +0.535 | |
| HOI/I- | +0.987 | IO-/I- | +0.48 | |
| IO- 3/I- |
+0.26 | |||
| HOI/I2 | +1.439 | IO-/I2 | +0.42 | |
| IO- 3/I2 |
+1.195 | |||
| IO- 3/HOI |
+1.134 | IO- 3/IO- |
+0.15 | |
| IO- 4/IO- 3 |
+1.653 | |||
| H5IO6/IO- 3 |
+1.601 | H 3IO2- 6/IO- 3 |
+0.65 |
Wichtiger sind die vier Oxosäuren: Unterjodsäure (HIO), Jodsäure (HIO2), Jodsäure (HIO3) und Perjodsäure (HIO4 oder H5IO6). Wenn sich Jod in wässriger Lösung auflöst, kommt es zu folgenden Reaktionen:
| I2 + H2O ⇌ HIO + H+ + I- | Kac = 2,0 × 10-13 mol2 l-2 ⓘ | |
| I2 + 2 OH- | ⇌ IO- + H2O + I- | Kalk = 30 mol-1 l |
Hypojodsäure ist instabil gegenüber Disproportionierung. Die so gebildeten Hypoiodit-Ionen disproportionieren sofort zu Iodid und Iodat:
| 3 IO- ⇌ 2 I- + IO- 3 || K = 1020 ⓘ |
Jodsäure und Jodit sind noch weniger stabil und kommen, wenn überhaupt, nur als flüchtiges Zwischenprodukt bei der Oxidation von Jodid zu Jodat vor. Jodate sind die bei weitem wichtigsten dieser Verbindungen, die durch Oxidation von Alkalimetalljodiden mit Sauerstoff bei 600 °C und hohem Druck oder durch Oxidation von Jod mit Chloraten hergestellt werden können. Im Gegensatz zu den Chloraten, die nur sehr langsam zu Chlorid und Perchlorat disproportionieren, sind die Iodate sowohl in sauren als auch in alkalischen Lösungen stabil gegenüber Disproportionierung. Aus ihnen lassen sich die Salze der meisten Metalle gewinnen. Jodsäure lässt sich am einfachsten durch Oxidation einer wässrigen Jodsuspension durch Elektrolyse oder rauchende Salpetersäure herstellen. Iodat hat von den Halogenaten die schwächste Oxidationskraft, reagiert aber am schnellsten. ⓘ
Es sind viele Periodate bekannt, darunter nicht nur das erwartete tetraedrische IO-
4, sondern auch das quadratpyramidale IO3-
5, das oktaedrische Orthoperiodat IO5-
6, [IO3(OH)3]2-, [I2O8(OH2)]4-, und I
2O4-
9. Sie werden in der Regel durch elektrochemische Oxidation von alkalischem Natriumjodat (mit Blei(IV)-oxid als Anode) oder durch Chlorgas hergestellt:
- IO-
3 + 6 OH- → IO5-
6 + 3 H2O + 2 e- - IO-
3 + 6 OH- + Cl2 → IO5-
6 + 2 Cl- + 3 H2O ⓘ
Sie sind thermodymisch und kinetisch starke Oxidationsmittel, die Mn2+ schnell zu MnO-
4 und spalten Glykole, α-Diketone, α-Ketole, α-Aminoalkohole und α-Diamine. Orthoperiodat stabilisiert insbesondere hohe Oxidationsstufen unter den Metallen aufgrund seiner sehr hohen negativen Ladung von -5. Orthoperjodsäure, H5IO6, ist stabil und dehydratisiert bei 100 °C im Vakuum zu Metaperjodsäure, HIO4. Der Versuch, weiter zu gehen, führt nicht zu dem nicht vorhandenen Jodheptoxid (I2O7), sondern zu Jodpentoxid und Sauerstoff. Die Periodsäure kann durch Schwefelsäure protoniert werden, wobei das I(OH)+
6, das isoelektronisch zu Te(OH)6 und Sb(OH)-
6 und bildet Salze mit Bisulfat und Sulfat. ⓘ
Polyiodverbindungen
Löst sich Iod in starken Säuren wie rauchender Schwefelsäure, so entsteht eine hellblaue paramagnetische Lösung mit I+
2-Kationen enthält, gebildet. Ein festes Salz des Dijodkations kann durch Oxidation von Iod mit Antimonpentafluorid erhalten werden:
2 I2 + 5 SbF5 2 I2Sb2F11 + SbF3
Das Salz I2Sb2F11 ist dunkelblau, und auch das blaue Tantal-Analogon I2Ta2F11 ist bekannt. Während die I-I-Bindungslänge in I2 267 pm beträgt, ist die in I+
2 nur 256 pm, da bei letzterem das fehlende Elektron aus einem antibindenden Orbital entfernt wurde, wodurch die Bindung stärker und damit kürzer ist. In fluorschwefelsaurer Lösung dimerisiert das tiefblaue I+
2 unterhalb von -60 °C reversibel dimerisiert und bildet rotes rechteckiges diamagnetisches I2+
4. Andere Polyiodin-Kationen sind nicht so gut charakterisiert, darunter gebogenes dunkelbraunes oder schwarzes I+
3 und zentrosymmetrisches grünes oder schwarzes C2h I+
5, bekannt in den Verbindungen AsF-
6 und AlCl-
4-Salzen bekannt sind. ⓘ
Das einzige wichtige Polyiodid-Anion in wässriger Lösung ist das lineare Triiodid, I-
3. Seine Bildung erklärt, warum die Löslichkeit von Jod in Wasser durch den Zusatz von Kaliumjodidlösung erhöht werden kann:
- I2 + I- ⇌ I-
3 (Keq = ~700 bei 20 °C)
Viele andere Polyiodide können entstehen, wenn Lösungen, die Iod und Iodid enthalten, kristallisieren, z. B. I-
5, I-
9, I2-
4 und I2-
8, deren Salze mit großen, schwach polarisierenden Kationen wie Cs+ isoliert werden können. ⓘ
Jodorganische Verbindungen

Jodorganische Verbindungen waren von grundlegender Bedeutung für die Entwicklung der organischen Synthese, z. B. für die Hofmann-Eliminierung von Aminen, die Williamson-Ethersynthese, die Wurtz-Kupplungsreaktion und die Grignard-Reagenzien. ⓘ
Die Kohlenstoff-Jod-Bindung ist eine häufig vorkommende funktionelle Gruppe, die zum Kernbereich der organischen Chemie gehört; formal können diese Verbindungen als organische Derivate des Jodid-Anions betrachtet werden. Die einfachsten jodorganischen Verbindungen, die Alkyljodide, können durch die Reaktion von Alkoholen mit Phosphortrijodid synthetisiert werden; diese können dann in nukleophilen Substitutionsreaktionen oder zur Herstellung von Grignard-Reagenzien verwendet werden. Die C-I-Bindung ist die schwächste aller Kohlenstoff-Halogen-Bindungen, da der Unterschied in der Elektronegativität zwischen Kohlenstoff (2,55) und Iod (2,66) sehr gering ist. Daher ist Iodid die beste Abgangsgruppe unter den Halogenen, und zwar in einem solchen Maße, dass sich viele Organoiodverbindungen bei längerer Lagerung durch Zersetzung in elementares Iod gelb verfärben; aufgrund der einfachen Bildung und Spaltung der C-I-Bindung werden sie häufig in der organischen Synthese verwendet. Außerdem sind sie aufgrund des hohen Atomgewichts von Iod wesentlich dichter als die anderen halogenorganischen Verbindungen. Einige organische Oxidationsmittel wie die Iodane enthalten Iod in einer höheren Oxidationsstufe als -1, wie z. B. 2-Iodoxybenzoesäure, ein gängiges Reagenz für die Oxidation von Alkoholen zu Aldehyden, und Iodbenzoldichlorid (PhICl2), das für die selektive Chlorierung von Alkenen und Alkinen verwendet wird. Eine der bekannteren Verwendungen von Organojodverbindungen ist der so genannte Jodoformtest, bei dem Jodoform (CHI3) durch erschöpfende Jodierung eines Methylketons (oder einer anderen Verbindung, die zu einem Methylketon oxidiert werden kann) wie folgt hergestellt wird:
Einige Nachteile der Verwendung von Organoiodverbindungen im Vergleich zu Organochlor- oder Organobromverbindungen sind die höheren Kosten und die Toxizität der Iodderivate, da Iod teuer ist und Organoiodverbindungen stärkere Alkylierungsmittel sind. So denaturieren beispielsweise Iodacetamid und Iodessigsäure Proteine, indem sie Cysteinreste irreversibel alkylieren und die Neubildung von Disulfidbindungen verhindern. ⓘ
Der Halogenaustausch zur Herstellung von Iodalkanen durch die Finkelstein-Reaktion wird durch die Tatsache etwas erschwert, dass Iodid eine bessere Abgangsgruppe ist als Chlorid oder Bromid. Der Unterschied ist jedoch so gering, dass die Reaktion durch Ausnutzung der unterschiedlichen Löslichkeit der Halogenidsalze oder durch Verwendung eines großen Überschusses des Halogenidsalzes zu Ende geführt werden kann. Bei der klassischen Finkelstein-Reaktion wird ein Alkylchlorid oder ein Alkylbromid durch Behandlung mit einer Lösung von Natriumiodid in Aceton in ein Alkyliodid umgewandelt. Natriumiodid ist in Aceton löslich, Natriumchlorid und Natriumbromid sind es nicht. Die Reaktion wird durch Massenwirkung aufgrund der Ausfällung des unlöslichen Salzes zu den Produkten getrieben. ⓘ
Vorkommen und Herstellung
Jod ist das am wenigsten häufig vorkommende der stabilen Halogene und kommt in den Gesteinen der Erdkruste nur zu 0,46 Teilen pro Million vor (zum Vergleich: Fluor 544 ppm, Chlor 126 ppm, Brom 2,5 ppm). Unter den 84 Elementen, die in nennenswerten Mengen vorkommen (Elemente 1-42, 44-60, 62-83, 90 und 92), rangiert es in seiner Häufigkeit an 61. Jodidminerale sind selten, und die meisten Vorkommen, die für eine wirtschaftliche Gewinnung konzentriert genug sind, sind stattdessen Jodatminerale. Beispiele hierfür sind Lautarit, Ca(IO3)2, und Dietzeit, 7Ca(IO3)2-8CaCrO4. Diese Minerale kommen als Spurenverunreinigungen in der in Chile vorkommenden Caliche vor, deren Hauptprodukt Natriumnitrat ist. Insgesamt können sie mindestens 0,02 % und höchstens 1 % Jod nach Masse enthalten. Das Natriumjodat wird aus der Caliche extrahiert und mit Natriumbisulfit zu Jodid reduziert. Diese Lösung wird dann mit frisch extrahiertem Jodat zur Reaktion gebracht, was zu einer Komproportionierung zu Jod führt, das abfiltriert werden kann. ⓘ
Die Caliche war im 19. Jahrhundert die Hauptquelle für Jod und ist auch heute noch wichtig, da sie den Seetang ersetzt (der keine wirtschaftlich rentable Quelle mehr ist), aber im späten 20. Das japanische Minami Kanto-Gasfeld östlich von Tokio und das amerikanische Anadarko Basin-Gasfeld im Nordwesten Oklahomas sind die beiden größten dieser Quellen. Die Sole ist in der Tiefe der Quelle heißer als 60 °C. Die Sole wird zunächst gereinigt und mit Schwefelsäure angesäuert, dann wird das vorhandene Jodid mit Chlor zu Jod oxidiert. Es entsteht eine Jodlösung, die jedoch verdünnt ist und aufkonzentriert werden muss. In die Lösung wird Luft eingeblasen, um das Jod zu verdampfen, das dann in einen Absorptionsturm geleitet wird, wo Schwefeldioxid das Jod reduziert. Der Jodwasserstoff (HI) wird mit Chlor umgesetzt, um das Jod auszufällen. Nach dem Filtern und Reinigen wird das Jod verpackt. ⓘ
- 2 HI + Cl2 → I2↑ + 2 HCl
- I2 + 2 H2O + SO2 → 2 HI + H2SO4
- 2 HI + Cl2 → I2↓ + 2 HCl ⓘ
Diese Quellen sorgen dafür, dass Chile und Japan heute die größten Jodproduzenten sind. Alternativ kann die Sole mit Silbernitrat behandelt werden, um Jod als Silberjodid auszufällen, das dann durch Reaktion mit Eisen zu metallischem Silber und einer Lösung von Eisen(II)-Jodid zersetzt wird. Das Jod kann dann durch Verdrängung mit Chlor freigesetzt werden. ⓘ
Anwendungen
Etwa die Hälfte des produzierten Jods wird zu verschiedenen jodorganischen Verbindungen verarbeitet, weitere 15 % verbleiben als reines Element, weitere 15 % werden zur Herstellung von Kaliumjodid verwendet und weitere 15 % für andere anorganische Jodverbindungen. Zu den wichtigsten Verwendungszwecken von Jodverbindungen gehören Katalysatoren, Futtermittelzusätze, Stabilisatoren, Farbstoffe und Pigmente, pharmazeutische Produkte, Sanitärprodukte (aus Jodtinktur) und die Fotografie; zu den weniger wichtigen Verwendungszwecken gehören die Smogbekämpfung, die Wolkenbildung und verschiedene Anwendungen in der analytischen Chemie. ⓘ
Chemische Analyse

Die Iodid- und Iodat-Anionen werden häufig für quantitative volumetrische Analysen verwendet, zum Beispiel in der Iodometrie. Iod und Stärke bilden einen blauen Komplex, und diese Reaktion wird häufig für den Nachweis von Stärke oder Iod und als Indikator in der Iodometrie verwendet. Der Jodtest für Stärke wird immer noch verwendet, um gefälschte Banknoten aufzuspüren, die auf stärkehaltigem Papier gedruckt wurden. ⓘ
Die Jodzahl ist die Masse an Jod in Gramm, die von 100 Gramm einer chemischen Substanz, in der Regel Fetten oder Ölen, verbraucht wird. Die Jodzahl wird häufig verwendet, um den Grad der Ungesättigtheit in Fettsäuren zu bestimmen. Diese Ungesättigtheit liegt in Form von Doppelbindungen vor, die mit Jodverbindungen reagieren. In der Biologie wurden Linolsäure (C18:2 n-6), Omega-6 und Alpha-Linolensäure (C18:3 n-3) - Omega-3, Arachidonsäure (AA) - Omega-6 (C20:4n-6) und Docosahexaensäure (DHA) - Omega-3 (C22:6n-3) mit Jod synthetisiert, die sich im Laufe der Evolution des Lebens in den Zellmembranen entwickelt haben und für den Mechanismus der Apoptose, der Karzinogenese und der degenerativen Krankheiten wichtig sind. ⓘ
Kaliumtetraiodomercurat(II), K2HgI4, ist auch als Nessler-Reagenz bekannt. Es wird häufig als empfindlicher Spot-Test für Ammoniak verwendet. In ähnlicher Weise wird Cu2HgI4 als Fällungsreagenz zum Nachweis von Alkaloiden verwendet. Wässrige alkalische Iodlösung wird im Iodoformtest für Methylketone verwendet. ⓘ
Spektroskopie
Das Spektrum des Iodmoleküls I2 besteht (nicht ausschließlich) aus Zehntausenden von scharfen Spektrallinien im Wellenlängenbereich von 500-700 nm. Es ist daher eine häufig verwendete Wellenlängenreferenz (Sekundärstandard). Durch die Messung mit einer spektroskopischen Doppler-freien Technik bei Fokussierung auf eine dieser Linien wird die Hyperfeinstruktur des Iodmoleküls sichtbar. Eine Linie wird nun so aufgelöst, dass entweder 15 Komponenten (aus geraden Drehquantenzahlen, Jeven) oder 21 Komponenten (aus ungeraden Drehquantenzahlen, Jodd) messbar sind. ⓘ
Cäsiumjodid und Thallium-dotiertes Natriumjodid werden in Kristallszintillatoren für den Nachweis von Gammastrahlen verwendet. Der Wirkungsgrad ist hoch und energiedispersive Spektroskopie ist möglich, aber die Auflösung ist eher schlecht. ⓘ
Antrieb von Raumfahrzeugen
Anfang 2021 führte die französische Gruppe ThrustMe eine Demonstration eines elektrisch betriebenen Ionentriebwerks für Raumfahrzeuge in der Umlaufbahn durch, bei der Jod anstelle von Xenon als Plasmaquelle verwendet wurde, um durch die Beschleunigung von Ionen mit einem elektrostatischen Feld Schub zu erzeugen. ⓘ
Antriebssysteme, die Jod als Treibstoff verwenden, können kompakter gebaut werden, haben eine geringere Masse (und geringere Kosten) und arbeiten effizienter als die gitterförmigen Ionentriebwerke, die für den Antrieb früherer Raumfahrzeuge wie der japanischen Hayabusa-Sonden, des GOCE-Satelliten der ESA oder der DART-Mission der NASA eingesetzt wurden, die alle Xenon als Reaktionsmasse verwendeten. Das Atomgewicht von Jod ist jedoch nur 3,3 % geringer als das von Xenon, während die ersten beiden Ionisierungsenergien im Durchschnitt 12 % geringer sind; zusammengenommen machen diese Faktoren Jodionen zu einem vielversprechenden Ersatz. ⓘ
Die Verwendung von Jod dürfte eine breitere Anwendung der Ionenschubtechnologie ermöglichen, insbesondere bei kleineren Raumfahrzeugen. Der Europäischen Weltraumorganisation zufolge "könnte diese kleine, aber potenziell bahnbrechende Innovation dazu beitragen, den Himmel von Weltraumschrott zu befreien, indem sie es winzigen Satelliten ermöglicht, sich am Ende ihrer Missionen kostengünstig und einfach selbst zu zerstören, indem sie in die Atmosphäre gelenkt werden, wo sie verglühen würden". ⓘ
Medizin
Elementares Jod
Elementares Jod wird als Antiseptikum verwendet, entweder als Element oder als wasserlösliches Triiodid-Anion I3, das in situ durch Zugabe von Jodid zu schwer wasserlöslichem elementarem Jod erzeugt wird (durch die umgekehrte chemische Reaktion wird etwas freies elementares Jod für die Antisepsis verfügbar). Elementares Jod kann auch zur Behandlung von Jodmangel verwendet werden. ⓘ
Alternativ kann Jod aus Jodophoren hergestellt werden, die Jod in Komplexform mit einem Lösungsvermittler enthalten (das Jodid-Ion kann grob als Jodophor in Triiodid-Wasserlösungen betrachtet werden). Beispiele für solche Zubereitungen sind:
- Jodtinktur: Jod in Ethanol oder Jod und Natriumjodid in einer Mischung aus Ethanol und Wasser.
- Lugolsches Jod: Jod und Jodid allein in Wasser, wobei meist Trijodid gebildet wird. Im Gegensatz zur Jodtinktur enthält Lugol'sches Jod nur einen geringen Anteil an freiem Jod (I2).
- Povidon-Iod (ein Iodophor).
- Jod-V: Jod (I2) und Fulvosäure bilden eine Clathratverbindung (Jodmoleküle werden von Fulvosäure in diesem Wirt-Gast-Komplex "eingesperrt"). Ein wasserlöslicher, fester, stabiler, kristalliner Komplex. Im Gegensatz zu anderen Iodophoren enthält Iod-V nur Iod in molekularer Form (I2). ⓘ
Die antimikrobielle Wirkung von Jod ist schnell und wirkt bereits bei niedrigen Konzentrationen, weshalb es in Operationssälen eingesetzt wird. Seine spezifische Wirkungsweise ist unbekannt. Es dringt in die Mikroorganismen ein und greift bestimmte Aminosäuren (wie Cystein und Methionin), Nukleotide und Fettsäuren an, was letztlich zum Zelltod führt. Es hat auch eine antivirale Wirkung, aber Viren ohne Lipidhülle und Parvoviren sind weniger empfindlich als lipidumhüllte Viren. Jod greift wahrscheinlich die Oberflächenproteine der umhüllten Viren an und kann auch die Membranfettsäuren destabilisieren, indem es mit ungesättigten Kohlenstoffbindungen reagiert. ⓘ
Andere Formulierungen
In der Medizin wird eine gesättigte Kaliumjodidlösung zur Behandlung der akuten Thyreotoxikose eingesetzt. Es wird auch verwendet, um die Aufnahme von Jod-131 in der Schilddrüse zu blockieren (siehe Abschnitt Isotope oben), wenn dieses Isotop als Teil von Radiopharmaka (wie Iobenguan) verwendet wird, die nicht auf die Schilddrüse oder schilddrüsenähnliche Gewebe abzielen. ⓘ
Jod-131 (in der Regel als Jodid) ist ein Bestandteil des nuklearen Fallouts und besonders gefährlich, da die Schilddrüse dazu neigt, aufgenommenes Jod zu konzentrieren und es länger als die radiologische Halbwertszeit dieses Isotops von acht Tagen zu speichern. Aus diesem Grund können Personen, die dem Risiko einer Exposition gegenüber radioaktivem Jod (Jod-131) in der Umwelt ausgesetzt sind, angewiesen werden, nicht-radioaktive Kaliumjodidtabletten einzunehmen. Die typische Dosis für Erwachsene ist eine 130-mg-Tablette pro 24 Stunden, die 100 mg (100.000 Mikrogramm) ionisches Jod liefert. (Die typische Tagesdosis an Jod für eine normale Gesundheit liegt in der Größenordnung von 100 Mikrogramm; siehe unten "Nahrungsaufnahme"). Die Aufnahme dieser hohen Dosis an nicht-radioaktivem Jod minimiert die Aufnahme von radioaktivem Jod durch die Schilddrüse. ⓘ

Als Element mit hoher Elektronendichte und Ordnungszahl absorbiert Jod aufgrund des photoelektrischen Effekts der innersten Elektronen Röntgenstrahlen, die schwächer als 33,3 keV sind. Jodorganische Verbindungen werden bei intravenöser Injektion als Röntgenkontrastmittel verwendet. Diese Anwendung erfolgt häufig in Verbindung mit fortgeschrittenen Röntgentechniken wie Angiographie und CT-Scanning. Gegenwärtig basieren alle wasserlöslichen Radiokontrastmittel auf Jod. ⓘ
Andere
Bei der Herstellung von Ethylendiamindihydroiodid, das als Nahrungsergänzungsmittel für die Viehzucht verwendet wird, wird ein großer Teil des verfügbaren Jods verbraucht. Eine weitere wichtige Verwendung ist ein Katalysator für die Herstellung von Essigsäure nach dem Monsanto- und dem Cativa-Verfahren. Bei diesen Verfahren, die den weltweiten Bedarf an Essigsäure decken, wandelt die Jodwasserstoffsäure den Ausgangsstoff Methanol in Methyljodid um, das carbonyliert wird. Durch Hydrolyse des entstehenden Acetyljodids wird Jodwasserstoffsäure regeneriert und Essigsäure erzeugt. ⓘ
Anorganische Iodide finden besondere Verwendung. Titan, Zirkonium, Hafnium und Thorium werden nach dem van Arkel-de Boer-Verfahren gereinigt, bei dem die Tetraiodide dieser Elemente reversibel gebildet werden. Silberjodid ist ein Hauptbestandteil des traditionellen Fotofilms. Tausende von Kilogramm Silberjodid werden jährlich für das Cloud Seeding verwendet, um Regen herbeizuführen. ⓘ
Die Organojodverbindung Erythrosin ist ein wichtiger Lebensmittelfarbstoff. Perfluoralkyljodide sind Vorläufer wichtiger Tenside, wie z. B. Perfluoroctansulfonsäure. ⓘ
Die Iod-Uhr-Reaktion (bei der Iod auch als Test für Stärke dient, indem es einen dunkelblauen Komplex bildet) ist ein beliebtes Demonstrationsexperiment für den Unterricht und ein Beispiel für eine scheinbar oszillierende Reaktion (es ist nur die Konzentration eines Zwischenprodukts, die oszilliert). ⓘ
Obwohl Jod bei vielen Arten eine weit verbreitete Rolle spielt, können jodhaltige Mittel eine unterschiedliche Wirkung auf verschiedene Arten in einem landwirtschaftlichen System ausüben. Das Wachstum aller Stämme von Fusarium verticillioides wird durch ein jodhaltiges Fungistatikum (AJ1629-34EC) in Konzentrationen, die der Kultur nicht schaden, deutlich gehemmt. Aufgrund seiner relativ natürlichen Chemie könnte dies ein weniger toxisches Mittel zur Bekämpfung von Pilzen in der Landwirtschaft sein. ⓘ
125I wird als radioaktive Markierung verwendet, um zu untersuchen, welche Liganden zu welchen pflanzlichen Mustererkennungsrezeptoren (PRRs) gehen. ⓘ
Biologische Rolle


Jod ist ein lebensnotwendiges Element und mit der Ordnungszahl Z = 53 das schwerste Element, das lebende Organismen üblicherweise benötigen. (Lanthan und die anderen Lanthaniden sowie Wolfram mit Z = 74 werden von einigen wenigen Mikroorganismen verwendet). Es wird für die Synthese der wachstumsregulierenden Schilddrüsenhormone Thyroxin und Trijodthyronin (T4 bzw. T3, benannt nach der Anzahl ihrer Jodatome) benötigt. Ein Jodmangel führt zu einer verminderten Produktion von T3 und T4 und einer gleichzeitigen Vergrößerung des Schilddrüsengewebes in dem Versuch, mehr Jod zu erhalten, was die als einfache Struma bekannte Krankheit verursacht. Die Hauptform des Schilddrüsenhormons im Blut ist Thyroxin (T4), das eine längere Halbwertszeit als T3 hat. Beim Menschen liegt das Verhältnis von T4 zu T3, das ins Blut abgegeben wird, zwischen 14:1 und 20:1. T4 wird in den Zellen durch Deiodinasen (5'-Jodinase) in das aktive T3 umgewandelt (drei- bis viermal stärker als T4). Diese werden durch Decarboxylierung und Deiodierung weiterverarbeitet, um Jodthyronamin (T1a) und Thyronamin (T0a') herzustellen. Alle drei Isoformen der Deiodinasen sind selenhaltige Enzyme; daher ist Selen in der Nahrung für die T3-Produktion unerlässlich. ⓘ
Jod macht 65 % des Molekulargewichts von T4 und 59 % von T3 aus. Fünfzehn bis 20 mg Jod sind im Schilddrüsengewebe und in den Schilddrüsenhormonen konzentriert, aber 70 % des gesamten Jods im Körper befinden sich in anderen Geweben, darunter in den Brustdrüsen, den Augen, der Magenschleimhaut, dem fötalen Thymus, der Gehirn-Rückenmarks-Flüssigkeit und dem Plexus choroideus, den Arterienwänden, dem Gebärmutterhals und den Speicheldrüsen. In die Zellen dieser Gewebe gelangt das Jodid direkt über den Natrium-Jodid-Symporter (NIS). Die Wirkung von Jod im Brustgewebe hängt mit der fötalen und neonatalen Entwicklung zusammen, während sie in den anderen Geweben (zumindest) teilweise unbekannt ist. ⓘ
Zur Rolle der Iodversorgung bei Schilddrüsenkrankheiten siehe Jodprophylaxe, Iodunverträglichkeit, Hyperthyreose und Hashimoto-Thyreoiditis. ⓘ
Aufnahme über die Nahrung
Die von der Nationalen Akademie für Medizin der Vereinigten Staaten empfohlene Tagesdosis liegt zwischen 110 und 130 µg für Säuglinge bis zu 12 Monaten, 90 µg für Kinder bis zu acht Jahren, 130 µg für Kinder bis zu 13 Jahren, 150 µg für Erwachsene, 220 µg für Schwangere und 290 µg für Stillende. Die tolerierbare obere Aufnahmemenge (UL) für Erwachsene beträgt 1.100 μg/Tag. Diese Obergrenze wurde durch die Analyse der Auswirkungen einer Supplementierung auf das schilddrüsenstimulierende Hormon ermittelt. ⓘ
Die Schilddrüse benötigt nicht mehr als 70 μg/Tag, um die erforderlichen Tagesmengen an T4 und T3 zu synthetisieren. Die höheren empfohlenen Tagesdosen an Jod scheinen für die optimale Funktion einer Reihe von Körpersystemen notwendig zu sein, einschließlich der Stillzeit, der Magenschleimhaut, der Speicheldrüsen, der Gehirnzellen, des Plexus choroideus, der Thymusdrüse und der Arterienwände. ⓘ
Natürliche Jodquellen sind Meeresfrüchte wie Fisch, Algen (z. B. Seetang) und Schalentiere, Milchprodukte und Eier, sofern die Tiere ausreichend mit Jod versorgt wurden, sowie Pflanzen, die auf jodhaltigem Boden wachsen. Jodsalz ist mit Jod in Form von Natriumjodid angereichert. ⓘ
Im Jahr 2000 lag die durchschnittliche Jodzufuhr aus der Nahrung in den Vereinigten Staaten bei 240 bis 300 μg/Tag für Männer und 190 bis 210 μg/Tag für Frauen. Die allgemeine US-Bevölkerung ist ausreichend mit Jod versorgt, wobei bei Frauen im gebärfähigen Alter und bei Schwangeren möglicherweise ein geringes Risiko für einen Mangel besteht. In Japan wurde der Verbrauch als viel höher eingeschätzt und lag zwischen 5.280 μg/Tag und 13.800 μg/Tag aus Seetang oder Kombu-Tang, der häufig in Form von Kombu-Umami-Extrakten für Suppenbrühe und Kartoffelchips verzehrt wird. Neue Studien deuten jedoch darauf hin, dass der Konsum in Japan eher bei 1.000-3.000 μg/Tag liegt. Der UL-Wert für Erwachsene in Japan wurde zuletzt 2015 auf 3.000 µg/Tag angehoben. ⓘ
Nach der Einführung von Jodanreicherungsprogrammen wie der Jodierung von Salz wurden einige Fälle von jodinduzierter Schilddrüsenüberfunktion beobachtet (das sogenannte Jod-Basedow-Phänomen). Diese Erkrankung scheint vor allem bei Menschen über vierzig Jahren aufzutreten, und das Risiko scheint höher zu sein, wenn der Jodmangel schwerwiegend ist und die anfängliche Jodzufuhr stark ansteigt. ⓘ
Jodmangel
In Gebieten, in denen die Ernährung wenig Jod enthält, typischerweise in abgelegenen Gebieten im Landesinneren und in halbtrockenen äquatorialen Klimazonen, in denen keine Meeresfrüchte verzehrt werden, führt Jodmangel zu einer Schilddrüsenunterfunktion (Hypothyreose), deren Symptome extreme Müdigkeit, Kropf, geistige Verlangsamung, Depression, Gewichtszunahme und niedrige Basaltemperatur sind. Jodmangel ist die Hauptursache für vermeidbare geistige Behinderungen, die vor allem dann auftreten, wenn Säuglinge oder Kleinkinder durch einen Mangel an diesem Element eine Schilddrüsenunterfunktion erleiden. Durch den Zusatz von Jod zum Speisesalz konnte dieses Problem in den wohlhabenderen Ländern weitgehend beseitigt werden, aber in den Entwicklungsländern ist Jodmangel nach wie vor ein ernstes Problem der öffentlichen Gesundheit. Jodmangel ist auch in bestimmten Gebieten Europas ein Problem. Die Informationsverarbeitung, die Feinmotorik und das visuelle Problemlösen werden bei Kindern mit mäßigem Jodmangel durch eine Jodsättigung verbessert. ⓘ
Vorsichtsmaßnahmen
Toxizität
|
+ Iod ⓘ | |
| Gefahren | |
|---|---|
| GHS-Kennzeichnung: | |
Piktogramme
|
 
|
Signalwort
|
Gefahr |
Gefahrenhinweise
|
H312, H315, H319, H332, H335, H372, H400 |
Sicherheitshinweise
|
P261, P273, P280, P305, P314, P338, P351 |
| NFPA 704 (Feuerdiamant) | |
Elementares Jod (I2) ist giftig, wenn es unverdünnt oral eingenommen wird. Die tödliche Dosis für einen erwachsenen Menschen beträgt 30 mg/kg, was bei einem 70 bis 80 kg schweren Menschen etwa 2,1 bis 2,4 Gramm entspricht (auch wenn Versuche an Ratten gezeigt haben, dass diese Tiere nach dem Verzehr einer Dosis von 14000 mg/kg überleben können). Überschüssiges Jod kann bei Selenmangel zytotoxisch wirken. Eine Jodsupplementierung in Bevölkerungsgruppen mit Selenmangel ist theoretisch problematisch, auch aus diesem Grund. Die Toxizität ergibt sich aus seinen oxidierenden Eigenschaften, durch die es Proteine (einschließlich Enzyme) denaturiert. ⓘ
Elementares Jod ist auch ein Hautreizstoff. Der direkte Kontakt mit der Haut kann zu Schäden führen, und feste Jodkristalle sollten mit Vorsicht gehandhabt werden. Lösungen mit einer hohen Konzentration an elementarem Jod, wie z. B. Jodtinktur und Lugolsche Lösung, können bei längerer Reinigung oder Antisepsis zu Gewebeschäden führen; ebenso führte flüssiges Povidon-Jod (Betadine), das auf die Haut aufgetragen wurde, in einigen gemeldeten Fällen zu chemischen Verbrennungen. ⓘ
Berufliche Exposition
Menschen können Jod am Arbeitsplatz durch Einatmen, Verschlucken, Haut- und Augenkontakt ausgesetzt sein. Die Occupational Safety and Health Administration (OSHA) hat den gesetzlichen Grenzwert (zulässiger Grenzwert) für die Jodbelastung am Arbeitsplatz auf 0,1 ppm (1 mg/m3) während eines 8-Stunden-Arbeitstages festgelegt. Das National Institute for Occupational Safety and Health (NIOSH) hat einen empfohlenen Expositionsgrenzwert (REL) von 0,1 ppm (1 mg/m3) während eines 8-Stunden-Arbeitstages festgelegt. Bei einer Konzentration von 2 ppm ist Jod unmittelbar lebens- und gesundheitsgefährlich. ⓘ
Allergische Reaktionen
Manche Menschen entwickeln eine Überempfindlichkeit gegen jodhaltige Produkte und Lebensmittel. Die Anwendung von Jodtinktur oder Betadin kann zu Ausschlägen führen, die manchmal schwerwiegend sind. Die parenterale Anwendung von jodhaltigen Kontrastmitteln (siehe oben) kann Reaktionen hervorrufen, die von einem leichten Ausschlag bis zu einer tödlichen Anaphylaxie reichen. Solche Reaktionen haben zu dem (selbst unter Ärzten weit verbreiteten) Irrglauben geführt, dass manche Menschen gegen Jod selbst allergisch sind; sogar Allergien gegen jodhaltige Meeresfrüchte wurden so ausgelegt. Tatsächlich wurde noch nie über eine echte Jodallergie berichtet, und eine Allergie gegen elementares Jod oder einfache Jodidsalze ist theoretisch unmöglich. Überempfindlichkeitsreaktionen auf jodhaltige Produkte und Lebensmittel hängen offenbar mit deren anderen molekularen Bestandteilen zusammen; so kann eine Person, die nachweislich auf ein jodhaltiges Lebensmittel oder Produkt allergisch reagiert, nicht auf ein anderes allergisch reagieren. Patienten mit verschiedenen Nahrungsmittelallergien (Schalentiere, Ei, Milch usw.) haben kein erhöhtes Risiko für eine Kontrastmittelüberempfindlichkeit. Wie bei allen Medikamenten sollte die Allergieanamnese des Patienten erfragt und konsultiert werden, bevor jodhaltige Medikamente verabreicht werden. ⓘ
US DEA Liste I Status
Phosphor kann elementares Jod zu Jodwasserstoffsäure reduzieren, die ein wirksames Reagenz für die Reduktion von Ephedrin oder Pseudoephedrin zu Methamphetamin ist. Aus diesem Grund wurde Jod von der United States Drug Enforcement Administration gemäß 21 CFR 1310.02 als Vorläuferchemikalie der Liste I eingestuft. ⓘ
In der Populärkultur
In der Pilotfolge von Breaking Bad ist ein Behälter mit Jod zu sehen, als Walter White zum ersten Mal Methamphetamin über die Nagai-Route synthetisiert, indem er roten Phosphor und Jod verwendet, um Pseudoephedrin zu reduzieren. ⓘ
Vorkommen
Iod ist abgesehen von Astat wesentlich seltener als die übrigen Halogene. In der Natur ist es weit verbreitet, jedoch nur in Form seiner Verbindungen, zum Beispiel angereichert (0,02–1 %) im Chilesalpeter, hauptsächlich in Form von Natriumiodat (NaIO3), aber auch Natriumperiodat (NaIO4) und Lautarit (Ca(IO3)2). In geringen Spuren ist es in Böden und Gesteinen nachweisbar. Im Durchschnitt enthält 1000 Gramm wasserfreier Feinboden aus dem deutschen Raum etwa 2,5 Milligramm Iod. Der Iodgehalt des Bodens ist wesentlich für die Versorgung der Bevölkerung mit natürlichem Iod. Als Iodwasserstoff kommt es in geringsten Mengen in vulkanischen Gasen vor. ⓘ
Lösliche Iodverbindungen wie Alkali- und Erdalkaliiodide werden während der Verwitterung von Gesteinen durch Regenwasser freigesetzt oder zerfallen bei höheren Temperaturen. So gelangen sie ins Grundwasser und schließlich in die Meere. Einige Mineralwässer enthalten Iod. Die Mineralquelle von Woodhall Spa in Lincolnshire (England) bringt Wasser hervor, das durch Iod braun gefärbt ist. Im Meerwasser liegt die Menge an Iod bei 0,05 Milligramm pro Liter. Es kommt dort in Form von Iodid (I−) und Iodat (IO3−) in einer Konzentration von etwa 500 nmol/L vor. Die Verteilung variiert in Oberflächenwasser im Allgemeinen von 0–200 nmol I−/L. ⓘ
In der Erdatmosphäre ist Iod in Form von organischen Verbindungen oder anorganisch in Form von Iodoxid (IO), Iodnitrat oder höheren Oxiden zu finden. Für die Stratosphäre gibt es wenig Informationen und eine obere Grenze von 0,1 ppt für anorganisches Iod. Über Algenfeldern an Küsten wurden hohe Konzentrationen von mehr als 10 ppt IO nachgewiesen und auch auf dem tropischen Atlantik wurde das Iodoxid-Radikal nachgewiesen. ⓘ
Organische Iodverbindungen kann man aus Meeresalgen (19 Gramm Iod pro Kilogramm Trockenmasse), Tangen und Schwämmen (bis zu 14 Gramm Iod pro Kilogramm Trockenmasse) isolieren. Die globale Menge Iod in Meerwasser wird auf 90 Milliarden Tonnen geschätzt, die derzeit (2022) bekannten globalen Iodreserven betragen 6,2 Millionen Tonnen. Eine Knappheit ist trotz der relativen Seltenheit von Iod deshalb nicht gegeben oder zu erwarten. Das spiegelt sich auch im Preis wieder, der 2021 deutlich unter dem Höchststand aus dem Jahr 2013 (bis zu 85 $ pro kg) bei durchschnittlich 36,5 $ pro kg notierte. Die Gewinnung aus Seegras und Algen spielt dabei derzeit eine untergeordnete Rolle, da die Gewinnung als Nebenprodukt aus dem Bergbau bzw. Gas- und Ölföderung kommerziell erfolgreicher ist. Vor 1959 war diese Form der Iodgewinnung jedoch vorherrschend. Die weltweite Iodförderung betrug 2020 über 30.000 Tonnen, ohne Fördermengen aus den USA, die diese als Geschäftsgeheimnis seit 2005 nicht mehr veröffentlichen. Größter globaler Iodproduzent ist Chile mit seinen Nitratminen, aus denen ca. 2/3 der globalen Iodmengen gewonnen werden. Zweitgrößter Produzent ist Japan, wo Iod bei der Öl- und Gasförderung gewonnen wird und auf Platz 3 der wichtigsten Quellen liegt Soleförderung aus Minen im nordwestlichen Oklahoma. ⓘ
| Land | 2005 | 2019 | 2020 | Reserven ⓘ |
|---|---|---|---|---|
| (in Tonnen) | ||||
| 300 | 190 | 180 | 170000 | |
| 15000 | 20200 | 20000 | 610000 | |
| 550 | n.bek. | n.bek. | n.bek. | |
| 75 | 40 | 31 | 100000 | |
| 7300 | 9100 | 8880 | 4900000 | |
| 300 | 2 | 3 | 120000 | |
| 270 | 600 | 600 | 70000 | |
| 1570 | n.bek. | n.bek. | 250000 | |
| Gesamt (gerundet) | 25400 | 30100 | 29900 | 6200000 |
Gewinnung und Darstellung
Früher gewann man Iod in Form von Iodiden und Iodaten, indem man die durch die Flut an den Strand angeschwemmten Tange einsammelte und verbrannte. Die erhaltene Asche enthielt etwa 0,1–0,5 % Iod. Diese Iodgewinnung hat heute jedoch nur noch lokale Bedeutung und macht ungefähr 2 % der Weltjahresproduktion aus. ⓘ
Die technische Gewinnung von Iod ist eng mit der Salpetergewinnung verknüpft. Das in den Mutterlaugen enthaltene Iodat wird durch Reduktion in elementares Iod umgewandelt. Im ersten Reaktionsschritt setzt man Schweflige Säure ein, um Iodsäure (Iodat ist das Anion dieser Säure) zu Iodwasserstoff zu reduzieren:
- Iodsäure und Schweflige Säure reagieren zu Iodwasserstoff und Schwefelsäure ⓘ
Der Iodwasserstoff wird wiederum in einem zweiten Schritt durch die in der Lösung vorhandene Iodsäure zu Iod oxidiert. Man spricht in diesem Fall von einer Komproportionierung, da Iod in zwei verschiedenen Oxidationsstufen (−1 im Iodwasserstoff und +5 in der Iodsäure) zu elementarem Iod mit der Oxidationsstufe 0 wird. ⓘ
Alternativ kann zur Reduktion auch Schwefeldioxid (SO2) den Endlaugen, aus denen der Salpeter bereits aus kristallisiert ist, zugesetzt werden. ⓘ
Bei der Erdöl- und Erdgasförderung fallen bedeutende Mengen an Salzsole an, die einen Iodgehalt von 30 bis über 100 ppm aufweisen. Das in Form von Natriumiodid vorliegende Iod wird durch die Oxidation mit Chlor aus der Sole freigesetzt:
- Natriumiodid und Chlor reagieren zu Natriumchlorid und Iod ⓘ
Eine weitere Reinigung des gewonnenen Iods wird dadurch erreicht, dass es mit Luft ausgeblasen, anschließend mit Schwefeldioxid in schwefelsaurer Lösung wieder reduziert und zum Schluss mit gasförmigem Chlor zum Iod zurück oxidiert wird. ⓘ
- Iod wird durch Schwefeldioxid zu Iodwasserstoff reduziert
- Iodwasserstoff und Chlor reagieren zu Chlorwasserstoff und Iod ⓘ
Chromatographisch kann Iod mittels Adsorption von Polyiodid an Anionenaustauschern angereichert werden. Zur Reinstherstellung setzt man Kaliumiodid und halogenfreies Kupfersulfat ein. ⓘ
Im Labormaßstab lässt sich Iod durch Einwirken von Schwefelsäure und Mangan(IV)-oxid oder Wasserstoffperoxid auf Kaliumiodid herstellen. Die Gewinnung gelingt ebenso aus der iodhaltigen Asche von Meerespflanzen durch Behandlung mit Chlor. ⓘ
Verwendung
Lebensmittel
| Tiergruppe | Iodmenge [mg/kg] ⓘ |
|---|---|
| Unpaarhufer (Pferde, Esel, Maultiere) |
4 |
| Milchkühe | 5 |
| Legehennen | 5 |
| Schweine | 10 |
| Mastgeflügel | 10 |
| Fische | 20 |
Der Mineralstoff Iod (meist in der Form als Iodid) gilt in der Ernährung der Menschen und vieler Tiere als Nährstoff und hierbei als essentielles Spurenelement. Insbesondere Jodsalz wird als iodiertes Lebensmittel (angereichert mit Iodaten) zur Vorbeugung gegen Jodmangel eingesetzt. In Verordnung (EG) Nr. 1925/2006 (Anreicherungsverordnung) wurde der Iodgehalt in Lebensmitteln festgesetzt, um ihn gesundheitsbezogen entsprechend Verordnung (EG) Nr. 1924/2006 (Health Claims) in der Europäischen Union (deklariert nach Maßgabe der nationalen Lebensmittel-Kennzeichnungsverordnungen in Deutschland, Österreich und der Schweiz) bewerben zu dürfen. Dazu wird es oft zugesetzt, meist als Calciumiodid. Auch in Fertig-Tierfutter wird Iod zugesetzt, so in den meisten Katzen- und Hundenahrungen, aber auch Vogelfutter (z. B. für Kanarienvögel) kann iodiert werden. Für die Iodzugabe bei Schlachttieren gelten in der EU auf Empfehlung bzw. auf Befragen der Europäischen Behörde für Lebensmittelsicherheit (EFSA) Höchstgehalte. (siehe nebenstehende Tabelle) ⓘ
In Deutschland kommen Iodverbindungen in den Böden unverändert in zu geringen Mengen vor. Durch die Jodprophylaxe, die im Wesentlichen aus der Iodierung von Speisesalz („Jodsalz“) und der Iodierung von Futtermitteln in der Landwirtschaft besteht, konnte die Iodversorgung in Deutschland soweit verbessert werden, dass die Iodurie bei Kindern – die als zuverlässigstes Kriterium zur Beurteilung der Iodversorgung gilt – in einer großen Stichprobe zwischen 2003 und 2006 im Median 117 μg/l erreichte. Sie lag damit im unteren Bereich der von der Weltgesundheitsorganisation (WHO) empfohlenen Spanne von 100 bis 200 μg/l. Damit gilt Deutschland nach WHO-Kriterien als ausreichend mit Iod versorgt. Dennoch besteht in Deutschland bei 36 % der Bevölkerung ein milder und bei 21 % ein moderater bis schwerer Jodmangel. ⓘ
Medizinische Anwendungen

Iodtinktur und Iodoform enthalten Iod in elementarer bzw. gebundener Form und dienen als Antimykotikum und Antiseptikum. Es wird vermutet, dass die desinfizierende Wirkung auf der Abspaltung von Sauerstoff aus Wasser beruht. Dieser Sauerstoff ist kurz nach seiner Freisetzung (in statu nascendi) besonders reaktionsfähig:
Dieser Mechanismus wird auch für die anderen Halogene diskutiert. Iod wird aus diesem Grund in einzelnen Fällen auch zur Desinfektion von Wasser in Badeanstalten genutzt. Vorteilhaft ist in diesem Zusammenhang, dass Iod weniger aggressiv ist als Chlor. Allerdings vermag diese Wasserbehandlung nicht Algen abzutöten, so dass zusätzlich ein Algizid zugesetzt werden muss. Der intensive Gebrauch von Iod kann aber zu Hautverfärbungen führen. Auch besteht die Gefahr der Allergisierung. Beides ist durch Einsatz von so genannten Iodophoren, Trägermaterialien, die Iod binden können, vermeidbar. ⓘ
Iodate werden in Form von Natriumiodat oder Kaliumiodat in geringen Mengen dem Speisesalz zugesetzt, um Jodmangelerkrankungen vorzubeugen. Es wird im Handel umgangssprachlich als Jodsalz angeboten. ⓘ
Die radioaktiven Iod-Isotope 131I (8,02 Tage Halbwertszeit) und 123I (13,22 Stunden Halbwertszeit) werden als Radiopharmaka in der nuklearmedizinischen Diagnostik und Therapie vorwiegend von Schilddrüsenerkrankungen eingesetzt (vergleiche Radiojodtherapie), wobei 131I heute verstärkt zum Einsatz kommt. Zur Bestimmung des Knochenmineralgehalts wird 125I (Gammastrahlung von Eγ = 35 keV, 59,4 Tage Halbwertszeit) herangezogen. 125I ist zudem das am häufigsten im Radioimmunassay (RIA) verwendete Radioisotop. ⓘ
Iod ist ein häufig eingesetzter Katalysator bei chemischen Reaktionen. So verwendet man es bei stereospezifischen Polymerisationen von 1,3-Butadien. Die Sulfurierung aromatischer Verbindungen sowie die Alkylierung und Kondensation aromatischer Amine sind weitere Einsatzfelder. ⓘ
Aromatische Iodverbindungen werden als Röntgenkontrastmittel in der Diagnostik eingesetzt. ⓘ
Natriumiodid wird als Szintillator in Szintillationszählern eingesetzt. ⓘ
Strahlenschutz
Radioaktive Iod-Isotope sind im Fallout von Nuklearexplosionen und im Reaktor von Kernkraftwerken (KKW) enthalten. Für den Fall eines Atomunfalles mit der Freisetzung radioaktiver Iodisotope bevorraten Bund und Länder in der Umgebung der deutschen Kernkraftwerke insgesamt 137 Millionen Kaliumiodid-Tabletten mit hohem Gehalt des stabilen Iodisotops 127I (meist als „Jod-Tabletten“ bezeichnet), die im Kontaminierungsfall durch eine Iodblockade die Aufnahme der radioaktiven Iodisotope in der Schilddrüse verhindern sollen. Der Vorrat wurde zuletzt 2004 erneuert. In der Schweiz werden an alle Personen, die im Umkreis von 50 Kilometer um ein Kernkraftwerk wohnen (rund 4,6 Millionen), sowie an die dort ansässigen Betriebe Kaliumiodid-Tabletten abgegeben. ⓘ
Iod-Radionuklide liegen als Ergebnis der Kernspaltung in hoher Konzentration im Gap, dem Spalt zwischen den Brennstofftabletten und dem Hüllrohr der KKW-Brennstäbe, vor. Sollte der Sicherheitsbehälter des KKW im Falle eines Kernschadens oder gar einer Kernschmelze nach Unfalleintritt ein Leck aufweisen, so sorgt es aus Sicht des Strahlenschutzes für großen Schaden, da es als sehr flüchtiges Nuklid praktisch als erstes, neben den radioaktiven Isotopen 85Kr und 135Xe der Edelgase Krypton und Xenon, in größerer Konzentration freigesetzt wird und in den biologischen Kreislauf gelangt. ⓘ
Biologische Bedeutung

Nach Aufnahme von größeren, im Milligrammbereich liegenden Dosen von Iodverbindungen treten Reizwirkungen an Haut und Schleimhäuten auf. Dies kann zum „Jodismus“ führen, einhergehend mit den Symptomen Schnupfen („Jodschnupfen“), Konjunktivitis, Bronchitis und Exanthemen. Die Wirkung auf die Bronchialschleimhaut hat dazu geführt, dass Iodsalze früher als Expektorans benutzt wurden. Andererseits kann hochdosiertes Iodid bei Hyperthyreose zur Suppression genutzt werden, da es die Freisetzung und die Synthese von Schilddrüsenhormonen hemmt. ⓘ
Sicherheitshinweise
Iod ist von der EU als Gefahrstoff klassifiziert, dessen Freisetzung in die Umwelt zu vermeiden ist. Beim Umgang mit dem Element sind entsprechende Schutzmaßnahmen einzuhalten. Reste von Iod sind mit Natriumthiosulfat-Lösung zu behandeln (→ Reduktion zu Iodid). Vor der Entsorgung ins Abwasser muss der pH-Wert des Reaktionsgemisches mit Natriumhydrogencarbonat neutralisiert werden. Iod darf niemals mit Ammoniak in Verbindung gebracht werden, da sich sonst explosiver Iodstickstoff bilden kann. ⓘ
Analytik
Instrumentelle quantitative Analytik des Iods
Atomabsorptionsspektrometrie (AAS)
Iod ist mit Hilfe der AAS praktisch nicht routinemäßig nachweisbar, da die Resonanzlinie im Vakuum-UV bei 183,0 nm liegt. Lediglich vereinzelte analytische Arbeitsgruppen berichten von indirekten Verfahren, welche jedoch mit großen Unsicherheiten behaftet sind. ⓘ
Atomemissionsspektrometrie (AES)
Iodid kann mit Hilfe der ICP-AES (ICP, induktiv-gekoppeltes Plasma) nachgewiesen werden. Eine Methode ist die oxidative Ioddampferzeugung. Die aus Iodat reduktiv erzeugten Iodidionen werden im Plasma atomisiert und zur Emission bei 178,3 nm angeregt. Die mit dieser Methode erreichte Nachweisgrenze beträgt 0,4 μg/l. ⓘ
Massenspektrometrie (MS)
In der Natur kommt nur das Isotop 127I vor. Es ist als einziges stabil. Mit Hilfe der ICP-Quadrupol-MS (ICP, induktiv-gekoppeltes Plasma) kann es in aufgeschlossenen Gesteinsproben mit einer Nachweisgrenze von etwa 0,01 ng/ml bestimmt werden. Für die Analytik des Iods in Serum- und Urinproben steht als spezifische und sensitive Methode die Kopplung der Ionenchromatographie und der ICP-MS zur Verfügung. ⓘ
Ionenchromatographie (IC)
Eine gute Methode, um Iodide aus einer Probelösung zu separieren, ist die Anionenaustausch-Chromatographie. Dabei wird Iodid auf einer Ionentauschersäule von anderen Ionen getrennt. Die Detektion erfolgt z. B. mit Hilfe elektrochemischer Detektoren, die entweder die Leitfähigkeit des Eluats messen oder mittels gepulster Amperometrie die geflossene Strommenge bestimmen. Mit Hilfe der gepulsten Amperometrie konnte eine Nachweisgrenze von 0,5 μg/l Iodid im Meerwasser erzielt werden. Seit kurzer Zeit wird die Ionenchromatographie auch mit der Massenspektrometrie gekoppelt. Die IC-Tandem-MS-Technik erreicht eine Nachweisgrenze von 0,33 μg/l Urin. ⓘ
Photometrie
Die bekannteste Methode zur photometrischen Erfassung von Iodid ist die kinetische Methode nach Sandell und Kolthoff. Die katalytische Wirkung von Iodid auf die Reduktion von Cer(IV) durch As(III) ist proportional zur Iodidkonzentration und kann über die Geschwindigkeit der Entfärbung der gelben Cer(III)-Lösung bestimmt werden. Dieses Verfahren wurde von Moxon und Dixon weiterentwickelt und auf die Oxidation von Thiocyanat durch Nitrit angewandt. Die kinetische Messung der Absorbanz wird bei 450 nm durchgeführt. Es wurde eine Nachweisgrenze für den Gesamtiodgehalt in Nahrungsmitteln von 0,01 μg/g erreicht. ⓘ
Voltammetrie
Für die elektrochemische Bestimmung von Iodid eignet sich hervorragend die kathodische Stripping-Voltammetrie. Dabei geht der eigentlichen voltammetrischen Bestimmung eine oxidative Anreicherungsperiode auf einer Kohlenstoffpaste-Elektrode bei 700 mV voraus. Das angereicherte Iod wird beim Scannen eines Potentialfensters von 700 mV bis −400 mV wieder reduziert. Der Reduktionsstrom ist proportional zur Iodidkonzentration. Es wurde eine Nachweisgrenze von 0,25 μmol/l erzielt. ⓘ
Verbindungen
→ Kategorie: Iodverbindung ⓘ
Iod bildet Verbindungen in verschiedenen Oxidationsstufen von −1 bis +7. Die stabilste und häufigste Oxidationsstufe ist dabei −1, die höheren werden nur in Verbindungen mit den elektronegativeren Elementen Sauerstoff, Fluor, Chlor und Brom gebildet. Dabei sind die ungeraden Oxidationsstufen +1, +3, +5 und +7 stabiler als die geraden. ⓘ
Iodoxide
Es ist eine größere Anzahl Verbindungen von Iod und Sauerstoff bekannt. Diese sind nach den allgemeinen Formeln IOx (x = 1–4) und I2Ox (x = 1–7) aufgebaut. Von den Iodoxiden wurden die Verbindungen IO, IO2, I2O4, I4O9, I2O5 und I2O6 nachgewiesen, wovon Diiodpentoxid (I2O5) die stabilste Verbindung ist. ⓘ
Iodsauerstoffsäuren
Neben den Iodoxiden bilden Iod und Sauerstoff auch mehrere Sauerstoffsäuren, bei denen ein Iodatom von einem bis vier Sauerstoffatomen umgeben ist, sowie die dazugehörigen Salze: Hypoiodige Säure (HIO) und Hypoiodite, Iodige Säure (HIO2) und die entsprechenden Iodite, Iodsäure (HIO3) und Iodate sowie die Periodsäure (H5IO6) und die dazugehörigen Periodate. ⓘ
Interhalogenverbindungen
Iod geht mit den anderen Halogenen eine Reihe von Interhalogenverbindungen ein. Diese sind Iodfluorid (IF), Iodtrifluorid (IF3), Iodpentafluorid (IF5), Iodheptafluorid (IF7), Iodchlorid (ICl), Ioddichlorid ((ICl2)2), Iodtrichlorid (ICl3) und Iodbromid (IBr). Iod ist in diesen Verbindungen stets das elektropositivere Element. ⓘ
Organische Iodverbindungen
Eine Vielzahl von organischen Iodverbindungen (auch Organoiodverbindungen) wird synthetisch hergestellt, z. B. Iodalkane und Iodaromaten. Eingesetzt werden sie unter anderem in der Medizin als Kontrastmittel. Auch in der Natur werden Iodverbindungen durch bspw. Makroalgen produziert. Unter Sonneneinstrahlung ist außerdem die Produktion von CH3I und anderen Verbindungen an der Meeresoberfläche möglich. ⓘ