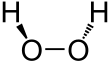Wasserstoffperoxid
 Eine Flasche mit 100 ml 3%igem Wasserstoffperoxid
| |||
 Kugelstabmodell des Wasserstoffperoxid-Moleküls
| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Wasserstoffperoxid
| |||
| Andere Namen
Dioxidan
Oxidanyl Perhydroxische Säure 0-Hydroxyol Dihydroxy-Dioxid Sauerstoffhaltiges Wasser Peroxaan | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 2015 (>60% soln.) 2014 (20-60% soln.) 2984 (8-20% soln.) | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
H2O2 | ||
| Molekulare Masse | 34,0147 g/mol | ||
| Erscheinungsbild | Sehr hellblaue Flüssigkeit | ||
| Geruch | leicht scharf | ||
| Dichte | 1,11 g/cm3 (20 °C, 30%ige (w/w) Lösung) 1,450 g/cm3 (20 °C, rein) | ||
| Schmelzpunkt | -0,43 °C (31,23 °F; 272,72 K) | ||
| Siedepunkt | 150,2 °C (302,4 °F; 423,3 K) (zersetzt sich) | ||
Löslichkeit in Wasser
|
mischbar | ||
| Löslichkeit | löslich in Ether, Alkohol unlöslich in Petrolether | ||
| log P | -0.43 | ||
| Dampfdruck | 5 mmHg (30 °C) | ||
| Acidität (pKa) | 11.75 | ||
Magnetische Suszeptibilität (χ)
|
-17,7-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1.4061 | ||
| Viskosität | 1.245 cP (20 °C) | ||
Dipolmoment
|
2.26 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
1.267 J/(g-K) (Gas) 2,619 J/(g-K) (Flüssigkeit) | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-187,80 kJ/mol | ||
| Pharmakologie | |||
ATC-Code
|
A01AB02 (WER) D08AX01 (WER), D11AX25 (WER), S02AA06 (WER) | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
  
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H271, H302, H314, H332, H335, H412 | ||
Sicherheitshinweise
|
P280, P305+P351+P338, P310 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | Nicht brennbar | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (Mittlere Dosis)
|
1518 mg/kg 2000 mg/kg (oral, Maus) | ||
LC50 (mittlere Konzentration)
|
1418 ppm (Ratte, 4 Std.) | ||
LCLo (niedrigste veröffentlichte)
|
227 ppm (Maus) | ||
| NIOSH (US-Grenzwerte für Gesundheitsgefährdung): | |||
PEL (Zulässig)
|
TWA 1 ppm (1,4 mg/m3) | ||
REL (Empfohlen)
|
TWA 1 ppm (1,4 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
75 ppm | ||
| Sicherheitsdatenblatt (SDS) | ICSC 0164 (>60% soln.) | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Wasser Ozon Hydrazin Disulfidwasserstoff Dioxygen-Difluorid | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Wasserstoffperoxid ist eine chemische Verbindung mit der Formel H2O2. In reiner Form ist es eine sehr blassblaue Flüssigkeit, etwas zähflüssiger als Wasser. Es wird als Oxidationsmittel, Bleichmittel und Antiseptikum verwendet, in der Regel als verdünnte Lösung (3-6 Gew.-%) in Wasser für den privaten Gebrauch und in höheren Konzentrationen für die industrielle Verwendung. Konzentriertes Wasserstoffperoxid, auch "High-Test-Peroxid" genannt, zersetzt sich explosionsartig, wenn es erhitzt wird, und wurde als Treibstoff in der Raketentechnik verwendet. ⓘ
Wasserstoffperoxid ist eine reaktive Sauerstoffart und das einfachste Peroxid, eine Verbindung mit einer Sauerstoff-Sauerstoff-Einfachbindung. Es zersetzt sich langsam, wenn es Licht ausgesetzt wird, und schnell in Gegenwart von organischen oder reaktiven Verbindungen. In der Regel wird es mit einem Stabilisator in einer schwach sauren Lösung in einer dunklen Flasche gelagert, um Licht abzuschirmen. Wasserstoffperoxid kommt in biologischen Systemen vor, auch im menschlichen Körper. Enzyme, die Wasserstoffperoxid verwenden oder zersetzen, werden als Peroxidasen bezeichnet. ⓘ
Wasserstoffperoxid (H2O2) ist eine blassblaue, in verdünnter Form farblose, weitgehend stabile Flüssigverbindung aus Wasserstoff und Sauerstoff. Es ist etwas viskoser als Wasser, eine schwache Säure und gegenüber den meisten Stoffen ein sehr starkes Oxidationsmittel, das als solches heftig mit Substanzen wie etwa Kupfer, Messing, Kaliumiodid reagiert und somit als starkes Bleich- und Desinfektionsmittel fungiert. In hochkonzentrierter Form ist es sowohl als Einzel- als auch als Komponentenraketentreibstoff einsetzbar. ⓘ
Im Handel ist Wasserstoffperoxid meist als wässrige Lösung zu beziehen und unterliegt je nach Konzentration variablen Vorschriften. ⓘ
Eigenschaften
Der Siedepunkt von H2O2 wurde auf 150,2 °C (302,4 °F) extrapoliert und liegt damit etwa 50 °C (90 °F) über dem von Wasser. In der Praxis zersetzt sich Wasserstoffperoxid explosionsartig, wenn es auf diese Temperatur erhitzt wird. Es kann bei niedrigeren Temperaturen unter vermindertem Druck sicher destilliert werden. ⓘ
Struktur
Wasserstoffperoxid (H2O2) ist ein nicht planares Molekül mit (verdrehter) C2-Symmetrie; dies wurde erstmals 1950 von Paul-Antoine Giguère mit Hilfe der Infrarotspektroskopie nachgewiesen. Obwohl die O-O-Bindung eine Einfachbindung ist, weist das Molekül eine relativ hohe Rotationsbarriere von 386 cm-1 (4,62 kJ/mol) für die Rotation zwischen Enantiomeren über die trans-Konfiguration und 2460 cm-1 (29,4 kJ/mol) über die cis-Konfiguration auf. Es wird angenommen, dass diese Barrieren auf die Abstoßung zwischen den einsamen Paaren der benachbarten Sauerstoffatome und auf dipolare Effekte zwischen den beiden O-H-Bindungen zurückzuführen sind. Zum Vergleich: Die Rotationsbarriere für Ethan beträgt 1040 cm-1 (12,4 kJ/mol). ⓘ
Der etwa 100°-Dhedralwinkel zwischen den beiden O-H-Bindungen macht das Molekül chiral. Es ist das kleinste und einfachste Molekül, das eine Enantiomerie aufweist. Es wurde vorgeschlagen, dass die enantiospezifischen Wechselwirkungen der einen und nicht der anderen Bindung zur Vervielfältigung einer enantiomeren Form der Ribonukleinsäuren und damit zum Ursprung der Homochiralität in der RNA-Welt geführt haben könnten. ⓘ
Die Molekularstrukturen von gasförmigem und kristallinem H2O2 unterscheiden sich erheblich. Dieser Unterschied ist auf die Auswirkungen der Wasserstoffbrückenbindungen zurückzuführen, die im gasförmigen Zustand nicht vorhanden sind. Kristalle von H2O2 sind tetragonal und haben die Raumgruppe D4
4P4121. ⓘ
Wässrige Lösungen
Die Verbindung ist mit Wasser in jedem Verhältnis mischbar. Obwohl die Schmelzpunkte der reinen Komponenten relativ ähnlich sind, werden in Mischungen signifikant niedrigere Schmelzpunkte beobachtet. Dabei wird ein definiert bei −52,1 °C schmelzendes Dihydrat (H2O2·2H2O) gefunden. Dieses bildet mit den Reinstoffkomponenten zwei Eutektika bei einem Wasserstoffperoxidgehalt von 452 g/kg mit −52,4 °C und von 612 g/kg mit −56,5 °C. Wasserstoffperoxid und Wasser bilden kein azeotrop siedendes Gemisch. ⓘ
Das H2O2-Molekül ist hinsichtlich der beiden O–O–H-Ebenen gewinkelt (Diederwinkel = 90,2±0,6°). Die O–O-Bindungslänge beträgt 145,3±0,7 pm, die O–H-Bindungslänge 99,8±0,5 pm sowie der O–O–H-Bindungswinkel 102,7±0,3°. In flüssiger Phase werden wie beim Wasser Wasserstoffbrücken gebildet. Die gewinkelte Struktur und geänderte Wasserstoffbrückenstruktur führt zu einer im Vergleich zu Wasser wesentlich höheren Dichte und etwas höheren Viskosität. ⓘ
| Physikalische Eigenschaften von wässrigen Wasserstoffperoxidlösungen. ⓘ | ||||||||||||
| H2O2-Massenanteil (w ) | 0 % | 10 % | 20 % | 35 % | 50 % | 70 % | 90 % | 100 % | ||||
| Schmelzpunkt (in °C) | 0 | −6 | −14 | −33 | −52,2 | −40,3 | −11,9 | −0,43 | ||||
| Siedepunkt (in °C, 101,3 kPa) | 100 | 101,7 | 103,6 | 107,9 | 113,8 | 125,5 | 141,3 | 150,2 | ||||
| Dichte (in g·cm−3) | 0 °C | 0,9998 | 1,1441 | 1,2110 | 1,3071 | 1,4136 | 1,4700 | |||||
| 20 °C | 0,9980 | 1,03 | 1,07 | 1,1312 | 1,1953 | 1,2886 | 1,3920 | 1,4500 | ||||
| 25 °C | 0,9971 | 1,1282 | 1,1914 | 1,2839 | 1,3867 | 1,4425 | ||||||
| Dampfdruck (in hPa) | 20 °C | 23 | 17 | 8 | 1,9 | |||||||
| 30 °C | 42 | 30,7 | 14,7 | 6,67 | 3,9 | |||||||
| 50 °C | 123 | 13,2 | ||||||||||
| Spezifische Wärmekapazität (in J·K−1·g−1) | 25 °C | 4,18 | 3,96 | 3,78 | 3,57 | 3,35 | 3,06 | 2,77 | 2,62 | |||
| Viskosität (in mPa·s) | 0 °C | 1,792 | 1,82 | 1,87 | 1,93 | 1,88 | 1,819 | |||||
| 20 °C | 1,002 | 1,11 | 1,17 | 1,23 | 1,26 | 1,249 | ||||||
| Brechungsindex () | 1,3330 | 1,3563 | 1,3672 | 1,3827 | 1,3995 | 1,4084 | ||||||
Wasserstoffperoxid ist eine sehr schwache Säure. In Wasser stellt sich das folgende Gleichgewicht ein:
Die Säurekonstante beträgt KS = 1,6·10−12 bzw. pKS = 11,8. ⓘ
Vergleich mit Analoga
Wasserstoffperoxid hat mehrere strukturelle Analoga mit HmX-XHn-Bindungsanordnungen (zum Vergleich ist auch Wasser dargestellt). Es hat den höchsten (theoretischen) Siedepunkt dieser Reihe (X = O, S, N, P). Sein Schmelzpunkt ist ebenfalls recht hoch und mit dem von Hydrazin und Wasser vergleichbar, wobei nur Hydroxylamin wesentlich leichter kristallisiert, was auf eine besonders starke Wasserstoffbindung hinweist. Diphosphan und Schwefelwasserstoff weisen nur schwache Wasserstoffbrückenbindungen auf und haben wenig chemische Ähnlichkeit mit Wasserstoffperoxid. Strukturell weisen die Analoga alle ähnliche schräge Strukturen auf, die auf die Abstoßung zwischen benachbarten Einzelpaaren zurückzuführen sind. ⓘ
| Bezeichnung | Formel | Molekulare Masse (g/mol) |
Schmelzen punkt (°C) |
Siedepunkt punkt (°C) |
|---|---|---|---|---|
| Wasser | HOH | 18.02 | 0.00 | 99.98 |
| Wasserstoffperoxid | HOOH | 34.01 | −0.43 | 150.2* |
| Disulfidwasserstoff | HSSH | 66.15 | −89.6 | 70.7 |
| Hydrazin | H2NNH2 | 32.05 | 2 | 114 |
| Hydroxylamin | NH2OH | 33.03 | 33 | 58* |
| Diphosphan | H2PPH2 | 65.98 | −99 | 63.5* |
Entdeckung
Alexander von Humboldt berichtete 1799 über eines der ersten synthetischen Peroxide, das Bariumperoxid, das als Nebenprodukt seiner Versuche zur Zersetzung von Luft entstand. Neunzehn Jahre später erkannte Louis Jacques Thénard, dass diese Verbindung für die Herstellung einer bis dahin unbekannten Verbindung verwendet werden konnte, die er als Eau oxygénée ("sauerstoffhaltiges Wasser") bezeichnete - später bekannt als Wasserstoffperoxid. Heute kann der Begriff "sauerstoffhaltiges Wasser" auf Verpackungen im Einzelhandel erscheinen und sich auf Mischungen beziehen, die entweder Wasser und Wasserstoffperoxid oder Wasser und gelösten Sauerstoff enthalten. Dies kann zu Personenschäden führen, wenn der Benutzer den Unterschied nicht richtig versteht. ⓘ
Bei einer verbesserten Version des Thénard-Verfahrens wurde Salzsäure verwendet, gefolgt von der Zugabe von Schwefelsäure, um das Bariumsulfat als Nebenprodukt auszufällen. Dieses Verfahren wurde vom Ende des 19. Jahrhunderts bis zur Mitte des 20. Jahrhunderts angewandt. ⓘ
Thénard und Joseph Louis Gay-Lussac synthetisierten 1811 Natriumperoxid. Die bleichende Wirkung von Peroxiden und ihren Salzen auf natürliche Farbstoffe wurde zu dieser Zeit bekannt, aber frühe Versuche der industriellen Herstellung von Peroxiden scheiterten. Die erste Anlage zur Herstellung von Wasserstoffperoxid wurde 1873 in Berlin gebaut. Mit der Entdeckung der Synthese von Wasserstoffperoxid durch Elektrolyse mit Schwefelsäure wurde die effizientere elektrochemische Methode eingeführt. Es wurde erstmals 1908 in Weißenstein, Kärnten, Österreich, kommerziell genutzt. Das heute noch verwendete Anthrachinon-Verfahren wurde in den 1930er Jahren vom deutschen Chemiekonzern IG Farben in Ludwigshafen entwickelt. Die steigende Nachfrage und die Verbesserung der Synthesemethoden führten dazu, dass die jährliche Produktion von Wasserstoffperoxid von 35.000 Tonnen im Jahr 1950 auf über 100.000 Tonnen im Jahr 1960 und auf 300.000 Tonnen im Jahr 1970 anstieg; 1998 erreichte sie 2,7 Millionen Tonnen. ⓘ
Frühe Versuche, reines Wasserstoffperoxid herzustellen, scheiterten. Wasserfreies Wasserstoffperoxid wurde zunächst durch Vakuumdestillation gewonnen. ⓘ
Die Bestimmung der Molekularstruktur von Wasserstoffperoxid erwies sich als sehr schwierig. Im Jahr 1892 bestimmte der italienische Chemiker Giacomo Carrara (1864-1925) die Molekülmasse des Wasserstoffperoxids durch Gefrierpunktserniedrigung und bestätigte damit die Summenformel H2O2. Mindestens ein halbes Dutzend hypothetischer Molekülstrukturen schienen mit den vorliegenden Beweisen übereinzustimmen. Im Jahr 1934 schlugen der englische mathematische Physiker William Penney und der schottische Physiker Gordon Sutherland eine Molekularstruktur für Wasserstoffperoxid vor, die der heute akzeptierten sehr ähnlich war. ⓘ
Zuvor wurde Wasserstoffperoxid industriell durch Hydrolyse von Ammoniumpersulfat hergestellt, das wiederum durch Elektrolyse einer Lösung von Ammoniumbisulfat ([NH4]HSO4) in Schwefelsäure gewonnen wurde:
- 2 [NH4]HSO4 → [NH4]2S2O8 + H2 (Elektrolyse)
- [NH4]2S2O8 + 2 H2O → 2 [NH4]HSO4 + H2O2 (Hydrolyse) ⓘ
Herstellung

Wasserstoffperoxid wird heute fast ausschließlich nach dem Anthrachinon-Verfahren hergestellt, das ursprünglich 1939 von der BASF entwickelt wurde. Es beginnt mit der Reduktion eines Anthrachinons (wie 2-Ethylanthrachinon oder das 2-Amyl-Derivat) zum entsprechenden Anthrahydrochinon, in der Regel durch Hydrierung an einem Palladiumkatalysator. In Gegenwart von Sauerstoff wird das Anthrahydrochinon dann autoxidiert: Die labilen Wasserstoffatome der Hydroxygruppen gehen auf das Sauerstoffmolekül über, wobei Wasserstoffperoxid entsteht und das Anthrachinon regeneriert wird. Bei den meisten kommerziellen Verfahren wird die Oxidation erreicht, indem Druckluft durch eine Lösung des Anthrachinons geblasen wird, wobei das Wasserstoffperoxid anschließend aus der Lösung extrahiert und das Anthrachinon für aufeinander folgende Hydrierungs- und Oxidationszyklen zurückgeführt wird. ⓘ
Die Nettoreaktion für den durch Anthrachinon katalysierten Prozess ist:
- H2 + O2 → H2O2 ⓘ
Die Wirtschaftlichkeit des Prozesses hängt in hohem Maße vom effektiven Recycling der Extraktionslösungsmittel, des Hydrierungskatalysators und des teuren Chinons ab. ⓘ


Andere Quellen
Kleine, aber nachweisbare Mengen von Wasserstoffperoxid können durch verschiedene Methoden gebildet werden. Geringe Mengen entstehen bei der Elektrolyse von verdünnter Säure in der Nähe der Kathode, wo sich Wasserstoff entwickelt, wenn Sauerstoff in die Umgebung geblasen wird. Wasserstoffperoxid entsteht auch, wenn Wasser in einem UV-durchlässigen Gefäß (z. B. Quarz) den ultravioletten Strahlen einer Quecksilberlampe oder eines Lichtbogens ausgesetzt wird. Es ist in Eiswasser nachweisbar, nachdem ein darauf gerichteter Wasserstoffgasstrom verbrannt wurde, und es ist auch auf schwimmendem Eis nachweisbar. Schnell abkühlende feuchte Luft, die durch eine etwa 2.000 °C heiße Funkenstrecke geblasen wird, führt zu nachweisbaren Mengen. ⓘ
Ein kommerziell nutzbares Verfahren zur Herstellung von Wasserstoffperoxid direkt aus der Umwelt ist seit vielen Jahren von Interesse. Eine effiziente Direktsynthese ist schwierig zu erreichen, da die Reaktion von Wasserstoff mit Sauerstoff thermodynamisch die Bildung von Wasser begünstigt. Es wurden Systeme für die Direktsynthese entwickelt, von denen die meisten feindisperse Metallkatalysatoren verwenden, ähnlich denen, die für die Hydrierung organischer Substrate eingesetzt werden. Ein wirtschaftliches Hindernis besteht darin, dass direkte Verfahren eine verdünnte Lösung ergeben, die für den Transport unwirtschaftlich ist. Keines dieser Verfahren ist bisher so weit entwickelt, dass es für die Synthese im industriellen Maßstab eingesetzt werden kann. ⓘ
Verfügbarkeit
Wasserstoffperoxid ist in der Regel als Lösung in Wasser erhältlich. Für den Verbraucher ist es in der Regel in Apotheken in Konzentrationen von 3 und 6 Gew.-% erhältlich. Die Konzentrationen werden manchmal in Bezug auf das Volumen des erzeugten Sauerstoffgases beschrieben; ein Milliliter einer 20-volumigen Lösung erzeugt bei vollständiger Zersetzung 20 Milliliter Sauerstoffgas. Für Laborzwecke sind Lösungen mit 30 Gew.-% am gebräuchlichsten. Handelsübliche Qualitäten von 70 % bis 98 % sind ebenfalls erhältlich, aber aufgrund der Möglichkeit, dass Lösungen mit mehr als 68 % Wasserstoffperoxid vollständig in Dampf und Sauerstoff umgewandelt werden (wobei die Temperatur des Dampfes mit steigender Konzentration über 68 % zunimmt), sind diese Qualitäten potenziell weitaus gefährlicher und erfordern besondere Sorgfalt in speziellen Lagerbereichen. Die Käufer müssen in der Regel eine Inspektion durch kommerzielle Hersteller zulassen. ⓘ
1994 belief sich die Weltproduktion von H2O2 auf etwa 1,9 Millionen Tonnen und stieg bis 2006 auf 2,2 Millionen Tonnen, wobei der größte Teil davon mit einer Konzentration von 70 % oder weniger hergestellt wurde. In jenem Jahr wurde 30%iges H2O2 in loser Schüttung für etwa 0,54 USD/kg verkauft, was auf "100%-Basis" 1,50 USD/kg (0,68 USD/lb) entspricht. ⓘ
Natürliches Vorkommen
Wasserstoffperoxid kommt in Oberflächenwasser, Grundwasser und in der Atmosphäre vor. Es bildet sich bei Beleuchtung oder durch natürliche katalytische Wirkung von im Wasser enthaltenen Substanzen. Meerwasser enthält 0,5 bis 14 μg/L Wasserstoffperoxid, Süßwasser 1 bis 30 μg/L und Luft 0,1 bis 1 Teile pro Milliarde. ⓘ
Reaktionen
Zersetzung
Wasserstoffperoxid zersetzt sich unter Bildung von Wasser und Sauerstoff mit einem ΔHo von -2884,5 kJ/kg und einem ΔS von 70,5 J/(mol-K):
- 2 H2O2 → 2 H2O + O2 ⓘ
Die Zersetzungsgeschwindigkeit steigt mit zunehmender Temperatur, Konzentration und pH-Wert (H2O2 ist unter alkalischen Bedingungen instabil), wobei kühle, verdünnte und saure Lösungen die beste Stabilität aufweisen. Die Zersetzung wird durch verschiedene redoxaktive Ionen oder Verbindungen katalysiert, darunter die meisten Übergangsmetalle und ihre Verbindungen (z. B. Mangandioxid (MnO2), Silber und Platin). Bestimmte Metallionen, z. B. Fe2+ oder Ti3+, können die Zersetzung in eine andere Richtung lenken, wobei freie Radikale wie das Hydroxylradikal (HO-) und Hydroperoxyl (HOO-) gebildet werden. Zu den nichtmetallischen Katalysatoren gehört Kaliumjodid (KI), das besonders schnell reagiert und die Grundlage für die Demonstration der Elefantenzahnpasta bildet. Wasserstoffperoxid kann auch biologisch durch das Enzym Katalase zersetzt werden. Bei der Zersetzung von Wasserstoffperoxid werden Sauerstoff und Wärme freigesetzt; dies kann gefährlich sein, da das Verschütten von Wasserstoffperoxid in hoher Konzentration auf eine brennbare Substanz einen sofortigen Brand verursachen kann. ⓘ
Redox-Reaktionen
Wasserstoffperoxid neigt dazu, in Wasser und Sauerstoff zu zerfallen. Insbesondere bei hochkonzentrierten Lösungen und bei Kontakt mit Metalloberflächen beziehungsweise der Gegenwart von Metallsalzen und Oxiden kann eine spontane Zersetzung erfolgen. Die Zerfallsreaktion verläuft mit einer Reaktionswärme von −98,20 kJ·mol−1 bzw. −2887 kJ·kg−1 stark exotherm. Zudem wird mit 329 l·kg−1 Wasserstoffperoxid eine erhebliche Gasmenge freigesetzt:
- Disproportionierung zweier Moleküle Wasserstoffperoxid zu Wasser und Sauerstoff. ⓘ
Die spezifischen Zersetzungswärmen relativieren sich mit zunehmender Verdünnung, wobei ein praktisch linearer Zusammenhang mit der Wasserstoffperoxidkonzentration besteht. ⓘ
| Zersetzung von Wasserstoffperoxidlösungen. ⓘ | ||||||||||||
| H2O2-Massenanteil (w ) | 0 % | 10 % | 20 % | 30 % | 40 % | 50 % | 60 % | 70 % | 80 % | 90 % | 100 % | |
| Konzentration H2O2 (in mol·kg−1) | 0 | 2,94 | 5,88 | 8,82 | 11,76 | 14,70 | 17,64 | 20,58 | 23,53 | 26,45 | 29,39 | |
| Zersetzungswärme (in kJ·kg−1) | 0 | 281,2 | 557,8 | 838,2 | 1118,6 | 1402,1 | 1691,1 | 1982,4 | 2275,3 | 2596,4 | 2884,7 | |
| Gasfreisetzung (in l·kg−1) | 0 | 32,9 | 65,8 | 98,7 | 131,7 | 164,6 | 197,5 | 230,4 | 263,3 | 296,2 | 329,1 | |
Diese Zersetzungsreaktion wird unter anderem durch Schwermetallionen, I−- und OH−-Ionen katalysiert. Daher werden H2O2-Lösungen im Handel mit Stabilisatoren (unter anderem Phosphorsäure) versetzt. Es ist ein starkes Oxidationsmittel. Unter Verminderung der Oxidationsstufe von −I auf −II entstehen als Reaktionsprodukte nur Wasser und Sauerstoff. Schwer abzutrennende oder störende Nebenprodukte fallen nicht an, was seine Anwendung im Labor vereinfacht. ⓘ
Abhängig von der Lage beider Redox-Potentiale kann H2O2 auch als Reduktionsmittel wirken, so wird im Sauren das MnVII (im Kaliumpermanganat) reduziert. ⓘ
Wasserstoffperoxid ist eine sehr schwache Säure; seine anorganischen Salze und organischen Ester sind die Hydroperoxide und Peroxide. ⓘ
Die Redoxeigenschaften von Wasserstoffperoxid hängen vom pH-Wert ab, da saure Bedingungen die Wirkung von Oxidationsmitteln und basische Bedingungen die Wirkung von Reduktionsmitteln verstärken. Da Wasserstoffperoxid ambivalente Redoxeigenschaften aufweist, da es gleichzeitig ein Oxidationsmittel und ein Reduktionsmittel ist, hängt sein Redoxverhalten unmittelbar vom pH-Wert ab. ⓘ
In sauren Lösungen ist H2O2 ein starkes Oxidationsmittel, stärker als Chlor, Chlordioxid und Kaliumpermanganat. Eine Lösung aus Wasserstoffperoxid und Schwefelsäure, die zur Reinigung von Laborglas verwendet wird, wird als Piranha-Lösung bezeichnet. ⓘ
H2O2 ist eine Quelle von Hydroxylradikalen (-OH), die sehr reaktiv sind. H2O2 wird in den oszillierenden Reaktionen nach Briggs-Rauscher und Bray-Liebhafsky verwendet. ⓘ
| Oxidierend Reagenz |
Reduziert Produkt |
Oxidation potenzial (V) ⓘ |
|---|---|---|
| F2 | HF | 3.0 |
| O3 | O2 | 2.1 |
| H2O2 | H2O | 1.8 |
| KMnO4 | MnO2 | 1.7 |
| ClO2 | HClO | 1.5 |
| Cl2 | Cl- | 1.4 |
In sauren Lösungen wird Fe2+ zu Fe3+ oxidiert (Wasserstoffperoxid wirkt als Oxidationsmittel):
- 2 Fe2+(aq) + H2O2 + 2 H+(aq) → 2 Fe3+(aq) + 2 H2O(l) ⓘ
- 2 MnO-4 + 5 H2O2 + 6 H+ → 2 Mn2+ + 8 H2O + 5 O2 ⓘ
Unter alkalischen Bedingungen kehren sich einige dieser Reaktionen jedoch um; so wird Mn2+ beispielsweise zu Mn4+ (als MnO2) oxidiert. ⓘ
Organische Reaktionen
Wasserstoffperoxid wird häufig als Oxidationsmittel eingesetzt. Ein Beispiel dafür ist die Oxidation von Thioethern zu Sulfoxiden:
- Ph-S-CH3 + H2O2 → Ph-S(O)-CH3 + H2O ⓘ
Alkalisches Wasserstoffperoxid wird für die Epoxidierung von Alkenen mit Elektronenmangel, wie z. B. Acrylsäurederivaten, und für die Oxidation von Alkylboranen zu Alkoholen, dem zweiten Schritt der Hydrobor-Oxidation, verwendet. Es ist auch das Hauptreagenz im Dakin-Oxidationsverfahren. ⓘ
Vorstufe zu anderen Peroxidverbindungen
Wasserstoffperoxid ist eine schwache Säure, die mit vielen Metallen Hydroperoxide oder Peroxidsalze bildet. ⓘ
Es wandelt auch Metalloxide in die entsprechenden Peroxide um. So bildet beispielsweise Chromsäure (CrO3 und H2SO4) bei der Behandlung mit Wasserstoffperoxid ein blaues Peroxid CrO(O2)2. ⓘ
Diese Art der Reaktion wird industriell zur Herstellung von Peroxoanionen verwendet. Zum Beispiel führt die Reaktion mit Borax zu Natriumperborat, einem Bleichmittel, das in Waschmitteln verwendet wird:
- Na2B4O7 + 4 H2O2 + 2 NaOH → 2 Na2B2O4(OH)4 + H2O ⓘ
H2O2 wandelt Carbonsäuren (RCO2H) in Peroxysäuren (RC(O)O2H) um, die ihrerseits als Oxidationsmittel verwendet werden. Wasserstoffperoxid reagiert mit Aceton unter Bildung von Acetonperoxid und mit Ozon unter Bildung von Trioxidan. Wasserstoffperoxid bildet stabile Addukte mit Harnstoff (Wasserstoffperoxid-Harnstoff), Natriumcarbonat (Natriumpercarbonat) und anderen Verbindungen. Ein Säure-Base-Addukt mit Triphenylphosphinoxid ist ein nützlicher "Träger" für H2O2 in einigen Reaktionen. ⓘ
Wasserstoffperoxid ist sowohl ein Oxidationsmittel als auch ein Reduktionsmittel. Bei der Oxidation von Wasserstoffperoxid durch Natriumhypochlorit entsteht Singulett-Sauerstoff. Bei der Nettoreaktion eines Eisen(III)-Ions mit Wasserstoffperoxid entstehen ein Eisen(II)-Ion und Sauerstoff. Dies geschieht über eine Ein-Elektronen-Oxidation und Hydroxylradikale. Dies wird bei einigen Oxidationen in der organischen Chemie verwendet, z. B. beim Fenton-Reagenz. Es werden nur katalytische Mengen an Eisenionen benötigt, da Peroxid auch Eisen(II)- zu Eisen(III)-Ionen oxidiert. Die Nettoreaktion von Wasserstoffperoxid und Permanganat oder Mangandioxid besteht aus Manganionen; bis das Peroxid verbraucht ist, werden jedoch einige Manganionen reoxidiert, damit die Reaktion katalytisch ist. Dies bildet die Grundlage für gängige Monotreibstoffraketen. ⓘ
Biologische Funktion

Wasserstoffperoxid entsteht bei Menschen und anderen Tieren als kurzlebiges Produkt in biochemischen Prozessen und ist für Zellen giftig. Die Toxizität ist auf die Oxidation von Proteinen, Membranlipiden und DNA durch die Peroxidionen zurückzuführen. Die Klasse der biologischen Enzyme mit der Bezeichnung Superoxiddismutase (SOD) ist in fast allen lebenden Zellen als wichtiges Antioxidans entwickelt. Sie fördern die Disproportionierung von Superoxid in Sauerstoff und Wasserstoffperoxid, das dann durch das Enzym Katalase rasch zu Sauerstoff und Wasser abgebaut wird. ⓘ
- 2 O-2 + 2 H+ → O2 + H2O2
- 2 H2O2 → O2 + 2 H2O ⓘ
Peroxisomen sind Organellen, die in praktisch allen eukaryontischen Zellen vorkommen. Sie sind am Abbau von sehr langkettigen Fettsäuren, verzweigtkettigen Fettsäuren, D-Aminosäuren, Polyaminen und an der Biosynthese von Plasmalogenen, Etherphospholipiden, die für die normale Funktion von Gehirn und Lunge von Säugetieren wichtig sind, beteiligt. Bei ihrer Oxidation entsteht Wasserstoffperoxid in einem Prozess, der durch Flavin-Adenin-Dinukleotid (FAD) katalysiert wird:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{R-CH2-CH2-CO-SCoA + O2 ->[\ce{FAD}] R-CH=CH-CO-SCoA + H2O2 <span title="Aus: Englische Wikipedia, Abschnitt "Biological function"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrogen_peroxide#Biological_function <span style="color:#dddddd">ⓘ</span>]</span>}}
Katalase, ein weiteres peroxisomales Enzym, nutzt dieses H2O2, um andere Substrate, darunter Phenole, Ameisensäure, Formaldehyd und Alkohol, durch eine Peroxidationsreaktion zu oxidieren:
- H2O2 + R'H2 → R' + 2 H2O
und eliminiert dabei das giftige Wasserstoffperoxid. ⓘ
Diese Reaktion ist in Leber- und Nierenzellen wichtig, wo die Peroxisomen verschiedene toxische Substanzen, die ins Blut gelangen, neutralisieren. Ein Teil des Ethanols, das Menschen trinken, wird auf diese Weise zu Acetaldehyd oxidiert. Wenn sich außerdem überschüssiges H2O2 in der Zelle ansammelt, wird es durch diese Reaktion von der Katalase in H2O umgewandelt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{H2O2 ->[\ce{CAT}] {1/2O2} + H2O <span title="Aus: Englische Wikipedia, Abschnitt "Biological function"" class="plainlinks">[https://en.wikipedia.org/wiki/Hydrogen_peroxide#Biological_function <span style="color:#dddddd">ⓘ</span>]</span>}}
Ein weiterer Ursprung von Wasserstoffperoxid ist der Abbau von Adenosinmonophosphat, bei dem Hypoxanthin entsteht. Hypoxanthin wird dann oxidativ zunächst zu Xanthin und dann zu Harnsäure abgebaut, wobei die Reaktion durch das Enzym Xanthinoxidase katalysiert wird:

Beim Abbau von Guanosinmonophosphat entsteht Xanthin als Zwischenprodukt, das dann auf die gleiche Weise unter Bildung von Wasserstoffperoxid zu Harnsäure umgewandelt wird. ⓘ
Die Eier des Seeigels produzieren kurz nach der Befruchtung durch ein Spermium Wasserstoffperoxid. Es wird dann schnell zu HO-Radikalen dissoziiert. Die Radikale dienen als Initiator der radikalischen Polymerisation, die die Eier mit einer schützenden Polymerschicht umgibt. ⓘ
Der Bombardierkäfer verfügt über eine Vorrichtung, mit der er ätzende und übel riechende Blasen auf seine Feinde schießen kann. Der Käfer produziert und speichert Hydrochinon und Wasserstoffperoxid in zwei getrennten Behältern in der hinteren Spitze seines Hinterleibs. Bei Bedrohung kontrahiert der Käfer Muskeln, die die beiden Reaktanten durch Röhren mit Ventilen in eine Mischkammer mit Wasser und einer Mischung katalytischer Enzyme drücken. Wenn sich die Reaktanten verbinden, kommt es zu einer heftigen exothermen chemischen Reaktion, bei der die Temperatur bis nahe an den Siedepunkt des Wassers ansteigt. Die kochende, übel riechende Flüssigkeit wird teilweise gasförmig (Flash-Verdampfung) und wird durch ein Auslassventil mit einem lauten Knall ausgestoßen. ⓘ
Wasserstoffperoxid ist ein Signalmolekül der Pflanzenabwehr gegen Krankheitserreger. ⓘ
Wasserstoffperoxid spielt als Signalmolekül bei der Regulierung einer Vielzahl biologischer Prozesse eine Rolle. Die Verbindung ist ein wichtiger Faktor in der Theorie der freien Radikale, die darauf beruht, wie leicht sich Wasserstoffperoxid in ein Hydroxylradikal zersetzen kann und wie Superoxidradikale, Nebenprodukte des Zellstoffwechsels, mit dem umgebenden Wasser reagieren können, um Wasserstoffperoxid zu bilden. Diese Hydroxylradikale wiederum reagieren leicht mit lebenswichtigen Zellbestandteilen, insbesondere mit denen der Mitochondrien, und schädigen diese. Mindestens eine Studie hat auch versucht, die Wasserstoffperoxidproduktion mit Krebs in Verbindung zu bringen. Diese Studien werden häufig in betrügerischen Behandlungsaussagen zitiert. ⓘ
Die Menge an Wasserstoffperoxid in biologischen Systemen kann mit einem fluorometrischen Test bestimmt werden. ⓘ
Verwendungen
Bleichen

Wasserstoffperoxid ist ein Bleichmittel. Weltweit die häufigste Anwendung ist das Bleichen von Zellstoff. Zellstoff wird aus Holz gewonnen, und das enthaltene Lignin gibt dem Zellstoff einen Gilbton, der bei der Hauptverwendung von Zellstoff für Papier und Papiererzeugnisse als störend empfunden wird. ⓘ
Im Handwerk werden Hölzer bei der Restaurierung oder der Renovierung mit Wasserstoffperoxid gebleicht und dadurch aufgehellt. ⓘ
Es kommt beim Blondieren sowie Färben, Tönen und Intensivtönen und zur Fixierung dauerhafter Umformungen (Dauerwelle und Volumenwelle) sowie zum Fixieren permanenter Glättung von Haaren zum Einsatz. Ein sehr heller, künstlicher Blondton wird daher „wasserstoffblond“ genannt. Noch deutlicher wird der Zusammenhang in der englischen Bezeichnung peroxide blonde. ⓘ
In der Zahnmedizin wird es in unterschiedlichen Konzentrationen zur Zahnaufhellung verwendet. ⓘ
Häufig wird es als an Carbamid gebundenes Peroxid eingesetzt. ⓘ
Wasserstoffperoxid und wasserstoffperoxidhaltige Bleichmittel, wie etwa ein Peroxyessigsäure-Wasserstoffperoxid-Gemisch, werden in der Werbesprache auch mit dem Kunstwort „Aktiv-Sauerstoff“ bezeichnet. Außer dem Wasserstoffperoxid kommen für Bleichzwecke auch andere Peroxide in Frage, die beim Zutritt von Wasser zerfallen und den aktiven atomaren Sauerstoff abgeben. ⓘ
Auch bei der Tierpräparation wird es verwendet, um bei Tierschädeln den Knochen weiß zu bleichen. Die hierfür erforderlichen Konzentrationen erfordern entweder ein Gewerbe (Berufsjäger) oder eine Genehmigung nach Art. 5 Abs. 3 der EU-Verordnung. ⓘ
Etwa 60 % der Weltproduktion von Wasserstoffperoxid wird für die Zellstoff- und Papierbleiche verwendet. Die zweite wichtige industrielle Anwendung ist die Herstellung von Natriumpercarbonat und Natriumperborat, die als milde Bleichmittel in Waschmitteln verwendet werden. Natriumpercarbonat, ein Addukt aus Natriumcarbonat und Wasserstoffperoxid, ist der aktive Bestandteil von Waschmitteln wie OxiClean und Tide. Wenn es in Wasser aufgelöst wird, werden Wasserstoffperoxid und Natriumcarbonat freigesetzt. Diese Bleichmittel sind nur bei Waschtemperaturen von 60 °C oder mehr wirksam und werden daher oft in Verbindung mit Bleichaktivatoren verwendet, die die Reinigung bei niedrigeren Temperaturen erleichtern. Es wurde auch als Mehlbleichmittel und als Zahnbleichmittel verwendet. ⓘ
Herstellung von organischen Verbindungen
Es wird bei der Herstellung verschiedener organischer Peroxide verwendet, wobei Dibenzoylperoxid ein Beispiel für große Mengen ist. Auch Peroxysäuren, wie Peressigsäure und meta-Chlorperoxybenzoesäure, werden mit Wasserstoffperoxid hergestellt. Wasserstoffperoxid wurde zur Herstellung von Sprengstoffen auf der Basis von organischem Peroxid verwendet, wie z. B. Acetonperoxid. Es wird als Initiator bei Polymerisationen verwendet. ⓘ
Durch die Peroxidgruppe ist die Verbindung energiereich und zerfällt unter Sauerstofffreigabe. Wasserstoffperoxid reagiert in Anwesenheit eines geeigneten Katalysators mit Aceton zu Acetonperoxid, das ein Triaceton-Triperoxid ist und als Sprengstoff mit TATP bezeichnet wird. Unter Verwendung von Wasserstoffperoxid wird auch der Sprengstoff Hexamethylentriperoxiddiamin (HMTD) hergestellt. ⓘ
Behandlung von Abwässern
Wasserstoffperoxid wird in bestimmten Abwasserbehandlungsverfahren zur Entfernung von organischen Verunreinigungen eingesetzt. Bei der fortgeschrittenen Oxidationsbehandlung entsteht durch die Fenton-Reaktion das hochreaktive Hydroxylradikal (-OH). Dieses baut organische Verbindungen ab, auch solche, die normalerweise robust sind, wie aromatische oder halogenierte Verbindungen. Es kann auch schwefelhaltige Verbindungen im Abfall oxidieren, was von Vorteil ist, da es im Allgemeinen deren Geruch reduziert. ⓘ
Desinfektionsmittel
Wasserstoffperoxid kann für die Sterilisation verschiedener Oberflächen, einschließlich chirurgischer Instrumente, und als Dampf (VHP) für die Raumsterilisation eingesetzt werden. H2O2 zeigt ein breites Wirkungsspektrum gegen Viren, Bakterien, Hefen und bakterielle Sporen. Im Allgemeinen wird eine größere Aktivität gegen grampositive als gegen gramnegative Bakterien beobachtet; das Vorhandensein von Katalase oder anderen Peroxidasen in diesen Organismen kann jedoch die Toleranz gegenüber niedrigeren Konzentrationen erhöhen. Niedrigere Konzentrationen (3 %) wirken gegen die meisten Sporen; höhere Konzentrationen (7 bis 30 %) und längere Kontaktzeiten verbessern die sporizide Wirkung. ⓘ
Wasserstoffperoxid gilt als umweltverträgliche Alternative zu Bleichmitteln auf Chlorbasis, da es zu Sauerstoff und Wasser abgebaut wird und von der US-amerikanischen Food and Drug Administration (FDA) allgemein als sicheres antimikrobielles Mittel anerkannt ist. ⓘ
Treibstoff

H2O2 in hoher Konzentration wird als "hochprozentiges Peroxid" (HTP) bezeichnet. Es kann entweder als Monotreibstoff (nicht mit Treibstoff gemischt) oder als Oxidationsmittelkomponente einer Rakete mit Doppeltreibstoff verwendet werden. Bei der Verwendung als Monotreibstoff wird die Zersetzung von Wasserstoffperoxid in einer Konzentration von 70-98 % in Dampf und Sauerstoff genutzt. Der Treibstoff wird in eine Reaktionskammer gepumpt, wo ein Katalysator, in der Regel ein Silber- oder Platinsieb, die Zersetzung auslöst und Dampf mit einer Temperatur von über 600 °C erzeugt, der durch eine Düse ausgestoßen wird und Schub erzeugt. H2O2-Monotreibstoff erzeugt einen maximalen spezifischen Impuls (Isp) von 161 s (1,6 kN-s/kg). Peroxid war der erste wichtige Monotreibstoff, der für Raketenanwendungen verwendet wurde. Hydrazin verdrängte schließlich Wasserstoffperoxid als Monotreibstoff für Triebwerke, vor allem wegen des um 25 % höheren spezifischen Impulses im Vakuum. Hydrazin (giftig) und Wasserstoffperoxid (weniger giftig [ACGIH TLV 0,01 bzw. 1 ppm]) sind die einzigen beiden Monotreibstoffe (außer kalten Gasen), die in großem Umfang für Antriebs- und Leistungsanwendungen eingesetzt wurden. Der Bell Rocket Belt, die Reaktionskontrollsysteme für X-1, X-15, Centaur, Mercury und Little Joe sowie die Turbopumpen-Gasgeneratoren für X-1, X-15, Jupiter, Redstone und Viking verwendeten Wasserstoffperoxid als Monotreibstoff. ⓘ
Als Bipropellant wird H2O2 zersetzt, um einen Brennstoff als Oxidationsmittel zu verbrennen. Je nach Treibstoff können spezifische Impulse von bis zu 350 s (3,5 kN-s/kg) erreicht werden. Peroxid als Oxidationsmittel hat einen etwas niedrigeren Isp als flüssiger Sauerstoff, ist aber dicht, lagerfähig, nicht kryogen und kann leichter für den Antrieb von Gasturbinen verwendet werden, um in einem effizienten geschlossenen Kreislauf hohe Drücke zu erzeugen. Er kann auch für die regenerative Kühlung von Raketentriebwerken verwendet werden. Peroxid wurde sehr erfolgreich als Oxidationsmittel in deutschen Raketenmotoren des Zweiten Weltkriegs eingesetzt (z. B. T-Stoff, der Oxychinolin-Stabilisator enthält, sowohl für das Walter HWK 109-500 Starthilfe RATO Monopropellant-Boostersystem mit Außenhülse als auch für die Walter HWK 109-509 Raketenmotorenserie, die für die Me 163B verwendet wurde), am häufigsten zusammen mit C-Stoff in einer selbstzündenden hypergolischen Kombination, und für die kostengünstigen britischen Black Knight- und Black Arrow-Trägerraketen. Gegenwärtig wird HTP in den suborbitalen Raketen ILR-33 AMBER und Nucleus verwendet. ⓘ
In den 1940er und 1950er Jahren verwendete die von Hellmuth Walter KG konzipierte Turbine Wasserstoffperoxid für den Einsatz in U-Booten unter Wasser; sie erwies sich als zu laut und zu wartungsintensiv im Vergleich zu dieselelektrischen Antriebssystemen. Einige Torpedos verwendeten Wasserstoffperoxid als Oxidationsmittel oder Treibstoff. Bedienerfehler bei der Verwendung von Wasserstoffperoxid-Torpedos wurden als mögliche Ursachen für den Untergang der HMS Sidon und des russischen U-Boots Kursk genannt. SAAB Underwater Systems stellt den Torpedo 2000 her. Dieser Torpedo, der von der schwedischen Marine eingesetzt wird, wird von einem Kolbenmotor angetrieben, der mit HTP als Oxidationsmittel und Kerosin als Treibstoff in einem Bipropellant-System betrieben wird. ⓘ
Verwendung im Haushalt

Wasserstoffperoxid wird in verschiedenen Bereichen des Haushalts verwendet, vor allem als Reinigungs- und Desinfektionsmittel. ⓘ
- Haare bleichen
Verdünntes H2O2 (zwischen 1,9 % und 12 %), gemischt mit wässrigem Ammoniak, wurde zum Bleichen von menschlichem Haar verwendet. Die bleichende Wirkung dieser Chemikalie ist namensgebend für den Ausdruck "Peroxidblond". Wasserstoffperoxid wird auch zur Zahnaufhellung verwendet. Es ist in den meisten bleichenden Zahnpasten enthalten. Wasserstoffperoxid hat positive Ergebnisse in Bezug auf die Parameter Helligkeit und Chroma-Farbe der Zähne gezeigt. Es wirkt durch die Oxidation von Farbpigmenten auf dem Zahnschmelz, wodurch der Farbton des Zahns heller werden kann. Wasserstoffperoxid kann mit Backpulver und Salz gemischt werden, um eine selbstgemachte Zahnpasta herzustellen. ⓘ
- Entfernung von Blutflecken
Wasserstoffperoxid reagiert mit Blut als Bleichmittel. Wenn ein Blutfleck frisch oder noch nicht zu alt ist, lässt sich der Fleck durch großzügige Anwendung von Wasserstoffperoxid, wenn nötig in mehreren Anwendungen, vollständig ausbleichen. Nach einer Einwirkzeit von etwa zwei Minuten sollte das Blut fest ausgetupft werden. ⓘ
- Behandlung von Akne
Wasserstoffperoxid kann zur Behandlung von Akne verwendet werden, obwohl Benzoylperoxid eine häufigere Behandlung ist. ⓘ
Nischenanwendungen

- Glow Sticks
Wasserstoffperoxid reagiert mit bestimmten Diestern, wie z. B. Phenyloxalatester (Cyalume), und erzeugt Chemilumineszenz; diese Anwendung ist am häufigsten in Form von Leuchtstäben anzutreffen. ⓘ
- Gartenbau
Einige Gärtner und Anwender von Hydrokulturen befürworten die Verwendung von schwacher Wasserstoffperoxidlösung in Bewässerungslösungen. Durch seine spontane Zersetzung wird Sauerstoff freigesetzt, der die Wurzelentwicklung der Pflanzen fördert und bei der Behandlung von Wurzelfäule (zelluläres Wurzelsterben aufgrund von Sauerstoffmangel) und einer Reihe anderer Schädlinge hilft. ⓘ
Für die allgemeine Bewässerung werden Konzentrationen von etwa 0,1 % verwendet, die für die Anti-Pilz-Wirkung auf bis zu einem Prozent erhöht werden können. Tests haben gezeigt, dass Pflanzenblätter Konzentrationen von bis zu 3 % sicher vertragen können. ⓘ
- Fischzucht
Wasserstoffperoxid wird in der Aquakultur zur Bekämpfung der durch verschiedene Mikroben verursachten Sterblichkeit eingesetzt. Im Jahr 2019 wurde es von der FDA zur Bekämpfung von Saprolegniasis bei allen Kaltwasserfischen und allen Jungfischen und ausgewachsenen Kalt- und Warmwasserfischen, zur Bekämpfung der externen Columnaris-Krankheit bei Warmwasserfischen und zur Bekämpfung von Gyrodactylus spp. bei in Süßwasser aufgezogenen Salmoniden zugelassen. Von Fischzüchtern durchgeführte Labortests haben gezeigt, dass haushaltsübliches Wasserstoffperoxid sicher zur Sauerstoffversorgung von kleinen Fischen verwendet werden kann. Das Wasserstoffperoxid setzt durch Zersetzung Sauerstoff frei, wenn es mit Katalysatoren wie Mangandioxid in Kontakt kommt. ⓘ
- Vergilbung von gealterten Kunststoffen entfernen
Wasserstoffperoxid kann in Kombination mit einer UV-Lichtquelle verwendet werden, um die Vergilbung von weißen oder hellgrauen Acrylnitril-Butadien-Styrol-Kunststoffen (ABS) zu entfernen und die ursprüngliche Farbe teilweise oder vollständig wiederherzustellen. In der Retrocomputer-Szene wird dieses Verfahren allgemein als retr0bright bezeichnet. ⓘ
Sicherheit

Die Vorschriften sind unterschiedlich, aber niedrige Konzentrationen, wie z. B. 5 %, sind weithin erhältlich und für den medizinischen Gebrauch legal zu kaufen. Die meisten freiverkäuflichen Peroxidlösungen sind nicht zum Verschlucken geeignet. Höhere Konzentrationen können als gefährlich angesehen werden und werden in der Regel mit einem Sicherheitsdatenblatt (SDS) versehen. In hohen Konzentrationen ist Wasserstoffperoxid ein aggressives Oxidationsmittel, das viele Materialien, einschließlich der menschlichen Haut, angreift. In Gegenwart eines Reduktionsmittels reagieren hohe Konzentrationen von H2O2 heftig. ⓘ
Hochkonzentrierte Wasserstoffperoxidströme, in der Regel über 40 %, sollten als gefährlich angesehen werden, da konzentriertes Wasserstoffperoxid nach den US-Vorschriften als Oxidationsmittel gilt, wenn es in die Umwelt gelangt. Die von der EPA festgelegte meldepflichtige Menge (RQ) für gefährliche Abfälle der Klasse D001 beträgt 45 kg (100 Pfund) oder etwa 38 l (10 US-Gallonen) konzentriertes Wasserstoffperoxid. ⓘ
Wasserstoffperoxid sollte in einem kühlen, trockenen, gut belüfteten Bereich und entfernt von entzündlichen oder brennbaren Substanzen gelagert werden. Es sollte in einem Behälter aus nicht reaktivem Material wie Edelstahl oder Glas aufbewahrt werden (andere Materialien, einschließlich einiger Kunststoffe und Aluminiumlegierungen, können ebenfalls geeignet sein). Da es sich unter Lichteinwirkung schnell zersetzt, sollte es in einem lichtundurchlässigen Behälter aufbewahrt werden; pharmazeutische Formulierungen werden in der Regel in braunen Flaschen geliefert, die das Licht abhalten. ⓘ
Wasserstoffperoxid kann sowohl in reiner als auch in verdünnter Form mehrere Risiken bergen, wobei das Hauptrisiko darin besteht, dass es bei Kontakt mit organischen Verbindungen explosive Gemische bildet. Die Destillation von Wasserstoffperoxid bei normalem Druck ist sehr gefährlich. Es ist außerdem ätzend, vor allem in konzentrierter Form, aber auch Lösungen in Haushaltsstärke können zu Reizungen der Augen, der Schleimhäute und der Haut führen. Das Verschlucken von Wasserstoffperoxidlösungen ist besonders gefährlich, da bei der Zersetzung im Magen große Mengen an Gas freigesetzt werden (das Zehnfache des Volumens einer 3 %igen Lösung), was zu inneren Blähungen führt. Das Einatmen von mehr als 10 % kann zu schweren Lungenreizungen führen. ⓘ
Mit einem erheblichen Dampfdruck (1,2 kPa bei 50 °C) ist Wasserstoffperoxiddampf potenziell gefährlich. Nach Angaben des US-amerikanischen NIOSH liegt der Grenzwert für die unmittelbare Gefahr für Leben und Gesundheit (IDLH) bei nur 75 ppm. Die U.S. Occupational Safety and Health Administration (OSHA) hat einen zulässigen Expositionsgrenzwert von 1,0 ppm festgelegt, der als zeitlich gewichteter 8-Stunden-Mittelwert berechnet wird (29 CFR 1910.1000, Tabelle Z-1). Wasserstoffperoxid wurde auch von der American Conference of Governmental Industrial Hygienists (ACGIH) als "bekanntes Karzinogen für Tiere, mit unbekannter Bedeutung für den Menschen" eingestuft. An Arbeitsplätzen, an denen das Risiko einer Exposition gegenüber den gefährlichen Konzentrationen der Dämpfe besteht, sollten kontinuierliche Überwachungsgeräte für Wasserstoffperoxid eingesetzt werden. Informationen über die Gefahren von Wasserstoffperoxid sind bei der OSHA und bei der ATSDR erhältlich. ⓘ
Wundheilung
In der Vergangenheit wurde Wasserstoffperoxid zur Desinfektion von Wunden verwendet, auch weil es im Vergleich zu anderen Antiseptika kostengünstig und schnell verfügbar ist. ⓘ
Es gibt widersprüchliche Erkenntnisse über die Wirkung von Wasserstoffperoxid auf die Wundheilung. Einige Untersuchungen zeigen einen Nutzen, während andere Untersuchungen Verzögerungen und eine Hemmung der Heilung feststellen. ⓘ
Verwendung in der Alternativmedizin
Alternativmediziner haben die Verwendung von Wasserstoffperoxid bei verschiedenen Erkrankungen befürwortet, darunter Emphysem, Grippe, AIDS und insbesondere Krebs. Es gibt keine Beweise für die Wirksamkeit, und in einigen Fällen hat sie sich als tödlich erwiesen. ⓘ
Sowohl die Wirksamkeit als auch die Sicherheit der Wasserstoffperoxidtherapie sind wissenschaftlich fragwürdig. Wasserstoffperoxid wird vom Immunsystem produziert, allerdings auf eine sorgfältig kontrollierte Weise. Zellen, so genannte Phagozyten, nehmen Krankheitserreger auf und verwenden dann Wasserstoffperoxid, um sie zu zerstören. Da das Peroxid sowohl für die Zelle als auch für den Erreger giftig ist, wird es in einem speziellen Kompartiment, dem Phagosom, gespeichert. Freies Wasserstoffperoxid schädigt jedes Gewebe, mit dem es in Berührung kommt, durch oxidativen Stress, ein Prozess, der auch als Ursache für Krebs vorgeschlagen wurde. Behauptungen, dass eine Wasserstoffperoxidtherapie den Sauerstoffgehalt in den Zellen erhöht, wurden nicht bestätigt. Es ist davon auszugehen, dass die verabreichten Mengen nur sehr wenig zusätzlichen Sauerstoff im Vergleich zu dem bei der normalen Atmung verfügbaren liefern. Außerdem ist es schwierig, den Sauerstoffgehalt in der Umgebung von Krebszellen innerhalb eines Tumors zu erhöhen, da die Blutversorgung eher schlecht ist, eine Situation, die als Tumorhypoxie bekannt ist. ⓘ
Große orale Dosen von Wasserstoffperoxid in einer Konzentration von 3 % können zu Reizungen und Blasenbildung in Mund, Rachen und Bauch sowie zu Bauchschmerzen, Erbrechen und Durchfall führen. Das Verschlucken von Wasserstoffperoxid in Konzentrationen von 35 % oder mehr wurde als Ursache zahlreicher Gasembolien mit Krankenhauseinweisung in Betracht gezogen. In diesen Fällen wurde eine hyperbare Sauerstofftherapie zur Behandlung der Embolien eingesetzt. ⓘ
Die intravenöse Injektion von Wasserstoffperoxid wurde mit mehreren Todesfällen in Verbindung gebracht. Die Amerikanische Krebsgesellschaft stellt fest, dass "es keine wissenschaftlichen Beweise dafür gibt, dass Wasserstoffperoxid eine sichere, wirksame oder nützliche Krebsbehandlung ist". Darüber hinaus ist die Therapie nicht von der US-amerikanischen Zulassungsbehörde FDA zugelassen. ⓘ
Historische Vorfälle
- Am 16. Juli 1934 explodierte in Kummersdorf, Deutschland, während eines Tests ein Treibstofftank mit einer experimentellen Monotreibstoffmischung aus Wasserstoffperoxid und Ethanol, wobei drei Menschen ums Leben kamen.
- Während des Zweiten Weltkriegs experimentierten Ärzte in deutschen Konzentrationslagern mit der Verwendung von Wasserstoffperoxid-Injektionen zur Tötung von Menschen.
- Im April 1992 ereignete sich in der Wasserstoffperoxidanlage in Jarrie in Frankreich eine Explosion, die auf ein technisches Versagen des computergesteuerten Kontrollsystems zurückzuführen war und einen Todesfall und die weitgehende Zerstörung der Anlage zur Folge hatte.
- Am 28. Oktober 1998 wurden mehrere Personen leicht verletzt, nachdem an Bord eines Fluges zwischen den amerikanischen Städten Orlando und Memphis Wasserstoffperoxid ausgetreten war.
- Das russische U-Boot K-141 Kursk lief aus, um bei einer Übung Torpedoattrappen auf den Pjotr Welikiy, einen Schlachtkreuzer der Kirow-Klasse, abzuschießen. Am 12. August 2000, um 11.28 Uhr Ortszeit (07.28 Uhr UTC), kam es bei der Vorbereitung des Torpedoschusses zu einer Explosion. Der einzige glaubwürdige Bericht, der bisher vorliegt, besagt, dass dies auf das Versagen und die Explosion eines der mit Wasserstoffperoxid betriebenen Torpedos der Kursk zurückzuführen ist. Es wird vermutet, dass HTP, eine Form von hochkonzentriertem Wasserstoffperoxid, das als Treibstoff für die Torpedos verwendet wurde, durch den Behälter gesickert ist und entweder durch Rost oder bei der Verladung an Land beschädigt wurde, wobei ein Vorfall, bei dem einer der Torpedos versehentlich den Boden berührte, nicht gemeldet wurde. Das Schiff ging mit allen Personen unter. Ein ähnlicher Vorfall war für den Verlust der HMS Sidon im Jahr 1955 verantwortlich.
- Am 15. August 2010 kam es im 54. Stock des Gebäudes 1515 Broadway am Times Square in New York City zu einem Auslaufen von etwa 110 Litern Reinigungsflüssigkeit. Stock des Gebäudes 1515 Broadway am Times Square in New York City. Nach Angaben eines Sprechers der New Yorker Feuerwehr handelte es sich um Wasserstoffperoxid, das den Broadway zwischen der West 42nd und der West 48th Street sperrte, als die Feuerwehr auf die Gefahrensituation reagierte. Es wurden keine Verletzten gemeldet. ⓘ
Biologische Eigenschaften (Physiologie)

Wasserstoffperoxid wirkt stark ätzend, besonders als Dampf. Falls man Wasserstoffperoxid auf die Haut bekommt, sollte man die Stelle mit Wasser gut spülen (Verdünnung) oder das Wasserstoffperoxid zumindest sofort von der Haut entfernen. Dringt es in die Haut ein, so zersetzt es sich dort rasch, und die entstehenden Sauerstoffbläschen lassen die Haut weiß erscheinen. ⓘ
Allgemein wirkt Wasserstoffperoxid zytotoxisch und durch seine starke Toxizität gegenüber vielen prokaryotischen Kleinstlebewesen desinfizierend. ⓘ
Wasserstoffperoxid entsteht bei zahlreichen biochemischen Prozessen. Im biologischen Kreislauf entsteht es durch die oxidative Metabolisierung von Zucker. Der Organismus schützt sich gegen seine toxische Wirkung mittels Enzymen – Katalasen, Peroxidasen –,die es wieder zum ungiftigen O2 und H2O zersetzen. ⓘ
Zudem stellt Wasserstoffperoxid ein Signalmolekül für die Induktion der pflanzlichen Abwehr von Pathogenen dar (Aspekt der Zytotoxizität). ⓘ
Graufärbung von Haaren im Alter
Deutsche und britische Forscher gaben in einer Studie im März 2009 bekannt, dass die „Graufärbung“ (eigentlich Weißfärbung) von Haaren im Alter Folge eines geringeren Abbaus von Wasserstoffperoxid in den Haaren ist. Man konnte im Laborversuch zeigen, dass Wasserstoffperoxid die Funktion des Enzyms Tyrosinase behindert, das für die Melaninproduktion benötigt wird. Dies geschieht durch Oxidation der in der Tyrosinase enthaltenen Aminosäure Methionin. ⓘ
Verwendung
Wasserstoffperoxid als starkes Oxidationsmittel eignet sich dazu, als Sauerstoffträger für auf Verbrennung basierende Sprengstoffe zu dienen. Daher sind bei Konzentrationen ab 120 g/kg in der EU die Abgabe an sowie der Besitz, die Verwendung und die Verbringung durch Personen, die nicht zu beruflichen oder gewerblichen Zwecken handeln, verboten und nur bis 349 g/kg genehmigungsfähig. Für den Industriebedarf gibt es wässrige Lösungen mit Konzentrationen von bis zu 70 % H2O2. Hochkonzentrierte Lösungen von Wasserstoffperoxid können sich spontan unter Explosion zersetzen. ⓘ
Wasseraufbereitung
Trinkwasser
Bei der Einwirkung von UV-Strahlen auf Wasserstoffperoxid wird das Hydroxyl-Radikal, ein wesentlich stärkeres Oxidationsmittel als das Peroxid selbst, gebildet. Nachfolgend die Gleichung für die Bildung:
Diese starke Oxidationswirkung wird in der Wasseraufbereitung zum Abbau organischer Verunreinigungen verwendet. Als Beispiel das sogenannte UVOX-Verfahren (UV-Licht und OXidation), mit dem das Herbizid Atrazin und sein Abbauprodukt Desethylatrazin oder auch andere toxische Inhaltsstoffe aus dem Trinkwasser sicher entfernt werden können. Durch diese „nasse Verbrennung“ des Atrazin werden nur Abbauprodukte wie Wasser, Sauerstoff, Kohlenstoffdioxid und Stickstoff gebildet, und es tritt keine zusätzliche Aufsalzung des Wassers auf. Zudem ersetzt diese Methode die Verwendung von Aktivkohle, die deutlich kostenintensiver ist. ⓘ
Kühlwasser
Wasserstoffperoxid wird auch Kühlkreisläufen zugesetzt, um ein Verkeimen, u. a. mit Legionellen, zu verhindern. Dazu wird dem Kühlwasser in periodischen Zeitabständen höherprozentiges (maximal 349 g/kg) Wasserstoffperoxid automatisch dosiert zugesetzt. ⓘ
Desinfektion und Sterilisation
Eine 3-prozentige Lösung Wasserstoffperoxid wird zur Desinfektion, auch im Haushaltsbereich, eingesetzt. Einsatzbeispiele sind Mund- und Rachenraum (zur Mundspülung wird es auf 0,3 % verdünnt), die Zahnmedizin, die Desinfektion von Kontaktlinsen in Reinigern, die Entkeimung von Packstoffen oder die Desinfektion der Hände in Krankheitsfällen. Demgemäß kommt es in Gesichtscremes zum Einsatz: zur Reinigung der Poren und der Bekämpfung von Pickeln und Hautverunreinigungen. Auch bei der Reinigung von industriellen Abwässern und in der Schwimmbadtechnik erfolgt damit die Desinfektion des Wassers. ⓘ
Die 35-prozentige Lösung von Wasserstoffperoxid wird in der Lebensmittelindustrie in aseptischen Abfüllanlagen zur Sterilisation von PET-Flaschen, Kunststoffbehältern und den typischen mehrschichtigen Kartonverpackungen verwendet. Zahlreiche Lebensmittel (Getränke, Milch, Milchprodukte, Soßen, Suppen) werden heute zur besseren Haltbarkeit und Produktqualität in Kartons, Becher, Flaschen und Folien aseptisch abgepackt. Dabei wird das Verpackungsmaterial mit 35-prozentigem Wasserstoffperoxid desinfiziert, bevor das jeweilige Lebensmittel eingefüllt wird. ⓘ
Ein weiteres Anwendungsgebiet ist der Einsatz von gasförmigem H2O2 zur Reinraumdekontamination. Dazu wird eine üblicherweise 35-prozentige Lösung in einem speziellen Apparat verdampft und in den zu dekontaminierenden Bereich (Raum, Kammer usw.) geblasen. ⓘ
Die hohe bakterizide Wirkung von H2O2, die Umweltverträglichkeit und die gute technische Realisierbarkeit sind die Gründe für die weite Verbreitung dieses Verfahrens. ⓘ
Ein anderes Verfahren zur Raumdesinfektion mit Wasserstoffperoxid stellt die Kaltverneblung dar. Dabei wird Wasserstoffperoxid in ein Aerosol überführt und je nach Konzentration (ab 3 %) nach einem festgelegten Prozesszyklus durch einen Aerosolerzeuger im Raum verteilt. Die Aerosole haben eine Tröpfchengröße von 0,5–40 µm. Die Tröpfchengröße ist abhängig von der eingesetzten Technologie zur Generation der Aerosole. Die Aerosole verteilen sich nach kurzer Zeit gleichmäßig im Raum. Eine geringe Tröpfchengröße wirkt sich positiv auf die Verteilung und die Schwebefähigkeit der Tröpfchen aus. Je nach klimatischen Ausgangsbedingungen des Raumes wird ein Teil der in flüssiger Phase vorliegenden Tröpfchen in die Gasphase überführt. Die dazu notwendige Energie wird der Raumtemperatur entnommen. Der Prozess ist identisch zur adiabaten Befeuchtung. Das Medium durchmischt sich mit dem Medium Luft und bewirkt bei fachgerechter Anwendung eine holotische Desinfektion. Die Apparatur (Generator) zur Verneblung sowie das spezielle Verfahren müssen im Vorfeld zur Wirksamkeit validiert werden. Darüber hinaus ist diese auf Basis vorliegender Normung auf Wirksamkeit zu überprüfen. Hierbei wird das System aus Desinfektionsprodukt und Aerosolerzeuger in einem Labor auf seine Wirksamkeit getestet. ⓘ
Für den Spezialfall SARS-CoV-2/COVID-19 kommt eine systematische Übersichtsarbeit aus dem Jahr 2020 über Wasserstoffperoxid (H2O2)-Mundspülungen zu dem Schluss, dass diese keinen Einfluss auf die viruzide Aktivität haben, und empfiehlt, dass "Zahnpflegeprotokolle während der COVID-19-Pandemie überarbeitet werden sollten." ⓘ
Sauerstoffzuführung
Wasserstoffperoxid kann in Aquarien zum Zuführen von Sauerstoff benutzt werden. Die Sauerstofferzeugung geschieht in einem Oxidator. Dazu wird in einem Gefäß im Aquarium Wasserstoffperoxid mit Hilfe eines Katalysators in Wasser und Sauerstoffradikale gespalten. ⓘ
Gegen Schimmelbefall
Bei der Innenrenovierung kann Schimmelpilzbefall mit Wasserstoffperoxid bekämpft werden. Dabei wirkt es desinfizierend sowohl gegen die biologisch aktiven Pilzzellen – als Fungizid – als auch gegen die „Konidien“ genannten Sporen der Schimmelpilze. ⓘ
Durch die bleichende Wirkung entfernt es auch „optisch“ die Rückstände des Schimmelbelags von porösen Untergründen. Wasserstoffperoxid hat gegenüber Alkohol oder Chlorbleichlauge einige Vorteile, da es im Gegensatz zu Alkohol unbrennbar ist, bleichende Wirkung hat und im Gegensatz zu Chlorbleichlauge keine chlorierten Nebenprodukte hinterlässt. ⓘ
Medizin
In der Zahnmedizin wird H2O2 als dreiprozentige wässrige Lösung zur lokalen Desinfektion des Zahngewebes und zur Blutstillung bei kleineren Eingriffen verwendet. In der Medizin und Notfallmedizin kann die Substanz zur Desinfektion von Oberflächen, Instrumenten, Haut und Schleimhaut verwendet werden. Bei der Reinigung von Wunden kommt Wasserstoffperoxid heutzutage zwar noch vereinzelt zum Einsatz, hat aber seine traditionell bedingte Bedeutung inzwischen verloren, denn es wird innerhalb der Wunde bei Kontakt mit roten Blutkörperchen unter Aufschäumen schnell inaktiviert und entfaltet daher seine Wirkung nur kurz. ⓘ
Seit geraumer Zeit wird ein Verfahren zum Sterilisieren von bestimmten Medizinprodukten und chirurgischen Instrumenten angewandt, in dem H2O2 als Prozesschemikalie Verwendung findet (H2O2-Plasmaverfahren). Besonders bei thermolabilen Produkten bringt es Vorteile gegenüber der Dampfsterilisation. Es kann z. B. im Vakuum bei Raumtemperatur verdampft und zusätzlich ionisiert werden. ⓘ
Zudem wird H2O2 zur Desinfektion von Piercings verwendet. Dort soll es die betroffene Stelle desinfizieren und eine mögliche Blutung gerinnen lassen, wodurch ein schnellerer Heilprozess eintreten soll. ⓘ
Landwirtschaft
In der Landwirtschaft wird Wasserstoffperoxid zur Desinfektion in Gewächshäusern und zur Sauerstoffanreicherung in Nährlösungen von Hydrokulturen benutzt. Wasserstoffperoxid wird auch zur Desinfektion von Tränkeleitungssystemen oder Stalleinrichtungen zum Beispiel in der Schweinehaltung verwendet. ⓘ
Biologie
Für die Bestimmung von Bakterienkulturen wird der Katalase-Test mit dreiprozentiger Wasserstoffperoxidlösung durchgeführt. Die meisten aeroben und fakultativ anaeroben Bakterien wie auch Pilze haben das Enzym Katalase, das imstande ist, das für die Zellen giftige H2O2 zu spalten. ⓘ
Experimentell wird Wasserstoffperoxid in der Biologie zur Herbeiführung des programmierten Zelltodes von isolierten eukaryotischen Zellen genutzt. ⓘ
Forensik
Wasserstoffperoxid wurde in der Forensik zum Nachweis von Blut verwendet. Louis Jacques Thénard entdeckte 1818, dass Hämoglobin Wasserstoffperoxid zersetzt. Christian Friedrich Schönbein entwickelte daraus 1863 einen Test auf Blut. Heute wird jedoch der empfindlichere Kastle-Meyer-Test zum Nachweis von Blut verwendet. ⓘ
Ätzmittel
In der Mikroelektronik benutzt man das Gemisch von Schwefelsäure und Wasserstoffperoxid – „Piranha“ genannt – zur Reinigung der Oberfläche von Wafern und zur Erzeugung einer dünnen, etwa drei bis vier Nanometer dicken hydrophilen Oxidschicht auf den Wafern. Heutzutage ist die Bezeichnung „SPM“ (Sulfuric Peroxide Mixture) geläufiger. Die Hauptanwendung ist das Entfernen von Fotolacken auf Wafern. ⓘ
Bei der Herstellung von gedruckten Leiterplatten (Platinen) werden konzentrierte Wasserstoffperoxid-haltige Kupferchlorid-Ätzbäder zum Entfernen des Kupfers verwendet:
- .
- Elementares Kupfer reagiert mit Kupfer(II)-chlorid zu Kupfer(I)-chlorid. Es handelt sich hierbei um eine Komproportionierung. ⓘ
Zur Regeneration der Kupferchlorid-Ätzbäder wird Wasserstoffperoxid zusammen mit Salzsäure eingesetzt:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{2CuCl \ + 2Cl^{-}_{(aq)} \ + 2H3O^{+}_{(aq)} \ + H2O2 -> 2CuCl2 + 4 H2O <span title="Aus: Deutsche Wikipedia, Abschnitt "Ätzmittel"" class="plainlinks">[https://de.wikipedia.org/wiki/Wasserstoffperoxid#Ätzmittel <span style="color:#dddddd">ⓘ</span>]</span> }} .
- Durch Reaktion des Kupfer(I)-chlorid mit Wasserstoffperoxid und Salzsäure wird das Kupfer(II)-chlorid regeneriert. Das Kupferatom wird dabei oxidiert. ⓘ
Dabei werden die Wasserstoffperoxid- und Salzsäurezugabe über das Redoxpotential gesteuert; die hier verwendeten Fotolacke sind stabil gegen Wasserstoffperoxid. ⓘ
Analytik
Klassische qualitative und quantitative Analytik
Diese klassischen Methoden verlieren wegen ihrer geringen Nachweisgrenzen und ihrer Umständlichkeit ihre Bedeutung in der Laborpraxis. ⓘ
Nachweis als blaues Chromperoxid (CrO(O2)2) ⓘ
Chromtrioxid CrO3 wird im stark sauren Bereich (pH<0) durch Wasserstoffperoxid zum tiefblau gefärbten und etherlöslichen Chrom(VI)-peroxid umgesetzt. Dazu wird Kaliumdichromat im Reagenzglas mit verdünnter Schwefelsäure angesäuert und mit etwas Ether überschichtet. Bei Anwesenheit von H2O2 färbt sich die Etherphase bläulich. Wegen der Verwendung giftiger und karzinogener Chrom(VI)-Verbindungen ist dieser Test heute nur noch von akademischem Interesse. ⓘ
Nachweis als gelbes Peroxotitanyl(IV)-Ion ⓘ
Der Nachweis als Titangelb (nicht zu verwechseln mit dem gleichnamigen organischen Reagenz) ist sehr empfindlich. Titan(IV)-Ionen reagieren mit Spuren von Wasserstoffperoxid zu intensiv orangegelb gefärbten Peroxotitanyl-Komplexionen. ⓘ
Redox-Titration mit Kaliumpermanganat ⓘ
Die Konzentration von Wasserstoffperoxid in schwefelsaurer wässriger Lösung kann mit Kaliumpermanganat titrimetrisch ermittelt werden. Ist stattdessen Salzsäure vorhanden, wird Reinhardt-Zimmermann-Lösung hinzugefügt. Der Titration liegt folgende Reaktion zu Grunde:
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{2 MnO4- + 5 H2O2 + 6 H3O+ -> 2 Mn^2+ + 5O2 + 14 H2O <span title="Aus: Deutsche Wikipedia, Abschnitt "Klassische qualitative und quantitative Analytik"" class="plainlinks">[https://de.wikipedia.org/wiki/Wasserstoffperoxid#Klassische_qualitative_und_quantitative_Analytik <span style="color:#dddddd">ⓘ</span>]</span> }}
Der Farbumschlag erfolgt von farblos bis zur schwachen Rosafärbung, die für eine Minute bestehen bleiben sollte. Der Verbrauch von 1 ml KMnO4-Lösung (0,02 mol/l = 0,1N) entspricht 1,701 mg H2O2. Auf diesem Weg können auch Verbindungen titriert werden, die in schwefelsaurer Lösung H2O2 abspalten, wie Peroxide, Perborate oder Percarbonate. ⓘ
Nachweis mit Iodidstärke-Papier ⓘ
Iodid-getränktes und stärkehaltiges Filterpapier zeigt bereits geringe Peroxidmengen durch Blaufärbung an. Hierbei oxidiert das Peroxid das Iodid zu Iod, das wiederum mit Stärke zusammen einen charakteristischen blauen Komplex bildet. ⓘ
Instrumentelle quantitative Analytik
Optische Methoden
Photometrie ⓘ
Das Oxidationsvermögen von H2O2 ermöglicht eine Vielzahl von (zum Teil enzymatisch katalysierten) chromogenen Reaktionen. Dadurch sind photometrische oder reflektometrische Bestimmungen von H2O2 möglich. Eine der bewährtesten Oxidationsreaktionen ist die „Trinder-Reaktion“ von Phenol mit 4-Aminoantipyrin zu einem violetten Farbstoff. Die Absorbanz ist proportional zur Analytkonzentration und kann bei 510 Nanometer gemessen werden. Chemische Modifikationen der Reagenzien erlauben auch eine Messung bei Wellenlängen von 550 und 750 Nanometer. Mit dieser Methode konnte eine Nachweisgrenze von 1 µmol erzielt werden. ⓘ
Fluorometrie ⓘ
Eine der wohl wichtigsten Nachweismethoden für Wasserstoffperoxid ist die peroxidase-katalysierte Oxidation von Amplex Red durch H2O2 zu Resorufin. Resorufin zeigt nach Anregung bei 535 Nanometer eine deutliche Fluoreszenz bei 590 Nanometer, während Amplex Red nicht fluoresziert. Die Wasserstoffperoxidkonzentration kann so mit einer Nachweisgrenze von 5 nmol/l bestimmt werden. ⓘ
Amperometrische Sensorik
Amperometrische Sensoren zum Nachweis von Wasserstoffperoxid sind schon länger bekannt. Das Messprinzip beruht darauf, dass Wasserstoffperoxid an einer Arbeitselektrode bei einem konstanten Potential entweder kathodisch reduziert oder anodisch oxidiert wird. Der resultierende Strom ist dabei proportional zur Konzentration des H2O2. Das Potential für die kathodische Reduktion liegt meist zwischen −100 und −200 mV und das Potentialfenster für die anodische Oxidation reicht von 600 bis 800 mV bezogen auf eine Ag/AgCl-Referenzelektrode. ⓘ
Ein weiterer Ansatz ist die Immobilisierung von Enzymen (etwa der Meerrettichperoxidase) auf einer Kompositschicht aus Kohlenstoffnanoröhren und Chitosan. Mit diesen Biosensoren wurde eine Nachweisgrenze von 10,3 µmol/l erzielt. Eine zunehmend wichtigere Rolle spielen biomimetische, nichtenzymatische Sensoren auf Basis von magnetischen Eisenoxid-Nanopartikeln. Diese übernehmen die katalytische Funktion der Peroxidase und ermöglichen eine Nachweisgrenze von 3,6 µmol/l. Weitere Sonden bedienen sich sogenannter Mn-NTA-Nanodrähte (Mangan-Nitrilotriacetat-Komplex), die amperometrisch die elektrochemische Oxidation des Wasserstoffperoxids verfolgen. Es wurde eine Nachweisgrenze von 0,2 µmol/l beschrieben. ⓘ
Vorschriften
Situation in Deutschland
Die jeweils geltenden Vorschriften für den Stoff und seine wässrige Lösung hängen von der in "Massen-Prozent" oder auch "g/kg" angegebenen massebezogenen Konzentration ab. Hier gibt es verschiedene Grenzwerte. ⓘ
Konzentration unter 8 %
Nur recht allgemeine Sicherheitsregeln. ⓘ
Konzentration 8 bis unter 35 %
Ab 80 g/kg gilt die Lösung als Gefahrstoff. Die Zersetzungstemperatur liegt oberhalb von 100 °C. Es gilt:
- Durchfahrverbot für Tunnel der Kategorie E.
- Einstufung als Gefahrgut der Klasse 5.1 (brandfördernd)
- UN-Nummer 2984 / Kennzeichnung 50. ⓘ
Ab 120 g/kg zählt die EU Wasserstoffperoxid zu den beschränkten Ausgangsstoffen für Explosivstoffe mit der Folge, dass die Verwendung, der Besitz, die Verbringung und die Abgabe durch und an Personen verboten ist, die nicht zu beruflichen oder gewerblichen Zwecken handeln; die berufliche oder gewerbliche Zweckbestimmung ist bei Verkauf zu überprüfen und verdächtige Transaktionen sowie Diebstahl sind meldepflichtig. Verstöße gegen das Besitz- und Verwendungsverbot sind in Deutschland strafbar. Ausnahmegenehmigungen sind jedoch für Gemische bis 35 % möglich. ⓘ
Ab 200 g/kg ist die Lösung auch als Gefahrgut Klasse 8 (ätzend) zu deklarieren. Die Kennzeichnung erfolgt mit der UN-Nummer 58 / 1014. ⓘ
Konzentration 35 bis unter 50 %
- Ab 350 g/kg sind Genehmigungen nach Art. 5 Abs. 3 der EU-Verordnung nicht mehr möglich. Daher ist 349 g/kg eine verbreitete genaue Konzentration im Handel, wenn von "35 %" geschrieben wird. die Zersetzungstemperatur liegt oberhalb von 60 °C. ⓘ
Konzentration 50 bis unter 60 %
Hier verschärfen sich besonders Empfehlungen und Sicherheitsregeln. Die Neigung zur Zersetzung steigt erheblich, die Zersetzungstemperatur liegt aber immer noch über 60 °C. ⓘ
Konzentration ab 60 %
Aufgrund der extremen Zersetzungsgefahr gilt bei mind. 600 g/kg die Einstufung H271: "Kann Brand oder Explosion verursachen; starkes Oxidationsmittel". Auch der Kontakt mit schlecht entflammbaren Substanzen kann zur Selbstentzündung führen. Aus diesem Grund gelten beim Transport viel strengere Regeln.
- Lagerklasse ist 5.1 A statt 5.1 B
- Kennzeichnung der Gefahr: 558, UN-Nummer 2015
- Wird es in Tanks befördert, so dürfen auch Tunnel der Kategorien B, C, und D nicht durchfahren werden. ⓘ