Chlorwasserstoff
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Chlorwasserstoff
| |||
| Andere Namen
Salzsäuregas
Chlorwasserstoff-Gas Chlorwasserstoff Chloran | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
Beilstein-Referenz
|
1098214 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin-Referenz
|
322 | ||
| KEGG | |||
| MeSH | Salzsäure+Säure | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
| UN-Nummer | 1050 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
HCl | ||
| Molekulare Masse | 36,46 g/mol | ||
| Erscheinungsbild | Farbloses Gas | ||
| Geruch | stechend; scharf und brennend | ||
| Dichte | 1,49 g/L | ||
| Schmelzpunkt | -114,22 °C (-173,60 °F; 158,93 K) | ||
| Siedepunkt | -85,05 °C (-121,09 °F; 188,10 K) | ||
Löslichkeit in Wasser
|
823 g/L (0 °C) 720 g/L (20 °C) 561 g/L (60 °C) | ||
| Löslichkeit | löslich in Methanol, Ethanol, Ether | ||
| Dampfdruck | 4352 kPa (bei 21,1 °C) | ||
| Azidität (pKa) | −3.0; −5.9 (±0.4) | ||
| Basizität (pKb) | 17.0 | ||
| Konjugierte Säure | Chloronium | ||
| Konjugierte Base | Chlorid | ||
Brechungsindex (nD)
|
1,0004456 (Gas) 1,254 (flüssig) | ||
| Viskosität | 0,311 cP (-100 °C) | ||
| Struktur | |||
Molekulare Form
|
linear | ||
Dipolmoment
|
1.05 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
0,7981 J/(K-g) | ||
Std. molare
Entropie (S |
186.902 J/(K-mol) | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-92,31 kJ/mol | ||
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
-95,31 kJ/mol | ||
| Pharmakologie | |||
ATC-Code
|
A09AB03 (WHO) B05XA13 (WHO) | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H280, H314, H331 | ||
Sicherheitshinweise
|
P261, P280, P305+P351+P338, P310, P410+P403 | ||
| NFPA 704 (Feuerdiamant) | |||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (mittlere Dosis)
|
238 mg/kg (Ratte, oral) | ||
LC50 (mittlere Konzentration)
|
3124 ppm (Ratte, 1 h) 1108 ppm (Maus, 1 h) | ||
LCLo (niedrigste veröffentlichte)
|
1300 ppm (Mensch, 30 min) 4416 ppm (Kaninchen, 30 min) 4416 ppm (Meerschweinchen, 30 min) 3000 ppm (Mensch, 5 min) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
C 5 ppm (7 mg/m3) | ||
REL (Empfohlen)
|
C 5 ppm (7 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
50 ppm | ||
| Sicherheitsdatenblatt (SDS) | JT Baker Sicherheitsdatenblatt | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Fluorwasserstoff Bromwasserstoff Jodwasserstoff Astatwasserstoff | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Die Verbindung Chlorwasserstoff hat die chemische Formel HCl und ist damit ein Halogenwasserstoff. Bei Raumtemperatur ist sie ein farbloses Gas, das bei Kontakt mit atmosphärischem Wasserdampf weiße Salzsäuredämpfe bildet. Chlorwasserstoffgas und Salzsäure sind in Technik und Industrie von großer Bedeutung. Chlorwasserstoffsäure, die wässrige Lösung von Chlorwasserstoff, wird auch mit der Formel HCl bezeichnet. ⓘ
Es wurde von Humphry Davy 1808 dargestellt. ⓘ
Reaktionen

Chlorwasserstoff ist ein zweiatomiges Molekül, bestehend aus einem Wasserstoffatom H und einem Chloratom Cl, die durch eine polare kovalente Bindung verbunden sind. Das Chloratom ist viel elektronegativer als das Wasserstoffatom, was diese Bindung polar macht. Folglich hat das Molekül ein großes Dipolmoment mit einer negativen Partialladung (δ-) am Chloratom und einer positiven Partialladung (δ+) am Wasserstoffatom. Unter anderem aufgrund seiner hohen Polarität ist HCl sehr gut in Wasser (und anderen polaren Lösungsmitteln) löslich. ⓘ
Bei Kontakt verbinden sich H2O und HCl in einer reversiblen chemischen Reaktion zu Hydroniumkationen [H3O]+ und Chloridanionen Cl-:
- HCl + H2O → [H3O]+ + Cl- ⓘ
Die resultierende Lösung wird Salzsäure genannt und ist eine starke Säure. Die Säuredissoziations- oder Ionisationskonstante Ka ist groß, d. h. HCl dissoziiert oder ionisiert praktisch vollständig in Wasser. Auch in Abwesenheit von Wasser kann Chlorwasserstoff als Säure wirken. So kann sich Chlorwasserstoff beispielsweise in bestimmten anderen Lösungsmitteln wie Methanol lösen:
- HCl + CH3OH → [CH3OH2]+ + Cl- ⓘ
Chlorwasserstoff kann Moleküle oder Ionen protonieren und kann auch als Säurekatalysator für chemische Reaktionen dienen, bei denen wasserfreie Bedingungen gewünscht sind. ⓘ
Aufgrund seines sauren Charakters ist Chlorwasserstoff eine korrosive Substanz, insbesondere in Gegenwart von Feuchtigkeit. ⓘ
Struktur und Eigenschaften
Gefrorenes HCl durchläuft bei 98,4 K einen Phasenübergang. Die Röntgenpulverbeugung des gefrorenen Materials zeigt, dass sich das Material während dieses Übergangs von einer orthorhombischen zu einer kubischen Struktur verändert. In beiden Strukturen befinden sich die Chloratome in einer flächenzentrierten Anordnung. Die Wasserstoffatome konnten jedoch nicht lokalisiert werden. Die Analyse der spektroskopischen und dielektrischen Daten sowie die Bestimmung der Struktur von DCl (Deuteriumchlorid) zeigen, dass HCl im Festkörper Zickzackketten bildet, ebenso wie HF (siehe Abbildung rechts). ⓘ
| Temperatur (°C) | 0 | 20 | 30 | 50 |
|---|---|---|---|---|
| Wasser | 823 | 720 | 673 | 596 |
| Methanol | 513 | 470 | 430 | |
| Ethanol | 454 | 410 | 381 | |
| Ether | 356 | 249 | 195 |


Das links abgebildete Infrarotspektrum von gasförmigem Chlorwasserstoff besteht aus einer Reihe von scharfen Absorptionslinien, die sich um 2886 cm-1 (Wellenlänge ~3,47 µm) gruppieren. Bei Raumtemperatur befinden sich fast alle Moleküle im Grundschwingungszustand v = 0. Unter Berücksichtigung der Anharmonizität kann die Schwingungsenergie wie folgt beschrieben werden.
Um ein HCl-Molekül vom Zustand v = 0 in den Zustand v = 1 zu überführen, würde man eine Infrarotabsorption um νo = νe + 2xeνe = 2880 cm-1 erwarten. Diese Absorption, die dem Q-Zweig entspricht, wird jedoch nicht beobachtet, da sie durch die Symmetrie untersagt ist. Stattdessen werden zwei Gruppen von Signalen (P- und R-Zweige) beobachtet, die auf eine gleichzeitige Änderung des Rotationszustands der Moleküle zurückzuführen sind. Aufgrund von quantenmechanischen Selektionsregeln sind nur bestimmte Rotationsübergänge erlaubt. Die Zustände werden durch die Rotationsquantenzahl J = 0, 1, 2, 3, ... charakterisiert. Die Auswahlregeln besagen, dass ΔJ nur Werte von ±1 annehmen kann.
Der Wert der Rotationskonstante B ist viel kleiner als der der Schwingungskonstante νo, so dass eine viel geringere Energiemenge erforderlich ist, um das Molekül zu drehen; für ein typisches Molekül liegt diese im Mikrowellenbereich. Aufgrund der Schwingungsenergie des HCl-Moleküls liegen seine Absorptionen jedoch im Infrarotbereich, so dass sich ein Spektrum, das die Schwingungsübergänge dieses Moleküls zeigt, leicht mit einem Infrarotspektrometer mit Gaszelle aufnehmen lässt. Letztere kann sogar aus Quarz bestehen, da die HCl-Absorption in einem Fenster liegt, das für dieses Material transparent ist. ⓘ
Das natürlich vorkommende Chlor besteht aus zwei Isotopen, 35Cl und 37Cl, in einem Verhältnis von etwa 3:1. Während die Federkonstanten nahezu identisch sind, führen die unterschiedlichen reduzierten Massen von H35Cl und H37Cl zu messbaren Unterschieden in der Rotationsenergie, so dass bei genauer Betrachtung jeder Absorptionslinie Dubletten beobachtet werden, die im gleichen Verhältnis von 3:1 gewichtet sind. ⓘ
Herstellung
Der größte Teil des industriell hergestellten Chlorwasserstoffs wird für die Herstellung von Salzsäure verwendet. ⓘ
Historische Wege
Im 17. Jahrhundert verwendete Johann Rudolf Glauber aus Karlstadt am Main, Deutschland, Natriumchloridsalz und Schwefelsäure zur Herstellung von Natriumsulfat nach dem Mannheimer Verfahren, wobei Chlorwasserstoff freigesetzt wurde. Joseph Priestley aus Leeds, England, stellte 1772 reinen Chlorwasserstoff her, und 1808 wies Humphry Davy aus Penzance, England, nach, dass die chemische Zusammensetzung Wasserstoff und Chlor enthält. ⓘ
Direkte Synthese
Chlorwasserstoff wird durch die Verbindung von Chlor und Wasserstoff hergestellt:
- Cl2 + H2 → 2 HCl
Da es sich um eine exotherme Reaktion handelt, wird die Anlage als HCl-Ofen oder HCl-Brenner bezeichnet. Das entstehende Chlorwasserstoffgas wird in deionisiertem Wasser absorbiert, wodurch chemisch reine Salzsäure entsteht. Diese Reaktion kann ein sehr reines Produkt ergeben, z. B. für die Verwendung in der Lebensmittelindustrie. ⓘ
Die Reaktion kann auch durch blaues Licht ausgelöst werden. ⓘ
Organische Synthese
Die industrielle Produktion von Chlorwasserstoff ist häufig mit der Herstellung von chlorierten und fluorierten organischen Verbindungen verbunden, z. B. Teflon, Freon und anderen FCKW sowie Chloressigsäure und PVC. Häufig ist diese Produktion von Salzsäure mit dem Eigenverbrauch vor Ort verbunden. Bei den chemischen Reaktionen werden die Wasserstoffatome des Kohlenwasserstoffs durch Chloratome ersetzt, woraufhin sich das freigesetzte Wasserstoffatom mit dem Ersatzatom des Chlormoleküls verbindet und Chlorwasserstoff bildet. Die Fluorierung ist eine anschließende Chlor-Ersatzreaktion, bei der wiederum Chlorwasserstoff entsteht:
- RH + Cl2 → RCl + HCl
- RCl + HF → RF + HCl
Der entstehende Chlorwasserstoff wird entweder direkt wiederverwendet oder in Wasser absorbiert, wobei Salzsäure in technischer oder industrieller Qualität entsteht. ⓘ
Methoden im Labor
Kleine Mengen von Chlorwasserstoff für den Laborgebrauch können in einem HCl-Generator durch Dehydratisierung von Salzsäure mit Schwefelsäure oder wasserfreiem Calciumchlorid erzeugt werden. Alternativ kann HCl auch durch die Reaktion von Schwefelsäure mit Natriumchlorid erzeugt werden:
- NaCl + H2SO4 → NaHSO4 + HCl ⓘ
Diese Reaktion findet bei Raumtemperatur statt. Sofern NaCl im Generator verbleibt und dieser auf über 200 °C erhitzt wird, läuft die Reaktion weiter ab:
- NaCl + NaHSO4 → HCl + Na2SO4
Damit diese Generatoren funktionieren, müssen die Reagenzien trocken sein. ⓘ
Chlorwasserstoff kann auch durch die Hydrolyse bestimmter reaktiver Chloridverbindungen wie Phosphorchloride, Thionylchlorid (SOCl2) und Acylchloride hergestellt werden. Zum Beispiel kann kaltes Wasser allmählich auf Phosphorpentachlorid (PCl5) getropft werden, um HCl zu erhalten:
- PCl5 + H2O → POCl3 + 2 HCl ⓘ
Anwendungen
Der meiste Chlorwasserstoff wird für die Herstellung von Salzsäure verwendet. Er wird auch bei der Herstellung von Vinylchlorid und vielen Alkylchloriden verwendet. Trichlorsilan wird mit HCl hergestellt:
- Si + 3 HCl → HSiCl3 + H2 ⓘ
Geschichte
Um 900 experimentierten die Autoren der arabischen Schriften, die Dschabir ibn Hayyan (lateinisch: Geber) und dem persischen Arzt und Alchemisten Abu Bakr al-Razi (ca. 865-925, lateinisch: Rhazes) zugeschrieben werden, mit Salmiak (Ammoniumchlorid), das bei der Destillation zusammen mit Vitriol (hydratisierte Sulfate verschiedener Metalle) Chlorwasserstoff ergab. Es ist möglich, dass al-Razi bei einem seiner Experimente auf eine primitive Methode zur Herstellung von Salzsäure gestoßen ist. Es scheint jedoch, dass bei den meisten dieser frühen Experimente mit Chlorsalzen die gasförmigen Produkte verworfen wurden, und Chlorwasserstoff wurde möglicherweise viele Male hergestellt, bevor man entdeckte, dass er chemisch verwendet werden kann. ⓘ
Eine der ersten derartigen Verwendungen war die Synthese von Quecksilber(II)-chlorid (ätzender Sublimat), dessen Herstellung durch Erhitzen von Quecksilber entweder mit Alaun und Ammoniumchlorid oder mit Vitriol und Natriumchlorid erstmals in De aluminibus et salibus ("Über Alaun und Salze") beschrieben wurde, einem arabischen Text aus dem elften oder zwölften Jahrhundert, der fälschlicherweise Abu Bakr al-Razi zugeschrieben und von Gerard von Cremona (1144-1187) ins Lateinische übersetzt wurde. ⓘ
Eine weitere wichtige Entwicklung war die Entdeckung von Pseudo-Geber (in De inventione veritatis, "Über die Entdeckung der Wahrheit", nach ca. 1300), dass durch Zugabe von Ammoniumchlorid zu Salpetersäure ein starkes Lösungsmittel hergestellt werden kann, das in der Lage ist, Gold aufzulösen (d. h. Königswasser). ⓘ
Nach der Entdeckung des Verfahrens zur Herstellung unvermischter Salzsäure im späten 16. Jahrhundert erkannte man, dass diese neue Säure (damals als Salzgeist oder acidum salis bezeichnet) dampfförmigen Chlorwasserstoff freisetzte, der als saure Meeresluft bezeichnet wurde. Im 17. Jahrhundert verwendete Johann Rudolf Glauber Salz (Natriumchlorid) und Schwefelsäure zur Herstellung von Natriumsulfat, wobei Chlorwasserstoffgas freigesetzt wurde (siehe Herstellung, oben). Carl Wilhelm Scheele berichtete 1772 ebenfalls über diese Reaktion und wird manchmal für ihre Entdeckung verantwortlich gemacht. Joseph Priestley stellte Chlorwasserstoff 1772 her, und 1810 wies Humphry Davy nach, dass er aus Wasserstoff und Chlor besteht. ⓘ
Während der Industriellen Revolution stieg die Nachfrage nach alkalischen Stoffen wie Soda, und Nicolas Leblanc entwickelte ein neues industrielles Verfahren zur Herstellung von Soda. Beim Leblanc-Verfahren wurde Salz unter Verwendung von Schwefelsäure, Kalkstein und Kohle in Soda umgewandelt, wobei Chlorwasserstoff als Nebenprodukt entstand. Ursprünglich wurde dieses Gas in die Luft abgeleitet, aber das Alkaligesetz von 1863 verbot eine solche Freisetzung, so dass die Sodahersteller das HCl-Abgas in Wasser absorbierten und Salzsäure in industriellem Maßstab herstellten. Später wurde das Hargreaves-Verfahren entwickelt, das dem Leblanc-Verfahren ähnelt, mit dem Unterschied, dass Schwefeldioxid, Wasser und Luft anstelle von Schwefelsäure in einer insgesamt exothermen Reaktion verwendet werden. Zu Beginn des 20. Jahrhunderts wurde das Leblanc-Verfahren durch das Solvay-Verfahren ersetzt, bei dem kein HCl erzeugt wurde. Die Herstellung von Chlorwasserstoff wurde jedoch als ein Schritt in der Salzsäureproduktion fortgesetzt. ⓘ
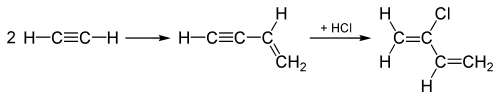
Zu den historischen Verwendungen von Chlorwasserstoff im 20. Jahrhundert gehören Hydrochlorierungen von Alkinen zur Herstellung der chlorierten Monomere Chloropren und Vinylchlorid, die anschließend zu Polychloropren (Neopren) bzw. Polyvinylchlorid (PVC) polymerisiert werden. Bei der Herstellung von Vinylchlorid wird Acetylen (C2H2) durch Zugabe von HCl an der Dreifachbindung des C2H2-Moleküls hydrochloriert, wodurch die Dreifachbindung in eine Doppelbindung umgewandelt wird und Vinylchlorid entsteht. ⓘ
Beim "Acetylen-Verfahren", das bis in die 1960er Jahre zur Herstellung von Chloropren verwendet wurde, werden zunächst zwei Acetylenmoleküle miteinander verbunden, und dann wird dem verbundenen Zwischenprodukt über die Dreifachbindung HCl zugesetzt, um es in Chloropren umzuwandeln, wie hier gezeigt:
Dieses "Acetylen-Verfahren" wurde durch ein Verfahren ersetzt, bei dem stattdessen Cl2 an die Doppelbindung des Ethylens angehängt wird, und bei der anschließenden Eliminierung entsteht stattdessen HCl sowie Chloropren. ⓘ
Sicherheit
Chlorwasserstoff bildet bei Kontakt mit Wasser, das sich im Körpergewebe befindet, ätzende Salzsäure. Das Einatmen der Dämpfe kann zu Husten, Erstickungsanfällen, Entzündungen der Nase, des Rachens und der oberen Atemwege und in schweren Fällen zu Lungenödemen, Kreislaufversagen und Tod führen. Hautkontakt kann zu Rötungen, Schmerzen und schweren chemischen Verbrennungen führen. Chlorwasserstoff kann schwere Verätzungen der Augen und dauerhafte Augenschäden verursachen. ⓘ
Die U.S. Occupational Safety and Health Administration (US-Arbeitsschutzbehörde) und das National Institute for Occupational Safety and Health (Nationales Institut für Arbeitssicherheit und Gesundheit) haben für Chlorwasserstoff einen Grenzwert von 5 ppm (7 mg/m3) für die Exposition am Arbeitsplatz festgelegt und umfangreiche Informationen über die Sicherheit von Chlorwasserstoff am Arbeitsplatz zusammengestellt. ⓘ
Eigenschaften
Die systematische Bezeichnung Wasserstoffchlorid bringt mit der Silbe -chlorid zum Ausdruck, dass das Chloratom in der Molekülverbindung eine negative Partialladung trägt, ähnlich wie nach Chloridionen, die eine negative Ionenladung besitzen. ⓘ
Chlorwasserstoff hat eine etwas höhere Dichte als Luft. In einem Liter Wasser lösen sich bei 0 °C unter Erwärmung 520 l, das entspricht 850 g HCl-Gas. Bei 20 °C lösen sich in einem Liter Wasser 442 Liter Chlorwasserstoff. An feuchter Luft bildet HCl-Gas Nebel aus feinen Salzsäure-Tröpfchen. Chlorwasserstoff löst sich in Alkoholen ähnlich gut wie in Wasser. Er ist in Ethern noch gut und in Kohlenwasserstoffen oder Chlorkohlenwasserstoffen nur gering löslich. ⓘ
| Löslichkeiten von Chlorwasserstoff in organischen Lösungsmitteln (gemessen bei 101,3 kPa) ⓘ | ||||||||||||
| Temperatur in °C | 0 | 10 | 15 | 20 | 25 | 27 | 30 | 40 | 50 | 102 | 177 | |
| Löslichkeit in g·kg−1 Lösungsmittel | ||||||||||||
| Methanol | 1092 | 877 | 688 | |||||||||
| Ethanol | 838 | 756 | 681 | 610 | ||||||||
| Tetrahydrofuran | 584 | |||||||||||
| 1,4-Dioxan | 433 | |||||||||||
| Diisopropylether | 349 | |||||||||||
| Dibutylether | 250 | |||||||||||
| n-Hexan | 7,1 | |||||||||||
| n-Hexadecan | 3,9 | 2,2 | 1,6 | |||||||||
| Benzol | 20 | 12,5 | ||||||||||
| Toluol | 21,3 | |||||||||||
| Chloroform | 8,5 | 6,9 | ||||||||||
| Tetrachlormethan | 6,0 | 3,9 | ||||||||||
Seine spezifische Wärmekapazität cp beträgt 799 J/(kg K). ⓘ
Verwendung
Neben der vielfältigen Verwendung als Säure findet reiner Chlorwasserstoff Verwendung als Chlorierungsmittel in der Oxychlorierung von Ethen zu Vinylchlorid. ⓘ
Sicherheitshinweise
Chlorwasserstoff ist ätzend und in hohen Konzentrationen giftig. Vergiftungen sind jedoch sehr selten. Beim Einatmen können Reizungen und Verätzungen der Schleimhäute und der Atemwege auftreten, die zu einer akuten Bronchitis oder Lungenentzündung führen können. Bei Kontakt mit Haut und Kleidung lässt sich die Säure mit Wasser gut und restlos auswaschen. ⓘ