Mutation
| Teil einer Serie über ⓘ |
| Genetik |
|---|
 |
|
| Teil einer Serie über ⓘ |
| Evolutionsbiologie |
|---|
 |
|
|


In der Biologie ist eine Mutation eine Veränderung in der Nukleinsäuresequenz des Genoms eines Organismus, eines Virus oder einer extrachromosomalen DNA. Virale Genome enthalten entweder DNA oder RNA. Mutationen entstehen durch Fehler während der DNA- oder Virusreplikation, Mitose oder Meiose oder durch andere Arten von DNA-Schäden (z. B. Pyrimidindimere, die durch ultraviolette Strahlung verursacht werden), die dann eine fehleranfällige Reparatur durchlaufen (insbesondere Mikrohomologie-vermittelte Endverbindung), einen Fehler bei anderen Formen der Reparatur oder einen Fehler bei der Replikation (Translesionssynthese) verursachen können. Mutationen können auch durch Insertion oder Deletion von DNA-Abschnitten aufgrund mobiler genetischer Elemente entstehen. ⓘ
Mutationen können zu nachweisbaren Veränderungen in den beobachtbaren Merkmalen (Phänotyp) eines Organismus führen, müssen es aber nicht. Mutationen spielen sowohl bei normalen als auch bei anormalen biologischen Prozessen eine Rolle, z. B. bei der Evolution, bei Krebs und bei der Entwicklung des Immunsystems, einschließlich der Vielfalt der Verbindungen. Die Mutation ist die eigentliche Quelle aller genetischen Variationen und liefert das Rohmaterial, auf das evolutionäre Kräfte wie die natürliche Selektion einwirken können. ⓘ
Mutationen können zu vielen verschiedenen Arten von Veränderungen in Sequenzen führen. Mutationen in Genen können keine Wirkung haben, das Produkt eines Gens verändern oder verhindern, dass das Gen richtig oder vollständig funktioniert. Mutationen können auch in nicht-genetischen Regionen auftreten. Eine Studie aus dem Jahr 2007 über genetische Variationen zwischen verschiedenen Drosophila-Arten ergab, dass eine Mutation, die ein von einem Gen produziertes Protein verändert, wahrscheinlich schädlich ist, wobei schätzungsweise 70 % der Aminosäure-Polymorphismen schädliche Auswirkungen haben und der Rest entweder neutral oder geringfügig vorteilhaft ist. Aufgrund der schädlichen Auswirkungen, die Mutationen auf Gene haben können, verfügen Organismen über Mechanismen wie die DNA-Reparatur, um Mutationen zu verhindern oder zu korrigieren, indem die mutierte Sequenz wieder in ihren ursprünglichen Zustand zurückversetzt wird. ⓘ
Als Mutation (lat. mutare „ändern/verändern, verwandeln“) wird in der Biologie eine spontan auftretende, dauerhafte Veränderung des Erbgutes bezeichnet. Die Veränderung betrifft zunächst das Erbgut nur einer Zelle, wird aber an deren Tochterzellen weitergegeben. Bei mehrzelligen Tieren unterscheidet man Keimbahn-Mutationen, die durch Vererbung an die Nachkommen weitergegeben werden können, von Mutationen in somatischen Zellen, die nicht in den Keimzellen (Gameten), sondern nur in den übrigen Geweben des Körpers vorliegen. Ein Organismus mit einem neuen, durch Mutation entstandenen Merkmal wird als Mutant oder Mutante bezeichnet. ⓘ
Eine Mutation kann Auswirkungen auf die Merkmale eines Organismus haben oder auch nicht (stille Mutation). Abweichende Merkmalsausprägungen können negative, positive oder auch gar keine Folgen hinsichtlich der Lebensfähigkeit und/oder des Fortpflanzungsvermögens haben. Prägt sich eine Mutation als deutlich unterschiedener Phänotyp aus, der in einer Population zu einem gewissen Anteil (über 1 %) stabil erhalten bleibt, spricht man in der Biologie auch von Polymorphismus. Polymorphismus ist eine wesentliche Voraussetzung für die Entstehung neuer Arten (Biodiversität). ⓘ
Manchmal wird das unerwartete phänotypische Auftreten sehr seltener rezessiver Erbanlagen, die von unauffälligen mischerbigen (heterozygoten) Vorfahren (als Konduktoren) an den gemeinsamen Nachkommen vererbt wurden, fälschlich für eine Mutation gehalten. ⓘ
Echte Mutationen können spontan (stochastisch) auftreten oder durch äußere Einflüsse verursacht werden, wie beispielsweise mutagene Strahlung (z. B.:UV-Strahlung, ionisierende Strahlung) oder erbgutverändernde Chemikalien (Mutagene). ⓘ
In der klassischen Zytogenetik werden Mutationen nach ihrem Umfang eingeteilt: Genommutationen sind Veränderungen der Anzahl der Chromosomen, Chromosomenmutationen sind Veränderungen der Chromosomenstruktur, die bei Chromosomenpräparaten lichtmikroskopisch erkennbar sind. Genmutationen sind dagegen an solchen Präparaten mikroskopisch nicht erkennbar und können nur durch DNA-Analyse festgestellt werden. Eine Genmutation kann darin bestehen, dass neue Nukleotidsequenzen entstehen oder dass zuvor vorhandene Erbinformation verloren geht oder beides. ⓘ
Mutationen in Genen, deren Genprodukte für die Aufrechterhaltung einer intakten DNA erforderlich sind, zum Beispiel Tumorsuppressorgene, können weitere Mutationen nach sich ziehen (Mutatorphänotyp). ⓘ
Der Begriff der Mutation wurde von dem Botaniker Hugo de Vries 1901 geprägt. ⓘ
Überblick
Mutationen können die Verdoppelung großer DNA-Abschnitte zur Folge haben, in der Regel durch genetische Rekombination. Diese Verdopplungen sind eine wichtige Quelle für das Rohmaterial zur Entwicklung neuer Gene, wobei alle Millionen Jahre Dutzende bis Hunderte von Genen in Tiergenomen verdoppelt werden. Die meisten Gene gehören zu größeren Genfamilien mit gemeinsamer Abstammung, die sich an ihrer Sequenzhomologie erkennen lassen. Neue Gene entstehen durch verschiedene Methoden, in der Regel durch die Duplikation und Mutation eines Vorgängergens oder durch die Rekombination von Teilen verschiedener Gene, um neue Kombinationen mit neuen Funktionen zu bilden. ⓘ
Hier fungieren Proteindomänen als Module, die jeweils eine bestimmte und unabhängige Funktion haben und die miteinander kombiniert werden können, um Gene zu erzeugen, die für neue Proteine mit neuartigen Eigenschaften kodieren. Das menschliche Auge beispielsweise verwendet vier Gene, um Strukturen zu bilden, die Licht wahrnehmen: drei für die Zapfenzelle oder das Farbensehen und eines für die Stäbchenzelle oder das Nachtsehen; alle vier sind aus einem einzigen Vorläufergen hervorgegangen. Ein weiterer Vorteil der Duplizierung eines Gens (oder sogar eines ganzen Genoms) besteht darin, dass dadurch die technische Redundanz erhöht wird; so kann ein Gen des Paares eine neue Funktion übernehmen, während die andere Kopie die ursprüngliche Funktion ausführt. Andere Arten der Mutation schaffen gelegentlich neue Gene aus zuvor nicht kodierender DNA. ⓘ
Bei Veränderungen der Chromosomenzahl können sogar noch größere Mutationen auftreten, bei denen Abschnitte der DNA innerhalb der Chromosomen brechen und sich dann neu anordnen. Bei den Homininae fusionierten beispielsweise zwei Chromosomen zum menschlichen Chromosom 2; diese Fusion fand bei den anderen Menschenaffen nicht statt, und sie behalten diese separaten Chromosomen bei. In der Evolution könnte die wichtigste Rolle solcher Chromosomenumlagerungen darin bestehen, die Divergenz einer Population zu neuen Arten zu beschleunigen, indem sie die Wahrscheinlichkeit der Kreuzung von Populationen verringern und so die genetischen Unterschiede zwischen diesen Populationen bewahren. ⓘ
DNA-Sequenzen, die sich im Genom bewegen können, wie z. B. Transposons, machen einen großen Teil des genetischen Materials von Pflanzen und Tieren aus und könnten bei der Evolution der Genome eine wichtige Rolle gespielt haben. So sind beispielsweise mehr als eine Million Kopien der Alu-Sequenz im menschlichen Genom vorhanden, und diese Sequenzen wurden nun rekrutiert, um Funktionen wie die Regulierung der Genexpression zu übernehmen. Eine weitere Auswirkung dieser mobilen DNA-Sequenzen ist, dass sie, wenn sie sich innerhalb eines Genoms bewegen, bestehende Gene mutieren oder löschen können und dadurch genetische Vielfalt erzeugen. ⓘ
Nicht-tödliche Mutationen sammeln sich im Genpool an und erhöhen die genetische Vielfalt. Die Häufigkeit einiger genetischer Veränderungen innerhalb des Genpools kann durch natürliche Selektion reduziert werden, während sich andere "günstigere" Mutationen ansammeln und zu adaptiven Veränderungen führen können. ⓘ

So kann beispielsweise ein Schmetterling Nachkommen mit neuen Mutationen hervorbringen. Die meisten dieser Mutationen werden keine Auswirkungen haben, aber eine davon könnte die Farbe eines Nachkommens des Schmetterlings verändern, so dass er für Fressfeinde schwerer (oder leichter) zu erkennen ist. Wenn diese Farbveränderung vorteilhaft ist, sind die Chancen dieses Schmetterlings, zu überleben und eigene Nachkommen zu produzieren, etwas besser, und im Laufe der Zeit kann die Anzahl der Schmetterlinge mit dieser Mutation einen größeren Prozentsatz der Population ausmachen. ⓘ
Neutrale Mutationen sind definiert als Mutationen, deren Auswirkungen keinen Einfluss auf die Fitness eines Individuums haben. Ihre Häufigkeit kann im Laufe der Zeit durch die genetische Drift zunehmen. Es wird davon ausgegangen, dass die überwiegende Mehrheit der Mutationen keine signifikanten Auswirkungen auf die Fitness eines Organismus hat. Außerdem sind DNA-Reparaturmechanismen in der Lage, die meisten Veränderungen auszubessern, bevor sie zu dauerhaften Mutationen werden, und viele Organismen verfügen über Mechanismen zur Eliminierung ansonsten dauerhaft mutierter Körperzellen. ⓘ
Nützliche Mutationen können den Fortpflanzungserfolg verbessern. ⓘ
Ursachen
Beim Menschen hat man die Zahl von Neumutationen (De-novo-Mutationen) durch Sequenzierung der DNA von Vater, Mutter und dem entsprechenden Kind bestimmt. Im Durchschnitt fand man 45 Neumutationen, wobei etwa 80 % der Mutationen aus den Spermien des Vaters stammen. Da die Spermienbildung (Spermatogenese) beim Mann kontinuierlich verläuft und somit die Zahl der Replikationen der DNA mit dem Alter zunimmt, ist es nicht erstaunlich, dass die Zahl der Neumutationen mit dem Alter des Vaters ansteigt. Ein junger Vater von 20 Jahren trägt 20 Mutationen bei, während ein älterer Vater von 40 Jahren 40 Mutationen beisteuert. Obwohl die Eizellen der Frau schon alle in der Embryonalentwicklung vor der Geburt ausgebildet sind und somit keine weitere Replikation der DNA stattfindet, konnte bei Frauen von 40 Jahren im Vergleich zu 20-jährigen Frauen ein Anstieg der Neumutationen von 7 auf 12 beobachtet werden. Offensichtlich treten die Neumutationen nicht nur bei der Replikation der DNA auf. ⓘ
Die große Häufigkeit an Mutationen wurde in einer Sequenzanalyse der proteincodierenden DNA des Menschen bei 60.706 Personen aufgezeigt. Die Studie deckte 7,4 Millionen Varianten auf, was im Schnitt einer Mutation an jedem 8. Basenpaar der DNA des Menschen entspricht. ⓘ
Es gibt vier Arten von Mutationen: (1) Spontanmutationen (molekularer Zerfall), (2) Mutationen durch fehleranfällige Replikation unter Umgehung natürlich auftretender DNA-Schäden (auch fehleranfällige Translesionssynthese genannt), (3) bei der DNA-Reparatur eingeführte Fehler und (4) durch Mutagene induzierte Mutationen. Wissenschaftler können auch absichtlich mutierte Sequenzen durch DNA-Manipulationen einführen, um wissenschaftliche Experimente zu ermöglichen. ⓘ
Eine Studie aus dem Jahr 2017 besagt, dass 66 % der krebsverursachenden Mutationen zufällig sind, 29 % durch die Umwelt verursacht werden (die untersuchte Bevölkerung umfasste 69 Länder) und 5 % vererbt werden. ⓘ
Spontane Mutation
Spontanmutationen treten mit einer Wahrscheinlichkeit ungleich Null auf, selbst wenn es sich um eine gesunde, nicht kontaminierte Zelle handelt. Man schätzt, dass natürlich auftretende oxidative DNA-Schäden beim Menschen 10 000 Mal pro Zelle und bei Ratten 100 000 Mal pro Zelle und Tag auftreten. Spontane Mutationen können durch die spezifische Veränderung charakterisiert werden:
- Tautomerie - Eine Base wird durch die Neupositionierung eines Wasserstoffatoms verändert, wodurch sich das Wasserstoffbrückenbindungsmuster dieser Base ändert, was zu einer falschen Basenpaarung während der Replikation führt. Theoretische Ergebnisse deuten darauf hin, dass Protonentunnelung ein wichtiger Faktor bei der spontanen Bildung von GC-Tautomeren ist.
- Depurinierung - Verlust einer Purinbase (A oder G) zur Bildung einer apurinischen Stelle (AP-Stelle).
- Deaminierung - Durch Hydrolyse wird eine normale Base in eine atypische Base umgewandelt, die eine Ketogruppe anstelle der ursprünglichen Aminogruppe enthält. Beispiele hierfür sind C → U und A → HX (Hypoxanthin), die durch DNA-Reparaturmechanismen korrigiert werden können, und 5MeC (5-Methylcytosin) → T, was weniger wahrscheinlich als Mutation erkannt wird, da Thymin eine normale DNA-Base ist.
- Slipperstrang-Fehlpaarung - Denaturierung des neuen Strangs von der Vorlage während der Replikation, gefolgt von einer Renaturierung an einer anderen Stelle ("Slippen"). Dies kann zu Insertionen oder Deletionen führen. ⓘ
Fehleranfälliger Replikations-Bypass
Es gibt immer mehr Hinweise darauf, dass die Mehrzahl der spontan auftretenden Mutationen auf eine fehlerhafte Replikation (Translesionssynthese) an einer DNA-Schädigung des Templat-Strangs vorbei zurückzuführen ist. Bei Mäusen wird die Mehrzahl der Mutationen durch Translesionssynthese verursacht. Auch bei Hefe fanden Kunz et al. heraus, dass mehr als 60 % der spontanen Substitutionen und Deletionen einzelner Basenpaare durch Translesionssynthese verursacht werden. ⓘ
Bei der DNA-Reparatur eingeführte Fehler
Obwohl natürlich auftretende Doppelstrangbrüche in der DNA relativ selten vorkommen, führt ihre Reparatur häufig zu Mutationen. Die nicht-homologe Endverbindung (NHEJ) ist ein wichtiger Weg zur Reparatur von Doppelstrangbrüchen. Bei NHEJ werden einige Nukleotide entfernt, um eine etwas ungenaue Ausrichtung der beiden Enden für die Wiedervereinigung zu ermöglichen, gefolgt von der Hinzufügung von Nukleotiden, um die Lücken zu schließen. Infolgedessen führt NHEJ häufig Mutationen ein. ⓘ

Induzierte Mutation
Induzierte Mutationen sind Veränderungen im Gen, nachdem es mit Mutagenen und Umweltfaktoren in Kontakt gekommen ist. ⓘ
Induzierte Mutationen auf molekularer Ebene können verursacht werden durch:
- Chemikalien
- Hydroxylamin
- Basenanaloga (z. B. Bromdesoxyuridin (BrdU))
- Alkylierungsmittel (z. B. N-Ethyl-N-Nitrosoharnstoff (ENU)). Diese Mittel können sowohl replizierende als auch nicht-replizierende DNA mutieren. Im Gegensatz dazu kann ein Basenanalogon die DNA nur mutieren, wenn das Analogon in die replizierende DNA eingebaut wird. Jede dieser Klassen chemischer Mutagene hat bestimmte Wirkungen, die dann zu Transitionen, Transversionen oder Deletionen führen.
- Agenzien, die DNA-Addukte bilden (z. B. Ochratoxin A)
- DNA-Interkalationsmittel (z. B. Ethidiumbromid)
- DNA-Quervernetzer
- Oxidative Schäden
- Salpetrige Säure wandelt die Amingruppen von A und C in Diazogruppen um, wodurch sich ihre Wasserstoffbrückenbindungen verändern, was zu einer falschen Basenpaarung während der Replikation führt.
- Strahlung
- Ultraviolettes Licht (UV) (einschließlich nichtionisierender Strahlung). Zwei Nukleotidbasen in der DNA - Cytosin und Thymin - sind besonders anfällig für Strahlung, die ihre Eigenschaften verändern kann. UV-Licht kann benachbarte Pyrimidinbasen in einem DNA-Strang dazu bringen, sich kovalent zu einem Pyrimidin-Dimer zu verbinden. UV-Strahlung, insbesondere die längerwellige UVA-Strahlung, kann auch oxidative Schäden an der DNA verursachen.
- Ionisierende Strahlung. Die Exposition gegenüber ionisierender Strahlung, wie z. B. Gammastrahlung, kann zu Mutationen führen, die möglicherweise Krebs oder den Tod zur Folge haben. ⓘ
Während man früher davon ausging, dass Mutationen zufällig auftreten oder durch Mutagene ausgelöst werden, wurden molekulare Mechanismen der Mutation in Bakterien und im gesamten Stammbaum des Lebens entdeckt. S. Rosenberg erklärt: "Diese Mechanismen offenbaren ein Bild hochgradig regulierter Mutagenese, die zeitlich durch Stressreaktionen hochreguliert und aktiviert wird, wenn Zellen/Organismen an ihre Umgebung schlecht angepasst sind - wenn sie gestresst sind -, was die Anpassung möglicherweise beschleunigt." Da es sich um selbstinduzierte Mutagenesemechanismen handelt, die die Anpassungsrate von Organismen erhöhen, werden sie manchmal auch als adaptive Mutagenesemechanismen bezeichnet und umfassen die SOS-Reaktion in Bakterien, ektopische intrachromosomale Rekombination und andere chromosomale Ereignisse wie Duplikationen. ⓘ
Klassifizierung der Typen
Nach Auswirkung auf die Struktur


Die Sequenz eines Gens kann auf verschiedene Weise verändert werden. Genmutationen haben unterschiedliche Auswirkungen auf die Gesundheit, je nachdem, wo sie auftreten und ob sie die Funktion wesentlicher Proteine verändern. Mutationen in der Genstruktur lassen sich in verschiedene Typen einteilen. ⓘ
Großflächige Mutationen
Zu den großflächigen Mutationen in der Chromosomenstruktur gehören:
- Amplifikationen (oder Genduplikationen) oder die Wiederholung eines Chromosomenabschnitts oder das Vorhandensein eines zusätzlichen Chromosomenstücks. Ein gebrochenes Chromosomenstück kann an ein homologes oder nicht-homologes Chromosom angehängt werden, so dass einige der Gene in mehr als zwei Dosen vorhanden sind, was zu Mehrfachkopien aller Chromosomenregionen führt und die Dosis der darin befindlichen Gene erhöht.
- Polyploidie, Verdoppelung ganzer Chromosomensätze, was zu einer getrennten Zuchtpopulation und zur Speziation führen kann.
- Deletionen von großen Chromosomenregionen, die zum Verlust der Gene in diesen Regionen führen.
- Mutationen, die dazu führen, dass zuvor getrennte DNA-Stücke nebeneinander liegen und möglicherweise getrennte Gene zu funktionell unterschiedlichen Fusionsgenen zusammengeführt werden (z. B. bcr-abl).
- Großflächige Veränderungen der Chromosomenstruktur, so genannte chromosomale Umlagerungen, die zu einer Verringerung der Fitness, aber auch zur Artbildung in isolierten Inzuchtpopulationen führen können. Dazu gehören:
- Chromosomentranslokationen: Austausch genetischer Teile von nichthomologen Chromosomen.
- Chromosomeninversionen: Umkehrung der Ausrichtung eines Chromosomensegments.
- Nicht-homologes chromosomales Crossover.
- Interstitielle Deletionen: eine intrachromosomale Deletion, bei der ein DNA-Segment von einem einzelnen Chromosom entfernt wird, wodurch zuvor weit voneinander entfernte Gene miteinander verbunden werden. So wurde beispielsweise bei Zellen, die aus einem menschlichen Astrozytom, einer Art Hirntumor, isoliert wurden, eine chromosomale Deletion festgestellt, bei der Sequenzen zwischen dem Fused in Glioblastoma (FIG)-Gen und der Rezeptor-Tyrosin-Kinase (ROS) entfernt wurden, wodurch ein Fusionsprotein (FIG-ROS) entstand. Das abnorme FIG-ROS-Fusionsprotein hat eine konstitutiv aktive Kinaseaktivität, die eine onkogene Transformation (eine Umwandlung von normalen Zellen in Krebszellen) verursacht.
- Verlust der Heterozygotie: Verlust eines Allels, entweder durch eine Deletion oder ein genetisches Rekombinationsereignis, in einem Organismus, der zuvor zwei verschiedene Allele besaß. ⓘ
Kleinräumige Mutationen
Kleine Mutationen betreffen ein Gen an einem oder wenigen Nukleotiden. (Wenn nur ein einziges Nukleotid betroffen ist, spricht man von Punktmutationen):
- Insertionen fügen ein oder mehrere zusätzliche Nukleotide in die DNA ein. Sie werden in der Regel durch transponierbare Elemente oder Fehler bei der Replikation von sich wiederholenden Elementen verursacht. Insertionen in der kodierenden Region eines Gens können das Spleißen der mRNA verändern (Spleißstellenmutation) oder eine Verschiebung des Leserasters verursachen (Frameshift), die beide das Genprodukt erheblich verändern können. Insertionen können durch Exzision des transponierbaren Elements rückgängig gemacht werden.
- Bei Deletionen werden ein oder mehrere Nukleotide aus der DNA entfernt. Wie Insertionen können auch diese Mutationen das Leseraster des Gens verändern. Im Allgemeinen sind sie irreversibel: Zwar könnte theoretisch genau dieselbe Sequenz durch eine Insertion wiederhergestellt werden, doch sind transponierbare Elemente, die in der Lage sind, eine sehr kurze Deletion (z. B. 1-2 Basen) an einer beliebigen Stelle rückgängig zu machen, entweder sehr unwahrscheinlich oder existieren überhaupt nicht.
- Substitutionsmutationen, die oft durch Chemikalien oder Fehlfunktionen der DNA-Replikation verursacht werden, tauschen ein einzelnes Nukleotid gegen ein anderes aus. Diese Veränderungen werden als Transitionen oder Transversionen bezeichnet. Am häufigsten ist der Übergang, bei dem ein Purin gegen ein Purin (A ↔ G) oder ein Pyrimidin gegen ein Pyrimidin (C ↔ T) ausgetauscht wird. Ein Übergang kann durch salpetrige Säure, Basenfehlpaarungen oder mutagene Basenanaloga wie BrdU verursacht werden. Weniger häufig ist eine Transversion, bei der ein Purin gegen ein Pyrimidin oder ein Pyrimidin gegen ein Purin ausgetauscht wird (C/T ↔ A/G). Ein Beispiel für eine Transversion ist die Umwandlung von Adenin (A) in ein Cytosin (C). Punktmutationen sind Veränderungen von einzelnen Basenpaaren der DNA oder anderen kleinen Basenpaaren innerhalb eines Gens. Eine Punktmutation kann durch eine andere Punktmutation rückgängig gemacht werden, bei der das Nukleotid in seinen ursprünglichen Zustand zurückverwandelt wird (echte Reversion), oder durch eine Reversion an einer zweiten Stelle (eine komplementäre Mutation an anderer Stelle, die zur Wiederherstellung der Genfunktion führt). Wie weiter unten erläutert, können Punktmutationen, die in der proteinkodierenden Region eines Gens auftreten, als synonyme oder nicht-synonyme Substitutionen klassifiziert werden, wobei letztere wiederum in Missense- oder Nonsense-Mutationen unterteilt werden können. ⓘ
Nach Auswirkungen auf die Proteinsequenz

Wie sich eine Mutation auf die Proteinsequenz auswirkt, hängt zum Teil davon ab, wo im Genom sie auftritt, insbesondere davon, ob sie in einer kodierenden oder nicht kodierenden Region liegt. Mutationen in den nicht-kodierenden regulatorischen Sequenzen eines Gens, wie Promotoren, Enhancern und Silencern, können das Niveau der Genexpression verändern, sind aber weniger wahrscheinlich, um die Proteinsequenz zu verändern. Mutationen innerhalb von Introns und in Regionen ohne bekannte biologische Funktion (z. B. Pseudogene, Retrotransposons) sind im Allgemeinen neutral und haben keine Auswirkungen auf den Phänotyp - obwohl Intron-Mutationen das Proteinprodukt verändern könnten, wenn sie das mRNA-Spleißen beeinträchtigen. ⓘ
Mutationen, die in kodierenden Regionen des Genoms auftreten, verändern mit größerer Wahrscheinlichkeit das Proteinprodukt und können nach ihren Auswirkungen auf die Aminosäuresequenz kategorisiert werden:
- Eine Frameshift-Mutation wird durch die Insertion oder Deletion einer Anzahl von Nukleotiden, die nicht gleichmäßig durch drei teilbar ist, in einer DNA-Sequenz verursacht. Aufgrund der Triplett-Natur der Genexpression durch Codons kann die Insertion oder Deletion das Leseraster oder die Gruppierung der Codons stören, was zu einer völlig anderen Übersetzung als im Original führt. Je früher in der Sequenz die Deletion oder Insertion auftritt, desto stärker ist das produzierte Protein verändert. (Zum Beispiel kodiert der Code CCU GAC UAC CUA für die Aminosäuren Prolin, Asparaginsäure, Tyrosin und Leucin. Würde das U in CCU gestrichen, ergäbe sich die Sequenz CCG ACU ACC UAx, die stattdessen für Prolin, Threonin, Threonin und einen Teil einer anderen Aminosäure oder vielleicht ein Stoppcodon kodiert (wobei das x für das folgende Nukleotid steht). Im Gegensatz dazu wird jede Insertion oder Deletion, die gleichmäßig durch drei teilbar ist, als In-Frame-Mutation bezeichnet.
- Eine Punktsubstitutionsmutation führt zu einer Veränderung in einem einzigen Nukleotid und kann entweder synonym oder nicht-synonym sein.
- Bei einer synonymen Substitution wird ein Codon durch ein anderes Codon ersetzt, das für dieselbe Aminosäure kodiert, so dass die entstehende Aminosäuresequenz nicht verändert wird. Synonyme Mutationen treten aufgrund der degenerierten Natur des genetischen Codes auf. Wenn diese Mutation keine phänotypischen Auswirkungen hat, wird sie als stumm bezeichnet, aber nicht alle synonymen Substitutionen sind stumm. (Es kann auch stille Mutationen in Nukleotiden außerhalb der kodierenden Regionen geben, z. B. in den Introns, weil die genaue Nukleotidsequenz nicht so entscheidend ist wie in den kodierenden Regionen, aber diese werden nicht als synonyme Substitutionen betrachtet).
- Bei einer nicht-synonymen Substitution wird ein Codon durch ein anderes Codon ersetzt, das für eine andere Aminosäure kodiert, so dass die entstehende Aminosäuresequenz verändert wird. Nicht-synonyme Substitutionen können als Nonsense- oder Missense-Mutationen klassifiziert werden:
- Bei einer Missense-Mutation wird ein Nukleotid so verändert, dass eine andere Aminosäure substituiert wird. Dies wiederum kann dazu führen, dass das resultierende Protein nicht mehr funktionsfähig ist. Solche Mutationen sind für Krankheiten wie Epidermolysis bullosa, Sichelzellkrankheit und SOD1-vermittelte ALS verantwortlich. Tritt dagegen eine Missense-Mutation in einem Aminosäurecodon auf, die zur Verwendung einer anderen, aber chemisch ähnlichen Aminosäure führt, so ändert sich das Protein manchmal kaum oder gar nicht. So wird beispielsweise bei einer Änderung von AAA zu AGA Arginin kodiert, ein chemisch ähnliches Molekül wie das beabsichtigte Lysin. In diesem Fall hat die Mutation nur geringe oder gar keine Auswirkungen auf den Phänotyp und ist daher neutral.
- Eine Nonsense-Mutation ist eine Punktmutation in einer DNA-Sequenz, die zu einem vorzeitigen Stoppcodon oder einem Nonsense-Codon in der transkribierten mRNA und möglicherweise zu einem verkürzten und oft nicht funktionsfähigen Proteinprodukt führt. Diese Art von Mutation wurde mit verschiedenen Krankheiten in Verbindung gebracht, wie z. B. der kongenitalen Nebennierenhyperplasie. (Siehe Stopcodon.) ⓘ
Nach Auswirkung auf die Funktion
- Funktionsverlustmutationen, auch inaktivierende Mutationen genannt, führen dazu, dass das Genprodukt weniger oder keine Funktion hat (teilweise oder ganz inaktiviert ist). Wenn das Allel einen vollständigen Funktionsverlust aufweist (Null-Allel), wird es oft als amorphe oder amorphe Mutation im Mullerschen Morphschema bezeichnet. Die mit solchen Mutationen verbundenen Phänotypen sind meist rezessiv. Ausnahmen sind, wenn der Organismus haploid ist oder wenn die reduzierte Dosis eines normalen Genprodukts nicht für einen normalen Phänotyp ausreicht (dies wird als Haploinsuffizienz bezeichnet).
- Gain-of-function-Mutationen, auch aktivierende Mutationen genannt, verändern das Genprodukt so, dass seine Wirkung stärker wird (verstärkte Aktivierung) oder sogar durch eine andere, abnorme Funktion ersetzt wird. Wenn das neue Allel geschaffen wird, wird ein Heterozygote, der sowohl das neu geschaffene Allel als auch das ursprüngliche Allel enthält, das neue Allel exprimieren; genetisch gesehen werden die Mutationen dadurch als dominante Phänotypen definiert. Mehrere von Mullers Morphen entsprechen einem Funktionsgewinn, darunter Hypermorph (erhöhte Genexpression) und Neomorph (neue Funktion). Im Dezember 2017 hob die US-Regierung ein vorübergehendes Verbot aus dem Jahr 2014 auf, das die Finanzierung von Experimenten zur Funktionssteigerung von Krankheitserregern wie der Vogelgrippe, SARS und dem Middle East Respiratory Syndrome (MERS) untersagte.
- Dominant negative Mutationen (auch antimorphe Mutationen genannt) haben ein verändertes Genprodukt, das sich antagonistisch zum Wildtyp-Allel verhält. Diese Mutationen führen in der Regel zu einer veränderten molekularen Funktion (oft inaktiv) und sind durch einen dominanten oder halbdominanten Phänotyp gekennzeichnet. Beim Menschen wurden dominant-negative Mutationen mit Krebs in Verbindung gebracht (z. B. Mutationen in den Genen p53, ATM, CEBPA und PPARgamma). Das Marfan-Syndrom wird durch Mutationen im FBN1-Gen auf Chromosom 15 verursacht, das für Fibrillin-1 kodiert, ein Glykoprotein, das Bestandteil der extrazellulären Matrix ist. Das Marfan-Syndrom ist auch ein Beispiel für eine dominant negative Mutation und Haploinsuffizienz.
- Hypomorphe Mutationen sind nach der Mullerschen Klassifikation durch veränderte Genprodukte gekennzeichnet, die im Vergleich zum Wildtyp-Allel mit einer verminderten Genexpression einhergehen. In der Regel sind hypomorphe Mutationen rezessiv, aber bei Haploinsuffizienz sind einige Allele dominant.
- Neomorphe Mutationen sind durch die Kontrolle der Synthese neuer Proteinprodukte gekennzeichnet.
- Letale Mutationen sind Mutationen, die zum Tod der Organismen führen, die die Mutation tragen.
- Eine Rückmutation oder Reversion ist eine Punktmutation, die die ursprüngliche Sequenz und damit den ursprünglichen Phänotyp wiederherstellt. ⓘ
Nach Auswirkungen auf die Fitness (schädliche, nützliche, neutrale Mutationen)
In der Genetik ist es manchmal sinnvoll, Mutationen entweder als schädlich oder als nützlich (oder neutral) zu klassifizieren:
- Eine schädliche oder nachteilige Mutation verringert die Fitness des Organismus. Viele, aber nicht alle Mutationen in essenziellen Genen sind schädlich (wenn eine Mutation die Aminosäuresequenz in einem essenziellen Protein nicht verändert, ist sie in den meisten Fällen harmlos).
- Eine nützliche oder vorteilhafte Mutation erhöht die Fitness des Organismus. Beispiele hierfür sind Mutationen, die zu einer Antibiotikaresistenz bei Bakterien führen (die für Bakterien von Vorteil sind, aber normalerweise nicht für den Menschen).
- Eine neutrale Mutation hat weder schädliche noch nützliche Auswirkungen auf den Organismus. Solche Mutationen treten mit einer gleichmäßigen Rate auf und bilden die Grundlage für die molekulare Uhr. In der neutralen Theorie der molekularen Evolution bilden neutrale Mutationen die Grundlage für die meisten Variationen auf molekularer Ebene, die genetische Drift. Bei Tieren und Pflanzen sind die meisten Mutationen neutral, da der überwiegende Teil ihrer Genome entweder nicht kodierend ist oder aus sich wiederholenden Sequenzen besteht, die keine offensichtliche Funktion haben ("Junk-DNA").
Bei groß angelegten quantitativen Mutagenese-Screens, bei denen Tausende oder Millionen von Mutationen getestet werden, stellt man immer fest, dass ein größerer Teil der Mutationen schädliche Auswirkungen hat, aber auch immer eine Reihe von nützlichen Mutationen aufweist. Bei einem Screening aller Gendeletionen in E. coli waren beispielsweise 80 % der Mutationen negativ, aber 20 % positiv, obwohl viele von ihnen nur sehr geringe Auswirkungen auf das Wachstum hatten (abhängig von den Bedingungen). Man beachte, dass bei Gendeletionen ganze Gene entfernt werden, so dass Punktmutationen fast immer eine viel geringere Wirkung haben. In einem ähnlichen Screening bei Streptococcus pneumoniae, diesmal jedoch mit Transposon-Insertionen, wurden 76 % der Insertionsmutanten als neutral eingestuft, 16 % hatten eine deutlich reduzierte Fitness, aber 6 % waren vorteilhaft. ⓘ
Diese Klassifizierung ist natürlich relativ und etwas künstlich: eine schädliche Mutation kann sich schnell in eine vorteilhafte Mutation verwandeln, wenn sich die Bedingungen ändern. Außerdem gibt es ein Gefälle zwischen schädlich/vorteilhaft und neutral, da viele Mutationen zwar geringe und meist vernachlässigbare Auswirkungen haben, aber unter bestimmten Bedingungen relevant werden. Außerdem werden viele Merkmale durch Hunderte von Genen (oder Loci) bestimmt, so dass jeder Locus nur eine geringe Wirkung hat. So wird beispielsweise die menschliche Körpergröße durch Hunderte von genetischen Varianten ("Mutationen") bestimmt, aber jede von ihnen hat nur einen sehr geringen Einfluss auf die Körpergröße, abgesehen von den Auswirkungen der Ernährung. Die Höhe (oder Größe) selbst kann mehr oder weniger vorteilhaft sein, wie die riesige Bandbreite an Größen in Tier- und Pflanzengruppen zeigt. ⓘ
Verteilung der Fitness-Effekte (DFE)
Mit Hilfe von Mutagenese-Experimenten und theoretischen Modellen, die auf molekulare Sequenzdaten angewandt werden, wurde versucht, die Verteilung von Fitness-Effekten (DFE) zu ermitteln. Die DFE, die zur Bestimmung der relativen Häufigkeit verschiedener Arten von Mutationen (d. h. stark schädlich, nahezu neutral oder vorteilhaft) verwendet wird, ist für viele evolutionäre Fragen von Bedeutung, z. B. für die Aufrechterhaltung der genetischen Variation, die Geschwindigkeit des genomischen Verfalls, die Aufrechterhaltung der sexuellen Fortpflanzung durch Auskreuzung im Gegensatz zur Inzucht und die Entwicklung von Geschlecht und genetischer Rekombination. Die DFE kann auch verfolgt werden, indem die Schiefe der Verteilung von Mutationen mit vermeintlich schwerwiegenden Auswirkungen im Vergleich zur Verteilung von Mutationen mit vermeintlich geringen oder fehlenden Auswirkungen untersucht wird. Zusammenfassend lässt sich sagen, dass die DFE eine wichtige Rolle bei der Vorhersage der evolutionären Dynamik spielt. Zur Untersuchung der DFE wurde eine Vielzahl von Ansätzen verwendet, darunter theoretische, experimentelle und analytische Methoden.
- Mutagenese-Experiment: Die direkte Methode zur Untersuchung der DFE besteht darin, Mutationen herbeizuführen und dann die Auswirkungen der Mutation auf die Fitness zu messen, was bereits bei Viren, Bakterien, Hefe und Drosophila durchgeführt wurde. Bei den meisten Studien zur DFE in Viren wurde beispielsweise die ortsgerichtete Mutagenese verwendet, um Punktmutationen zu erzeugen und die relative Fitness der einzelnen Mutanten zu messen. In Escherichia coli wurde in einer Studie die Transposon-Mutagenese verwendet, um die Fitness einer zufälligen Insertion eines Tn10-Derivats direkt zu messen. In Hefe wurde ein kombinierter Ansatz aus Mutagenese und Deep Sequencing entwickelt, um qualitativ hochwertige systematische Mutantenbibliotheken zu erzeugen und die Fitness im Hochdurchsatz zu messen. Da jedoch viele Mutationen zu geringe Auswirkungen haben, um erkannt zu werden, und Mutageneseexperimente nur Mutationen mit mäßig großen Auswirkungen erkennen können, kann die DNA-Sequenzanalyse wertvolle Informationen über diese Mutationen liefern. ⓘ
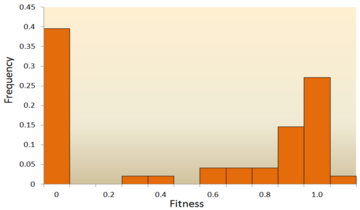
- Molekulare Sequenzanalyse: Mit der raschen Entwicklung der DNA-Sequenzierungstechnologie steht eine enorme Menge an DNA-Sequenzdaten zur Verfügung, und in Zukunft werden es noch mehr werden. Es wurden verschiedene Methoden entwickelt, um aus DNA-Sequenzdaten auf die DFE zu schließen. Durch die Untersuchung von DNA-Sequenzunterschieden innerhalb und zwischen Arten können wir auf verschiedene Merkmale der DFE für neutrale, schädliche und vorteilhafte Mutationen schließen. Genauer gesagt, ermöglicht uns der Ansatz der DNA-Sequenzanalyse, die Auswirkungen von Mutationen mit sehr geringen Auswirkungen abzuschätzen, die durch Mutageneseexperimente kaum nachweisbar sind. ⓘ
Eine der ersten theoretischen Studien über die Verteilung von Fitness-Effekten wurde von Motoo Kimura, einem einflussreichen theoretischen Populationsgenetiker, durchgeführt. Seine neutrale Theorie der molekularen Evolution geht davon aus, dass die meisten neuen Mutationen sehr schädlich sind, während ein kleiner Teil neutral ist. Ein späterer Vorschlag von Hiroshi Akashi sah ein bimodales Modell für die DFE vor, bei dem sich die Modi um hochgradig schädliche und neutrale Mutationen drehen. Beide Theorien stimmen darin überein, dass die überwiegende Mehrheit der neuen Mutationen neutral oder schädlich ist und dass vorteilhafte Mutationen selten sind, was durch experimentelle Ergebnisse bestätigt wird. Ein Beispiel dafür ist eine Studie über die DFE von Zufallsmutationen im Vesikulären Stomatitis-Virus. Von allen Mutationen waren 39,6 % tödlich, 31,2 % waren nicht tödlich schädlich und 27,1 % waren neutral. Ein weiteres Beispiel stammt aus einem Hochdurchsatz-Mutagenese-Experiment mit Hefe. In diesem Experiment wurde gezeigt, dass die Gesamt-DFE bimodal ist, mit einer Gruppe neutraler Mutationen und einer breiten Verteilung schädlicher Mutationen. ⓘ
Obwohl relativ wenige Mutationen vorteilhaft sind, spielen diejenigen, die es sind, eine wichtige Rolle bei evolutionären Veränderungen. Wie neutrale Mutationen können auch schwach selektierte vorteilhafte Mutationen durch zufällige genetische Drift verloren gehen, aber stark selektierte vorteilhafte Mutationen werden mit größerer Wahrscheinlichkeit fixiert. Die Kenntnis der DFE von vorteilhaften Mutationen kann zu einer besseren Vorhersage der evolutionären Dynamik führen. Theoretische Arbeiten über die DFE für vorteilhafte Mutationen wurden von John H. Gillespie und H. Allen Orr durchgeführt. Sie schlugen vor, dass die Verteilung für vorteilhafte Mutationen unter einer Vielzahl von Bedingungen exponentiell sein sollte, was im Allgemeinen durch experimentelle Studien bestätigt wurde, zumindest für stark selektierte vorteilhafte Mutationen. ⓘ
Im Allgemeinen wird davon ausgegangen, dass die meisten Mutationen neutral oder schädlich sind, während vorteilhafte Mutationen selten sind; der Anteil der verschiedenen Arten von Mutationen variiert jedoch zwischen den Arten. Dies weist auf zwei wichtige Punkte hin: Erstens variiert der Anteil der tatsächlich neutralen Mutationen wahrscheinlich zwischen den Arten, was auf die Abhängigkeit von der effektiven Populationsgröße zurückzuführen ist; zweitens variiert die durchschnittliche Wirkung der schädlichen Mutationen dramatisch zwischen den Arten. Darüber hinaus unterscheidet sich die DFE auch zwischen kodierenden und nicht kodierenden Regionen, wobei die DFE der nicht kodierenden DNA mehr schwach selektierte Mutationen enthält. ⓘ
Durch Vererbung

Bei mehrzelligen Organismen mit eigenen Fortpflanzungszellen lassen sich Mutationen unterteilen in Keimbahnmutationen, die über die Fortpflanzungszellen an die Nachkommen weitergegeben werden können, und somatische Mutationen (auch erworbene Mutationen genannt), die Zellen außerhalb der eigenen Fortpflanzungsgruppe betreffen und in der Regel nicht auf die Nachkommen übertragen werden. ⓘ
Diploide Organismen (z. B. der Mensch) enthalten zwei Kopien jedes Gens - ein väterliches und ein mütterliches Allel. Auf der Grundlage des Auftretens der Mutation auf jedem Chromosom können wir Mutationen in drei Typen einteilen. Ein Wildtyp oder homozygoter nicht mutierter Organismus ist ein Organismus, bei dem keines der Allele mutiert ist.
- Eine heterozygote Mutation ist eine Mutation nur eines Allels.
- Eine homozygote Mutation ist eine identische Mutation sowohl des väterlichen als auch des mütterlichen Allels.
- Zusammengesetzte heterozygote Mutationen oder eine genetische Verbindung bestehen aus zwei verschiedenen Mutationen im väterlichen und mütterlichen Allel. ⓘ
Keimbahnmutation
Eine Keimbahnmutation in den Fortpflanzungszellen eines Individuums führt zu einer konstitutionellen Mutation bei den Nachkommen, d. h. zu einer Mutation, die in jeder Zelle vorhanden ist. Eine konstitutionelle Mutation kann auch sehr bald nach der Befruchtung auftreten oder sich aus einer früheren konstitutionellen Mutation bei einem Elternteil ergeben. Eine Keimbahnmutation kann über nachfolgende Generationen von Organismen vererbt werden. ⓘ
Die Unterscheidung zwischen Keimbahn- und somatischen Mutationen ist wichtig bei Tieren, die eine eigene Keimbahn zur Erzeugung von Fortpflanzungszellen haben. Für das Verständnis der Auswirkungen von Mutationen in Pflanzen, die keine eigene Keimbahn haben, ist sie jedoch von geringem Wert. Auch bei Tieren, die sich ungeschlechtlich durch Mechanismen wie die Knospung fortpflanzen, ist die Unterscheidung unscharf, da die Zellen, aus denen die Tochterorganismen entstehen, auch die Keimbahn dieses Organismus hervorbringen. ⓘ
Eine neue Keimbahnmutation, die nicht von einem Elternteil vererbt wurde, wird als De-novo-Mutation bezeichnet. ⓘ
Somatische Mutation
Eine Veränderung der genetischen Struktur, die nicht von einem Elternteil vererbt wird und auch nicht an die Nachkommen weitergegeben wird, wird als somatische Mutation bezeichnet. Somatische Mutationen werden nicht an die Nachkommen eines Organismus vererbt, da sie nicht die Keimbahn betreffen. Sie werden jedoch während der Mitose an alle Nachkommen einer mutierten Zelle innerhalb desselben Organismus weitergegeben. Ein großer Teil eines Organismus kann daher die gleiche Mutation tragen. Diese Arten von Mutationen werden in der Regel durch Umwelteinflüsse wie ultraviolette Strahlung oder den Kontakt mit bestimmten schädlichen Chemikalien ausgelöst und können Krankheiten wie Krebs verursachen. ⓘ
Bei Pflanzen können einige somatische Mutationen ohne die Notwendigkeit der Saatguterzeugung vermehrt werden, z. B. durch Pfropfung und Stammstecklinge. Diese Art von Mutation hat zu neuen Obstsorten geführt, wie dem "Delicious"-Apfel und der "Washington"-Nabelorange. ⓘ
Die somatischen Zellen von Menschen und Mäusen haben eine Mutationsrate, die mehr als zehnmal höher ist als die Keimbahnmutationsrate bei beiden Arten; bei Mäusen ist die Rate sowohl der somatischen als auch der Keimbahnmutationen pro Zellteilung höher als beim Menschen. Der Unterschied in der Mutationsrate zwischen Keimbahn und somatischem Gewebe spiegelt wahrscheinlich die größere Bedeutung der Genomerhaltung in der Keimbahn als im Soma wider. ⓘ
Besondere Klassen
- Eine bedingte Mutation ist eine Mutation, die unter bestimmten "permissiven" Umweltbedingungen einen Wildtyp-Phänotyp (oder einen weniger schweren Phänotyp) und unter bestimmten "restriktiven" Bedingungen einen mutierten Phänotyp aufweist. So kann beispielsweise eine temperaturempfindliche Mutation bei hohen Temperaturen zum Zelltod führen (restriktive Bedingung), während sie bei niedrigeren Temperaturen (permissive Bedingung) keine nachteiligen Folgen hat. Diese Mutationen sind nicht-autonom, da ihre Manifestation vom Vorhandensein bestimmter Bedingungen abhängt, im Gegensatz zu anderen Mutationen, die autonom auftreten. Bei den permissiven Bedingungen kann es sich um Temperatur, bestimmte Chemikalien, Licht oder Mutationen in anderen Teilen des Genoms handeln. In-vivo-Mechanismen wie Transkriptionsschalter können bedingte Mutationen hervorrufen. So kann beispielsweise die Assoziation einer Steroidbindungsdomäne einen Transkriptionsschalter schaffen, der die Expression eines Gens in Abhängigkeit von der Anwesenheit eines Steroidliganden verändert. Konditionale Mutationen finden in der Forschung Anwendung, da sie die Kontrolle über die Genexpression ermöglichen. Dies ist besonders nützlich bei der Untersuchung von Krankheiten bei Erwachsenen, da die Expression nach einer bestimmten Wachstumsphase zugelassen wird, wodurch die schädlichen Auswirkungen der Genexpression in den Entwicklungsstadien von Modellorganismen vermieden werden. DNA-Rekombinase-Systeme wie die Cre-Lox-Rekombination können in Verbindung mit Promotoren, die unter bestimmten Bedingungen aktiviert werden, bedingte Mutationen erzeugen. Mit der Dualen Rekombinase-Technologie können mehrere bedingte Mutationen erzeugt werden, um Krankheiten zu untersuchen, die durch gleichzeitige Mutationen in mehreren Genen entstehen. Es wurden bestimmte Inteine identifiziert, die nur bei bestimmten zulässigen Temperaturen spleißen, was zu einer fehlerhaften Proteinsynthese und somit zu Funktionsverlustmutationen bei anderen Temperaturen führt. Konditionale Mutationen können auch in genetischen Studien im Zusammenhang mit der Alterung verwendet werden, da die Expression nach einem bestimmten Zeitraum in der Lebensspanne des Organismus verändert werden kann.
- Replikationszeitpunkt Quantitative Trait Loci beeinflussen die DNA-Replikation. ⓘ
Nomenklatur
Damit eine Mutation als solche eingestuft werden kann, muss die "normale" Sequenz aus der DNA eines "normalen" oder "gesunden" Organismus (im Gegensatz zu einem "mutierten" oder "kranken" Organismus) gewonnen, identifiziert und gemeldet werden; idealerweise sollte sie für einen einfachen Nukleotid-für-Nukleotid-Vergleich öffentlich zugänglich gemacht und von der wissenschaftlichen Gemeinschaft oder einer Gruppe von Fachgenetikern und Biologen, die für die Festlegung der Standard- oder sogenannten "Konsens"-Sequenz verantwortlich sind, vereinbart werden. Dieser Schritt erfordert einen enormen wissenschaftlichen Aufwand. Sobald die Konsenssequenz bekannt ist, können die Mutationen in einem Genom lokalisiert, beschrieben und klassifiziert werden. Das Komitee der Human Genome Variation Society (HGVS) hat die Standard-Nomenklatur für menschliche Sequenzvarianten entwickelt, die von Forschern und DNA-Diagnosezentren zur Erstellung eindeutiger Mutationsbeschreibungen verwendet werden soll. Im Prinzip kann diese Nomenklatur auch zur Beschreibung von Mutationen in anderen Organismen verwendet werden. Die Nomenklatur spezifiziert die Art der Mutation und die Basen- oder Aminosäureveränderungen.
- Nukleotidsubstitution (z. B. 76A>T) - Die Zahl gibt die Position des Nukleotids vom 5'-Ende aus an; der erste Buchstabe steht für das Wildtyp-Nukleotid und der zweite Buchstabe für das Nukleotid, das den Wildtyp ersetzt hat. Im vorliegenden Beispiel wurde das Adenin an der 76. Position durch ein Thymin ersetzt.
- Wenn es erforderlich ist, zwischen Mutationen in genomischer DNA, mitochondrialer DNA und RNA zu unterscheiden, wird eine einfache Konvention verwendet. Wenn beispielsweise die 100. Base einer Nukleotidsequenz von G zu C mutiert ist, wird sie als g.100G>C geschrieben, wenn die Mutation in der genomischen DNA aufgetreten ist, m.100G>C, wenn die Mutation in der mitochondrialen DNA aufgetreten ist, oder r.100g>c, wenn die Mutation in der RNA aufgetreten ist. Beachten Sie, dass bei Mutationen in RNA der Nukleotidcode klein geschrieben wird.
- Aminosäuresubstitution (z. B. D111E) - Der erste Buchstabe ist der Ein-Buchstaben-Code der Wildtyp-Aminosäure, die Zahl ist die Position der Aminosäure vom N-Terminus aus, und der zweite Buchstabe ist der Ein-Buchstaben-Code der in der Mutation vorhandenen Aminosäure. Nonsense-Mutationen werden mit einem X für die zweite Aminosäure dargestellt (z. B. D111X).
- Aminosäurendeletion (z. B. ΔF508) - Der griechische Buchstabe Δ (delta) steht für eine Deletion. Der Buchstabe bezieht sich auf die Aminosäure, die im Wildtyp vorhanden ist, und die Zahl gibt die Position vom N-Terminus der Aminosäure an, wenn sie wie im Wildtyp vorhanden wäre. ⓘ
Mutationsraten
Die Mutationsraten variieren von Art zu Art erheblich, und die evolutionären Kräfte, die im Allgemeinen die Mutation bestimmen, sind Gegenstand laufender Untersuchungen. ⓘ
Beim Menschen liegt die Mutationsrate bei etwa 50-90 De-novo-Mutationen pro Genom und Generation, d. h. jeder Mensch sammelt etwa 50-90 neue Mutationen an, die bei seinen Eltern nicht vorhanden waren. Diese Zahl wurde durch die Sequenzierung von Tausenden von menschlichen Trios ermittelt, d. h. zwei Eltern und mindestens ein Kind. ⓘ
Die Genome von RNA-Viren basieren auf RNA und nicht auf DNA. Das Genom von RNA-Viren kann doppelsträngig (wie bei der DNA) oder einzelsträngig sein. Bei einigen dieser Viren (z. B. dem einzelsträngigen humanen Immundefizienzvirus) erfolgt die Replikation schnell, und es gibt keine Mechanismen, um das Genom auf seine Richtigkeit zu überprüfen. Dieser fehleranfällige Prozess führt häufig zu Mutationen. ⓘ
Zufälligkeit von Mutationen
Es besteht die weit verbreitete Annahme, dass Mutationen im Hinblick auf ihre Folgen (in Bezug auf die Wahrscheinlichkeit) (völlig) "zufällig" sind. Dies hat sich als falsch erwiesen, da die Mutationshäufigkeit in verschiedenen Regionen des Genoms variieren kann, wobei solche DNA-Reparatur- und Mutationsbiasen mit verschiedenen Faktoren in Verbindung gebracht werden. So wurde beispielsweise festgestellt, dass biologisch wichtige Regionen vor Mutationen geschützt sind und Mutationen, die für die untersuchte Pflanze vorteilhaft sind, wahrscheinlicher sind - d. h. die Mutation ist "nicht zufällig in einer Weise, die der Pflanze zugute kommt". ⓘ
Krankheitsverursachung
Veränderungen in der DNA, die durch eine Mutation in einem kodierenden Bereich der DNA verursacht werden, können Fehler in der Proteinsequenz verursachen, die zu teilweise oder vollständig nicht funktionierenden Proteinen führen können. Jede Zelle ist, um korrekt zu funktionieren, auf Tausende von Proteinen angewiesen, die an den richtigen Stellen und zur richtigen Zeit wirken. Wenn eine Mutation ein Protein verändert, das eine wichtige Rolle im Körper spielt, kann dies zu einer Erkrankung führen. Eine Studie über den Vergleich von Genen verschiedener Drosophila-Arten deutet darauf hin, dass eine Mutation, die ein Protein verändert, höchstwahrscheinlich schädlich ist, wobei schätzungsweise 70 % der Aminosäure-Polymorphismen schädliche Auswirkungen haben und der Rest entweder neutral oder schwach vorteilhaft ist. Einige Mutationen verändern die DNA-Basensequenz eines Gens, nicht aber das vom Gen gebildete Protein. Studien haben gezeigt, dass nur 7 % der Punktmutationen in der nicht kodierenden DNA von Hefe schädlich sind und 12 % in der kodierenden DNA schädlich sind. Der Rest der Mutationen ist entweder neutral oder leicht vorteilhaft. ⓘ
Vererbte Störungen
Wenn eine Mutation in einer Keimzelle vorhanden ist, kann sie Nachkommen hervorbringen, die die Mutation in allen ihren Zellen tragen. Dies ist bei Erbkrankheiten der Fall. Insbesondere wenn eine Mutation in einem DNA-Reparaturgen in einer Keimzelle vorliegt, können Menschen, die solche Keimbahnmutationen tragen, ein erhöhtes Krebsrisiko haben. Eine Liste von 34 solcher Keimbahnmutationen findet sich in dem Artikel DNA-Reparatur-Mangelkrankheit. Ein Beispiel dafür ist Albinismus, eine Mutation, die im OCA1- oder OCA2-Gen auftritt. Menschen mit dieser Störung sind anfälliger für viele Krebsarten und andere Erkrankungen und haben eine Sehschwäche. ⓘ
DNA-Schäden können bei der Replikation der DNA einen Fehler verursachen, und dieser Replikationsfehler kann zu einer Genmutation führen, die wiederum eine genetische Störung verursachen kann. DNA-Schäden werden durch das DNA-Reparatursystem der Zelle repariert. Jede Zelle verfügt über eine Reihe von Wegen, über die Enzyme Schäden an der DNA erkennen und reparieren. Da die DNS auf vielfältige Weise geschädigt werden kann, ist der Prozess der DNS-Reparatur eine wichtige Methode, mit der sich der Körper vor Krankheiten schützt. Sobald eine DNA-Schädigung zu einer Mutation geführt hat, kann diese nicht mehr repariert werden. ⓘ
Rolle bei der Krebsentstehung
Andererseits kann eine Mutation in einer somatischen Zelle eines Organismus auftreten. Solche Mutationen sind dann in allen Nachkommen dieser Zelle innerhalb desselben Organismus vorhanden. Die Anhäufung bestimmter Mutationen über Generationen von somatischen Zellen ist eine der Ursachen für die bösartige Umwandlung von einer normalen Zelle in eine Krebszelle. ⓘ
Zellen mit heterozygoten Funktionsverlustmutationen (eine gute Kopie des Gens und eine mutierte Kopie) können mit der nicht mutierten Kopie normal funktionieren, bis die gute Kopie spontan somatisch mutiert ist. Diese Art von Mutation kommt in lebenden Organismen häufig vor, aber es ist schwierig, die Rate zu messen. Die Messung dieser Rate ist wichtig für die Vorhersage der Häufigkeit, mit der Menschen Krebs entwickeln können. ⓘ
Punktmutationen können aus spontanen Mutationen entstehen, die während der DNA-Replikation auftreten. Die Mutationsrate kann durch Mutagene erhöht werden. Mutagene können physikalischer Natur sein, wie z. B. UV-Strahlen, Röntgenstrahlen oder extreme Hitze, oder chemischer Natur (Moleküle, die Basenpaare verschieben oder die Helixform der DNA stören). Mutagene, die mit Krebserkrankungen in Verbindung gebracht werden, werden häufig untersucht, um mehr über Krebs und seine Prävention zu erfahren. ⓘ
Prion-Mutationen
Prionen sind Proteine und enthalten kein genetisches Material. Es hat sich jedoch gezeigt, dass die Replikation von Prionen ebenso wie andere Replikationsformen Mutationen und natürlicher Selektion unterliegt. Das menschliche Gen PRNP kodiert für das wichtigste Prionprotein, PrP, und unterliegt Mutationen, die zu krankheitsverursachenden Prionen führen können. ⓘ
Nützliche Mutationen
Obwohl Mutationen, die Veränderungen in Proteinsequenzen verursachen, für einen Organismus schädlich sein können, kann die Wirkung in einem bestimmten Umfeld auch positiv sein. In diesem Fall kann die Mutation den mutierten Organismus in die Lage versetzen, bestimmten Umweltbelastungen besser standzuhalten als Wildtyp-Organismen oder sich schneller zu vermehren. In diesen Fällen wird sich die Mutation durch natürliche Selektion in einer Population immer weiter verbreiten. Zu den Beispielen gehören folgende: HIV-Resistenz: Eine spezifische Deletion von 32 Basenpaaren im menschlichen CCR5 (CCR5-Δ32) verleiht Homozygoten eine HIV-Resistenz und verzögert den Ausbruch von AIDS bei Heterozygoten. Eine mögliche Erklärung für die relativ hohe Häufigkeit von CCR5-Δ32 in der europäischen Bevölkerung ist, dass diese Mutation Mitte des 14. Jahrhunderts in Europa Resistenz gegen die Beulenpest vermittelte. Jahrhunderts eine Resistenz gegen die Beulenpest verlieh. Menschen mit dieser Mutation überlebten die Infektion mit größerer Wahrscheinlichkeit, so dass ihre Häufigkeit in der Bevölkerung zunahm. Diese Theorie könnte erklären, warum diese Mutation im südlichen Afrika, das von der Beulenpest verschont blieb, nicht vorkommt. Eine neuere Theorie besagt, dass der Selektionsdruck auf die CCR5-Delta-32-Mutation durch die Pocken und nicht durch die Beulenpest verursacht wurde. ⓘ
Malaria-Resistenz: Ein Beispiel für eine schädliche Mutation ist die Sichelzellenkrankheit, eine Blutkrankheit, bei der der Körper eine abnormale Form der sauerstofftragenden Substanz Hämoglobin in den roten Blutkörperchen produziert. Ein Drittel aller Ureinwohner Afrikas südlich der Sahara trägt dieses Allel, denn in Gebieten, in denen Malaria häufig vorkommt, hat es einen Überlebensvorteil, nur ein einziges Sichelzellen-Allel zu tragen (Sichelzellen-Trait). Menschen, die nur eines der beiden Allele der Sichelzellenkrankheit tragen, sind resistenter gegen Malaria, da der Befall des Malariaerregers Plasmodium durch die Sichelung der von ihm befallenen Zellen gestoppt wird. ⓘ
Antibiotikaresistenz: Praktisch alle Bakterien entwickeln eine Antibiotikaresistenz, wenn sie Antibiotika ausgesetzt sind. In der Tat gibt es in Bakterienpopulationen bereits solche Mutationen, die durch die antibiotische Selektion ausgewählt werden. Offensichtlich sind solche Mutationen nur für die Bakterien von Vorteil, nicht aber für die Infizierten. ⓘ
Persistenz der Laktase. Eine Mutation ermöglichte es dem Menschen, das Enzym Laktase zu exprimieren, nachdem er auf natürliche Weise von der Muttermilch abgestillt wurde, so dass er als Erwachsener Laktose verdauen kann - wahrscheinlich eine der vorteilhaftesten Mutationen in der jüngsten menschlichen Evolution. ⓘ
Geschichte

Der Mutationismus ist eine von mehreren Alternativen zur Darwinschen Evolutionstheorie, die sowohl vor als auch nach der Veröffentlichung von Charles Darwins Buch "Über die Entstehung der Arten" (1859) bestanden haben. In dieser Theorie war die Mutation die Quelle der Neuheit, die in einem plötzlichen Sprung neue Formen und neue Arten hervorbringt. Dies sollte die Evolution vorantreiben, die durch das Angebot an Mutationen begrenzt war. ⓘ
Vor Darwin glaubten die Biologen allgemein an den Saltationismus, die Möglichkeit großer Evolutionssprünge, einschließlich der sofortigen Artbildung. Étienne Geoffroy Saint-Hilaire vertrat beispielsweise 1822 die Ansicht, dass Arten durch plötzliche Umwandlungen entstehen könnten, was später als Makromutation bezeichnet wurde. Darwin lehnte die Saltation ab und beharrte auf dem Gradualismus der Evolution wie in der Geologie. 1864 griff Albert von Kölliker die Theorie Geoffroys wieder auf. Im Jahr 1901 gab der Genetiker Hugo de Vries scheinbar neuen Formen, die bei seinen Experimenten mit der Nachtkerze Oenothera lamarckiana plötzlich auftraten, den Namen "Mutation", und im ersten Jahrzehnt des 20. Jahrhunderts wurde der Mutationismus, oder wie de Vries ihn nannte, die Mutationstheorie, zu einem Rivalen des Darwinismus, der eine Zeit lang von Genetikern wie William Bateson, Thomas Hunt Morgan und Reginald Punnett unterstützt wurde. ⓘ
Das Verständnis des Mutationismus wird dadurch getrübt, dass die Befürworter der modernen Synthese Mitte des 20. Jahrhunderts die frühen Mutationisten als Gegner der Darwinschen Evolution und Rivalen der biometrischen Schule darstellten, die argumentierten, dass die Selektion auf kontinuierlicher Variation beruht. In dieser Darstellung wurde der Mutationismus durch eine Synthese von Genetik und natürlicher Selektion besiegt, die angeblich später, um 1918, mit den Arbeiten des Mathematikers Ronald Fisher begann. Die Angleichung der Mendelschen Genetik und der natürlichen Selektion begann jedoch bereits 1902 mit einer Arbeit von Udny Yule und wurde durch theoretische und experimentelle Arbeiten in Europa und Amerika vertieft. Trotz der Kontroverse hatten die frühen Mutationisten bereits 1918 die natürliche Auslese akzeptiert und erklärten die kontinuierliche Variation als das Ergebnis mehrerer Gene, die auf dasselbe Merkmal, wie z. B. die Körpergröße, einwirken. ⓘ
Der Mutationismus wurde zusammen mit anderen Alternativen zum Darwinismus wie dem Lamarckismus und der Orthogenese von den meisten Biologen verworfen, als sie erkannten, dass die Mendelsche Genetik und die natürliche Auslese problemlos zusammenarbeiten konnten; die Mutation nahm ihren Platz als Quelle der genetischen Variation ein, die für die natürliche Auslese unerlässlich ist. Der Mutationismus verschwand jedoch nicht völlig. Im Jahr 1940 argumentierte Richard Goldschmidt erneut für eine einstufige Speziation durch Makromutation und bezeichnete die so entstandenen Organismen als "hoffnungsvolle Monster", was ihm viel Spott einbrachte. 1987 argumentierte Masatoshi Nei kontrovers, dass die Evolution häufig mutationsbegrenzt sei. Moderne Biologen wie Douglas J. Futuyma kommen zu dem Schluss, dass im Wesentlichen alle Behauptungen über eine durch große Mutationen angetriebene Evolution durch die Darwinsche Evolution erklärt werden können. ⓘ
Arten der Mutation
Unterscheidung nach Ursache
- Spontanmutationen
- sind Mutationen ohne besondere äußere Ursache, etwa der chemische Zerfall eines Nukleotids (z. B. kann aus Cytosin durch spontane Desaminierung Uracil entstehen) oder der Tunneleffekt (Protonen-Tunneln in DNA).
- Induzierte Mutationen
- sind durch Mutagene (mutationsauslösende Stoffe oder Strahlen) erzeugte Mutationen. ⓘ
Unterscheidung nach Mechanismus
- Fehler bei der Replikation
- DNA-Polymerasen bauen nach Vorlage mit unterschiedlich hohen Fehlerraten einen komplementären DNA-Strang auf.
- Unzureichende Proof-reading-Aktivität
- Manche DNA-Polymerasen haben die Möglichkeit, Fehleinbauten selbstständig zu erkennen und zu korrigieren (englisch proof-reading ‚Korrekturlesen‘). Jedoch besitzt z. B. die DNA-Polymerase α der Eukaryoten keine Proof-reading-Aktivität.
- Fehler bei prä- und postreplikativen Reparaturmechanismen
- Beim Auffinden eines ungewöhnlichen Nukleotids, etwa von Uracil in der DNA, wird dieses entfernt. Bei einer Fehlpaarung zwischen zwei DNA-typischen Nukleotiden trifft das Reparatur-Enzym eine Entscheidung mit 50-prozentiger Fehlerwahrscheinlichkeit.
- Ungleichmäßiges Crossing-over
- Zu Fehlpaarungen bei der Meiose kann es kommen durch benachbarte ähnliche oder identische Sequenzen auf dem Strang, wie etwa Satelliten-DNA oder Transposons.
- Non-Disjunction
- Die Fehlsegregation oder Non-Disjunction (englisch disjunction ‚Trennung‘) von Chromosomen führt zur fehlerhaften Verteilung auf die Tochterzellen und so zu Trisomien und Monosomien.
- Integration oder Herausspringen von Transposons oder Retroviren
- Diese Elemente können in Gene oder genregulatorische Bereiche integrieren oder desintegrieren und dadurch die Aminosäuresequenz eines Proteins oder die Ablesehäufigkeit eines Proteins verändern. ⓘ
Unterscheidung nach Folgen für den Organismus
- Neutrale Mutationen
- können den Phänotyp verändern, haben aber keine Fitnesskonsequenzen.
- Stille Mutationen
- sind Mutationen, bei denen das gebildete Protein unverändert bleibt. Trotzdem kann es zu Veränderungen im Organismus kommen, da die mRNA sich bei Verlassen des Zellkerns faltet. Dabei kann unterschiedliche Faltung die Menge des gebildeten Proteins beeinflussen.
- Konditional-letale Mutationen
- Mutationen, deren Veränderung des Genprodukts einen Organismus nur bei bestimmten Wachstumsbedingungen tötet.
- Letale Mutationen
- Mutationen, die nach ihrem Auftreten einen Organismus unabhängig von seiner jeweiligen Lebensphase in jedem Falle töten. ⓘ
Folgen
Negative Folgen
Besonders größere Veränderungen im Erbgut führen oft zu nachteiligen Veränderungen im Stoffwechsel oder auch zu Fehlbildungen und anderen Besonderheiten. ⓘ
Es gibt verschiedene Erbkrankheiten, die entweder vererbt sind oder durch Mutation neu auftreten können. Beispiele dafür sind:
- Sichelzellenanämie: Bei dieser Blutkrankheit ist die äußere Form der roten Blutkörperchen verändert und die Sauerstoffaufnahme verringert
- Phenylketonurie: gestörter Abbau der Aminosäure Phenylalanin, der das kindliche Gehirn schädigen kann
- Albinismus
- Mukoviszidose (zystische Fibrose): die häufigste genetisch bedingte Krankheit Nordeuropas. Das CFTR-Gen, das die Konsistenz der Drüsensekrete steuert, ist defekt. Wenn das Sekret zu zäh ist, kann es (je nach Drüse) die Atemwege oder die Ausführungsgänge der Drüsen verstopfen.
- Formen von Minderwuchs, bei denen die Arme und Beine ungewöhnlich kurz sind, während der Körper ansonsten wie üblich gebaut ist
- Rot-Grün-Schwäche
- Bluterkrankheit: gestörte Blutgerinnung ⓘ
Positive Folgen
Mutationen sind einer der Evolutionsfaktoren und damit für die Entwicklung des Lebens und der Artenvielfalt auf der Erde mitverantwortlich. Zwar sind Mutationen mit positiven Folgen der Wahrscheinlichkeit ihres Eintretens nach wesentlich seltener als solche neutraler oder negativer Auswirkung. Doch wenn eine positive Mutation auftritt, kann natürliche Selektion dazu beitragen, dass diese sich in einer Population ausbreiten kann. So sind beispielsweise die Folgen der Malaria bei heterozygoten Merkmalsträgern einer Sichelzellenanämie weniger schlimm. Diese Mutation ist daher in von Malaria betroffenen Gebieten häufiger verbreitet. ⓘ
Der Mensch macht sich den genomverändernden Effekt ionisierender Strahlen zunutze, um Mutationen künstlich auszulösen. Eine Anwendung besteht in der Bestrahlung von Blumen- und Pflanzensamen, um bisher unbekannte Formen zu erzeugen und wirtschaftlich zu nutzen. Das Verfahren hat aufgrund der breitgestreuten, zu umfangreichen und ungezielten Veränderung des Erbmaterials meist eine sehr geringe Erfolgsquote. ⓘ
Beispiele

- Manx-Katzen sind durch Genmutation infolge extremer Inzucht entstanden. Neben der Schwanzlosigkeit bestehen Skelettmissbildungen und weitere Fehlbildungen. Manx-Katzen sind in diesem mutierten Gen M nie reinerbig, es liegt also bei ihnen die Kombination Mm vor, d. h., es besteht ein autosomal unvollkommen dominanter Erbgang mit variabler Expressivität (Ausprägung). Bei Tieren mit der reinerbigen Gen-Kombination MM sterben die Feten schon im Mutterleib.
- Die Sphynx-Katze hat keinerlei Fell. Diese Rasse wird seit 1966 aus einer in Kanada geborenen, natürlich mutierten Katze vom Menschen weitergezüchtet.
- Nacktmäuse, auch thymusaplastische Mäuse oder athymische Mäuse genannt, sind genetische Mutanten der Hausmaus mit fehlendem Thymus. Sie entstanden 1961 in Glasgow infolge einer Spontanmutation bei Albino-Mäusen und sind für die Forschung ein außerordentlich wichtiger Modellorganismus.
- Beim Escherichia coli-Langzeitexperiment von Lenski wurden Bakterien über zwei Jahrzehnte unter konstanten Bedingungen gehalten und die auftretenden Veränderungen im Genom regelmäßig dokumentiert. Als Kohlenstoffquellen befanden sich im Glasgefäß nur Glucose und Citrat. E. coli verwendet Glucose als natürliche Nahrungsquelle; Citrat als Kohlenstoffquelle kann der Wildtyp von E. coli nicht metabolisieren. 2003 zeigten sich plötzlich E. coli-Mutanten, die auch Citrat verstoffwechseln können.
- Laktose-Toleranz beim Menschen: Genetisch determiniert sind die meisten Menschen wie alle Säugetiere im Erwachsenenalter laktose-intolerant, können also dann milchzuckerhaltige Nahrung nur noch schlecht oder gar nicht mehr verdauen. Nach Ansicht von Genetikern ist vor etwa 8.000 bis 10.000 Jahren bei einem Menschen im kaukasischen Raum eine Mutation aufgetreten, die die natürliche Laktosetoleranz des Säuglings und Kindes über die Stillzeit hinaus auf die gesamte Lebensspanne ausdehnte. Somit zeigen alle Nachkommen dieses Menschen zeit ihres Lebens keine gesundheitliche Beeinträchtigung beim Verzehr von Milch bzw. Milchzucker, wohingegen solche Nahrungsmittel beispielsweise von erwachsenen Asiaten oder Afrikanern nicht vertragen werden, die von dieser Mutation nicht betroffen sind (siehe Laktoseintoleranz).
- Gehirnentwicklung des Menschen: Die Gene Microcephalin und ASPM steuern beim Menschen das Größenwachstum des Gehirns. Forscher um Bruce Lahn vom Howard Hughes Medical Institute der University of Chicago (USA) haben herausgefunden, dass zwei Mutationen sich in der jüngeren Stammesgeschichte des Menschen als vorteilhaft erwiesen haben. Die Haplogruppe D als Ergebnis einer Mutation des Microcephalins entstand vor 37.000 Jahren im menschlichen Genom und verbreitete sich etwa gleichzeitig mit den ältesten Funden, die von der Beschäftigung des Menschen mit Kunst, Musik und Religion zeugen. Diese Mutation findet man heute bei etwa 70 % aller Menschen. Bei einer anderen Mutation entstand vor etwa 5.800 Jahren die Haplogruppe D des ASPM, etwa zeitgleich mit der ersten Zivilisation in Mesopotamien, von der auch die ältesten Schriftfunde der Menschheitsgeschichte stammen. Diese zweite Mutation hat sich bis heute bei 30 % der Weltbevölkerung durchgesetzt. Zusätzlich gibt es auch regionale Unterschiede. So kommt die Haplogruppe D des ASPM-Gens besonders in Europa und den angrenzenden Gebieten Asiens und Afrikas vor. Die Parallelität der beschriebenen Ereignisse wird von den Wissenschaftlern dahingehend interpretiert, dass beide Mutationen einen evolutionären Vorteil bieten müssen.
- Erkrankungsrisiko bei Brustkrebs: Im Sommer 2006 haben Forscher um Naznee Rahman vom britischen Institut of cancer research in Surrey ein neues Brustkrebsgen mit der Bezeichnung BRIP-1 identifiziert. Dieses Gen codiert ein Protein, welches an der Reparatur von DNA-Schäden beteiligt ist. Eine zugleich entdeckte, selten vorkommende Mutation dieses Gens bewirkt, dass das BRIP-1-Protein diese Schutzfunktion nicht mehr ausführen kann. Bei einem Vorliegen dieser Mutation haben Frauen ein doppelt so hohes Brustkrebsrisiko wie andere mit einer normalen Version dieser Erbanlage. Mutationen der schon länger bekannten Gene BRCA1 und BRCA2 erhöhen dagegen das Erkrankungsrisiko um den Faktor 10 bis 20. ⓘ
Gartenbau
Im Gartenbau wird eine Mutation, aus der eine neue Sorte entsteht, auch „Abart“ oder „Sport“ genannt. ⓘ
