Malaria
| Malaria ⓘ | |
|---|---|
 | |
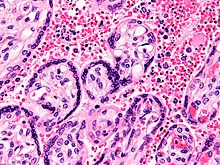
| Malariaparasit, der sich mit einem roten Blutkörperchen verbindet | |
| Aussprache |
|
| Fachgebiet | Infektionskrankheit |
| Symptome | Fieber, Erbrechen, Kopfschmerzen, gelbe Haut |
| Komplikationen | Krampfanfälle, Koma, Organversagen, Anämie, zerebrale Malaria |
| Gewöhnlicher Ausbruch | 10-15 Tage nach der Exposition |
| Erreger | Plasmodium wird durch Stechmücken verbreitet |
| Diagnostische Methode | Untersuchung des Blutes, Antigen-Nachweis-Tests |
| Vorbeugung | Moskitonetze, Insektenschutzmittel, Stechmückenbekämpfung, Medikamente |
| Medikation | Antimalariamittel |
| Häufigkeit | 241 Millionen (2020) |
| Todesfälle | 627,000+ (2020) |
Malaria ist eine durch Stechmücken übertragene Infektionskrankheit, die Menschen und andere Tiere befällt. Malaria verursacht Symptome wie Fieber, Müdigkeit, Erbrechen und Kopfschmerzen. In schweren Fällen kann sie Gelbsucht, Krampfanfälle, Koma oder Tod verursachen. Die Symptome treten in der Regel zehn bis fünfzehn Tage nach dem Stich durch eine infizierte Mücke auf. Wenn die Krankheit nicht angemessen behandelt wird, kann sie Monate später erneut ausbrechen. Bei Personen, die erst kürzlich eine Infektion überlebt haben, verursacht eine erneute Infektion in der Regel mildere Symptome. Diese teilweise Resistenz verschwindet im Laufe von Monaten bis Jahren, wenn die Person nicht mehr mit Malaria in Kontakt kommt. ⓘ
Malaria wird durch einzellige Mikroorganismen der Plasmodium-Gruppe verursacht. Sie wird ausschließlich durch Stiche von infizierten Anopheles-Mücken übertragen. Durch den Mückenstich gelangen die Parasiten aus dem Speichel der Mücke in das Blut einer Person. Die Parasiten wandern in die Leber, wo sie heranreifen und sich vermehren. Fünf Plasmodium-Arten können Menschen infizieren und von ihnen übertragen werden. Die meisten Todesfälle werden durch P. falciparum verursacht, während P. vivax, P. ovale und P. malariae im Allgemeinen eine mildere Form der Malaria verursachen. Die Spezies P. knowlesi verursacht nur selten Krankheiten beim Menschen. Malaria wird in der Regel durch die mikroskopische Untersuchung von Blut anhand von Blutfilmen oder durch antigenbasierte Schnelltests diagnostiziert. Es wurden Methoden entwickelt, die die DNA des Parasiten mit Hilfe der Polymerase-Kettenreaktion nachweisen, doch werden sie in Gebieten, in denen Malaria häufig vorkommt, aufgrund ihrer Kosten und Komplexität nicht häufig eingesetzt. ⓘ
Das Krankheitsrisiko kann durch die Vermeidung von Mückenstichen durch die Verwendung von Moskitonetzen und Insektenschutzmitteln oder durch Maßnahmen zur Mückenbekämpfung wie das Versprühen von Insektiziden und das Ablassen von stehendem Wasser verringert werden. Für Reisende in Gebiete, in denen die Krankheit häufig vorkommt, stehen mehrere Medikamente zur Vorbeugung von Malaria zur Verfügung. Gelegentliche Dosen des Kombinationspräparats Sulfadoxin/Pyrimethamin werden bei Säuglingen und nach dem ersten Schwangerschaftsdrittel in Gebieten mit hohem Malariavorkommen empfohlen. Ab 2020 steht ein Impfstoff zur Verfügung, der das Malariarisiko bei Kindern in Afrika nachweislich um etwa 40 % senkt. Eine Vorabdruckstudie zu einem anderen Impfstoff hat eine Wirksamkeit von 77 % gezeigt, aber diese Studie hat die Peer Review noch nicht bestanden. Die Bemühungen um die Entwicklung wirksamerer Impfstoffe sind noch nicht abgeschlossen. Die empfohlene Behandlung von Malaria ist eine Kombination von Malariamedikamenten, die Artemisinin enthält. Das zweite Medikament kann entweder Mefloquin, Lumefantrin oder Sulfadoxin/Pyrimethamin sein. Wenn Artemisinin nicht verfügbar ist, kann Chinin zusammen mit Doxycyclin verwendet werden. In Gebieten, in denen die Krankheit häufig vorkommt, wird empfohlen, die Malaria möglichst zu bestätigen, bevor mit der Behandlung begonnen wird, da eine zunehmende Arzneimittelresistenz zu befürchten ist. Unter den Parasiten hat sich eine Resistenz gegen mehrere Malariamedikamente entwickelt; so hat sich beispielsweise chloroquinresistente P. falciparum in den meisten Malariagebieten ausgebreitet, und in einigen Teilen Südostasiens ist die Resistenz gegen Artemisinin zu einem Problem geworden. ⓘ
Die Krankheit ist in den tropischen und subtropischen Regionen weit verbreitet, die in einem breiten Band um den Äquator liegen. Dazu gehören große Teile von Afrika südlich der Sahara, Asien und Lateinamerika. Im Jahr 2020 gab es weltweit 241 Millionen Malariafälle, an denen schätzungsweise 627.000 Menschen starben. Ungefähr 95 % der Fälle und Todesfälle traten in Afrika südlich der Sahara auf. Die Erkrankungsraten sind von 2010 bis 2014 zurückgegangen, haben aber von 2015 bis 2020 zugenommen. Malaria wird häufig mit Armut in Verbindung gebracht und hat einen erheblichen negativen Einfluss auf die wirtschaftliche Entwicklung. In Afrika entstehen durch erhöhte Gesundheitskosten, Arbeitsausfälle und negative Auswirkungen auf den Tourismus schätzungsweise Verluste von 12 Milliarden US-Dollar pro Jahr. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| B50 | Malaria tropica durch Plasmodium falciparum |
| B51 | Malaria tertiana durch Plasmodium vivax |
| B52 | Malaria quartana durch Plasmodium malariae |
| B53 | Sonstige parasitologisch bestätigte Malaria |
| B54 | Malaria, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Malaria – auch Sumpffieber, Paludismus, Wechselfieber, Marschenfieber, Febris intermittens, Kaltes Fieber oder veraltet Akklimatisationsfieber, Klimafieber, Küstenfieber, Tropenfieber genannt – ist eine Infektionskrankheit, die von einzelligen Parasiten der Gattung Plasmodium hervorgerufen wird. Sie wird heutzutage hauptsächlich in den Tropen und Subtropen durch den Stich einer weiblichen Stechmücke (Moskito) der Gattung Anopheles übertragen. Außerhalb dieser Gebiete lösen gelegentlich durch den Luftverkehr eingeschleppte Moskitos die sogenannte „Flughafen-Malaria“ aus. Hierbei sind alle Personen im direkten Umfeld von Flughäfen gefährdet, z. B. Flughafenbedienstete oder Anwohner. Bis auf eine Übertragung durch Bluttransfusion und Laborunfälle ist eine Mensch-zu-Mensch-Ansteckung nur gelegentlich von der Mutter auf das ungeborene Kind möglich, wenn die Plazenta (besonders während der Geburt) verletzt wird. Der Mensch und die Anopheles-Mücken stellen das einzige nennenswerte Erregerreservoir humanpathogener Plasmodien dar. ⓘ
Die Malaria ist mit etwa 200 Millionen Erkrankten pro Jahr die häufigste Infektionskrankheit der Welt. Mit wissenschaftlichen Computermodellen wurden für das Jahr 2010 rund 1,2 Millionen Todesfälle aufgrund einer Malariainfektion errechnet, nachdem Daten von 1980 bis 2010 gesammelt worden waren. Den Modellen nach erreichte die Zahl der Malariatoten im Jahr 2004 mit 1,8 Millionen einen Höhepunkt. ⓘ
Früher galten nur vier Erreger als humanpathogen: Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale und Plasmodium malariae. Mittlerweile ist bekannt, dass eine weitere Art aus Südostasien, die bislang hauptsächlich als für Makaken gefährlich galt, auch in größerer Zahl als bislang angenommen den Menschen infizieren kann: Plasmodium knowlesi. Hinsichtlich ihres Krankheitsverlaufes und ihrer geographischen Verbreitung unterscheiden sich die Erreger erheblich. Plasmodium falciparum ist der klinisch bedeutsamste und bedrohlichste Erreger der früher auch als bösartiges Wechselfieber bezeichneten Malaria. ⓘ
Im Wesentlichen werden, entsprechend den verschiedenen Malariaparasiten, drei Krankheitsbilder unterschieden: Malaria tropica, Malaria tertiana und Malaria quartana. Die Symptome der Malaria sind hohes, wiederkehrendes bis periodisches (Wechsel-)Fieber, Schüttelfrost, Beschwerden des Magen-Darm-Trakts und Krämpfe. Besonders bei Kindern kann die Krankheit rasch zu Koma und Tod führen. Die Frequenz der Fieberschübe ergibt sich aus der Länge der Vermehrungszyklen der Erreger. ⓘ
In Österreich und der Schweiz ist die Krankheit meldepflichtig, in Deutschland nur der Nachweis des Erregers (außer in Sachsen). ⓘ
Anzeichen und Symptome

Erwachsene, die an Malaria erkrankt sind, leiden in der Regel unter Schüttelfrost und Fieber - in der Regel in regelmäßigen intensiven Schüben, die etwa sechs Stunden andauern, gefolgt von einer Phase des Schwitzens und der Fieberabnahme - sowie unter Kopfschmerzen, Müdigkeit, Bauchbeschwerden und Muskelschmerzen. Bei Kindern treten eher allgemeine Symptome auf: Fieber, Husten, Erbrechen und Durchfall. ⓘ
Die anfänglichen Symptome der Krankheit - die für alle Malariaarten typisch sind - ähneln grippeähnlichen Symptomen und können anderen Erkrankungen wie Sepsis, Gastroenteritis und Viruserkrankungen ähneln. Das Krankheitsbild kann Kopfschmerzen, Fieber, Schüttelfrost, Gelenkschmerzen, Erbrechen, hämolytische Anämie, Gelbsucht, Hämoglobin im Urin, Netzhautschäden und Krampfanfälle umfassen. ⓘ
Das klassische Symptom der Malaria ist der Paroxysmus - ein zyklisches Auftreten von plötzlicher Kälte, gefolgt von Schüttelfrost und anschließendem Fieber und Schwitzen, das bei P. vivax und P. ovale alle zwei Tage (tertianisches Fieber) und bei P. malariae alle drei Tage (quartanisches Fieber) auftritt. Eine Infektion mit P. falciparum kann alle 36-48 Stunden wiederkehrendes Fieber oder ein weniger stark ausgeprägtes, fast kontinuierliches Fieber verursachen. ⓘ
Die Symptome beginnen in der Regel 10-15 Tage nach dem ersten Mückenstich, können aber bei einigen P. vivax-Stämmen auch erst mehrere Monate nach der Infektion auftreten. Reisende, die vorbeugende Malariamedikamente einnehmen, können Symptome entwickeln, sobald sie die Medikamente absetzen. ⓘ
Schwere Malaria wird in der Regel durch P. falciparum verursacht (oft auch als Falciparum-Malaria bezeichnet). Die Symptome der Falciparum-Malaria treten 9-30 Tage nach der Infektion auf. Personen mit zerebraler Malaria weisen häufig neurologische Symptome auf, darunter abnorme Körperhaltung, Nystagmus, konjugierte Blicklähmung (die Augen drehen sich nicht in dieselbe Richtung), Opisthotonus, Krampfanfälle oder Koma. ⓘ
Komplikationen
Malaria hat mehrere schwerwiegende Komplikationen. Dazu gehört die Entwicklung von Atemwegsbeschwerden, die bei bis zu 25 % der Erwachsenen und 40 % der Kinder mit schwerer P. falciparum-Malaria auftritt. Mögliche Ursachen sind die Atmungskompensation bei metabolischer Azidose, nicht-kardiogenes Lungenödem, begleitende Lungenentzündung und schwerer Anämie. Obwohl bei Kleinkindern mit schwerer Malaria selten, tritt bei 5-25 % der Erwachsenen und bis zu 29 % der Schwangeren ein akutes Atemnotsyndrom auf. Die Koinfektion von HIV mit Malaria erhöht die Sterblichkeit. Nierenversagen ist ein Merkmal des Schwarzwasserfiebers, bei dem Hämoglobin aus lysierten roten Blutkörperchen in den Urin gelangt. ⓘ
Eine Infektion mit P. falciparum kann zu zerebraler Malaria führen, einer Form schwerer Malaria, die Enzephalopathie beinhaltet. Sie ist mit einer retinalen Aufhellung verbunden, die ein nützliches klinisches Zeichen sein kann, um Malaria von anderen Ursachen des Fiebers zu unterscheiden. Eine vergrößerte Milz, eine vergrößerte Leber oder beides, schwere Kopfschmerzen, niedriger Blutzucker und Hämoglobin im Urin mit Nierenversagen können auftreten. Komplikationen können spontane Blutungen, Koagulopathie und Schock sein. Malaria bei schwangeren Frauen ist eine wichtige Ursache für Totgeburten, Säuglingssterblichkeit, Abtreibung und geringes Geburtsgewicht, vor allem bei P. falciparum-Infektionen, aber auch bei P. vivax. ⓘ
Aufgrund des unterschiedlichen Verlaufs der Erkrankung kann zwischen der Malaria tropica, der Malaria tertiana und der Malaria quartana unterschieden werden. Die Malaria tropica ist dabei die schwerste Verlaufsform der Malaria. ⓘ
Ursache
Malaria wird durch eine Infektion mit Parasiten der Gattung Plasmodium verursacht. Beim Menschen wird die Malaria durch sechs Plasmodium-Arten verursacht: P. falciparum, P. malariae, P. ovale curtisi, P. ovale wallikeri, P. vivax und P. knowlesi. Unter den Infizierten ist P. falciparum die am häufigsten identifizierte Spezies (~75 %), gefolgt von P. vivax (~20 %). Obwohl P. falciparum traditionell für die meisten Todesfälle verantwortlich ist, deuten neuere Erkenntnisse darauf hin, dass P. vivax-Malaria etwa genauso häufig mit potenziell lebensbedrohlichen Zuständen in Verbindung gebracht wird wie die Diagnose einer P. falciparum-Infektion. P. vivax ist außerhalb Afrikas verhältnismäßig häufiger anzutreffen. Es gibt dokumentierte Infektionen des Menschen mit mehreren Plasmodium-Arten, die von höheren Affen stammen; mit Ausnahme von P. knowlesi, einer zoonotischen Art, die Malaria bei Makaken verursacht, sind diese jedoch meist von begrenzter Bedeutung für die öffentliche Gesundheit. ⓘ
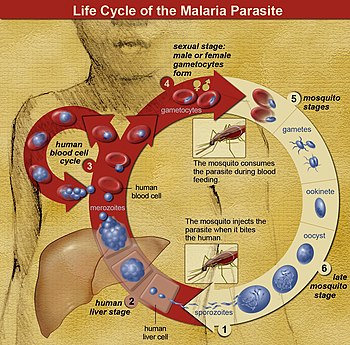
Die Parasiten werden in der Regel durch den Stich einer infizierten Anopheles-Mücke eingeschleppt. Diese eingeschleppten Parasiten, "Sporozoiten" genannt, folgen dem Blutstrom zur Leber, wo sie in die Hepatozyten eindringen. Sie wachsen und teilen sich in der Leber 2-10 Tage lang, wobei jeder infizierte Hepatozyt schließlich bis zu 40.000 Parasiten beherbergt. Die infizierten Hepatozyten brechen zusammen und geben diese invasive Form der Plasmodium-Zellen, die so genannten Merozoiten, in den Blutkreislauf ab. Im Blut dringen die Merozoiten schnell in einzelne rote Blutkörperchen ein und vermehren sich innerhalb von 24-72 Stunden zu 16-32 neuen Merozoiten. Die infizierte rote Blutzelle löst sich auf, und die neuen Merozoiten infizieren neue rote Blutzellen, was zu einem Zyklus führt, der die Anzahl der Parasiten in einer infizierten Person kontinuierlich erhöht. Es ist jedoch bekannt, dass der größte Teil der sich replizierenden Merozoiten-Biomasse von P. vivax (seit 2021) in der Milz und im Knochenmark (vielleicht auch anderswo) versteckt ist, was die wichtige, seit langem (seit 2011) bestehende, aber bisher ignorierte Theorie unterstützt, dass nicht zirkulierende Merozoiten die Quelle vieler P. vivax-Malaria-Rezidive sind (siehe Abschnitt "Rezidivierende Malaria" unten). Im Laufe dieses Infektionszyklus der roten Blutkörperchen im Blutkreislauf und anderswo vermehrt sich ein kleiner Teil der Parasiten nicht, sondern entwickelt sich stattdessen zu Parasiten im frühen Sexualstadium, den so genannten männlichen und weiblichen "Gametozyten". Diese Gametozyten entwickeln sich 11 Tage lang im Knochenmark und kehren dann in den Blutkreislauf zurück, um auf die Aufnahme durch den Stich einer anderen Mücke zu warten. In der Mücke vermehren sich die Gametozyten sexuell und bilden schließlich Tochtersporozoiten, die zu den Speicheldrüsen der Mücke wandern, um beim Stich in einen neuen Wirt injiziert zu werden. ⓘ
Die Infektion der Leber verursacht keine Symptome; alle Symptome der Malaria entstehen durch die Infektion der roten Blutkörperchen. Symptome treten auf, wenn mehr als 100.000 Parasiten pro Milliliter Blut vorhanden sind. Viele der mit schwerer Malaria verbundenen Symptome werden durch die Neigung von P. falciparum verursacht, sich an die Wände von Blutgefäßen zu binden, was zu einer Schädigung der betroffenen Gefäße und des umliegenden Gewebes führt. Parasiten, die sich in den Blutgefäßen der Lunge festsetzen, tragen zum Atemversagen bei. Im Gehirn tragen sie zum Koma bei. In der Plazenta tragen sie zu niedrigem Geburtsgewicht und vorzeitigen Wehen bei und erhöhen das Risiko von Aborten und Totgeburten. Die Zerstörung roter Blutkörperchen während der Infektion führt häufig zu Anämie, die durch die verminderte Produktion neuer roter Blutkörperchen während der Infektion noch verschlimmert wird. ⓘ
Nur weibliche Stechmücken ernähren sich von Blut; männliche Stechmücken ernähren sich von Pflanzennektar und übertragen die Krankheit nicht. Die Weibchen der Mückengattung Anopheles ernähren sich bevorzugt in der Nacht. Sie beginnen in der Regel in der Abenddämmerung mit der Suche nach einer Mahlzeit und suchen die ganze Nacht hindurch, bis sie erfolgreich sind. Malariaparasiten können auch durch Bluttransfusionen übertragen werden, was allerdings selten vorkommt. ⓘ
Wiederkehrende Malaria
Die Symptome der Malaria können nach unterschiedlichen symptomfreien Perioden wieder auftreten. Je nach Ursache kann ein Wiederauftreten entweder als Rezidiv, Rückfall oder Reinfektion bezeichnet werden. Ein Rezidiv liegt vor, wenn die Symptome nach einer symptomfreien Zeit wieder auftreten. Sie wird durch Parasiten verursacht, die aufgrund einer unzureichenden oder unwirksamen Behandlung im Blut überleben. Von einem Rückfall spricht man, wenn die Symptome wieder auftreten, nachdem die Parasiten aus dem Blut eliminiert wurden, aber als schlafende Hypnozoiten in den Leberzellen überlebt haben. Ein Rezidiv tritt in der Regel zwischen 8 und 24 Wochen auf und wird häufig bei P. vivax und P. ovale Infektionen beobachtet. Allerdings werden rezidivartige P. vivax-Rezidive wahrscheinlich zu sehr der Aktivierung von Hypnozoiten zugeschrieben. Einige von ihnen könnten einen extravaskulären oder sequestrierten Merozoiten-Ursprung haben, so dass es sich bei diesen Rezidiven um Rekrudeszenzen und nicht um Rückfälle handelt. Neu erkannte, nicht hypnozoitische Quellen, die möglicherweise zu einer rezidivierenden peripheren P. vivax-Parasitämie beitragen, sind erythrozytäre Formen im Knochenmark und in der Milz. Bei P.-vivax-Malaria-Fällen in gemäßigten Klimazonen überwintern häufig Hypnozoiten, wobei die Rückfälle im Jahr nach dem Mückenstich beginnen. Reinfektion bedeutet, dass der Parasit, der die frühere Infektion verursacht hat, aus dem Körper entfernt wurde, aber ein neuer Parasit eingeschleppt wurde. Eine Reinfektion lässt sich nicht ohne Weiteres von einem Rückfall unterscheiden, obwohl ein Wiederauftreten der Infektion innerhalb von zwei Wochen nach der Behandlung der Erstinfektion in der Regel auf ein Versagen der Behandlung zurückgeführt wird. Menschen können eine gewisse Immunität entwickeln, wenn sie häufigen Infektionen ausgesetzt sind. ⓘ
Pathophysiologie

Die Malariainfektion entwickelt sich über zwei Phasen: eine, die die Leber betrifft (exoerythrozytäre Phase), und eine, die die roten Blutkörperchen oder Erythrozyten betrifft (erythrozytäre Phase). Wenn eine infizierte Mücke die Haut eines Menschen durchsticht, um eine Blutmahlzeit zu sich zu nehmen, gelangen die Sporozoiten im Speichel der Mücke in den Blutkreislauf und wandern zur Leber, wo sie Hepatozyten infizieren und sich 8-30 Tage lang asexuell und asymptomatisch vermehren. ⓘ
Nach einer möglichen Ruhephase in der Leber differenzieren sich diese Organismen zu Tausenden von Merozoiten, die nach dem Zerreißen ihrer Wirtszellen in das Blut entweichen und rote Blutkörperchen infizieren, um das erythrozytäre Stadium des Lebenszyklus zu beginnen. Der Parasit entweicht unbemerkt aus der Leber, indem er sich in die Zellmembran der infizierten Wirtsleberzelle einhüllt. ⓘ
In den roten Blutkörperchen vermehren sich die Parasiten weiter, wiederum asexuell, und brechen in regelmäßigen Abständen aus ihren Wirtszellen aus, um in neue rote Blutkörperchen einzudringen. Es finden mehrere solcher Vermehrungszyklen statt. Die klassischen Beschreibungen von Fieberschüben beruhen daher auf gleichzeitigen Wellen von Merozoiten, die aus den roten Blutkörperchen entweichen und diese infizieren. ⓘ
Einige Sporozoiten von P. vivax entwickeln sich nicht sofort zu Merozoiten in der exoerythrozytären Phase, sondern produzieren Hypnozoiten, die über einen Zeitraum von mehreren Monaten (typisch sind 7-10 Monate) bis zu mehreren Jahren inaktiv bleiben. Nach einer Ruhephase werden sie reaktiviert und produzieren Merozoiten. Hypnozoiten sind für die lange Inkubationszeit und späte Rückfälle bei P. vivax-Infektionen verantwortlich, obwohl ihre Existenz bei P. ovale ungewiss ist. ⓘ
Der Parasit ist relativ gut vor dem Angriff des körpereigenen Immunsystems geschützt, da er sich während des größten Teils seines Lebenszyklus in der Leber und in Blutzellen aufhält und für die Immunüberwachung relativ unsichtbar ist. Allerdings werden zirkulierende infizierte Blutzellen in der Milz zerstört. Um diesem Schicksal zu entgehen, bildet der P. falciparum-Parasit auf der Oberfläche der infizierten Blutzellen adhäsive Proteine aus, die die Blutzellen dazu veranlassen, an den Wänden kleiner Blutgefäße zu haften, wodurch der Parasit an der Passage durch den allgemeinen Blutkreislauf und die Milz gehindert wird. Die Blockade der Mikrogefäße verursacht Symptome wie bei der Plazenta-Malaria. Abgesonderte rote Blutkörperchen können die Blut-Hirn-Schranke durchbrechen und zerebrale Malaria verursachen. ⓘ
Genetische Resistenz
Einem Bericht aus dem Jahr 2005 zufolge hat die Malaria aufgrund der hohen Mortalität und Morbidität, die sie verursacht - insbesondere die P. falciparum-Spezies -, den größten Selektionsdruck auf das menschliche Genom in der jüngeren Geschichte ausgeübt. Mehrere genetische Faktoren bieten eine gewisse Resistenz gegen Malaria, darunter Sichelzellanämie, Thalassämie, Glucose-6-Phosphat-Dehydrogenase-Mangel und das Fehlen von Duffy-Antigenen auf den roten Blutkörperchen. ⓘ
Die Auswirkungen der Sichelzellenanämie auf die Malariaimmunität veranschaulichen einige evolutionäre Kompromisse, die aufgrund der endemischen Malaria entstanden sind. Die Sichelzellenanämie verursacht eine Veränderung des Hämoglobinmoleküls im Blut. Normalerweise haben rote Blutkörperchen eine sehr flexible, bikonkave Form, die es ihnen ermöglicht, sich durch enge Kapillaren zu bewegen. Wenn die modifizierten Hämoglobin-S-Moleküle jedoch geringen Mengen an Sauerstoff ausgesetzt sind oder sich aufgrund von Dehydrierung zusammendrängen, können sie zusammenkleben und Stränge bilden, die dazu führen, dass sich die Zelle in eine gekrümmte Sichelform verzieht. In diesen Strängen kann das Molekül nicht so effektiv Sauerstoff aufnehmen oder abgeben, und die Zelle ist nicht flexibel genug, um frei zu zirkulieren. Im Frühstadium der Malaria kann der Parasit dafür sorgen, dass sich die infizierten Erythrozyten sicheln, so dass sie früher aus dem Verkehr gezogen werden. Dies verringert die Häufigkeit, mit der Malariaparasiten ihren Lebenszyklus in der Zelle vollenden. Homozygote Personen (mit zwei Kopien des abnormen Hämoglobin-Beta-Allels) leiden an Sichelzellenanämie, während heterozygote Personen (mit einem abnormen Allel und einem normalen Allel) eine Resistenz gegen Malaria aufweisen, ohne dass es zu schwerer Anämie kommt. Obwohl die kürzere Lebenserwartung der homozygoten Form eher gegen das Überleben des Merkmals spricht, bleibt das Merkmal in malariagefährdeten Regionen aufgrund der Vorteile der heterozygoten Form erhalten. ⓘ
Leberfunktionsstörung
Leberfunktionsstörungen als Folge von Malaria sind selten und treten in der Regel nur bei Menschen mit einer anderen Lebererkrankung wie Virushepatitis oder chronischer Lebererkrankung auf. Das Syndrom wird manchmal als Malaria-Hepatitis bezeichnet. Während es bisher als seltene Erscheinung galt, hat die malariabedingte Hepatopathie vor allem in Südostasien und Indien zugenommen. Die Beeinträchtigung der Leber von Menschen mit Malaria geht mit einer höheren Wahrscheinlichkeit von Komplikationen und Tod einher. ⓘ
Diagnose
Da die Malaria-Symptome unspezifisch sind, wird die Diagnose in der Regel anhand der Symptome und der Reisegeschichte vermutet und dann durch einen parasitologischen Test bestätigt. In Gebieten, in denen Malaria häufig vorkommt, empfiehlt die Weltgesundheitsorganisation (WHO) Ärzten, bei jeder Person, die über Fieber oder eine aktuelle Temperatur von über 37,5 °C ohne offensichtliche Ursache berichtet, Malaria zu vermuten. Ebenso sollte bei Kindern mit Anzeichen von Anämie Malaria vermutet werden: blasse Handflächen oder ein Labortest, der einen Hämoglobinwert von unter 8 Gramm pro Deziliter Blut ergibt. In Gebieten mit wenig oder gar keiner Malaria empfiehlt die WHO, nur Personen zu testen, die möglicherweise mit Malaria in Berührung gekommen sind (typischerweise bei Reisen in ein Malaria-endemisches Gebiet) und unerklärliches Fieber haben. ⓘ
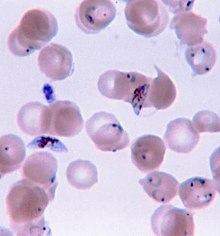
Malaria wird in der Regel durch die mikroskopische Untersuchung von Blutfilmen oder durch antigenbasierte Schnelltests (RDT) bestätigt. Die Mikroskopie - d. h. die Untersuchung von Giemsa-gefärbtem Blut mit einem Lichtmikroskop - ist der Goldstandard für die Malariadiagnose. Mikroskopiker untersuchen in der Regel sowohl einen "dicken Film" von Blut, der es ihnen ermöglicht, viele Blutzellen in kurzer Zeit zu untersuchen, als auch einen "dünnen Film" von Blut, der es ihnen ermöglicht, einzelne Parasiten deutlich zu sehen und die infizierende Plasmodium-Art zu identifizieren. Unter typischen Feldlaborbedingungen kann ein Mikroskopiker Parasiten nachweisen, wenn mindestens 100 Parasiten pro Mikroliter Blut vorhanden sind, was in etwa dem unteren Bereich einer symptomatischen Infektion entspricht. Die mikroskopische Diagnose ist relativ ressourcenintensiv und erfordert geschultes Personal, spezielle Geräte, Strom und einen ständigen Vorrat an Objektträgern und Färbemitteln. ⓘ
An Orten, an denen die Mikroskopie nicht zur Verfügung steht, wird Malaria mit RDTs, Antigen-Schnelltests, diagnostiziert, die Parasitenproteine in einer Blutprobe mit dem Finger nachweisen. Im Handel sind verschiedene RDTs erhältlich, die auf die Parasitenproteine Histidinreiches Protein 2 (HRP2, erkennt nur P. falciparum), Laktatdehydrogenase oder Aldolase abzielen. Der HRP2-Test ist in Afrika, wo P. falciparum vorherrscht, weit verbreitet. Da HRP2 jedoch bis zu fünf Wochen nach der Behandlung einer Infektion im Blut verbleibt, kann ein HRP2-Test manchmal nicht unterscheiden, ob jemand aktuell an Malaria erkrankt ist oder früher daran gelitten hat. Außerdem fehlt einigen P. falciparum-Parasiten in der Amazonasregion das HRP2-Gen, was den Nachweis erschwert. RDTs sind schnell und können leicht an Orten eingesetzt werden, an denen es keine vollständigen Diagnoselabors gibt. Sie liefern jedoch wesentlich weniger Informationen als die Mikroskopie und variieren manchmal in der Qualität von Hersteller zu Hersteller und von Charge zu Charge. ⓘ
Serologische Tests zum Nachweis von Antikörpern gegen Plasmodium im Blut wurden entwickelt, werden aber wegen ihrer relativ geringen Empfindlichkeit und Spezifität nicht zur Malariadiagnose eingesetzt. Es wurden hochempfindliche Nukleinsäure-Amplifikationstests entwickelt, die jedoch aufgrund ihrer relativ hohen Kosten und ihrer geringen Spezifität für aktive Infektionen nicht klinisch eingesetzt werden. ⓘ
Zu den vor einer Therapie hilfreichen Informationen gehören Angaben zum Reiseland, zu einer bestehenden Prophylaxe sowie Vorerkrankungen. Die Diagnose Malaria sollte mit Hilfe labordiagnostischer Methoden zur parasitologischen Speziesdifferenzierung und Bestimmung der Parasitenzahl abgesichert werden. Die in der Praxis wichtigste und kostengünstigste Methode bei Malariaverdacht ist die mikroskopische Untersuchung von normalen Blutausstrichen (Dünner Tropfen) und dem bis zu 10-fach angereicherten Dicken Tropfen unter Verwendung der Giemsa-Färbung auf Plasmodien. Eine Differenzierung der vier Plasmodien ist anhand morphologischer Kriterien möglich (siehe Maurersche Fleckung oder Schüffnersche Tüpfelung). Die ermittelte Parasiten- und Leukozytenzahl ist ein Maß der Schwere der Erkrankung. Ein negatives Ergebnis der mikroskopischen Untersuchung kann aufgrund der geringen Sensitivität dieser Methode eine Malaria jedoch nicht ausschließen. ⓘ

Auch allgemeine Untersuchungen gehören gegebenenfalls zur Diagnostik (Labor zur Bestimmung von Blutbild, Leber- und Nierenfunktion, Blutgasanalyse, Beurteilung der Lunge mit einem Röntgenbild und der Milz durch Ultraschall sowie ein EKG). ⓘ
Klassifizierung
Malaria wird von der Weltgesundheitsorganisation (WHO) in "schwer" und "unkompliziert" eingeteilt. Eine Malaria gilt als schwer, wenn eines der folgenden Kriterien zutrifft, andernfalls wird sie als unkompliziert eingestuft.
- Vermindertes Bewusstsein
- Erhebliche Schwäche, so dass die Person nicht mehr gehen kann
- Unfähigkeit zur Nahrungsaufnahme
- Zwei oder mehr Krämpfe
- Niedriger Blutdruck (weniger als 70 mmHg bei Erwachsenen und 50 mmHg bei Kindern)
- Atemprobleme
- Kreislaufschock
- Nierenversagen oder Hämoglobin im Urin
- Blutungsprobleme oder ein Hämoglobinwert von weniger als 50 g/L (5 g/dL)
- Lungenödem
- Blutzucker weniger als 2,2 mmol/L (40 mg/dL)
- Azidose oder Laktatwerte von mehr als 5 mmol/L
- Ein Parasitenspiegel im Blut von mehr als 100.000 pro Mikroliter (μL) in Gebieten mit geringer Übertragungsintensität oder 250.000 pro μL in Gebieten mit hoher Übertragungsintensität ⓘ
Zerebrale Malaria ist definiert als eine schwere P. falciparum-Malaria mit neurologischen Symptomen, einschließlich Koma (mit einer Glasgow-Koma-Skala von weniger als 11 oder einer Blantyre-Koma-Skala von weniger als 3), oder mit einem Koma, das nach einem Anfall länger als 30 Minuten andauert. ⓘ
Vorbeugung

Zu den Methoden zur Vorbeugung von Malaria gehören Medikamente, die Eliminierung der Mücken und die Vermeidung von Stichen. Ab 2020 gibt es einen Impfstoff gegen Malaria (RTS,S), der zur Verwendung zugelassen ist. Das Auftreten von Malaria in einem Gebiet erfordert eine Kombination aus hoher menschlicher Bevölkerungsdichte, hoher Anopheles-Mücken-Populationsdichte und hohen Übertragungsraten von Menschen auf Mücken und von Mücken auf Menschen. Wenn eine dieser Bedingungen ausreichend gesenkt wird, verschwindet der Parasit schließlich aus dem betreffenden Gebiet, wie es in Nordamerika, Europa und Teilen des Nahen Ostens geschehen ist. Wenn der Parasit jedoch nicht auf der ganzen Welt ausgerottet wird, könnte er sich wieder ansiedeln, wenn die Bedingungen wieder zu einer Kombination zurückkehren, die die Vermehrung des Parasiten begünstigt. Außerdem steigen die Kosten pro Person für die Beseitigung von Anopheles-Mücken mit abnehmender Bevölkerungsdichte, so dass sie in einigen Gebieten wirtschaftlich nicht tragbar ist. ⓘ
Die Vorbeugung von Malaria mag langfristig kosteneffizienter sein als die Behandlung der Krankheit, aber die erforderlichen Anfangskosten sind für viele der ärmsten Menschen der Welt unerschwinglich. Die Kosten für Kontroll- (d. h. für die Aufrechterhaltung einer niedrigen Endemie) und Eliminierungsprogramme sind von Land zu Land sehr unterschiedlich. In China beispielsweise - dessen Regierung 2010 eine Strategie zur Eliminierung von Malaria in den chinesischen Provinzen ankündigte - machen die erforderlichen Investitionen nur einen kleinen Teil der öffentlichen Gesundheitsausgaben aus. Im Gegensatz dazu würde ein ähnliches Programm in Tansania schätzungsweise ein Fünftel des öffentlichen Gesundheitsbudgets kosten. ⓘ
In Gebieten, in denen Malaria weit verbreitet ist, leiden Kinder unter fünf Jahren häufig an Anämie, die manchmal auf Malaria zurückzuführen ist. Die vorbeugende Verabreichung von Malariamedikamenten an Kinder mit Anämie in diesen Gebieten verbessert zwar die Anzahl der roten Blutkörperchen geringfügig, hat aber keinen Einfluss auf das Sterberisiko oder die Notwendigkeit eines Krankenhausaufenthalts. ⓘ
Mückenkontrolle

Die Vektorkontrolle bezieht sich auf Methoden zur Verringerung der Malaria, indem die Übertragungsrate durch Moskitos reduziert wird. Zum individuellen Schutz sind die wirksamsten Insektenschutzmittel auf der Basis von DEET oder Picaridin. Es gibt jedoch keine ausreichenden Beweise dafür, dass Mückenschutzmittel eine Malariainfektion verhindern können. Mit Insektiziden behandelte Netze (ITNs) und das Besprühen von Innenräumen (IRS) sind wirksam, werden häufig zur Malariaprophylaxe eingesetzt und haben wesentlich zum Rückgang der Malaria im 21. Jahrhundert beigetragen hat. ITN und IRS reichen möglicherweise nicht aus, um die Krankheit zu eliminieren, da diese Maßnahmen davon abhängen, wie viele Menschen Netze verwenden, wie viele Lücken in der Insektizidversorgung bestehen (Gebiete mit geringer Abdeckung), ob die Menschen außerhalb des Hauses nicht geschützt sind und ob es eine Zunahme von Moskitos gibt, die gegen Insektizide resistent sind. Eine wichtige langfristige Präventionsmaßnahme können Veränderungen an den Häusern der Menschen sein, um die Exposition gegenüber Stechmücken zu verhindern. ⓘ

Mit Insektiziden behandelte Netze

Moskitonetze halten Moskitos von Menschen fern und verringern die Infektionsraten und die Übertragung von Malaria. Netze sind keine perfekte Barriere und werden häufig mit einem Insektizid behandelt, das die Mücken abtötet, bevor sie Zeit haben, das Netz zu überwinden. Mit Insektiziden behandelte Netze (ITN) sind schätzungsweise doppelt so wirksam wie unbehandelte Netze und bieten im Vergleich zu Netzen ohne Behandlung einen Schutz von über 70 %. Zwischen 2000 und 2008 rettete die Verwendung von ITNs das Leben von schätzungsweise 250.000 Säuglingen in Afrika südlich der Sahara. Etwa 13 % der Haushalte in den Ländern südlich der Sahara besaßen 2007 ein ITN, und Schätzungen zufolge besaßen 31 % der afrikanischen Haushalte 2008 mindestens ein ITN. Im Jahr 2000 waren 1,7 Millionen (1,8 %) der afrikanischen Kinder, die in Gebieten leben, in denen Malaria verbreitet ist, durch ein ITN geschützt. Diese Zahl stieg bis 2007 auf 20,3 Millionen (18,5 %) afrikanische Kinder, die ein ITN benutzten, wobei 89,6 Millionen Kinder ungeschützt blieben, und bis 2015 auf 68 % afrikanische Kinder, die Moskitonetze benutzten. Die meisten Netze sind mit Pyrethroiden imprägniert, einer Klasse von Insektiziden mit geringer Toxizität. Sie sind am wirksamsten, wenn sie von der Abenddämmerung bis zur Morgendämmerung eingesetzt werden. Es wird empfohlen, ein großes "Bettnetz" über der Mitte des Bettes aufzuhängen und die Ränder entweder unter die Matratze zu stecken oder darauf zu achten, dass es groß genug ist, damit es den Boden berührt. In den Malariagebieten Afrikas wirken sich ITNs positiv auf die Schwangerschaftsergebnisse aus, in Asien und Lateinamerika sind jedoch weitere Daten erforderlich. ⓘ
In Gebieten mit hoher Malariaresistenz kann Piperonylbutoxid (PBO) in Kombination mit Pyrethroiden in Moskitonetzen die Malariainfektionsrate wirksam senken. Fragen zur Haltbarkeit von PBO auf Netzen bleiben offen, da die Wirkung auf die Mückensterblichkeit in experimentellen Versuchen nach zwanzig Wäschen nicht aufrechterhalten wurde. ⓘ
Sprühen mit Rückständen in Innenräumen
Beim Residualsprühen in Innenräumen werden Insektizide an die Wände eines Hauses gesprüht. Nach der Nahrungsaufnahme ruhen sich viele Mücken auf einer nahe gelegenen Oberfläche aus, während sie die Blutmahlzeit verdauen. Wenn die Hauswände mit Insektiziden bestrichen werden, können die ruhenden Mücken getötet werden, bevor sie eine andere Person stechen und den Malariaparasiten übertragen können. Seit 2006 empfiehlt die Weltgesundheitsorganisation 12 Insektizide für IRS-Maßnahmen, darunter DDT und die Pyrethroide Cyfluthrin und Deltamethrin. Diese Verwendung geringer Mengen von DDT für die öffentliche Gesundheit ist im Rahmen des Stockholmer Übereinkommens zulässig, das die Verwendung in der Landwirtschaft verbietet. Ein Problem bei allen Formen von IRS ist die Insektizidresistenz. Mücken, die von IRS betroffen sind, halten sich in der Regel in geschlossenen Räumen auf, und aufgrund der durch das Sprühen verursachten Irritationen halten sich ihre Nachkommen in der Regel im Freien auf, so dass sie von IRS weniger betroffen sind. In Gemeinden, die mit Insektiziden behandelte Netze verwenden und zusätzlich Innenräume mit "nicht-pyrethroidähnlichen" Insektiziden besprühen, wurde ein entsprechender Rückgang der Malaria festgestellt. Auch die Verwendung von pyrethroidähnlichen Insektiziden zusätzlich zum Besprühen von Innenräumen führte in Gemeinden, die mit Insektiziden behandelte Netze verwendeten, nicht zu einem nachweisbaren zusätzlichen Nutzen. ⓘ
Änderungen der Wohnverhältnisse
Die Wohnverhältnisse sind ein Risikofaktor für Malaria, und die Veränderung der Wohnverhältnisse als Präventionsmaßnahme kann eine nachhaltige Strategie sein, die nicht von der Wirksamkeit von Insektiziden wie Pyrethroiden abhängt. Die physische Umgebung innerhalb und außerhalb des Hauses, die die Mückendichte erhöhen kann, ist zu berücksichtigen. Beispiele für mögliche Veränderungen sind die Nähe des Hauses zu Mückenbrutstätten, die Entwässerung und die Wasserversorgung in der Nähe des Hauses, die Verfügbarkeit von Mückenrastplätzen (Vegetation rund um das Haus), die Nähe zu Vieh und Haustieren sowie bauliche Verbesserungen oder Veränderungen an der Konstruktion des Hauses, die das Eindringen von Mücken verhindern. ⓘ
Andere Methoden der Stechmückenbekämpfung
Die Menschen haben eine Reihe anderer Methoden ausprobiert, um Mückenstiche zu reduzieren und die Ausbreitung von Malaria zu verlangsamen. Bemühungen, die Zahl der Mückenlarven zu verringern, indem die Verfügbarkeit von offenem Wasser, in dem sie sich entwickeln, verringert wird, oder indem Substanzen zugesetzt werden, die ihre Entwicklung hemmen, sind an einigen Orten wirksam. Elektronische Mückenschutzgeräte, die hochfrequente Töne erzeugen, die weibliche Stechmücken fernhalten sollen, haben keine Belege für ihre Wirksamkeit. Mit geringer Sicherheit gibt es Hinweise darauf, dass die Vernebelung eine Auswirkung auf die Malariaübertragung haben könnte. Larvizidierung durch manuelle Verabreichung von chemischen oder mikrobiellen Insektiziden in Gewässern mit geringer Larvenverteilung kann die Malariaübertragung verringern. Es gibt keine ausreichenden Belege dafür, ob larvenfressende Fische die Mückendichte und die Übertragung in dem Gebiet verringern können. ⓘ
Medikamente
Es gibt eine Reihe von Medikamenten, die dazu beitragen können, Malaria bei Reisenden in Gebiete, in denen die Infektion häufig auftritt, zu verhindern oder zu unterbrechen. Viele dieser Medikamente werden auch zur Behandlung eingesetzt. An Orten, an denen Plasmodium gegen ein oder mehrere Medikamente resistent ist, werden drei Medikamente - Mefloquin, Doxycyclin oder die Kombination Atovaquon/Proguanil (Malarone) - häufig zur Prävention eingesetzt. Doxycyclin und Atovaquon/Proguanil sind besser verträglich, während Mefloquin einmal pro Woche eingenommen wird. Gebiete auf der Welt mit chloroquinempfindlicher Malaria sind selten. Die gleichzeitige Verabreichung von Malariamitteln an die gesamte Bevölkerung kann das Risiko, an Malaria zu erkranken, verringern, wobei die Wirksamkeit der Massenverabreichung von Medikamenten jedoch von der Prävalenz der Malaria in dem betreffenden Gebiet abhängt. Andere Faktoren wie die Verabreichung von Medikamenten in Verbindung mit anderen Schutzmaßnahmen wie der Bekämpfung von Moskitos, der Anteil der behandelten Personen in dem Gebiet und das Risiko einer Reinfektion mit Malaria können bei der Wirksamkeit von Massenbehandlungskonzepten eine Rolle spielen. ⓘ
Die Schutzwirkung setzt nicht sofort ein, und Menschen, die Gebiete besuchen, in denen Malaria vorkommt, beginnen in der Regel ein bis zwei Wochen vor ihrer Ankunft mit der Einnahme der Medikamente und setzen sie bis vier Wochen nach ihrer Abreise fort (mit Ausnahme von Atovaquon/Proguanil, das nur zwei Tage vor der Abreise begonnen und danach sieben Tage lang weiter eingenommen werden muss). Für Menschen, die in Gebieten leben, in denen Malaria vorkommt, ist die Einnahme von Präventivmitteln oft nicht praktikabel. Der Grund dafür sind die Kosten der Medikamente, die Nebenwirkungen bei Langzeitanwendung und die Schwierigkeit, außerhalb der reichen Länder Malariamittel zu erhalten. Es hat sich gezeigt, dass Medikamente zur Malariaprophylaxe während der Schwangerschaft das Gewicht des Babys bei der Geburt verbessern und das Risiko einer Anämie bei der Mutter verringern. Der Einsatz von Malariamedikamenten in Gebieten, in denen Malariamücken vorkommen, kann die Entwicklung einer Teilresistenz fördern. ⓘ
Die Verabreichung von Malariamedikamenten an Säuglinge im Rahmen einer intermittierenden präventiven Therapie kann das Risiko einer Malariainfektion, einer Krankenhauseinweisung und einer Blutarmut verringern. ⓘ
Mefloquin ist wirksamer als Sulfadoxin-Pyrimethamin bei der Malariaprophylaxe für HIV-negative Schwangere. Cotrimoxazol ist wirksam bei der Vorbeugung von Malariainfektionen und verringert das Risiko einer Anämie bei HIV-positiven Frauen. Die Verabreichung von Sulfadoxin-Pyrimethamin über drei oder mehr Dosen als intermittierende präventive Therapie ist für HIV-positive Frauen, die in Malaria-endemischen Gebieten leben, besser als zwei Dosen. ⓘ
Die sofortige Behandlung von bestätigten Fällen mit Artemisinin-basierten Kombinationstherapien (ACT) kann die Übertragung ebenfalls verringern. ⓘ
Andere
Die Beteiligung der Gemeinschaft und Strategien zur Gesundheitserziehung, die das Bewusstsein für Malaria und die Bedeutung von Kontrollmaßnahmen fördern, wurden erfolgreich eingesetzt, um die Häufigkeit von Malaria in einigen Gebieten der Entwicklungsländer zu verringern. Das Erkennen der Krankheit im Frühstadium kann verhindern, dass sie tödlich verläuft. Durch Aufklärung können die Menschen auch dazu gebracht werden, Bereiche mit stehendem Wasser, wie z. B. Wassertanks, die ideale Brutstätten für Parasiten und Mücken sind, abzudecken und so das Risiko einer Übertragung zwischen Menschen zu verringern. Dies wird in der Regel in städtischen Gebieten angewandt, in denen es große Bevölkerungszentren auf engem Raum gibt und eine Übertragung in diesen Gebieten am wahrscheinlichsten ist. Die intermittierende präventive Therapie ist eine weitere Maßnahme, die erfolgreich zur Kontrolle von Malaria bei Schwangeren und Säuglingen sowie bei Kindern im Vorschulalter eingesetzt wird, wo die Übertragung saisonal erfolgt. ⓘ
Behandlung
Malaria wird mit Malariamedikamenten behandelt; welche davon eingesetzt werden, hängt von der Art und dem Schweregrad der Krankheit ab. Medikamente gegen Fieber werden zwar häufig eingesetzt, ihre Auswirkungen auf die Ergebnisse sind jedoch unklar. Die kostenlose Abgabe von Malariamitteln an Haushalte kann die Zahl der Todesfälle im Kindesalter verringern, wenn sie richtig eingesetzt wird. Programme, bei denen präsumtiv alle Fieberursachen mit Malariamitteln behandelt werden, können zu einem übermäßigen Einsatz von Malariamitteln und einer Unterbehandlung anderer Fieberursachen führen. Der Einsatz von Malaria-Schnelldiagnosekits kann jedoch dazu beitragen, den übermäßigen Einsatz von Malariamitteln zu verringern. ⓘ
Unkomplizierte Malaria
Einfache oder unkomplizierte Malaria kann mit oralen Medikamenten behandelt werden. Artemisinin-Medikamente sind bei der Behandlung unkomplizierter Malaria wirksam und sicher. Artemisinin in Kombination mit anderen Antimalariamitteln (bekannt als Artemisinin-Kombinationstherapie oder ACT) ist zu etwa 90 % wirksam, wenn es zur Behandlung unkomplizierter Malaria eingesetzt wird. Die wirksamste Behandlung der P. falciparum-Infektion ist die ACT, die die Resistenz gegen jede einzelne Medikamentenkomponente verringert. Artemether-Lumefantrin (Sechs-Dosen-Schema) ist bei der Behandlung der Falciparum-Malaria wirksamer als Artemether-Lumefantrin (Vier-Dosen-Schema) oder andere Schemata, die keine Artemisinin-Derivate enthalten. Eine weitere empfohlene Kombination ist Dihydroartemisinin und Piperaquin. Die Artemisinin-Naphthoquin-Kombinationstherapie hat bei der Behandlung der Falciparum-Malaria vielversprechende Ergebnisse gezeigt. Es sind jedoch weitere Forschungsarbeiten erforderlich, um ihre Wirksamkeit als zuverlässige Behandlung zu belegen. Artesunat plus Mefloquin schneidet bei der Behandlung der unkomplizierten Falciparum-Malaria in Gebieten mit geringer Übertragung besser ab als Mefloquin allein. Atovaquon-Proguanil ist wirksam gegen unkomplizierte Falciparum-Malaria mit einer möglichen Versagerquote von 5 % bis 10 %; die Zugabe von Artesunat kann die Versagerquote verringern. Die Mono- oder Kombinationstherapie mit Azithromycin hat sich bei der Behandlung von Plasmodium- oder Vivax-Malaria nicht als wirksam erwiesen. Amodiaquin plus Sulfadoxin-Pyrimethamin kann im Vergleich zu Sulfadoxin-Pyrimethamin allein bei unkomplizierter Falciparum-Malaria zu weniger Behandlungsfehlern führen. Zu Chlorproguanil-Dapson liegen keine ausreichenden Daten für die Behandlung der unkomplizierten Falciparum-Malaria vor. Die Zugabe von Primaquin zu einer Kombinationstherapie auf Artemisinin-Basis bei Falciparum-Malaria reduziert die Übertragung am Tag 3-4 und am Tag 8 der Infektion. Sulfadoxin-Pyrimethamin plus Artesunat ist besser als Sulfadoxin-Pyrimethamin plus Amodiaquin bei der Kontrolle von Behandlungsversagen am Tag 28. Letzteres ist jedoch bei der Reduzierung der Gametozyten im Blut am Tag 7 besser als ersteres. ⓘ
Eine Infektion mit P. vivax, P. ovale oder P. malariae erfordert in der Regel keinen Krankenhausaufenthalt. Die Behandlung von P. vivax erfordert sowohl die Behandlung der Blutstadien (mit Chloroquin oder einer Kombinationstherapie auf Artemisinin-Basis) als auch die Beseitigung der Leberformen mit einem 8-Aminochinolin-Wirkstoff wie Primaquin oder Tafenoquin. ⓘ
Zur Behandlung der Malaria während der Schwangerschaft empfiehlt die WHO die Verwendung von Chinin plus Clindamycin zu Beginn der Schwangerschaft (1. Trimester) und ACT in späteren Stadien (2. und 3. Trimester). Es gibt nur begrenzte Daten zur Sicherheit von Malariamitteln in der Schwangerschaft. ⓘ
Schwere und komplizierte Malaria
Fälle von schwerer und komplizierter Malaria werden fast immer durch eine Infektion mit P. falciparum verursacht. Die anderen Arten verursachen in der Regel nur fiebrige Erkrankungen. Schwere und komplizierte Malariafälle sind medizinische Notfälle, da die Sterblichkeitsrate hoch ist (10 bis 50 %). ⓘ
Die empfohlene Behandlung für schwere Malaria ist die intravenöse Verabreichung von Malariamitteln. Bei schwerer Malaria war parenterales Artesunat sowohl bei Kindern als auch bei Erwachsenen besser als Chinin. In einer anderen systematischen Überprüfung erwiesen sich Artemisinin-Derivate (Artemether und Arteether) als ebenso wirksam wie Chinin bei der Behandlung der zerebralen Malaria bei Kindern. Die Behandlung von schwerer Malaria umfasst unterstützende Maßnahmen, die am besten auf einer Intensivstation durchgeführt werden. Dazu gehört die Behandlung von hohem Fieber und den daraus resultierenden Krampfanfällen. Dazu gehört auch die Überwachung von Atemnot, niedrigem Blutzucker und niedrigem Kaliumspiegel im Blut. Artemisinin-Derivate haben die gleiche oder eine bessere Wirksamkeit als Chinolone, wenn es darum geht, Todesfälle bei schwerer oder komplizierter Malaria zu verhindern. Eine Chinin-Ladedosis hilft, die Dauer des Fiebers zu verkürzen, und erhöht die Ausscheidung der Parasiten aus dem Körper. Es gibt keinen Unterschied in der Wirksamkeit von intrarektalem Chinin im Vergleich zu intravenösem oder intramuskulärem Chinin bei der Behandlung unkomplizierter/komplizierter Falciparum-Malaria. Für intramuskuläres Arteether zur Behandlung schwerer Malaria gibt es keine ausreichenden Belege. Die Verabreichung von rektalem Artesunat vor der Verlegung ins Krankenhaus kann die Sterblichkeitsrate bei Kindern mit schwerer Malaria verringern. ⓘ
Die zerebrale Malaria ist die Form der schweren und komplizierten Malaria mit den schwersten neurologischen Symptomen. Es gibt keine ausreichenden Daten darüber, ob osmotische Mittel wie Mannitol oder Harnstoff bei der Behandlung der zerebralen Malaria wirksam sind. Die routinemäßige Verabreichung von Phenobarbiton bei zerebraler Malaria ist mit weniger Krämpfen, aber möglicherweise mit mehr Todesfällen verbunden. Es gibt keine Hinweise darauf, dass Steroide bei zerebraler Malaria einen Behandlungsvorteil bringen. ⓘ
Umgang mit zerebraler Malaria ⓘ
Zerebrale Malaria führt in der Regel zu einem Koma. Wenn die Ursache des Komas zweifelhaft ist, sollte auf andere lokal vorherrschende Ursachen der Enzephalopathie (bakterielle, virale oder Pilzinfektion) getestet werden. In Gebieten, in denen eine hohe Prävalenz von Malaria-Infektionen besteht (z. B. in tropischen Regionen), kann die Behandlung ohne vorherige Tests beginnen. Zur Behandlung einer bestätigten zerebralen Malaria kann Folgendes getan werden:
- Patienten im Koma sollten sorgfältig gepflegt werden (Überwachung der Vitalzeichen, Umdrehen des Patienten alle 2 Stunden, Vermeiden eines nassen Bettes usw.)
- Zur Unterstützung des Wasserlassens sollte ein steriler Harnröhrenkatheter eingeführt werden.
- Zum Absaugen des Mageninhalts sollte eine sterile nasogastrale Sonde gelegt werden.
- Im Falle von Krämpfen wird eine langsame intravenöse Injektion eines Benzodiazepins verabreicht. ⓘ
Es gibt keine ausreichenden Belege dafür, dass Bluttransfusionen die Sterblichkeit von Kindern mit schwerer Anämie verringern oder ihren Hämatokritwert innerhalb eines Monats verbessern. Es gibt keine ausreichenden Belege dafür, dass Eisenchelatbildner wie Deferoxamin und Deferipron die Ergebnisse bei Malaria falciparum-Infektionen verbessern. ⓘ
Resistenz
Arzneimittelresistenz stellt ein wachsendes Problem bei der Malariabehandlung im 21. Jahrhundert dar. In den 2000er Jahren (Jahrzehnt) trat in Südostasien eine Malaria mit teilweiser Resistenz gegen Artemisine auf. Inzwischen sind Resistenzen gegen alle Klassen von Malariamitteln außer den Artemisininen üblich. Die Behandlung resistenter Stämme wurde zunehmend von dieser Medikamentenklasse abhängig. Die Kosten der Artemisinine schränken deren Einsatz in den Entwicklungsländern ein. Malariastämme, die an der Grenze zwischen Kambodscha und Thailand vorkommen, sind gegen Kombinationstherapien mit Artemisininen resistent und daher möglicherweise unbehandelbar. Da die Parasitenpopulation über 30 Jahre lang Artemisinin-Monotherapien in subtherapeutischen Dosen ausgesetzt war und minderwertige Artemisinine zur Verfügung standen, wurde die Selektion des resistenten Phänotyps wahrscheinlich gefördert. Eine Resistenz gegen Artemisinin wurde in Kambodscha, Myanmar, Thailand und Vietnam festgestellt, und auch in Laos ist eine Resistenzentwicklung zu beobachten. Die Resistenz gegen die Kombination von Artemisinin und Piperaquin wurde erstmals 2013 in Kambodscha festgestellt und hatte sich bis 2019 in ganz Kambodscha sowie in Laos, Thailand und Vietnam ausgebreitet (in einigen Regionen waren bis zu 80 Prozent der Malariaparasiten resistent). ⓘ
Es gibt keine ausreichenden Belege dafür, dass einheitlich verpackte Malariamittel Behandlungsfehler bei Malariainfektionen verhindern. Wenn sie jedoch durch die Schulung von Gesundheitsdienstleistern und die Information der Patienten unterstützt werden, verbessert sich die Therapietreue der Patienten. ⓘ
Prognose

Bei ordnungsgemäßer Behandlung können Menschen mit Malaria in der Regel eine vollständige Genesung erwarten. Eine schwere Malaria kann jedoch extrem schnell fortschreiten und innerhalb von Stunden oder Tagen zum Tod führen. In den schwersten Fällen der Krankheit kann die Sterblichkeitsrate selbst bei intensiver Pflege und Behandlung bis zu 20 % betragen. Längerfristig sind bei Kindern, die an schwerer Malaria erkrankt sind, Entwicklungsbeeinträchtigungen nachgewiesen worden. Eine chronische Infektion ohne schwere Erkrankung kann zu einem Immunschwächesyndrom führen, das mit einer verminderten Reaktionsfähigkeit auf Salmonellenbakterien und das Epstein-Barr-Virus einhergeht. ⓘ
In der Kindheit führt Malaria zu Blutarmut während einer Phase der raschen Gehirnentwicklung sowie zu direkten Hirnschäden infolge von zerebraler Malaria. Einige Überlebende der zerebralen Malaria haben ein erhöhtes Risiko für neurologische und kognitive Defizite, Verhaltensstörungen und Epilepsie. In klinischen Studien wurde gezeigt, dass eine Malariaprophylaxe im Vergleich zu Placebogruppen die kognitiven Funktionen und die schulischen Leistungen verbessert. ⓘ
Epidemiologie

Die WHO schätzt, dass es 2019 229 Millionen neue Malariafälle mit 409.000 Todesfällen geben wird. Kinder unter 5 Jahren sind am stärksten betroffen, auf sie entfallen 67 % der weltweiten Malaria-Todesfälle im Jahr 2019. Etwa 125 Millionen schwangere Frauen sind jedes Jahr dem Risiko einer Infektion ausgesetzt; in Afrika südlich der Sahara wird die Malaria bei Müttern mit bis zu 200.000 geschätzten Todesfällen bei Säuglingen pro Jahr in Verbindung gebracht. In Westeuropa gibt es etwa 10.000 Malariafälle pro Jahr, in den Vereinigten Staaten 1300-1500. In den Vereinigten Staaten wurde die Malaria 1951 als großes Problem für die öffentliche Gesundheit ausgerottet, obwohl immer wieder kleinere Ausbrüche auftreten. In Europa starben zwischen 1993 und 2003 etwa 900 Menschen an der Krankheit. Sowohl die weltweite Inzidenz der Krankheit als auch die daraus resultierende Sterblichkeit sind in den letzten Jahren zurückgegangen. Nach Angaben von WHO und UNICEF ist die Zahl der auf Malaria zurückzuführenden Todesfälle im Jahr 2015 gegenüber einer Schätzung aus dem Jahr 2000 (985 000) um 60 % zurückgegangen, was vor allem auf den weit verbreiteten Einsatz von mit Insektiziden behandelten Netzen und Kombinationstherapien auf Artemisinin-Basis zurückzuführen ist. Im Jahr 2012 gab es 207 Millionen Malariafälle. In diesem Jahr starben schätzungsweise zwischen 473.000 und 789.000 Menschen an der Krankheit, viele davon waren Kinder in Afrika. Die Bemühungen um eine Eindämmung der Krankheit in Afrika seit dem Jahr 2000 waren teilweise erfolgreich, da die Erkrankungsrate auf dem Kontinent um schätzungsweise vierzig Prozent zurückgegangen ist. ⓘ
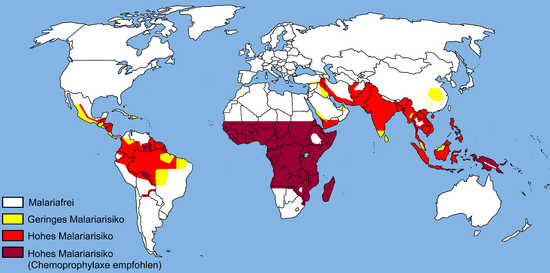
Malaria ist derzeit in einem breiten Band um den Äquator, in Gebieten Amerikas, in vielen Teilen Asiens und in weiten Teilen Afrikas endemisch; in Afrika südlich der Sahara treten 85-90 % der Malaria-Todesfälle auf. Einer Schätzung für 2009 zufolge waren die Länder mit der höchsten Todesrate pro 100 000 Einwohner die Elfenbeinküste (86,15), Angola (56,93) und Burkina Faso (50,66). Einer Schätzung aus dem Jahr 2010 zufolge waren Burkina Faso, Mosambik und Mali die Länder mit den meisten Todesfällen pro Einwohner. Das Malaria-Atlas-Projekt zielt darauf ab, das weltweite Ausmaß der Malaria zu kartieren, um die globalen räumlichen Grenzen der Krankheit zu bestimmen und die Krankheitslast zu bewerten. Im Rahmen dieses Projekts wurde 2010 eine Karte der Endemie von P. falciparum veröffentlicht, die 2019 aktualisiert wird. Im Jahr 2010 gab es in etwa 100 Ländern endemische Malaria. Jedes Jahr besuchen 125 Millionen internationale Reisende diese Länder, und mehr als 30.000 von ihnen erkranken daran. ⓘ
Die geografische Verteilung von Malaria innerhalb großer Regionen ist komplex, und malariagefährdete und malariafreie Gebiete liegen oft nahe beieinander. Malaria tritt vor allem in tropischen und subtropischen Regionen auf, da dort Niederschläge, gleichbleibend hohe Temperaturen und eine hohe Luftfeuchtigkeit herrschen und stehende Gewässer vorhanden sind, in denen Mückenlarven leicht heranreifen können, was ihnen die nötige Umgebung für eine kontinuierliche Vermehrung bietet. In trockeneren Gebieten lassen sich Malariaausbrüche durch die Kartierung der Niederschlagsmenge recht genau vorhersagen. Malaria tritt in ländlichen Gebieten häufiger auf als in Städten. So sind zum Beispiel mehrere Städte in der Greater Mekong Subregion in Südostasien im Wesentlichen malariafrei, aber die Krankheit ist in vielen ländlichen Regionen, auch entlang internationaler Grenzen und an Waldrändern, weit verbreitet. Im Gegensatz dazu tritt Malaria in Afrika sowohl in ländlichen als auch in städtischen Gebieten auf, wobei das Risiko in den größeren Städten geringer ist. ⓘ
Der Klimawandel
Der Klimawandel wird sich wahrscheinlich auf die Übertragung von Malaria auswirken, aber das Ausmaß der Auswirkungen und die betroffenen Gebiete sind ungewiss. Stärkere Regenfälle in bestimmten Gebieten Indiens und nach einem El-Niño-Ereignis werden mit einem Anstieg der Moskitozahlen in Verbindung gebracht. ⓘ
Seit 1900 haben sich die Temperaturen und Niederschläge in Afrika erheblich verändert. Die Faktoren, die dazu beitragen, dass die Niederschläge zu Wasser für die Mückenbrut führen, sind jedoch komplex und umfassen beispielsweise das Ausmaß, in dem sie vom Boden und der Vegetation aufgenommen werden, oder die Abfluss- und Verdunstungsraten. Jüngste Forschungsarbeiten haben ein detaillierteres Bild der Bedingungen in ganz Afrika geliefert, indem sie ein Modell der klimatischen Eignung für Malaria mit einem kontinentalen Modell kombiniert haben, das reale hydrologische Prozesse abbildet. ⓘ
Geographische Verteilung
Die geographische Verteilung der Malaria (siehe Karte 2005 – aktuelle Karte bei der DTG, Weblinks) ähnelt im 21. Jahrhundert der Temperaturverteilung der Erde. Die als Überträger geeigneten Anophelesarten kommen jedoch auf allen Kontinenten (außer der Antarktis) vor, wobei das Verbreitungsgebiet der Anopheles-Mücke auf niedrige Meereshöhen (unter 2500 m am Äquator und unter 1500 m in den restlichen Regionen) begrenzt ist. Malaria war insbesondere gegen Ende des Zweiten Weltkriegs bis in den Norden Europas und Nordamerikas verbreitet. Das Risiko in den einzelnen Endemiegebieten ist sehr unterschiedlich, was auch saisonale und geographische Gründe hat. Im subsaharischen Afrika überwiegt Plasmodium falciparum deutlich vor allen anderen Plasmodienarten. Eine Rückkehr der Malaria nach Mitteleuropa auf Grund der Klimaerwärmung wird kontrovers diskutiert. ⓘ
Genetische Mutationen und Bedeutung der Malaria in der Menschheitsgeschichte

Der moderne Mensch (Homo sapiens) war während des größten Teils der Menschheitsgeschichte der Bedrohung durch Malaria-Infektionen ausgesetzt. Man schätzt, dass die ersten Vertreter des Homo sapiens vor ungefähr 200.000 Jahren in Ostafrika auftraten. Von dort breiteten sie sich allmählich über die ganze Erde aus. Die klimatisch kalten und malariafreien Regionen der Welt wurden erst in den letzten 20.000–30.000 Jahren durch moderne Menschen besiedelt. ⓘ
Im Laufe der Zeit sind in der menschlichen Population Mutationen aufgetreten, die eine gewisse Resistenz gegen die schweren Verlaufsformen der Malaria bieten. Diese Mutationen betreffen die Erythrozyten (roten Blutkörperchen), in denen sich der Malaria-Parasit entwickelt. Es handelt sich in erster Linie um Mutationen in den Genen des Hämoglobins (Hämoglobinopathien), aber auch um Mutationen im Stoffwechsel der Erythrozyten:
- Bildung von Hämoglobin-Mutanten:
- Sichelzellenanämie (Bildung von Hämoglobin S, im tropischen Afrika)
- Hämoglobin C (in Westafrika)
- Hämoglobin E (in Südostasien)
- Hämoglobin D (in Indien)
- Verminderte Synthese des Hämoglobins:
- α-/β-Thalassämie (im Mittelmeerraum, ganz Südasien, Nordafrika)
- Enzymdefekte im Erythrozytenstoffwechsel:
- Glucose-6-phosphat-Dehydrogenase (G6PDH)-Mangel ⓘ
Heterozygote Anlageträger (mit nur einem mutierten Allel) können an Malaria erkranken, sind jedoch vor den schweren Verlaufsformen geschützt, da sich die Malariaparasiten nicht so gut in den Erythrozyten vermehren können. Homozygote Anlageträger (beide Allele mutiert) haben unbehandelt häufig eine deutlich verkürzte Lebenserwartung (z. B. bei Sichelzellanämie), da die Funktion der Erythrozyten gestört ist. Weltweit gesehen sind etwa 8 % der heutigen Weltbevölkerung von einer der obigen Mutationen betroffen. Die Hämoglobinopathien sind damit die bei weitem häufigsten menschlichen Erbkrankheiten. In manchen Regionen der Welt (Gebiet um die ostafrikanischen Seen, Teile Südostasiens) sind bis zu 50 % der dortigen Bevölkerung Anlageträger. Die Tatsache, dass sich derartige Mutationen, die größtenteils erhebliche Nachteile vor allem in homozygoter Form für den jeweiligen Träger mit sich bringen, in der menschlichen Population haben halten können, ist ein eindrucksvoller Beleg dafür, welchen großen genetischen Druck die Malaria auf die Menschheitsentwicklung ausgeübt hat. In Gebieten mit seltenerem oder nur episodischem Auftreten der Malaria (Nordeuropa, Nordasien) sind die oben genannten Mutationen bei der einheimischen Bevölkerung nicht zu finden, sie sind durch den Selektionsdruck innerhalb einiger tausend Jahre eliminiert worden. ⓘ
Daneben ist seit 2012 bekannt, dass es Genvariationen (Polymorphismen) in zwei Genen gibt, deren Träger seltener einen lebensgefährlichen Verlauf der Malaria zeigen. Das eine dieser Gene steuert die Zellmembranpumpe für Kalzium, die unter anderem auch auf Erythrozyten vorhanden ist, das andere spielt eine Rolle bei der Abdichtung von Gefäßwänden. Bei Trägern der Blutgruppe 0 ist ebenso eine verringerte Wahrscheinlichkeit für einen schweren Krankheitsverlauf zu beobachten. ⓘ
Jährliche Opfer und Inzidenz
Nach Angaben der Weltgesundheitsorganisation (WHO) sterben weltweit jährlich knapp eine halbe Million Menschen an Malaria. 90 % der Erkrankten leben auf dem afrikanischen Kontinent. Die Zahl der Malariakranken weltweit wird nach Zahlen des Robert Koch-Institutes auf 300–500 Millionen Fälle geschätzt. Die WHO schätzte die Zahl der Malariafälle 2016 auf 216 Millionen. ⓘ
In Deutschland wurden bis 2013 jährlich ca. 700 Erkrankte gemeldet, von denen 3–8 starben (0,3–0,9 %). Der Großteil der Patienten ist in afrikanischen Endemiegebieten unterwegs gewesen (ca. 87 %). ⓘ
| Jahr | 1980 | 1981 | 1982 | 1983 | 1984 | 1985 ⓘ |
|---|---|---|---|---|---|---|
| Gemeldete Fälle in der Bundesrepublik Deutschland mit West-Berlin | 573 | 393 | 514 | 447 | 482 | 530 |
| Jahr | 1996 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 ⓘ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Gemeldete Fälle in Deutschland |
> 1000 | 1008 | 931 | 800 | 1049 | 860 | 820 | 709 | 632 | 569 | 542 | 554 | 526 | 633 | 563 | 551 | 638 | 1007 | 1062 |
Geschichte

Obwohl der für die Malaria verantwortliche Parasit P. falciparum bereits seit 50 000 bis 100 000 Jahren existiert, nahm die Populationsgröße des Parasiten erst vor etwa 10 000 Jahren zu, zeitgleich mit den Fortschritten in der Landwirtschaft und der Entwicklung menschlicher Siedlungen. Enge Verwandte der menschlichen Malariaparasiten sind nach wie vor bei Schimpansen verbreitet. Einiges deutet darauf hin, dass die P. falciparum-Malaria ihren Ursprung in Gorillas hat. ⓘ
In der Geschichte finden sich immer wieder Hinweise auf das einzigartige periodische Fieber der Malaria. Hippokrates beschrieb die periodischen Fieber und bezeichnete sie als tertianisches, quartanisches, subtertianisches und quotidianisches Fieber. Der Römer Columella brachte die Krankheit mit Insekten aus Sümpfen in Verbindung. Malaria trug möglicherweise zum Niedergang des Römischen Reiches bei und war in Rom so weit verbreitet, dass sie als "römisches Fieber" bekannt wurde. Mehrere Regionen im antiken Rom galten als Risikoregionen für die Krankheit, da sie günstige Bedingungen für Malariaüberträger boten. Dazu gehörten Gebiete wie Süditalien, die Insel Sardinien, die Pontinischen Sümpfe, die unteren Regionen der etruskischen Küste und die Stadt Rom am Tiber. Das Vorhandensein von stehendem Wasser an diesen Orten wurde von den Mücken als Brutstätte bevorzugt. Bewässerte Gärten, sumpfige Böden, Abflüsse aus der Landwirtschaft und Entwässerungsprobleme durch den Straßenbau führten zu einer Zunahme von stehendem Wasser. ⓘ

Der Begriff Malaria stammt aus dem mittelalterlichen Italienisch: mala aria - "schlechte Luft"; die Krankheit wurde früher als Ague oder Sumpffieber bezeichnet, da sie mit Sümpfen und Marschland in Verbindung gebracht wurde. Der Begriff tauchte erstmals um 1829 in der englischen Literatur auf. Malaria war früher in den meisten Teilen Europas und Nordamerikas verbreitet, wo sie heute nicht mehr endemisch ist, obwohl importierte Fälle vorkommen. ⓘ
In den medizinischen Büchern der Mayas oder Azteken wird Malaria nicht erwähnt. Europäische Siedler und die von ihnen versklavten Westafrikaner brachten die Malaria wahrscheinlich ab dem 16. Jahrhundert nach Amerika. ⓘ
Wissenschaftliche Studien über Malaria machten ihre ersten bedeutenden Fortschritte im Jahr 1880, als Charles Louis Alphonse Laveran - ein französischer Militärarzt, der im Militärkrankenhaus von Constantine in Algerien arbeitete - zum ersten Mal Parasiten in den roten Blutkörperchen infizierter Menschen beobachtete. Er schlug daraufhin vor, dass Malaria durch diesen Organismus verursacht wird, womit zum ersten Mal ein Protist als Krankheitsverursacher identifiziert wurde. Für diese und spätere Entdeckungen erhielt er 1907 den Nobelpreis für Physiologie oder Medizin. Ein Jahr später lieferte Carlos Finlay, ein kubanischer Arzt, der in Havanna Gelbfieberkranke behandelte, eindeutige Beweise dafür, dass Moskitos Krankheiten auf den Menschen und von ihm übertragen. Diese Arbeit folgte früheren Vorschlägen von Josiah C. Nott und Arbeiten von Sir Patrick Manson, dem "Vater der Tropenmedizin", über die Übertragung der Filariose. ⓘ

Im April 1894 besuchte der schottische Arzt Sir Ronald Ross Sir Patrick Manson in seinem Haus in der Queen Anne Street in London. Dieser Besuch war der Beginn einer vierjährigen Zusammenarbeit und eifriger Forschung, die 1897 ihren Höhepunkt fand, als Ross, der im Presidency General Hospital in Kalkutta arbeitete, den vollständigen Lebenszyklus des Malariaparasiten in der Mücke nachwies. Er wies damit nach, dass die Stechmücke der Überträger der Malaria auf den Menschen ist, indem er zeigte, dass bestimmte Stechmückenarten Malaria auf Vögel übertragen. Er isolierte Malariaparasiten aus den Speicheldrüsen von Stechmücken, die sich von infizierten Vögeln ernährt hatten. Für diese Arbeit erhielt Ross 1902 den Nobelpreis für Medizin. Nach seinem Ausscheiden aus dem Indian Medical Service arbeitete Ross an der neu gegründeten Liverpool School of Tropical Medicine und leitete die Malariabekämpfung in Ägypten, Panama, Griechenland und Mauritius. Die Erkenntnisse von Finlay und Ross wurden später von einem medizinischen Gremium unter der Leitung von Walter Reed im Jahr 1900 bestätigt. Dessen Empfehlungen wurden von William C. Gorgas im Rahmen der Gesundheitsmaßnahmen beim Bau des Panamakanals umgesetzt. Diese Arbeit im Bereich der öffentlichen Gesundheit rettete Tausenden von Arbeitern das Leben und trug dazu bei, die Methoden für künftige Kampagnen zur Bekämpfung der Krankheit zu entwickeln. ⓘ
1896 erörterte Amico Bignami die Rolle der Stechmücken bei der Malaria. 1898 gelang es Bignami, Giovanni Battista Grassi und Giuseppe Bastianelli, die Übertragung von Malaria auf den Menschen experimentell nachzuweisen, indem sie infizierte Stechmücken benutzten, um selbst an Malaria zu erkranken, was sie im November 1898 der Accademia dei Lincei vorstellten. ⓘ

Das erste wirksame Mittel gegen Malaria wurde aus der Rinde des Chinarindenbaums gewonnen, der Chinin enthält. Dieser Baum wächst an den Hängen der Anden, hauptsächlich in Peru. Die Ureinwohner Perus stellten eine Tinktur aus Chinarinde her, um Fieber zu bekämpfen. Ihre Wirksamkeit gegen Malaria wurde entdeckt, und die Jesuiten führten das Mittel um 1640 in Europa ein; 1677 wurde es in das Londoner Arzneibuch als Malariamittel aufgenommen. Erst 1820 wurde der Wirkstoff Chinin aus der Rinde extrahiert, isoliert und von den französischen Chemikern Pierre Joseph Pelletier und Joseph Bienaimé Caventou benannt. ⓘ
Chinin war das vorherrschende Malariamedikament bis in die 1920er Jahre, als andere Medikamente aufkamen. In den 1940er Jahren löste Chloroquin das Chinin bei der Behandlung von unkomplizierter und schwerer Malaria ab, bis es in den 1950er Jahren zunächst in Südostasien und Südamerika und dann in den 1980er Jahren weltweit zu Resistenzen kam. ⓘ
Der medizinische Wert von Artemisia annua wird von chinesischen Kräuterkundigen seit 2.000 Jahren in der traditionellen chinesischen Medizin verwendet. Im Jahr 1596 empfahl Li Shizhen in seinem "Compendium of Materia Medica" Tee aus Qinghao speziell zur Behandlung von Malaria-Symptomen. Die von der chinesischen Wissenschaftlerin Tu Youyou und ihren Kollegen in den 1970er Jahren aus der Pflanze Artemisia annua entdeckten Artemisinine wurden zur empfohlenen Behandlung von P. falciparum Malaria, die in schweren Fällen in Kombination mit anderen Malariamitteln verabreicht wird. Tu sagt, sie sei von einer Quelle der traditionellen chinesischen Kräutermedizin beeinflusst worden, dem Handbuch der Rezepte für Notfallbehandlungen, das 340 von Ge Hong geschrieben wurde. Für ihre Arbeit über Malaria erhielt Tu Youyou 2015 den Nobelpreis für Physiologie oder Medizin. ⓘ
Plasmodium vivax wurde von 1917 bis in die 1940er Jahre für die Malariatherapie verwendet, d. h. für die absichtliche Injektion von Malariaparasiten zur Auslösung von Fieber, um bestimmte Krankheiten wie die tertiäre Syphilis zu bekämpfen. Der Erfinder dieser Technik, Julius Wagner-Jauregg, erhielt 1927 für seine Entdeckungen den Nobelpreis für Physiologie oder Medizin. Das Verfahren war gefährlich und führte bei etwa 15 % der Patienten zum Tod, weshalb es heute nicht mehr angewendet wird. ⓘ

Das erste Pestizid, das für die Besprühung von Innenräumen verwendet wurde, war DDT. Obwohl es zunächst ausschließlich zur Malariabekämpfung eingesetzt wurde, verbreitete sich sein Einsatz schnell in der Landwirtschaft. Mit der Zeit dominierte die Schädlingsbekämpfung und nicht die Krankheitsbekämpfung den Einsatz von DDT, und dieser großflächige Einsatz in der Landwirtschaft führte in vielen Regionen zur Entwicklung pestizidresistenter Mücken. Die DDT-Resistenz der Anopheles-Mücken kann mit der Antibiotikaresistenz von Bakterien verglichen werden. In den 1960er Jahren wuchs das Bewusstsein für die negativen Folgen des wahllosen Einsatzes von DDT, was schließlich in den 1970er Jahren in vielen Ländern zu einem Verbot der landwirtschaftlichen Anwendung von DDT führte. Vor dem Einsatz von DDT wurde Malaria in tropischen Gebieten wie Brasilien und Ägypten erfolgreich beseitigt oder bekämpft, indem die Brutstätten der Moskitos oder die aquatischen Lebensräume der Larvenstadien beseitigt oder vergiftet wurden, z. B. durch das Ausbringen der hochgiftigen Arsenverbindung Paris Green an Orten mit stehendem Wasser. ⓘ
Malaria-Impfstoffe sind ein schwer zu fassendes Ziel der Forschung. Die ersten vielversprechenden Studien, die das Potenzial für einen Malaria-Impfstoff aufzeigten, wurden 1967 durchgeführt, indem Mäuse mit lebenden, strahlenabgeschwächten Sporozoiten immunisiert wurden, die den Mäusen bei der anschließenden Injektion mit normalen, lebensfähigen Sporozoiten einen erheblichen Schutz boten. Seit den 1970er Jahren wurden erhebliche Anstrengungen unternommen, um ähnliche Impfstrategien für den Menschen zu entwickeln. Der erste Impfstoff mit der Bezeichnung RTS,S wurde 2015 von den europäischen Aufsichtsbehörden zugelassen. ⓘ
Bezeichnungen
Die verschiedenen Arten von Malaria werden mit den folgenden Namen bezeichnet:
| Name | Erreger | Anmerkungen ⓘ |
|---|---|---|
| Algid-Malaria | Plasmodium falciparum | schwere Malaria, die das Herz-Kreislauf-System beeinträchtigt und Schüttelfrost und Kreislaufschock verursacht |
| biliäre Malaria | Plasmodium falciparum | Schwere Malaria, die die Leber befällt und Erbrechen und Gelbsucht verursacht |
| zerebrale Malaria | Plasmodium falciparum | Schwere Malaria, die das Großhirn befällt |
| angeborene Malaria | verschiedene Plasmodien | Plasmodien, die von der Mutter über den fötalen Kreislauf eingeschleppt werden |
| perniziöse Malaria | Plasmodium falciparum | schwere Malaria, die zu einer schweren Erkrankung führt |
| maligne Malaria | Plasmodium falciparum | Schwere Malaria, die zum Tod führt |
| falciparum malaria, Plasmodium falciparum malaria, | Plasmodium falciparum | |
| ovale Malaria, Plasmodium ovale Malaria | Plasmodium ovale | |
| quartäre Malaria, malariae Malaria, Plasmodium malariae Malaria | Plasmodium malariae | Paroxysmen jeden vierten Tag (quartan), wobei der Tag des Auftretens als erster Tag gezählt wird |
| quotidiane Malaria | Plasmodium falciparum, Plasmodium vivax, Plasmodium knowlesi | Paroxysmen täglich (Quotidian) |
| Tertiärmalaria | Plasmodium falciparum, Plasmodium ovale, Plasmodium vivax | Paroxysmen jeden dritten Tag (tertian), wobei der Tag des Auftretens als erster Tag gezählt wird |
| Transfusionsmalaria | verschiedene Plasmodien | durch Bluttransfusion, gemeinsamen Gebrauch von Nadeln oder Nadelstichverletzungen eingeschlepptes Plasmodium |
| vivax-Malaria, Plasmodium vivax-Malaria | Plasmodium vivax |
Bemühungen zur Ausrottung
Die Malaria wurde in bestimmten Gebieten erfolgreich ausgerottet oder erheblich reduziert, jedoch nicht weltweit. In den Vereinigten Staaten war Malaria früher weit verbreitet, aber die USA haben die Malaria in den meisten Teilen des Landes Anfang des 20. Jahrhunderts mit Hilfe von Vektorkontrollprogrammen eliminiert, die die Überwachung und Behandlung infizierter Menschen, die Trockenlegung von Feuchtgebieten als Brutstätten für die Landwirtschaft und andere Änderungen in der Wasserbewirtschaftung sowie Fortschritte in der Hygiene, einschließlich der verstärkten Verwendung von Glasfenstern und Fliegengittern in Wohnungen, kombinierten. Durch den Einsatz des Pestizids DDT und anderer Mittel wurde die Malaria in den 1950er Jahren im Rahmen des Nationalen Programms zur Ausrottung der Malaria aus den verbliebenen Gebieten in den Südstaaten der USA ausgerottet. Der größte Teil Europas, Nordamerikas, Australiens, Nordafrikas und der Karibik sowie Teile Südamerikas, Asiens und des südlichen Afrikas haben die Malaria ebenfalls eliminiert. Die WHO definiert "Eliminierung" (oder "malariafrei") als das Fehlen einer inländischen Übertragung (einheimische Fälle) in den letzten drei Jahren. Sie definiert auch die Stufen "Vor-Eliminierung" und "Eliminierung", wenn in einem Land weniger als 5 bzw. 1 Fall pro 1000 gefährdete Personen pro Jahr auftritt. ⓘ
1955 rief die WHO das Global Malaria Eradication Program (GMEP) ins Leben, das in einigen Ländern, darunter auch Indien, zu einem erheblichen Rückgang der Malariafälle führte. Aufgrund der Resistenz von Vektoren und Parasiten und anderer Faktoren führte die Frage, ob die Ausrottung der Malaria mit der damals angewandten Strategie und den verfügbaren Ressourcen möglich war, jedoch zu einer schwindenden Unterstützung des Programms. Die WHO stellte das Programm 1969 ein.

Zielvorgabe 6C der Millenniums-Entwicklungsziele beinhaltete die Umkehrung des weltweiten Anstiegs der Malaria-Inzidenz bis zum Jahr 2015, mit spezifischen Zielen für Kinder unter 5 Jahren. Seit dem Jahr 2000 hat die Unterstützung für die Ausrottung von Malaria zugenommen, obwohl einige Akteure in der globalen Gesundheitsgemeinschaft (einschließlich Stimmen innerhalb der WHO) die Ausrottung von Malaria als verfrühtes Ziel ansehen und meinen, dass die Festlegung strenger Fristen für die Ausrottung von Malaria kontraproduktiv sein könnte, da sie wahrscheinlich verfehlt werden. ⓘ
Im Jahr 2006 setzte sich die Organisation Malaria No More das öffentliche Ziel, Malaria bis 2015 aus Afrika zu eliminieren, und erklärte, sie wolle sich auflösen, wenn dieses Ziel erreicht sei. Im Jahr 2007 wurde der Weltmalariatag auf der 60. Sitzung der Weltgesundheitsversammlung eingeführt. Im Jahr 2018 gibt es sie immer noch. ⓘ
Bis 2012 hat der Globale Fonds zur Bekämpfung von AIDS, Tuberkulose und Malaria 230 Millionen mit Insektiziden behandelte Netze verteilt, die die Übertragung von Malaria durch Moskitos verhindern sollen. Die Clinton Foundation mit Sitz in den USA hat sich für die Steuerung der Nachfrage und die Stabilisierung der Preise auf dem Artemisinin-Markt eingesetzt. Andere Bemühungen, wie das Malaria Atlas Project, konzentrieren sich auf die Analyse von Klima- und Wetterdaten, die für eine genaue Vorhersage der Malariaausbreitung auf der Grundlage der Verfügbarkeit von Lebensräumen für Malaria-übertragende Parasiten erforderlich sind. Das Malaria Policy Advisory Committee (MPAC) der Weltgesundheitsorganisation (WHO) wurde 2012 gegründet, "um die WHO in allen Aspekten der Malariakontrolle und -eliminierung strategisch zu beraten und fachlich zu unterstützen". Im November 2013 setzten sich die WHO und die Gruppe der Geldgeber für Malariaimpfstoffe das Ziel, Impfstoffe zu entwickeln, die die Übertragung von Malaria unterbrechen, wobei das langfristige Ziel die Ausrottung der Malaria ist. ⓘ
Im Jahr 2015 setzte sich die WHO das Ziel, die Zahl der Malaria-Todesfälle bis 2030 um 90 % zu senken, und Bill Gates sagte 2016, er halte eine weltweite Ausrottung bis 2040 für möglich. Laut dem Weltmalariabericht 2015 der WHO ist die weltweite Sterblichkeitsrate bei Malaria zwischen 2000 und 2015 um 60 % gesunken. Die WHO strebte eine weitere Senkung um 90 % zwischen 2015 und 2030 an, mit einer Reduzierung um 40 % und einer Ausrottung in 10 Ländern bis 2020. Das Ziel für 2020 wurde jedoch mit einem leichten Anstieg der Fälle im Vergleich zu 2015 verfehlt. ⓘ
Bis 2016 hat der Globale Fonds zur Bekämpfung von HIV/AIDS, Tuberkulose und Malaria 659 Millionen ITN (mit Insektiziden behandelte Moskitonetze) bereitgestellt sowie Unterstützung und Aufklärung zur Malariaprävention organisiert. Die Herausforderungen sind groß, denn es fehlt an Mitteln, die Gesundheitsstruktur ist fragil und die abgelegene indigene Bevölkerung ist schwer zu erreichen und aufzuklären. Der Großteil der indigenen Bevölkerung verlässt sich auf Selbstdiagnose, Selbstbehandlung, Heiler und traditionelle Medizin. Die WHO beantragte bei der Gates-Stiftung Mittel für die Ausrottung der Malaria im Jahr 2007. Sechs Ländern - den Vereinigten Arabischen Emiraten, Marokko, Armenien, Turkmenistan, Kirgisistan und Sri Lanka - ist es gelungen, drei Jahre in Folge keine endemischen Malariafälle mehr zu haben und von der WHO als malariafrei zertifiziert zu werden, obwohl die Finanzierung 2010 stagnierte. Die Mittel sind wichtig, um die Kosten für Medikamente und Krankenhausaufenthalte zu finanzieren, die von den armen Ländern, in denen die Krankheit weit verbreitet ist, nicht getragen werden können. Das Ziel der Ausrottung wurde zwar nicht erreicht, doch der Rückgang der Krankheit ist beträchtlich. ⓘ
Während 31 von 92 endemischen Ländern die WHO-Ziele für 2020 erreicht haben dürften, meldeten 15 Länder einen Anstieg von 40 % oder mehr zwischen 2015 und 2020. Zwischen 2000 und dem 30. Juni 2021 wurden zwölf Länder von der WHO als malariafrei zertifiziert. Argentinien und Algerien wurden im Jahr 2019 für malariafrei erklärt. El Salvador und China wurden in der ersten Hälfte des Jahres 2021 für malariafrei erklärt. ⓘ
Die regionalen Unterschiede waren offensichtlich: Südostasien war auf dem besten Weg, die WHO-Ziele für 2020 zu erreichen, während Afrika, Nord- und Südamerika, der östliche Mittelmeerraum und der westpazifische Raum von diesem Ziel abgewichen sind. Die sechs Länder der Greater Mekong Subregion streben die Eliminierung der von P. falciparum übertragenen Malaria bis 2025 und die Eliminierung der Malaria insgesamt bis 2030 an, nachdem sie seit 2000 einen Rückgang der Fälle um 97% bzw. 90% erreicht haben. Im Vorfeld des Weltmalariatages am 25. April 2021 hat die WHO im Rahmen ihrer E-2025-Initiative 25 Länder benannt, in denen sie sich für die Eliminierung von Malaria bis 2025 einsetzt. ⓘ
Eine große Herausforderung bei der Eliminierung von Malaria ist das Fortbestehen von Malaria in Grenzregionen, was eine internationale Zusammenarbeit erforderlich macht. ⓘ
Eines der Ziele von Ziel 3 der Nachhaltigen Entwicklungsziele der Vereinten Nationen ist die Beendigung der Malariaepidemie in allen Ländern bis 2030. ⓘ
Im Jahr 2018 gab die WHO bekannt, dass Paraguay frei von Malaria ist, nachdem die nationalen Bemühungen zur Ausrottung der Malaria im Jahr 1950 begonnen hatten. ⓘ
Ab 2019 wird der Ausrottungsprozess fortgesetzt, aber es wird schwierig sein, mit den derzeitigen Ansätzen und Instrumenten eine malariafreie Welt zu erreichen. Nur ein Malaria-Impfstoff ist für den Einsatz zugelassen, und er zeigt eine relativ geringe Wirksamkeit, während mehrere andere Impfstoffkandidaten, die sich in der klinischen Erprobung befinden, darauf abzielen, Kindern in endemischen Gebieten Schutz zu bieten und die Geschwindigkeit der Malariaübertragung zu verringern. Die Ansätze erfordern möglicherweise mehr Investitionen in die Forschung und eine bessere medizinische Grundversorgung. Eine kontinuierliche Überwachung wird auch wichtig sein, um die Rückkehr von Malaria in Ländern zu verhindern, in denen die Krankheit bereits ausgerottet wurde. ⓘ
Gesellschaft und Kultur
Wirtschaftliche Auswirkungen

Malaria ist nicht nur eine Krankheit, die gemeinhin mit Armut assoziiert wird: Einiges deutet darauf hin, dass sie auch eine Ursache für Armut und ein großes Hindernis für die wirtschaftliche Entwicklung ist. Obwohl tropische Regionen am stärksten betroffen sind, reicht der Einfluss der Malaria bis in einige gemäßigte Zonen mit extremen saisonalen Schwankungen. Die Krankheit wird mit erheblichen negativen wirtschaftlichen Auswirkungen auf die Regionen in Verbindung gebracht, in denen sie weit verbreitet ist. Im späten 19. und frühen 20. Jahrhundert war sie ein wichtiger Faktor für die langsame wirtschaftliche Entwicklung der amerikanischen Südstaaten. ⓘ
Ein Vergleich des durchschnittlichen Pro-Kopf-BIP im Jahr 1995, bereinigt um die Kaufkraftparität, zwischen Ländern mit Malaria und Ländern ohne Malaria ergibt einen fünffachen Unterschied (1.526 US-Dollar gegenüber 8.268 US-Dollar). Im Zeitraum 1965 bis 1990 stieg das durchschnittliche Pro-Kopf-BIP in Ländern, in denen Malaria verbreitet war, nur um 0,4 % pro Jahr, während es in anderen Ländern um 2,4 % pro Jahr stieg. ⓘ
Armut kann das Malariarisiko erhöhen, da Menschen in Armut nicht über die finanziellen Möglichkeiten verfügen, die Krankheit zu verhindern oder zu behandeln. Die wirtschaftlichen Auswirkungen der Malaria werden für Afrika insgesamt auf 12 Milliarden US-Dollar pro Jahr geschätzt. Zu den wirtschaftlichen Auswirkungen gehören Kosten für die Gesundheitsversorgung, krankheitsbedingte Arbeitsausfälle, Bildungsausfälle, Produktivitätseinbußen aufgrund von Hirnschäden durch zerebrale Malaria sowie Investitions- und Tourismusverluste. In einigen Ländern ist die Krankheit eine schwere Belastung, da sie für 30-50 % der Krankenhauseinweisungen, bis zu 50 % der ambulanten Besuche und bis zu 40 % der öffentlichen Gesundheitsausgaben verantwortlich sein kann. ⓘ
Zerebrale Malaria ist eine der häufigsten Ursachen für neurologische Behinderungen bei afrikanischen Kindern. Studien, in denen die kognitiven Funktionen vor und nach der Behandlung einer schweren Malariaerkrankung verglichen wurden, zeigten auch nach der Genesung eine erhebliche Beeinträchtigung der schulischen Leistungen und der kognitiven Fähigkeiten. Folglich haben schwere und zerebrale Malaria weitreichende sozioökonomische Folgen, die über die unmittelbaren Auswirkungen der Krankheit hinausgehen. ⓘ
Nach Studien liegt die durch Malaria verursachte Lähmung der Volkswirtschaften der betroffenen Länder nicht nur an den direkten Kosten für Medikamente und medizinische Behandlung. Malaria hat eine negative Auswirkung auf die Arbeitsproduktivität und somit auf das Bruttoinlandsprodukt des Landes, womit nötige Investitionen, wie beispielsweise in Bildung, ausbleiben. Zudem meiden ausländische Investoren solche Länder ebenso wie Touristen und Handelsunternehmen. ⓘ
Mittlerweile hat AIDS die ungünstige Situation für diese Länder noch dramatisch verschlimmert. ⓘ
Gefälschte und minderwertige Arzneimittel
In mehreren asiatischen Ländern wie Kambodscha, China, Indonesien, Laos, Thailand und Vietnam wurden ausgeklügelte Fälschungen entdeckt, die eine der Hauptursachen für vermeidbare Todesfälle in diesen Ländern sind. Nach Angaben der WHO deuten Studien darauf hin, dass bis zu 40 % der Malariamedikamente auf Artesunatbasis gefälscht sind, insbesondere in der Mekong-Region. Die WHO hat ein Schnellwarnsystem eingerichtet, um Informationen über gefälschte Medikamente rasch an die zuständigen Behörden in den beteiligten Ländern weiterzuleiten. Es gibt keine zuverlässige Möglichkeit für Ärzte oder Laien, gefälschte Medikamente ohne Hilfe eines Labors zu erkennen. Die Unternehmen versuchen, das Fortbestehen von Arzneimittelfälschungen zu bekämpfen, indem sie neue Technologien einsetzen, um die Sicherheit von der Quelle bis zum Vertrieb zu gewährleisten. ⓘ
Ein weiteres klinisches und gesundheitspolitisches Problem ist die Verbreitung von minderwertigen Malariamitteln, die durch eine unangemessene Konzentration der Inhaltsstoffe, Verunreinigungen mit anderen Medikamenten oder toxischen Verunreinigungen, minderwertige Inhaltsstoffe, schlechte Stabilität und unzureichende Verpackung entstehen. Eine Studie aus dem Jahr 2012 hat gezeigt, dass etwa ein Drittel der Malariamedikamente in Südostasien und Subsahara-Afrika bei der chemischen Analyse und der Verpackungsanalyse durchfiel oder gefälscht war. ⓘ
Krieg

Im Laufe der Geschichte hat die Ansteckung mit Malaria eine wichtige Rolle für das Schicksal von Machthabern, Nationalstaaten, Militärangehörigen und Militäraktionen gespielt. Im Jahr 1910 veröffentlichte der Medizin-Nobelpreisträger Ronald Ross (selbst ein Malaria-Überlebender) ein Buch mit dem Titel The Prevention of Malaria, das ein Kapitel mit dem Titel "The Prevention of Malaria in War" enthielt. Der Autor des Kapitels, Colonel C. H. Melville, Professor für Hygiene am Royal Army Medical College in London, ging auf die herausragende Rolle ein, die die Malaria in der Geschichte während der Kriege gespielt hat: "Die Geschichte der Malaria im Krieg könnte fast als die Geschichte des Krieges selbst angesehen werden, sicherlich als die Geschichte des Krieges im christlichen Zeitalter. ... Es ist wahrscheinlich, dass viele der so genannten Lagerfieber und wahrscheinlich auch ein beträchtlicher Teil der Lagerruhr in den Kriegen des sechzehnten, siebzehnten und achtzehnten Jahrhunderts auf Malaria zurückzuführen waren." Im britisch besetzten Indien entstand der Cocktail Gin Tonic möglicherweise als eine Möglichkeit, Chinin einzunehmen, das für seine malariabekämpfenden Eigenschaften bekannt ist. ⓘ
Malaria war das größte Gesundheitsrisiko für die US-Truppen im Südpazifik während des Zweiten Weltkriegs, wo etwa 500 000 Männer infiziert wurden. Laut Joseph Patrick Byrne "starben sechzigtausend amerikanische Soldaten während der Kampagnen in Afrika und im Südpazifik an Malaria". ⓘ
Für die Beschaffung bestehender und die Entwicklung neuer Malariamittel wurden beträchtliche finanzielle Mittel aufgewendet. Während des Ersten und Zweiten Weltkriegs wurden aufgrund der unzureichenden Versorgung mit den natürlichen Malariamitteln Chinarinde und Chinin erhebliche Mittel für die Erforschung und Entwicklung anderer Medikamente und Impfstoffe bereitgestellt. Zu den amerikanischen Militäreinrichtungen, die solche Forschungsinitiativen durchführen, gehören das Navy Medical Research Center, das Walter Reed Army Institute of Research und das U.S. Army Medical Research Institute of Infectious Diseases of the US Armed Forces. ⓘ
Darüber hinaus wurden Initiativen wie die 1942 gegründete Malaria Control in War Areas (MCWA) und ihr Nachfolger, das 1946 gegründete Communicable Disease Center (heute bekannt als Centers for Disease Control and Prevention, CDC), gegründet. Nach Angaben der CDC wurde das MCWA gegründet, um die Malaria in der Umgebung von militärischen Ausbildungsstätten im Süden der Vereinigten Staaten und ihren Territorien zu bekämpfen, wo die Malaria immer noch ein Problem darstellte". ⓘ
Forschung
Die Initiative Malaria Eradication Research Agenda (malERA) war ein Konsultationsprozess zur Ermittlung der Forschungs- und Entwicklungsbereiche, die für die weltweite Ausrottung der Malaria in Angriff genommen werden müssen. ⓘ
Impfstoff
Ein Impfstoff gegen Malaria mit der Bezeichnung RTS,S/AS01 (RTS,S) wurde 2015 von den europäischen Aufsichtsbehörden zugelassen. Ab 2019 wird er in drei afrikanischen Ländern südlich der Sahara - Ghana, Kenia und Malawi - im Rahmen des Malaria Vaccine Implementation Programme (MVIP) der WHO in Pilotversuchen getestet. ⓘ
Immunität (oder genauer gesagt Toleranz) gegen P. falciparum-Malaria tritt zwar auf natürliche Weise auf, aber nur als Reaktion auf eine jahrelange, wiederholte Infektion. Eine Person kann vor einer P. falciparum-Infektion geschützt werden, wenn sie etwa tausend Stiche von Moskitos erhält, die eine Version des Parasiten tragen, die durch eine Dosis Röntgenstrahlung nicht mehr infektiös ist. Die hohe Polymorphie vieler P. falciparum-Proteine stellt die Entwicklung von Impfstoffen vor große Herausforderungen. Impfstoffkandidaten, die auf Antigene auf Gameten, Zygoten oder Ookineten im Mitteldarm der Stechmücke abzielen, sollen die Übertragung von Malaria verhindern. Wenn eine Mücke eine Blutmahlzeit von einem geschützten Individuum zu sich nimmt, verhindern diese Antikörper, dass der Parasit seine Entwicklung in der Mücke abschließen kann. Andere Impfstoffkandidaten, die auf das Blutstadium des Lebenszyklus des Parasiten abzielen, waren für sich genommen unzureichend. So wurde beispielsweise SPf66 in den 1990er Jahren in Gebieten, in denen die Krankheit häufig auftrat, ausgiebig getestet, doch die Versuche erwiesen sich als unzureichend wirksam. ⓘ
Im Jahr 2021 berichteten Forscher der Universität Oxford über die Ergebnisse einer Phase-IIb-Studie mit dem Malaria-Impfstoffkandidaten R21/Matrix-M, die eine Wirksamkeit von 77 % über eine 12-monatige Nachbeobachtungszeit ergab. Dieser Impfstoff ist der erste, der das Ziel der Malaria Vaccine Technology Roadmap der Weltgesundheitsorganisation, einen Impfstoff mit mindestens 75 % Wirksamkeit zu entwickeln, erfüllt. ⓘ
Medikamente
Malariaparasiten enthalten Apikoplasten, Organellen, die mit den Plastiden in Pflanzen verwandt sind und über ein eigenes Genom verfügen. Man geht davon aus, dass diese Apikoplasten durch die Endosymbiose von Algen entstanden sind und eine entscheidende Rolle bei verschiedenen Aspekten des Parasitenstoffwechsels spielen, beispielsweise bei der Fettsäurebiosynthese. Es wurde festgestellt, dass über 400 Proteine von Apicoplasten produziert werden, und diese werden nun als mögliche Angriffspunkte für neue Malariamedikamente untersucht. ⓘ
Angesichts des Auftretens von arzneimittelresistenten Plasmodium-Parasiten werden neue Strategien zur Bekämpfung der weit verbreiteten Krankheit entwickelt. Ein solcher Ansatz besteht in der Einführung synthetischer Pyridoxal-Aminosäure-Addukte, die vom Parasiten aufgenommen werden und letztlich seine Fähigkeit beeinträchtigen, mehrere essenzielle B-Vitamine zu bilden. Malariamedikamente, die synthetische Komplexe auf Metallbasis verwenden, stoßen in der Forschung auf großes Interesse.
- (+)-SJ733: Gehört zu einer größeren Klasse von experimentellen Medikamenten, die Spiroindolone genannt werden. Es hemmt das ATP4-Protein infizierter roter Blutkörperchen, wodurch die Zellen schrumpfen und steif werden wie alternde Zellen. Dadurch wird das Immunsystem veranlasst, die infizierten Zellen aus dem System zu entfernen, wie in einem Mausmodell gezeigt wurde. Seit 2014 plant das Howard Hughes Medical Institute eine klinische Phase-1-Studie zur Bewertung des Sicherheitsprofils beim Menschen.
- NITD246 und NITD609: Sie gehören ebenfalls zur Klasse der Spiroindolone und greifen das ATP4-Protein an. ⓘ
Auf der Grundlage der molekularen Docking-Ergebnisse wiesen die Verbindungen 3j, 4b, 4h und 4m eine Selektivität gegenüber PfLDH auf. Die Post-Docking-Analyse zeigte ein stabiles dynamisches Verhalten aller ausgewählten Verbindungen im Vergleich zu Chloroquin. Die Analyse der Endzustandsthermodynamik ergab, dass die Verbindung 3j ein selektiver und potenter PfLDH-Inhibitor ist. ⓘ
Neue Ziele
Die selektive Bekämpfung von Plasmodium-Parasiten im Leberstadium entwickelt sich zu einer alternativen Strategie angesichts der Resistenz gegen die neuesten Kombinationstherapien gegen die Blutstadien des Parasiten. ⓘ
In einer 2019 durchgeführten Forschungsarbeit konnten die Autoren durch experimentelle Analysen mit Knockout-Mutanten (KO) von Plasmodium berguei Gene identifizieren, die im Leberstadium potenziell essenziell sind. Außerdem erstellten sie ein Computermodell, um die prä-erytrozytäre Entwicklung und den Stoffwechsel im Leberstadium zu analysieren. Durch die Kombination beider Methoden identifizierten sie sieben Stoffwechsel-Subsysteme, die im Vergleich zum Blutstadium wesentlich werden. Zu diesen Stoffwechselwegen gehören unter anderem die Fettsäuresynthese und -verlängerung, der Tricarbonsäure-, Aminosäure- und Häm-Stoffwechsel. ⓘ
Im Einzelnen untersuchten sie 3 Teilsysteme: Fettsäuresynthese und -elongation sowie Aminozuckerbiosynthese. Für die ersten beiden Wege wiesen sie eine klare Abhängigkeit des Leberstadiums von seinem eigenen Fettsäurestoffwechsel nach. ⓘ
Sie wiesen zum ersten Mal die kritische Rolle der Aminozuckerbiosynthese im Leberstadium von P. berghei nach. Die Aufnahme von N-Acetyl-Glucosamin scheint im Leberstadium begrenzt zu sein, da dessen Synthese für die Entwicklung des Parasiten notwendig ist. ⓘ
Diese Erkenntnisse und das Berechnungsmodell bieten eine Grundlage für die Entwicklung von Malariatherapien, die auf Stoffwechselproteine abzielen. ⓘ
Andere
Eine nicht-chemische Strategie zur Vektorkontrolle beinhaltet die genetische Manipulation von Malariamücken. Dank der Fortschritte in der Gentechnik ist es möglich, fremde DNA in das Genom der Mücke einzuschleusen und entweder die Lebensdauer der Mücke zu verkürzen oder sie resistenter gegen den Malariaparasiten zu machen. Die Technik der sterilen Insekten ist eine genetische Kontrollmethode, bei der eine große Anzahl steriler männlicher Moskitos gezüchtet und freigesetzt wird. Durch die Paarung mit wilden Weibchen wird die Wildpopulation in der folgenden Generation reduziert; wiederholte Freisetzungen eliminieren schließlich die Zielpopulation. ⓘ
Die Genomik spielt in der Malariaforschung eine zentrale Rolle. Mit der Sequenzierung von P. falciparum, einem seiner Vektoren, Anopheles gambiae, und dem menschlichen Genom kann die Genetik aller drei Organismen im Lebenszyklus der Malaria untersucht werden. Eine weitere neue Anwendung der Gentechnologie ist die Möglichkeit, gentechnisch veränderte Moskitos herzustellen, die keine Malaria übertragen, was eine biologische Kontrolle der Malariaübertragung ermöglichen könnte. ⓘ
In einer Studie wurde ein gentechnisch veränderter Stamm von Anopheles stephensi erzeugt, der die Malariaübertragung nicht mehr unterstützt, und diese Resistenz wurde an die Nachkommen der Mücken weitergegeben. ⓘ
Gene Drive ist eine Technik zur Veränderung von Wildpopulationen, um beispielsweise Insekten zu bekämpfen oder zu eliminieren, damit sie keine Krankheiten übertragen können (insbesondere Stechmücken im Falle von Malaria, Zika, Dengue und Gelbfieber). ⓘ
Im Dezember 2020 wurde in einem Übersichtsartikel festgestellt, dass in Regionen, in denen Malaria endemisch ist, die gemeldete Sterblichkeitsrate bei COVID-19 im Durchschnitt niedriger ist als in Regionen, in denen Malaria nicht als endemisch bekannt ist. ⓘ
Verteiltes Rechnen
Es existieren derzeit (Stand August 2013) mehrere nicht-kommerzielle Projekte des verteilten Rechnens für die Suche nach neuen Medikamenten resp. effektiven Gegenmaßnahmen. Dabei können Privatpersonen die überschüssige Rechenzeit ihres Computers zur Verfügung stellen. ⓘ
Das World-Community-Grid-Projekt GO Fight Against Malaria wurde Mitte 2013 erfolgreich abgeschlossen; die Datenauswertung läuft per Juli 2014 noch, erste Ergebnisse werden von den Projektinitiatoren als „vielversprechend“ eingeschätzt und haben auch zu einer wissenschaftlichen Publikation geführt. Aktiv sind aktuell die Projekte FightMalaria@Home sowie Malaria Control. ⓘ
Körpergeruch bei Erkrankten
In mehreren Studien wurde nachgewiesen, dass eine Infektion mit Plasmodium den Körpergeruch der Infizierten derart verändert, dass die Plasmodium übertragenden Insekten verstärkt von den Infizierten angelockt werden. Dies kann zur raschen und effektiven Verbreitung der Erreger beitragen. ⓘ
Andere Tiere
Zwar gibt es keine tierischen Reservoire für die Malariastämme, die Infektionen beim Menschen verursachen, doch wurden fast 200 parasitäre Plasmodium-Arten identifiziert, die Vögel, Reptilien und andere Säugetiere befallen, und etwa 30 Arten infizieren auf natürliche Weise nichtmenschliche Primaten. Einige Malariaparasiten, die nichtmenschliche Primaten befallen, dienen als Modellorganismen für menschliche Malariaparasiten, wie z. B. P. coatneyi (ein Modell für P. falciparum) und P. cynomolgi (P. vivax). Die Diagnoseverfahren zum Nachweis von Parasiten bei Nagetieren ähneln denen, die beim Menschen angewandt werden. Malariaparasiten, die Nagetiere befallen, werden in der Forschung häufig als Modelle verwendet, wie z. B. P. berghei. Die Vogelmalaria befällt in erster Linie Arten der Ordnung Passeriformes und stellt eine erhebliche Bedrohung für Vögel auf Hawaii, den Galapagos-Inseln und anderen Archipelen dar. Es ist bekannt, dass der Parasit P. relictum die Verbreitung und den Bestand endemischer Vögel auf Hawaii einschränkt. Es wird erwartet, dass die globale Erwärmung das Auftreten und die globale Verbreitung der Vogelmalaria verstärken wird, da die erhöhten Temperaturen optimale Bedingungen für die Vermehrung des Parasiten bieten. ⓘ
Wortherkunft
Der Krankheitsname Malaria ist abgeleitet von italienisch mal’aria („schlechte Luft“, die als schlechte Ausdünstung, genannt auch Miasma, insbesondere aus den Sümpfen steigt und seit der Antike als krankheitsverursachend, insbesondere beim Wechselfieber (Febris intermittens), gehalten wurde), von lateinisch mala „schlecht“, und aer „Luft“. Der italienische Ausdruck mal(a) aria findet sich 1709 in einem diese Erkrankung umfangreich behandelnden Werk des Mediziners Francesco Torti (1658–1741), einem Leibarzt von Francesco II. d’Este und Rinaldo d’Este. Der Anatom Jakob Henle hatte erkannt, dass die „Schlechte-Luft-Krankheit“ durch mikroskopisch kleine Lebewesen verursacht wird. ⓘ

Erreger
Lebenszyklus
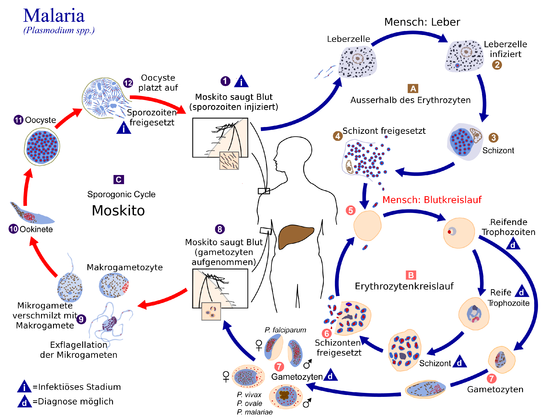
Im Laufe ihres Lebenszyklus vollziehen die Erreger der Malaria, die Plasmodien, einen Wirtswechsel. Der Mensch dient dabei als Zwischenwirt. Als Endwirt dienen Stechmücken, insbesondere der Gattung Anopheles. In ihnen vermehren sich die Plasmodien. ⓘ
In der Mücke (sexuelle Phase/Sporogonie)
Beim erneuten Stich einer Mücke werden die Gametozyten in die Mücke aufgenommen. Sie entwickeln sich in ihrem Darm zu Gameten. Der Mikrogamet penetriert den Makrogameten, und es entsteht eine Zygote. Diese verändert sich, nimmt eine längliche Form an und wird motil (= beweglich). Diese Zelle heißt nun Ookinet. Er lagert sich zwischen den Gewebeschichten des Mückendarms an und verwandelt sich dort zur Oozyste. In ihr entstehen bis zu 1.000 neue Sporozoiten. Nach ihrer Freisetzung wandern sie in die Speicheldrüsen der Mücke und stehen nun zur Neuinfektion bereit. Der Zyklus in der Anopheles dauert abhängig von der Außentemperatur zwischen 8 und 16 Tage. Dabei ist eine Mindesttemperatur von 15 °C erforderlich. Unterhalb dieser Temperatur kommt kein Zyklus mehr zustande. ⓘ
Infektionswege Mensch zu Mensch
Ohne den Weg über eine Mücke kann Malaria von Mensch zu Mensch über Blut übertragen werden. ⓘ
Dafür sind zwei Möglichkeiten bekannt:
- Über die verletzte Plazenta einer Schwangeren während der Geburt auf ihr Kind.
- Im Zuge einer Bluttransfusion. ⓘ
Nach dem Tod einer 84-Jährigen am 18. März 2019 nach einer Operation mit Bluttransfusionen im Februar davor in Kärnten wurde berichtet, dass Malaria, laut Staatsanwalt, ihren Tod verursacht habe. Die Blutbeutel sind zu den Spendern zurückverfolgbar. Spendenwillige müssen Auslandsreisen angeben und dürfen innerhalb von 6 Monaten nach Rückkehr aus einem von Malaria betroffenen Gebiet nicht spenden. Gespendetes Blut wird in Österreich bisher noch nicht auf Malariaerreger untersucht. ⓘ
Pathogenese
Immunologie
Bei der Erstinfektion mit Malaria besteht das höchste Sterberisiko. Die Überlebenden entwickeln eine teilweise Immunität und Toleranz gegenüber den Plasmodien. Diese partielle Immunität verhindert allerdings keine Reinfektion und sinkt bei fehlendem Erregerkontakt schnell ab. Der Erreger kann offensichtlich die immunologische Reaktion und das immunologische Gedächtnis behindern. Das Zytokin MIF (macrophage migration inhibitory factor) spielt dabei eine besondere Rolle. Plasmodien können im Erythrozyten-Stadium PMIF (Plasmodium MIF) synthetisieren, welches die gleichen biologischen Wirkungen wie menschliches MIF hat. PMIF kann die Differenzierung von Plasmodium-spezifischen CD4-T-Effektorzellen in langlebige Gedächtniszellen behindern. Ohne langlebige Gedächtniszellen nimmt aber die Immunität nach einer Infektion viel rascher ab. ⓘ
Darüber hinaus bestehen zwischen Plasmodium falciparum und den anderen Malariaerregern wichtige pathogenetische Unterschiede. ⓘ
Plasmodium falciparum
In den roten Blutkörperchen produziert der Trophozoit Proteine, wie zum Beispiel Pf EMP1 (Plasmodium falciparum infected erythrocyte membrane protein 1), welches eine Bindung der infizierten Blutkörperchen an das Endothel der Blutgefäße bewirkt. Die damit verbundenen Mikrozirkulationsstörungen erklären zumindest teilweise den deutlich schwereren Verlauf der durch Plasmodium falciparum hervorgerufenen Malaria tropica. ⓘ
Die Anhaftung der roten Blutkörperchen am Endothel und die mangelnde Verformbarkeit der befallenen Zellen führt zu einer Verengung der Kapillaren und somit zu einer Störung der Sauerstoff- und Nährstoffversorgung der Umgebung. Dies hat im zentralen Nervensystem besonders dramatische Auswirkungen und die häufigen zentralen Komplikationen der Malaria tropica zur Folge. Besonders kleine Kinder können in ein lebensbedrohliches Koma verfallen (cerebrale Malaria). ⓘ
Übrige Plasmodien
Die übrigen Plasmodienarten sind nicht in der Lage, am Endothel zu haften, womit auch die geringere Anzahl an Durchblutungsstörungen und somit die geringe Gefährlichkeit zu erklären ist. Plasmodium malariae unterscheidet sich von den anderen humanpathogenen Plasmodien dadurch, dass es vereinzelt auch andere höhere Primaten befällt. ⓘ
Klinisches Bild, Symptomatik
Malaria tropica
Inkubationszeit
Zwischen dem Stich der Anopheles-Mücke und dem Krankheitsausbruch liegen im Mittel zwölf (7 bis 14) Tage. Erheblich kürzere Zeitintervalle treten bei einer Infektion mit erregerhaltigem Blut auf. Längere Inkubationszeiten sind unter Einnahme einer unzureichenden Chemoprophylaxe möglich. ⓘ
Neurologische Komplikationen
Bewusstseinsstörungen, die bis zum Koma reichen können, stellen eine typische und auch lebensbedrohliche Komplikation der Malaria tropica dar. Dabei sind plötzliche Wechsel der Bewusstseinslage ohne Vorzeichen durchaus möglich. Es kann auch zu einer langsamen Eintrübung des Patienten kommen. Im Rahmen einer zerebralen Malaria können auch neurologische Herdsymptome wie Lähmungen und Krampfanfälle auftreten. Die normale neurologische Diagnostik führt hier kaum zu einer adäquaten Diagnose. Eine hohe Parasitenzahl im Blut dient als entscheidender Hinweis. ⓘ
Bei Schwangeren und Kindern können Hypoglykämien auftreten, die allein oder mit der zentralen Problematik zum Koma führen. ⓘ
Anämie
Anämien treten häufig bei schweren Infektionen auf und sind bei einem Hämoglobinwert unter 8 g/dL eines der Zeichen einer komplizierten Malaria. Eine besondere Risikogruppe für schwere Anämien stellen Säuglinge und Kleinkinder dar. Meist handelt es sich um eine hämolytische Anämie durch Zerstörung roter Blutkörperchen. Wie oben erwähnt besitzt auch die Hemmung der Erythropoese eine gewisse Bedeutung. Die Schwere der Anämie korreliert stark mit dem Ausmaß des Parasitenbefalls. ⓘ
Hämoglobinurie
Der durch die massive Hämolyse angestiegene Hämoglobin-Spiegel im Blut führt zu einer Hämoglobinurie (daher die frühere Bezeichnung Schwarzwasserfieber, welches vor allem bei Malaria tropica nach Chiningebrauch beobachtet wurde), dem Ausscheiden von Hämoglobin über die Nieren. Die dadurch verursachte Erhöhung des Hämoglobinanteils im Urin färbt ihn deutlich dunkler. Die mit bloßem Auge sichtbare Hämoglobinurie zählt zu den Kriterien einer komplizierten Malaria und kann zu einem akuten Nierenversagen führen. Zur Therapie des Schwarzwasserfiebers gehört das Absetzen von Chininpräparaten und die Gabe von Chloroquin. ⓘ
Veränderungen anderer Organsysteme

Im Laufe der Erkrankung kann es zu einer für die Malaria charakteristischen Vergrößerung der Milz (Splenomegalie, „Milztumor“) kommen, bedingt durch die große Zahl dort abzubauender Trümmer roter Blutkörperchen. In seltenen Fällen führt das Gewebswachstum zu einer Spannung der Kapsel, so dass diese leicht einreißen kann (Milzruptur). Den Magen-Darm-Trakt betreffende Symptome wie Durchfälle sind häufig und differentialdiagnostisch von Bedeutung, da sie bei fehlendem oder schwach ausgeprägtem Fieber zur falschen Diagnose bakterielle Enteritis führen können. ⓘ
In bis zu zehn Prozent der Fälle kann eine Lungenbeteiligung auftreten, die von leichten Symptomen bis zu einem Lungenödem als Kriterium einer komplizierten Malaria reichen kann. ⓘ
Nicht selten kommt es durch eine Durchblutungsstörung der Niere zu einem akuten Nierenversagen. Das Nierenversagen (mit einem Kreatininwert von über 250 µmol/L) gehört zu den Kriterien einer komplizierten Malaria. Nach ausgeheilter Infektion erholt sich die Niere meist. ⓘ
Meist kann eine Thrombozytopenie nachgewiesen werden. ⓘ
Malaria tertiana
Inkubationszeit
Die Inkubationszeit beträgt etwa zwischen 12 und 18 (zwischen 9 und 21) Tagen, kann aber auch mehrere Monate dauern, wenn der Verlauf der Infektion durch die Chemoprophylaxe verlangsamt wird. ⓘ
Malaria quartana
Die heute seltene, insbesondere in Afrika und Südostasien auftretende Malaria quartana (auch Quartana, von febris quartana, und viertägiges Fieber, früher auch Vierttagfieber, genannt; veraltete deutsche Bezeichnung: „Quartanfieber“) wird durch den Erreger Plasmodium malariae verursacht. Auch hier handelt es sich um eine schwere fieberhafte, aber nur selten tödlich endende Form der Malaria. Eine charakteristische Komplikation ist das nephrotische Syndrom. Besonders an dieser Form ist, dass es selbst nach über 50 Jahren noch zu Rezidiven kommen kann. Auch ist die Inkubationszeit erheblich länger als bei den beiden anderen Formen. ⓘ
Inkubationszeit
Die Inkubationszeit beträgt zwischen 16 und 50 (meist zwischen 19 und 41) Tagen. Somit ist sie erheblich länger als bei den übrigen Krankheitsformen. ⓘ
Nierenbeteiligung
Im Verlauf der Malaria quartana kann es zu einer schweren Nierenbeteiligung kommen. Diese wird unter anderem als Malarianephrose bezeichnet. Es handelt sich hierbei um ein nephrotisches Syndrom mit folgenden Symptomen:
- niedriges Serumeiweiß Albumin (im Blutkreislauf mitverantwortlich für die Regulation des Wasserhaushalts)
- Wasseransammlung im Bindegewebe (Ödeme) und der Bauchhöhle (Aszites) durch den Albuminmangel
- erhöhtes Serumcholesterin ⓘ
Epidemiologische Studien haben gezeigt, dass diese Komplikation gehäuft bei Kindern zwischen zwei und zehn Jahren im tropischen Afrika auftritt. ⓘ
Vorbeugung und Behandlung
Insektenschutz
Der Insektenschutz (als Expositionsprophylaxe) ist der wichtigste Bestandteil der Malariavorbeugung. Dazu zählt das Tragen heller, hautbedeckender, langer Kleidung, der Aufenthalt in mückensicheren Räumen (insbesondere nachts; Klimaanlage, Fliegengitter, Moskitonetz) sowie die Behandlung von Haut und Kleidung mit moskitoabweisenden Mitteln, sogenannten Repellentien (z. B. Icaridin oder DEET). Die zusätzliche Verwendung von Insektiziden in Sprays (allen voran Pyrethroide), Verdampfern, Räucherspiralen („mosquito coils“) und ähnlichem kann zusätzlichen Schutz bieten. Nach wie vor schützen sich jedoch viele Reisende nicht konsequent gegen Mücken. So ergab eine im April 2006 veröffentlichte Untersuchung aus Frankreich, dass weniger als 10 % der an Malaria erkrankten Patienten Maßnahmen zur Abwehr von Insekten angewendet hatten. ⓘ
Vektorkontrolle
Als Vektorkontrolle (Bekämpfung des Überträgers) bezeichnet man den Versuch, Neuinfektionen durch gezielte Bekämpfung der Anopheles-Mücke zu verhindern. Zu diesem Zweck werden Insektizide in den Wohnstätten der Menschen versprüht oder es wird die Verwendung von insektizidimprägnierten Bettnetzen (IIB) propagiert. ⓘ
In den 1950er- und 1960er-Jahren wurde unter Federführung der WHO versucht, Malaria im Rahmen des Global Eradication of Malaria Program zu vernichten. Ein wichtiger Bestandteil der Kampagne war das Besprühen der Innenwände aller Wohnungen und Häuser mit DDT. Das Testgebiet Sardinien wurde 1950 von Malaria befreit, ohne jedoch den Vektor auszurotten. Trotz der anfänglichen Erfolge wurde das Projekt Anfang der 1970er-Jahre als gescheitert eingestellt. ⓘ
Der Einsatz von DDT in Wohnhäusern (Innenraumbesprühung) ist umstritten. Die Zunahme von Resistenzen gegen DDT kann seine Wirksamkeit einschränken. Das Ausbringen von DDT in Innenräumen birgt möglicherweise gesundheitliche Risiken: Es gibt Hinweise darauf, dass das DDT zu einem höheren Risiko von Fehlgeburten oder Missbildungen führen, die Samenqualität bei Männern senken oder an der Entstehung verschiedener Formen von Krebs beteiligt sein könnte. Bei Langzeitstudien an Ratten, Mäusen und Hamstern konnte die kanzerogene Wirkung von technischem DDT mit Bildung von Tumoren in Leber, Lunge und dem Lymphsystem nachgewiesen werden und die Internationale Agentur für Krebsforschung (IARC) der WHO stufte DDT im Jahr 2015 als „wahrscheinlich krebserregend bei Menschen“ (Gruppe 2A) ein. Heute ist die Herstellung und Verwendung von DDT weltweit nur noch in wenigen Staaten zum Zwecke der Bekämpfung von Krankheitsüberträgern zugelassen. Doch selbst diese Zulassungen werden sukzessive zurückgenommen. Beispielsweise plant Indien als der letzte Großanwender von DDT zur Bekämpfung der Malaria die Verwendung bis 2020 einzustellen. ⓘ
Meldepflicht
In Deutschland ist der Nachweis der Erreger Plasmodium sp. nach § 7 Absatz 3 Infektionsschutzgesetz (IfSG) nichtnamentlich zu melden. Meldepflichtig sind die Leitungen der Labore usw. (§ 8 IfSG). Nach dem Recht Sachsens besteht eine namentliche Meldepflicht bezüglich Erkrankung und Tod an Malaria. ⓘ
In Österreich ist Malaria eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Nr. 2 Epidemiegesetz 1950. Meldepflichtig sind Erkrankungs- und Todesfälle. Zur Anzeige verpflichtet sind unter anderem Ärzte und Labore (§ 3 Epidemiegesetz). ⓘ
In der Schweiz besteht Meldepflicht für Malaria in Bezug auf einen positiven laboranalytischer Befund durch den behandelnden Arzt. Zudem bei positiven Laborbefund für die Erreger Plasmodium spp. durch das untersuchende Labor. Dies ergibt sich aus dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. ⓘ
Armutsbedingte Krankheit
Die Malaria wird auch als armutsbedingte Krankheit bezeichnet. Hinter dieser Bezeichnung steht zum einen das Kalkül, dass von der Krankheit hauptsächlich arme Menschen betroffen sind, die über wenig Kaufkraft verfügen und folglich keinen attraktiven Markt bilden. Für Pharmaunternehmen ist es daher ökonomisch sinnvoller, Mittel gegen medizinisch weniger „dringende“ Krankheiten zu erforschen, deren Betroffene kaufkräftiger sind. ⓘ
Norbert Blüm schrieb 2003 dazu:
„Die Pharmaindustrie gibt weltweit doppelt so viel Forschungsmittel im Kampf gegen Haarausfall und Erektionsschwächen aus wie gegen Malaria, Gelbfieber und Bilharziose. Das ist marktwirtschaftlich konsequent, denn die Kunden mit Erektionsschwächen und Haarausfall haben in der Regel mehr Kaufkraft als die Malaria- und Gelbfieberkranken.“ ⓘ
Die Europäische Union will als Reaktion auf diesen Mechanismus die Entwicklung von Mitteln gegen armutsbedingte Krankheiten mit 600 Millionen Euro fördern. 2019 gründete sie den EU Malaria Fund Berlin, mit dem europäische Projekte und Unternehmen in der Forschung gegen Malaria unterstützt werden. ⓘ
Andererseits ist es fraglich, ob gerade für Regionen, in denen die Malaria wie die Armut verbreitet sind, die Bekämpfung der Malaria durch Entwicklung eines Impfstoffes im Vordergrund stehen sollte. Der Parasitologe Paul Prociv weist darauf hin, dass Erwachsene in Malariagebieten durch ständige Reinfektion praktisch immun gegen die Krankheit sind. Vorrang hätte die Hebung der allgemeinen Gesundheitsfürsorge und Lebensumstände. Von einem Malariaimpfstoff würden hauptsächlich westliche Besucher der Tropen profitieren, die die Nebenwirkungen der herkömmlichen Malariavorsorge scheuen. ⓘ
Als armutsbedingte Erkrankung kann Malaria auch gelten, da in vielen Ländern der sogenannten Dritten Welt die Wohnverhältnisse der meisten Menschen nicht den Standards zur Infektionsvermeidung (geschlossene Wohnräume, Moskitonetze, Klimaanlage, Insektensprays usw.) entsprechen, keine Chemoprophylaxe zur Verfügung steht und Medikamente teuer und schwer zu beschaffen sind (siehe auch Abschnitt Vorbeugung und Behandlung). ⓘ
Aufgrund der mangelnden finanziellen Unterstützung gab Bill Gates Ende Oktober 2005 bekannt, dass er zur Förderung der Malariaforschung eine Summe von 258,3 Millionen Dollar zur Verfügung stellen werde. Seiner Meinung nach stelle „es für die Welt eine Schande dar, dass sich in den letzten 20 Jahren jene durch Malaria hervorgerufenen Todesfälle verdoppelten, zumal gegen jene Krankheit sehr stark vorgegangen werden könnte.“ ⓘ