Metalle


| Teil einer Serie über das ⓘ |
| Periodensystem |
|---|
|
Gruppen von Elementen |
|
Elemente |
|
Ein Metall (von griechisch μέταλλον métallon, "Bergwerk, Steinbruch, Metall") ist ein Material, das, wenn es frisch aufbereitet, poliert oder gebrochen ist, ein glänzendes Aussehen hat und Elektrizität und Wärme relativ gut leitet. Metalle sind in der Regel verformbar (sie können in dünne Bleche gehämmert werden) oder dehnbar (sie können zu Drähten gezogen werden). Ein Metall kann ein chemisches Element wie Eisen, eine Legierung wie rostfreier Stahl oder eine molekulare Verbindung wie polymeres Schwefelnitrid sein. ⓘ
In der Physik wird ein Metall im Allgemeinen als jede Substanz betrachtet, die bei einer Temperatur von absolut Null Elektrizität leiten kann. Viele Elemente und Verbindungen, die normalerweise nicht als Metalle eingestuft werden, werden unter hohem Druck zu Metallen. So wird beispielsweise das Nichtmetall Jod bei einem Druck zwischen dem 40- und 170-tausendfachen des Atmosphärendrucks allmählich zu einem Metall. Ebenso können einige Materialien, die als Metalle gelten, zu Nichtmetallen werden. Natrium zum Beispiel wird bei einem Druck von knapp zwei Millionen Mal Atmosphärendruck zum Nichtmetall. ⓘ
In der Chemie werden zwei Elemente, die (in der Physik) als spröde Metalle gelten würden - Arsen und Antimon - aufgrund ihrer chemischen Eigenschaften (überwiegend nichtmetallisch bei Arsen und ausgewogen zwischen Metallizität und Nichtmetallizität bei Antimon) üblicherweise als Metalloide bezeichnet. Etwa 95 der 118 Elemente im Periodensystem sind Metalle (oder werden wahrscheinlich Metalle sein). Die Zahl ist ungenau, da die Grenzen zwischen Metallen, Nichtmetallen und Metalloiden leicht schwanken, da es keine allgemein anerkannten Definitionen für die betreffenden Kategorien gibt. ⓘ
In der Astrophysik wird der Begriff "Metall" weiter gefasst und bezieht sich auf alle chemischen Elemente in einem Stern, die schwerer als Helium sind, und nicht nur auf die traditionellen Metalle. In diesem Sinne sind die ersten vier "Metalle", die sich in den Sternkernen durch Nukleosynthese ansammeln, Kohlenstoff, Stickstoff, Sauerstoff und Neon, die alle in der Chemie streng genommen Nichtmetalle sind. Ein Stern verschmilzt im Laufe seines Lebens leichtere Atome, meist Wasserstoff und Helium, zu schwereren Atomen. In diesem Sinne ist die Metallizität eines astronomischen Objekts der Anteil seiner Materie, der aus schwereren chemischen Elementen besteht. ⓘ
Metalle, als chemische Elemente, machen 25 % der Erdkruste aus und sind in vielen Aspekten des modernen Lebens vorhanden. Die Festigkeit und Widerstandsfähigkeit einiger Metalle hat dazu geführt, dass sie häufig verwendet werden, z. B. beim Bau von Hochhäusern und Brücken, aber auch bei den meisten Fahrzeugen, vielen Haushaltsgeräten, Werkzeugen, Rohren und Eisenbahnschienen. In der Vergangenheit wurden Edelmetalle als Münzen verwendet, aber in der Neuzeit haben sich die Münzmetalle auf mindestens 23 der chemischen Elemente ausgedehnt. ⓘ
Man geht davon aus, dass die Geschichte der veredelten Metalle mit der Verwendung von Kupfer vor etwa 11.000 Jahren begann. Gold, Silber, Eisen (als Meteoreisen), Blei und Messing wurden ebenfalls verwendet, bevor Bronze im 5. Zu den späteren Entwicklungen gehören die Herstellung früher Formen von Stahl, die Entdeckung von Natrium - dem ersten Leichtmetall - im Jahr 1809, der Aufstieg moderner legierter Stähle und seit dem Ende des Zweiten Weltkriegs die Entwicklung immer ausgefeilterer Legierungen. ⓘ
Kristall aus 99,999 % reinem Gallium
Kupferscheibe nach dem Stranggussverfahren hergestellt, geätzt, Reinheit ≥99,95 %, Ø≈10 cm ⓘ
Der Begriff Metall wird auch für Legierungen und einige intermetallische Phasen verwendet, denn der Begriff gilt für alle Materialien, die in fester oder flüssiger Form die folgenden vier charakteristischen metallischen Stoffeigenschaften in mehr oder weniger ausgeprägter Form aufweisen:
- hohe elektrische Leitfähigkeit, die mit steigender Temperatur abnimmt,
- hohe Wärmeleitfähigkeit, was dazu führt, dass sich Metalle kühl anfühlen
- Duktilität (Verformbarkeit), was die Bildung dünner Bleche oder langer Drähte ermöglicht
- metallischer Glanz (Spiegelglanz). ⓘ
Alle diese Eigenschaften beruhen darauf, dass der Zusammenhalt der betreffenden Atome mit der metallischen Bindung erfolgt, deren wichtigstes Merkmal die im Gitter frei beweglichen Elektronen sind. ⓘ
Ein einzelnes Atom dieser Elemente hat keine metallischen Eigenschaften; es ist kein Metall. Erst wenn mehrere solcher Atome miteinander wechselwirken können und wenn zwischen ihnen metallische Bindungen bestehen, zeigen solche Atomgruppen (cluster) metallische Eigenschaften. ⓘ
Einzelne Atome dieser Elemente können sich bei extrem schneller Abkühlung auch amorph zusammenlagern, ohne ein Kristallgitter zu bilden – siehe Metallisches Glas. ⓘ
Andererseits können auch Atome von Nichtmetallen unter extremen Bedingungen (Druck) metallische Bindungen eingehen und dann die genannten metallischen Eigenschaften annehmen – siehe metallischer Wasserstoff. ⓘ
Metalle finden seit Beginn der Zivilisation vielfältige Anwendungen als Werkstoffe. Unter dem Begriff Metallphysik oder auch Metallkunde beschäftigen sich Physiker und Materialwissenschaftler mit allen Grundlagen, siehe unter Festkörperphysik, und mit Anwendungen, siehe unter Materialwissenschaft. ⓘ
Eigenschaften
Form und Struktur
Metalle sind glänzend und schimmernd, zumindest wenn sie frisch präpariert, poliert oder zerbrochen sind. Metallplatten, die dicker als ein paar Mikrometer sind, erscheinen undurchsichtig, aber Blattgold lässt grünes Licht durch. ⓘ
Der feste oder flüssige Zustand von Metallen ist im Wesentlichen auf die Fähigkeit der beteiligten Metallatome zurückzuführen, ihre äußeren Schalenelektronen leicht zu verlieren. Im Allgemeinen sind die Kräfte, die die Elektronen der äußeren Schale eines einzelnen Atoms an Ort und Stelle halten, schwächer als die Anziehungskräfte auf dieselben Elektronen, die sich aus den Wechselwirkungen zwischen den Atomen in einem festen oder flüssigen Metall ergeben. Die beteiligten Elektronen werden delokalisiert und die atomare Struktur eines Metalls kann als eine Ansammlung von Atomen dargestellt werden, die in eine Wolke relativ beweglicher Elektronen eingebettet sind. Diese Art der Wechselwirkung wird als Metallbindung bezeichnet. Die Stärke der metallischen Bindungen verschiedener elementarer Metalle erreicht ein Maximum in der Mitte der Übergangsmetallreihe, da diese Elemente eine große Anzahl delokalisierter Elektronen aufweisen. ⓘ
Obwohl die meisten elementaren Metalle eine höhere Dichte als die meisten Nichtmetalle aufweisen, gibt es große Unterschiede in ihrer Dichte, wobei Lithium die geringste (0,534 g/cm3) und Osmium (22,59 g/cm3) die höchste Dichte aufweist. Magnesium, Aluminium und Titan sind Leichtmetalle von großer wirtschaftlicher Bedeutung. Ihre jeweiligen Dichten von 1,7, 2,7 und 4,5 g/cm3 können mit denen der älteren Konstruktionsmetalle, wie Eisen mit 7,9 und Kupfer mit 8,9 g/cm3, verglichen werden. Eine Eisenkugel wiegt also etwa so viel wie drei Aluminiumkugeln gleichen Volumens. ⓘ

Metalle sind in der Regel formbar und dehnbar und verformen sich unter Spannung, ohne sich zu spalten. Es wird angenommen, dass die ungerichtete Natur der metallischen Bindung wesentlich zur Verformbarkeit der meisten metallischen Festkörper beiträgt. Im Gegensatz dazu verschieben sich bei einer ionischen Verbindung wie Kochsalz die Ebenen einer Ionenbindung aneinander vorbei, wodurch sich die Ionen mit der gleichen Ladung in die Nähe des Kristalls bewegen, was zur Spaltung des Kristalls führt. Eine solche Verschiebung wird in einem kovalent gebundenen Kristall, wie z. B. einem Diamanten, nicht beobachtet, und es kommt zum Bruch und zur Zersplitterung des Kristalls. Reversible elastische Verformung in Metallen kann durch das Hooke'sche Gesetz für Rückstellkräfte beschrieben werden, bei dem die Spannung linear proportional zur Dehnung ist. ⓘ
Wärme oder Kräfte, die größer sind als die Elastizitätsgrenze eines Metalls, können eine dauerhafte (irreversible) Verformung verursachen, die als plastische Verformung oder Plastizität bezeichnet wird. Eine einwirkende Kraft kann eine Zugkraft (Ziehen), eine Druckkraft (Drücken) oder eine Scher-, Biege- oder Torsionskraft (Verdrehen) sein. Eine Temperaturänderung kann sich auf die Bewegung oder Verschiebung von Strukturdefekten im Metall auswirken, wie z. B. Korngrenzen, Punktlücken, Linien- und Schraubenversetzungen, Stapelfehler und Zwillinge sowohl in kristallinen als auch in nichtkristallinen Metallen. Internes Gleiten, Kriechen und Metallermüdung können die Folge sein. ⓘ
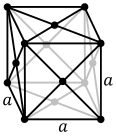
Die Atome metallischer Stoffe sind in der Regel in einer der drei üblichen Kristallstrukturen angeordnet, nämlich kubisch-raumzentriert (bcc), kubisch-flächenzentriert (fcc) und hexagonal dicht gepackt (hcp). In bcc, each atom is positioned at the center of a cube of eight others. In fcc and hcp, each atom is surrounded by twelve others, but the stacking of the layers differs. Some metals adopt different structures depending on the temperature. ⓘ
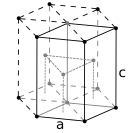
- Hexagonal close-packed crystal structure, with a 6-atom unit cell, as found in e.g. titanium, cobalt, and zincⓘ
The unit cell for each crystal structure is the smallest group of atoms which has the overall symmetry of the crystal, and from which the entire crystalline lattice can be built up by repetition in three dimensions. In the case of the body-centered cubic crystal structure shown above, the unit cell is made up of the central atom plus one-eight of each of the eight corner atoms. ⓘ
Electrical and thermal

Die elektronische Struktur von Metallen bedeutet, dass sie relativ gute Stromleiter sind. Elektronen können in der Materie nur feste und keine variablen Energieniveaus haben, und in einem Metall entsprechen die Energieniveaus der Elektronen in seiner Elektronenwolke zumindest bis zu einem gewissen Grad den Energieniveaus, bei denen elektrische Leitung auftreten kann. In einem Halbleiter wie Silizium oder einem Nichtmetall wie Schwefel gibt es eine Energielücke zwischen den Elektronen in der Substanz und dem Energieniveau, bei dem elektrische Leitung auftreten kann. Folglich sind Halbleiter und Nichtmetalle relativ schlecht leitend. ⓘ
Die elementaren Metalle haben elektrische Leitfähigkeitswerte von 6,9 × 103 S/cm für Mangan bis 6,3 × 105 S/cm für Silber. Im Gegensatz dazu hat ein halbleitendes Metalloid wie Bor eine elektrische Leitfähigkeit von 1,5 × 10-6 S/cm. Mit einer Ausnahme verringern metallische Elemente ihre elektrische Leitfähigkeit, wenn sie erhitzt werden. Plutonium erhöht seine elektrische Leitfähigkeit bei Erwärmung im Temperaturbereich von etwa -175 bis +125 °C. ⓘ
Metalle sind relativ gute Wärmeleiter. Die Elektronen in der Elektronenwolke eines Metalls sind sehr beweglich und können die durch Wärme verursachte Schwingungsenergie leicht weitergeben. ⓘ
Der Beitrag der Elektronen eines Metalls zu seiner Wärmekapazität und Wärmeleitfähigkeit sowie die elektrische Leitfähigkeit des Metalls selbst können anhand des Modells der freien Elektronen berechnet werden. Dabei wird jedoch die detaillierte Struktur des Ionengitters des Metalls nicht berücksichtigt. Die Berücksichtigung des positiven Potenzials, das durch die Anordnung der Ionenkerne entsteht, ermöglicht die Betrachtung der elektronischen Bandstruktur und der Bindungsenergie eines Metalls. Es gibt verschiedene mathematische Modelle, von denen das einfachste das Modell der nahezu freien Elektronen ist. ⓘ
Chemisch
Metalle neigen in der Regel dazu, durch Elektronenverluste Kationen zu bilden. Die meisten reagieren mit Luftsauerstoff und bilden über verschiedene Zeiträume hinweg Oxide (Kalium verbrennt in Sekunden, während Eisen über Jahre hinweg rostet). Einige andere, wie Palladium, Platin und Gold, reagieren überhaupt nicht mit der Atmosphäre. Die Oxide von Metallen sind im Allgemeinen basisch, während die Oxide von Nichtmetallen sauer oder neutral sind. Ausnahmen sind vor allem Oxide mit sehr hohen Oxidationsstufen wie CrO3, Mn2O7 und OsO4, die streng sauer reagieren. ⓘ
Lackieren, Eloxieren oder Beschichten von Metallen sind gute Möglichkeiten, ihre Korrosion zu verhindern. Für die Beschichtung muss jedoch ein reaktionsfreudigeres Metall aus der elektrochemischen Reihe gewählt werden, vor allem, wenn ein Abplatzen der Beschichtung zu erwarten ist. Wasser und die beiden Metalle bilden eine elektrochemische Zelle, und wenn die Beschichtung weniger reaktiv ist als das darunter liegende Metall, fördert die Beschichtung sogar die Korrosion. ⓘ
Einteilung
| H | He ⓘ | |||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| Cs | Ba | La | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| * | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| ** | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
Traditionell unterteilt man Metalle nach der Dichte in Schwermetalle und Leichtmetalle und nach der Reaktivität in Edelmetalle und unedle Metalle, wobei Letztere gute Reduktionsmittel darstellen. Siehe hierzu auch den Hauptartikel Metallischer Werkstoff (sowie zur Reaktivität unter Redoxreaktion). ⓘ
Metalle werden gebildet von den Elementen, die im Periodensystem der Elemente im Bereich links und unterhalb einer Linie vom Bor zum Astat stehen, wobei der metallische Charakter von oben nach unten bzw. von rechts nach links zunimmt. Ganz oben rechts befinden sich die Nichtmetalle, dazwischen die Halbmetalle. Die Nebengruppenelemente bilden ausnahmslos Metalle. Die Grenze zu den Nichtmetallen ist fließend. So haben zum Beispiel Antimon, Arsen, Cer und Zinn sowohl metallische als auch nichtmetallische Modifikationen. ⓘ
Für das chemische Verhalten ist auch die Zugehörigkeit zu Haupt- oder Nebengruppen des Periodensystems entscheidend. ⓘ
In der Chemie sind die Elemente, die unter normalen Bedingungen als Metalle angesehen werden, im nachstehenden Periodensystem gelb dargestellt. Bei den übrigen Elementen handelt es sich entweder um Metalloide (B, Si, Ge, As, Sb und Te werden gemeinhin als solche angesehen) oder um Nichtmetalle. Astat (At) wird in der Regel entweder als Nichtmetall oder als Metalloid eingestuft, aber einige Vorhersagen gehen davon aus, dass es sich um ein Metall handelt; daher wurde es aufgrund des unklaren Stands der experimentellen Erkenntnisse leer gelassen. Bei den anderen Elementen mit unbekannten Eigenschaften handelt es sich wahrscheinlich um Metalle, bei Copernicium (Cn) und Oganesson (Og) bestehen jedoch gewisse Zweifel. ⓘ
Legierungen
Eine Legierung ist ein Stoff mit metallischen Eigenschaften, der aus zwei oder mehr Elementen besteht, von denen mindestens eines ein Metall ist. Eine Legierung kann eine variable oder feste Zusammensetzung haben. So bilden beispielsweise Gold und Silber eine Legierung, bei der das Verhältnis von Gold und Silber frei eingestellt werden kann; Titan und Silizium bilden eine Legierung Ti2Si, bei der das Verhältnis der beiden Komponenten festgelegt ist (auch als intermetallische Verbindung bezeichnet). ⓘ
Die meisten reinen Metalle sind entweder zu weich, spröde oder chemisch reaktiv für den praktischen Gebrauch. Durch die Kombination verschiedener Anteile von Metallen in Form von Legierungen werden die Eigenschaften von reinen Metallen so verändert, dass sie die gewünschten Merkmale aufweisen. Ziel der Herstellung von Legierungen ist es im Allgemeinen, sie weniger spröde, härter und korrosionsbeständiger zu machen oder ihnen eine bessere Farbe und einen besseren Glanz zu verleihen. Von allen heute verwendeten Metalllegierungen machen die Eisenlegierungen (Stahl, Edelstahl, Gusseisen, Werkzeugstahl, legierter Stahl) sowohl mengenmäßig als auch vom Handelswert her den größten Anteil aus. Eisen, das mit verschiedenen Anteilen an Kohlenstoff legiert ist, ergibt Stähle mit niedrigem, mittlerem und hohem Kohlenstoffgehalt, wobei mit zunehmendem Kohlenstoffgehalt die Duktilität und Zähigkeit abnimmt. Der Zusatz von Silizium führt zu Gusseisen, während der Zusatz von Chrom, Nickel und Molybdän zu Kohlenstoffstählen (mehr als 10 %) zu rostfreien Stählen führt. ⓘ
Andere wichtige Metalllegierungen sind Aluminium, Titan, Kupfer und Magnesium. Kupferlegierungen sind seit der Vorgeschichte bekannt - Bronze gab der Bronzezeit ihren Namen - und finden heute zahlreiche Anwendungen, vor allem in der elektrischen Verdrahtung. Die Legierungen der anderen drei Metalle wurden erst vor relativ kurzer Zeit entwickelt; aufgrund ihrer chemischen Reaktivität erfordern sie elektrolytische Extraktionsverfahren. Die Legierungen aus Aluminium, Titan und Magnesium werden wegen ihres guten Verhältnisses von Festigkeit zu Gewicht geschätzt; Magnesium kann auch zur elektromagnetischen Abschirmung dienen. Diese Werkstoffe sind ideal für Situationen, in denen ein hohes Festigkeits-Gewichts-Verhältnis wichtiger ist als die Materialkosten, wie z. B. in der Luft- und Raumfahrt und bei einigen Automobilanwendungen. ⓘ
Legierungen, die speziell für sehr anspruchsvolle Anwendungen, wie z. B. Düsentriebwerke, entwickelt wurden, können mehr als zehn Elemente enthalten. ⓘ
Kategorien
| Metallische Elemente ⓘ |
|---|
| Alkalimetalle |
| Erdalkalimetalle |
| Übergangsmetalle |
| Post-Übergangsmetalle |
| Lanthanoide |
|
| Aktiniden |
| Elemente, die möglicherweise Metalle sind |
|
| Elemente, die manchmal als Metalle angesehen werden |
|
Metalle können nach ihren physikalischen oder chemischen Eigenschaften in Kategorien eingeteilt werden. Zu den in den folgenden Unterabschnitten beschriebenen Kategorien gehören Eisen- und Nichteisenmetalle, spröde Metalle und hochschmelzende Metalle, Weißmetalle, Schwer- und Leichtmetalle sowie unedle, edle und wertvolle Metalle. Die Tabelle der metallischen Elemente in diesem Abschnitt unterteilt die elementaren Metalle auf der Grundlage ihrer chemischen Eigenschaften in Alkali- und Erdalkalimetalle, Übergangs- und Post-Übergangsmetalle sowie Lanthanoide und Actiniden. Je nach den Kriterien für die Aufnahme sind weitere Kategorien möglich. Zu den ferromagnetischen Metallen, d. h. den Metallen, die bei Raumtemperatur magnetisch sind, gehören beispielsweise Eisen, Kobalt und Nickel. ⓘ
Eisenhaltige und nicht eisenhaltige Metalle
Der Begriff "eisenhaltig" leitet sich vom lateinischen Wort für "eisenhaltig" ab. Es kann sich dabei um reines Eisen handeln, wie z. B. Schmiedeeisen, oder um eine Legierung wie Stahl. Eisenmetalle sind häufig magnetisch, aber nicht ausschließlich. Nichteisenmetalle und -legierungen enthalten keine nennenswerten Mengen an Eisen. ⓘ
Sprödes Metall
While nearly all metals are malleable or ductile, a few—beryllium, chromium, manganese, gallium, and bismuth—are brittle. Arsenic and antimony, if admitted as metals, are brittle. Low values of the ratio of bulk elastic modulus to shear modulus (Pugh's criterion) are indicative of intrinsic brittleness. ⓘ
Refractory metal
In materials science, metallurgy, and engineering, a refractory metal is a metal that is extraordinarily resistant to heat and wear. Which metals belong to this category varies; the most common definition includes niobium, molybdenum, tantalum, tungsten, and rhenium. They all have melting points above 2000 °C, and a high hardness at room temperature. ⓘ
White metal
A white metal is any of range of white-coloured metals (or their alloys) with relatively low melting points. Zu diesen Metallen gehören Zink, Kadmium, Zinn, Antimon (hier als Metall gezählt), Blei und Wismut, von denen einige recht giftig sind. In Großbritannien verwendet der Kunsthandel in Auktionskatalogen den Begriff "Weißmetall", um ausländische Silbergegenstände zu bezeichnen, die keine Marken des britischen Assay Office tragen, aber dennoch als Silber angesehen werden und einen entsprechenden Preis haben. ⓘ
Schwermetalle und Leichtmetalle
Ein Schwermetall ist jedes relativ dichte Metall oder Metalloid. Es wurden spezifischere Definitionen vorgeschlagen, aber keine hat sich allgemein durchgesetzt. Einige Schwermetalle werden in Nischen verwendet oder sind besonders giftig; andere sind in Spuren essenziell. Alle anderen Metalle sind Leichtmetalle. ⓘ
Unedle, edle und wertvolle Metalle
In der Chemie wird der Begriff unedles Metall informell verwendet, um ein Metall zu bezeichnen, das leicht oxidiert oder korrodiert, z. B. indem es leicht mit verdünnter Salzsäure (HCl) reagiert und dabei ein Metallchlorid und Wasserstoff bildet. Beispiele hierfür sind Eisen, Nickel, Blei und Zink. Kupfer gilt als unedles Metall, da es relativ leicht oxidiert wird, obwohl es nicht mit HCl reagiert. ⓘ

Der Begriff Edelmetall wird im Allgemeinen im Gegensatz zu unedlen Metallen verwendet. Edelmetalle sind im Gegensatz zu den meisten unedlen Metallen korrosions- und oxidationsbeständig. Sie sind in der Regel Edelmetalle, oft aufgrund ihrer Seltenheit. Beispiele sind Gold, Platin, Silber, Rhodium, Iridium und Palladium. ⓘ
In der Alchemie und Numismatik werden unedle Metalle den Edelmetallen gegenübergestellt, d. h. den Metallen mit hohem wirtschaftlichen Wert. Ein langjähriges Ziel der Alchemisten war die Umwandlung von unedlen Metallen in Edelmetalle, einschließlich solcher Münzmetalle wie Silber und Gold. Die meisten Münzen bestehen heute aus unedlen Metallen mit geringem Eigenwert; in der Vergangenheit bezogen Münzen ihren Wert häufig vor allem aus ihrem Edelmetallgehalt. ⓘ
Chemisch gesehen sind die Edelmetalle (wie die Edelmetalle) weniger reaktiv als die meisten Elemente, haben einen hohen Glanz und eine hohe elektrische Leitfähigkeit. In der Vergangenheit waren Edelmetalle als Zahlungsmittel von Bedeutung, doch heute werden sie hauptsächlich als Investitions- und Industriegüter betrachtet. Gold, Silber, Platin und Palladium haben jeweils einen Währungscode nach ISO 4217. Die bekanntesten Edelmetalle sind Gold und Silber. Beide werden zwar industriell genutzt, sind aber eher für ihre Verwendung in der Kunst, für Schmuck und Münzen bekannt. Zu den anderen Edelmetallen gehören die Metalle der Platingruppe: Ruthenium, Rhodium, Palladium, Osmium, Iridium und Platin, von denen Platin das am meisten gehandelte ist. ⓘ
Die Nachfrage nach Edelmetallen wird nicht nur durch ihren praktischen Nutzen, sondern auch durch ihre Rolle als Anlage und Wertaufbewahrungsmittel bestimmt. Palladium und Platin wurden im Herbst 2018 zu etwa drei Vierteln des Goldpreises gehandelt. Silber ist wesentlich preiswerter als diese Metalle, wird aber aufgrund seiner Rolle als Münz- und Schmuckmetall traditionell oft als Edelmetall angesehen. ⓘ
Ventilmetalle
In der Elektrochemie ist ein Ventilmetall ein Metall, das Strom nur in eine Richtung durchlässt. ⓘ
Lebenszyklus
Entstehung
| Häufigkeit und Hauptvorkommen oder Quelle, nach Gewicht | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||
| 6 | Cs | Ba | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | ||||
| 7 | |||||||||||||||||||
| La | Ce | Pr | Nd | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||||
| Th | U | ||||||||||||||||||
Am häufigsten vorkommend (bis zu 82000 ppm)
| |||||||||||||||||||
Reichlich (100-999 ppm)
| |||||||||||||||||||
Ungewöhnlich (1-99 ppm)
| |||||||||||||||||||
Selten (0,01-0,99 ppm)
| |||||||||||||||||||
Sehr selten (0,0001-0,0099 ppm)
| |||||||||||||||||||
| Die Metalle links der Trennlinie kommen hauptsächlich als Lithophile vor (oder werden aus ihnen gewonnen); die Metalle rechts der Trennlinie sind chalcophil, mit Ausnahme von Gold (siderophil) und Zinn (lithophil). | |||||||||||||||||||
- Dieser Unterabschnitt befasst sich mit der Bildung der elementaren Metalle des Periodensystems, da diese die Grundlage der metallischen Werkstoffe, wie sie in diesem Artikel definiert werden, bilden. ⓘ
Metalle bis in die Nähe von Eisen (im Periodensystem) entstehen größtenteils durch stellare Nukleosynthese. Bei diesem Prozess durchlaufen leichtere Elemente von Wasserstoff bis Silizium im Inneren von Sternen aufeinanderfolgende Fusionsreaktionen, wobei Licht und Wärme freigesetzt werden und schwerere Elemente mit höherer Ordnungszahl entstehen. ⓘ
Schwerere Metalle werden in der Regel nicht auf diese Weise gebildet, da Fusionsreaktionen mit solchen Kernen eher Energie verbrauchen als freisetzen würden. Vielmehr werden sie größtenteils (aus Elementen mit niedrigerer Ordnungszahl) durch Neutroneneinfang synthetisiert, wobei die beiden Hauptarten dieses wiederholten Einfangs der s-Prozess und der r-Prozess sind. Beim s-Prozess ("s" steht für "slow") liegen zwischen den einzelnen Einfängen Jahre oder Jahrzehnte, so dass die weniger stabilen Kerne einen Betazerfall erleben, während beim r-Prozess ("rapid") die Einfänge schneller erfolgen, als die Kerne zerfallen können. Der s-Prozess hat also einen mehr oder weniger klaren Verlauf: Stabile Cadmium-110-Kerne werden beispielsweise im Inneren eines Sterns nacheinander von freien Neutronen beschossen, bis sie Cadmium-115-Kerne bilden, die instabil sind und zu Indium-115 zerfallen (das nahezu stabil ist und eine Halbwertszeit hat, die 30000 Mal so lang ist wie das Alter des Universums). Diese Kerne fangen Neutronen ein und bilden Indium-116, das wiederum instabil ist und zu Zinn-116 zerfällt, und so weiter. Im Gegensatz dazu gibt es beim r-Prozess keinen solchen Weg. Der s-Prozess endet bei Bismut aufgrund der kurzen Halbwertszeiten der nächsten beiden Elemente, Polonium und Astatin, die zu Bismut oder Blei zerfallen. Der r-Prozess ist so schnell, dass er diese Zone der Instabilität überspringen und zur Bildung schwererer Elemente wie Thorium und Uran übergehen kann. ⓘ
Metalle kondensieren in Planeten als Ergebnis von Prozessen der Sternentwicklung und -zerstörung. Sterne verlieren einen großen Teil ihrer Masse, wenn sie am Ende ihrer Lebenszeit ausgestoßen werden, und manchmal auch danach durch die Verschmelzung von Neutronensternen, wodurch die Häufigkeit von Elementen, die schwerer sind als Helium, im interstellaren Medium zunimmt. Wenn diese Materie durch die Anziehungskraft der Schwerkraft zusammenwächst und kollabiert, entstehen neue Sterne und Planeten. ⓘ
Häufigkeit und Vorkommen

Die Erdkruste besteht zu etwa 25 % ihres Gewichts aus Metallen, von denen 80 % Leichtmetalle wie Natrium, Magnesium und Aluminium sind. Der Rest der Kruste besteht aus Nichtmetallen (~75 %). Obwohl einige schwerere Metalle, wie z. B. Kupfer, insgesamt knapp sind, können sie durch Gebirgsbildung, Erosion oder andere geologische Prozesse in wirtschaftlich abbaubaren Mengen konzentriert werden. ⓘ
Metalle kommen in erster Linie als lithophile (gesteinsliebende) oder chalcophile (erzliebende) Metalle vor. Zu den lithophilen Metallen gehören vor allem die Elemente des s-Blocks, die reaktionsfreudigeren Elemente des d-Blocks und die Elemente des f-Blocks. Sie haben eine starke Affinität zu Sauerstoff und kommen meist als Silikatminerale mit relativ geringer Dichte vor. Bei den chalkophilen Metallen handelt es sich hauptsächlich um die weniger reaktiven Elemente des d-Blocks und die Metalle des p-Blocks der Periode 4-6. Sie sind in der Regel in (unlöslichen) Sulfidmineralen zu finden. Da sie dichter sind als die lithophilen Metalle und daher zum Zeitpunkt der Erstarrung tiefer in die Kruste sinken, sind die chalcophilen Metalle tendenziell weniger häufig als die lithophilen. ⓘ
Andererseits ist Gold ein siderophiles, also eisenliebendes Element. Es geht nicht ohne weiteres Verbindungen mit Sauerstoff oder Schwefel ein. Zur Zeit der Erdentstehung sank Gold als das edelste (träge) aller Metalle in den Erdkern, da es zur Bildung von Metalllegierungen hoher Dichte neigt. Daher ist es ein relativ seltenes Metall. Einige andere (weniger edle) Metalle - Molybdän, Rhenium, die Metalle der Platingruppe (Ruthenium, Rhodium, Palladium, Osmium, Iridium und Platin), Germanium und Zinn - können zu den siderophilen Metallen gezählt werden, allerdings nur in Bezug auf ihr primäres Vorkommen in der Erde (Kern, Mantel und Kruste), nicht in der Kruste. Ansonsten kommen diese Metalle in der Kruste in geringen Mengen vor allem als Chalkophile vor (weniger in ihrer nativen Form). ⓘ
Man nimmt an, dass der rotierende, flüssige äußere Kern des Erdinneren, der hauptsächlich aus Eisen besteht, die Quelle des schützenden Magnetfeldes der Erde ist. Der Kern liegt oberhalb des festen inneren Erdkerns und unterhalb des Erdmantels. Könnte man ihn zu einer Säule mit einer Grundfläche von 5 m2 umgestalten, so hätte er eine Höhe von fast 700 Lichtjahren. Das Magnetfeld schirmt die Erde vor den geladenen Teilchen des Sonnenwindes und der kosmischen Strahlung ab, die andernfalls die obere Atmosphäre (einschließlich der Ozonschicht, die die Durchlässigkeit für ultraviolette Strahlung begrenzt) zerstören würde. ⓘ
Extraktion
Metalle werden häufig durch den Abbau von Erzen aus der Erde gewonnen, die reich an den erforderlichen Elementen sind, wie z. B. Bauxit. Die Suche nach Erzen erfolgt durch Prospektionstechniken, gefolgt von der Erkundung und Untersuchung von Lagerstätten. Mineralvorkommen werden im Allgemeinen in übertägige Minen, die mit schwerem Gerät abgebaut werden, und untertägige Minen eingeteilt. In einigen Fällen ist es aufgrund des Verkaufspreises der betreffenden Metalle wirtschaftlich sinnvoll, Quellen mit geringerer Konzentration abzubauen. ⓘ
Sobald das Erz abgebaut ist, müssen die Metalle extrahiert werden, in der Regel durch chemische oder elektrolytische Reduktion. In der Pyrometallurgie wird das Erz bei hohen Temperaturen in Rohmetalle umgewandelt, während in der Hydrometallurgie für den gleichen Zweck wässrige Chemie eingesetzt wird. Welche Methoden angewandt werden, hängt von den Metallen und ihren Verunreinigungen ab. ⓘ
Handelt es sich bei einem Metallerz um eine ionische Verbindung aus diesem Metall und einem Nichtmetall, muss das Erz in der Regel mit einem Reduktionsmittel verhüttet - also erhitzt - werden, um das reine Metall zu gewinnen. Viele gängige Metalle, wie z. B. Eisen, werden mit Kohlenstoff als Reduktionsmittel verhüttet. Für einige Metalle, wie Aluminium und Natrium, gibt es kein kommerziell nutzbares Reduktionsmittel, so dass sie stattdessen durch Elektrolyse gewonnen werden. ⓘ
Sulfiderze werden nicht direkt zum Metall reduziert, sondern an der Luft geröstet, um sie in Oxide umzuwandeln. ⓘ
Verwendungen
Metalle sind in fast allen Bereichen des modernen Lebens zu finden. Eisen, ein Schwermetall, ist wohl das am häufigsten vorkommende Metall, da es 90 % aller raffinierten Metalle ausmacht; Aluminium, ein Leichtmetall, ist das am zweithäufigsten raffinierte Metall. Reines Eisen ist mit Kosten von etwa 0,07 US-Dollar pro Gramm das billigste metallische Element von allen. Seine Erze sind weit verbreitet, es ist leicht zu raffinieren, und die dazugehörige Technologie wurde über Hunderte von Jahren entwickelt. Gusseisen ist mit einem Bruchteil von 0,01 US-Dollar pro Gramm sogar noch billiger, da es nicht gereinigt werden muss. Platin, das etwa 27 US-Dollar pro Gramm kostet, ist aufgrund seines sehr hohen Schmelzpunkts, seiner Korrosionsbeständigkeit, seiner elektrischen Leitfähigkeit und seiner Langlebigkeit wohl das am weitesten verbreitete Material. Man sagt, dass es in 20 % aller Konsumgüter enthalten ist oder für deren Herstellung verwendet wird. Polonium ist wahrscheinlich das teuerste Metall, mit einem fiktiven Preis von etwa 100.000.000 Dollar pro Gramm, aufgrund seiner Knappheit und der Produktion im Mikrobereich. ⓘ
Einige Metalle und Metalllegierungen besitzen eine hohe strukturelle Festigkeit pro Masseneinheit, was sie zu nützlichen Materialien macht, um große Lasten zu tragen oder Schlagschäden zu widerstehen. Metalllegierungen können so konstruiert werden, dass sie eine hohe Scher-, Drehmoment- und Verformungsfestigkeit aufweisen. Das gleiche Metall kann jedoch auch durch wiederholte Verwendung oder plötzliches Spannungsversagen bei Überschreiten einer bestimmten Belastungsgrenze anfällig für Ermüdungsschäden sein. Die Festigkeit und Widerstandsfähigkeit von Metallen hat dazu geführt, dass sie häufig im Hochhaus- und Brückenbau sowie in den meisten Fahrzeugen, vielen Geräten, Werkzeugen, Rohren und Eisenbahnschienen verwendet werden. ⓘ
Metalle sind gute Leiter, was sie für elektrische Geräte und für die Übertragung von elektrischem Strom über eine längere Strecke mit geringem Energieverlust wertvoll macht. Elektrische Stromnetze sind auf Metallkabel angewiesen, um Elektrizität zu verteilen. Elektrische Anlagen in Privathaushalten werden aufgrund ihrer guten Leitfähigkeit größtenteils mit Kupferdraht verkabelt. ⓘ
Die Wärmeleitfähigkeit von Metallen ist für Behälter nützlich, um Materialien über einer Flamme zu erhitzen. Metalle werden auch als Wärmesenken verwendet, um empfindliche Geräte vor Überhitzung zu schützen. ⓘ
Das hohe Reflexionsvermögen einiger Metalle ermöglicht ihre Verwendung in Spiegeln, einschließlich astronomischer Präzisionsinstrumente, und trägt zur Ästhetik von Metallschmuck bei. ⓘ
Einige Metalle haben spezielle Verwendungszwecke; Quecksilber ist bei Raumtemperatur flüssig und wird in Schaltern verwendet, um einen Stromkreis zu schließen, wenn es über die Kontakte des Schalters fließt. Radioaktive Metalle wie Uran und Plutonium dienen als Brennstoff für Kernkraftwerke, die durch Kernspaltung Energie erzeugen. Formgedächtnislegierungen werden für Anwendungen wie Rohre, Befestigungselemente und Gefäßstents verwendet. ⓘ
Metalle können mit fremden Molekülen - organischen, anorganischen, biologischen und Polymeren - dotiert werden. Diese Dotierung verleiht dem Metall neue Eigenschaften, die durch die Gastmoleküle hervorgerufen werden. Es wurden Anwendungen in den Bereichen Katalyse, Medizin, elektrochemische Zellen, Korrosion und mehr entwickelt. ⓘ
Recycling

Die Nachfrage nach Metallen ist eng mit dem Wirtschaftswachstum verknüpft, da sie in der Infrastruktur, im Bauwesen, in der Fertigung und bei Konsumgütern verwendet werden. Im 20. Jahrhundert nahm die Vielfalt der in der Gesellschaft verwendeten Metalle rasch zu. Heute sorgen die Entwicklung großer Länder wie China und Indien sowie der technologische Fortschritt für eine immer größere Nachfrage. Dies hat zur Folge, dass die Bergbauaktivitäten ausgeweitet werden und sich immer mehr der weltweiten Metallvorräte über der Erde befinden und genutzt werden, anstatt als ungenutzte Reserven unter der Erde zu liegen. Ein Beispiel dafür sind die Kupfervorräte, die in Gebrauch sind. Zwischen 1932 und 1999 stieg der Kupferverbrauch in den USA von 73 g auf 238 g pro Person. ⓘ
Metalle sind von Natur aus recycelbar und können daher im Prinzip immer wieder verwendet werden, was die negativen Umweltauswirkungen minimiert und Energie spart. So werden beispielsweise 95 % der Energie, die für die Herstellung von Aluminium aus Bauxiterz benötigt wird, durch die Verwendung von recyceltem Material eingespart. ⓘ
Weltweit ist das Metallrecycling im Allgemeinen gering. Im Jahr 2010 veröffentlichte das vom Umweltprogramm der Vereinten Nationen veranstaltete International Resource Panel Berichte über die in der Gesellschaft vorhandenen Metallbestände und ihre Recyclingraten. Die Autoren des Berichts stellten fest, dass die Metallvorräte in der Gesellschaft als riesige Minen unter der Erde dienen können. Sie warnten, dass die Recyclingraten einiger seltener Metalle, die in Anwendungen wie Mobiltelefonen, Batterien für Hybridautos und Brennstoffzellen verwendet werden, so niedrig sind, dass diese wichtigen Metalle für den Einsatz in der modernen Technologie nicht mehr zur Verfügung stehen werden, wenn die Recyclingraten am Ende ihrer Lebensdauer nicht drastisch erhöht werden. ⓘ
Biologische Wechselwirkungen
Die Rolle der metallischen Elemente in der Entwicklung der Zellbiochemie wurde untersucht, einschließlich eines ausführlichen Abschnitts über die Rolle von Kalzium in Redox-Enzymen. ⓘ
Eines oder mehrere der Elemente Eisen, Kobalt, Nickel, Kupfer und Zink sind für alle höheren Lebensformen unerlässlich. Molybdän ist ein wesentlicher Bestandteil von Vitamin B12. Verbindungen aller anderen Übergangselemente und Elemente nach dem Übergang sind mehr oder weniger giftig, mit wenigen Ausnahmen wie bestimmte Verbindungen von Antimon und Zinn. Mögliche Quellen für Metallvergiftungen sind Bergbau, Abraumhalden, Industrieabfälle, landwirtschaftliche Abwässer, berufliche Exposition, Farben und behandeltes Holz. ⓘ
Geschichte
Vorgeschichte
Kupfer, das in natürlicher Form vorkommt, war möglicherweise das erste Metall, das entdeckt wurde, da es im Vergleich zu anderen Steinen oder Kieselsteinen unverwechselbar aussieht, schwer ist und sich gut formen lässt. Gold, Silber, Eisen (als Meteoreisen) und Blei wurden ebenfalls in der Vorgeschichte entdeckt. Forms of brass, an alloy of copper and zinc made by concurrently smelting the ores of these metals, originate from this period (although pure zinc was not isolated until the 13th century). The malleability of the solid metals led to the first attempts to craft metal ornaments, tools, and weapons. Meteoric iron containing nickel was discovered from time to time and, in some respects this was superior to any industrial steel manufactured up to the 1880s when alloy steels become prominent. ⓘ
- oxidised lead
nodules and 1 cm3 cube
Antiquity
The discovery of bronze (an alloy of copper with arsenic or tin) enabled people to create metal objects which were harder and more durable than previously possible. Bronze tools, weapons, armor, and building materials such as decorative tiles were harder and more durable than their stone and copper ("Chalcolithic") predecessors. Ursprünglich wurde Bronze aus Kupfer und Arsen (Arsenbronze) durch Verhüttung von natürlich oder künstlich gemischten Kupfer- und Arsenerzen hergestellt. Die frühesten bisher bekannten Artefakte stammen aus dem 5. Jahrtausend v. Chr. aus der iranischen Hochebene. Erst später wurde Zinn verwendet, das im späten 3. Jahrtausend v. Chr. zum wichtigsten Nicht-Kupfer-Bestandteil von Bronze wurde. Reines Zinn selbst wurde erstmals 1800 v. Chr. von chinesischen und japanischen Metallarbeitern isoliert. ⓘ
Quecksilber war den alten Chinesen und Indern bereits vor 2000 v. Chr. bekannt und wurde in ägyptischen Gräbern aus dem Jahr 1500 v. Chr. gefunden. ⓘ
Die früheste bekannte Herstellung von Stahl, einer Eisen-Kohlenstoff-Legierung, ist in Eisenwaren zu finden, die an einer archäologischen Stätte in Anatolien (Kaman-Kalehöyük) ausgegraben wurden und fast 4.000 Jahre alt sind und aus dem Jahr 1800 v. Chr. stammen. ⓘ
From about 500 BCE sword-makers of Toledo, Spain, were making early forms of alloy steel by adding a mineral called wolframite, which contained tungsten and manganese, to iron ore (and carbon). The resulting Toledo steel came to the attention of Rome when used by Hannibal in the Punic Wars. It soon became the basis for the weaponry of Roman legions; their swords were said to have been "so keen that there is no helmet which cannot be cut through by them." ⓘ
In pre-Columbian America, objects made of tumbaga, an alloy of copper and gold, started being produced in Panama and Costa Rica between 300 and 500 CE. Small metal sculptures were common and an extensive range of tumbaga (and gold) ornaments comprised the usual regalia of persons of high status. ⓘ
At around the same time indigenous Ecuadorians were combining gold with a naturally-occurring platinum alloy containing small amounts of palladium, rhodium, and iridium, to produce miniatures and masks composed of a white gold-platinum alloy. The metal workers involved heated gold with grains of the platinum alloy until the gold melted at which point the platinum group metals became bound within the gold. After cooling, the resulting conglomeration was hammered and reheated repeatedly until it became as homogenous as if all of the metals concerned had been melted together (attaining the melting points of the platinum group metals concerned was beyond the technology of the day). ⓘ
Middle Ages
Gold ist für die Mätresse, Silber für die Magd.
Kupfer für den Handwerker, der sein Handwerk versteht.
"Gut!" sagte der Baron in seiner Halle,
"Aber Eisen - kaltes Eisen - ist der Meister von allen."
from Cold Iron by Rudyard Kipling
Arabic and medieval alchemists believed that all metals and matter were composed of the principle of sulfur, the father of all metals and carrying the combustible property, and the principle of mercury, the mother of all metals and carrier of the liquidity, fusibility, and volatility properties. These principles were not necessarily the common substances sulfur and mercury found in most laboratories. This theory reinforced the belief that all metals were destined to become gold in the bowels of the earth through the proper combinations of heat, digestion, time, and elimination of contaminants, all of which could be developed and hastened through the knowledge and methods of alchemy. ⓘ
Arsenic, zinc, antimony, and bismuth became known, although these were at first called semimetals or bastard metals on account of their immalleability. All four may have been used incidentally in earlier times without recognising their nature. Albertus Magnus is believed to have been the first to isolate arsenic from a compound in 1250, by heating soap together with arsenic trisulfide. Metallic zinc, which is brittle if impure, was isolated in India by 1300 AD. The first description of a procedure for isolating antimony is in the 1540 book De la pirotechnia by Vannoccio Biringuccio. Bismuth was described by Agricola in De Natura Fossilium (c. 1546); it had been confused in early times with tin and lead because of its resemblance to those elements. ⓘ
The Renaissance




The first systematic text on the arts of mining and metallurgy was De la Pirotechnia (1540) by Vannoccio Biringuccio, which treats the examination, fusion, and working of metals. ⓘ
Sixteen years later, Georgius Agricola published De Re Metallica in 1556, a clear and complete account of the profession of mining, metallurgy, and the accessory arts and sciences, as well as qualifying as the greatest treatise on the chemical industry through the sixteenth century. ⓘ
He gave the following description of a metal in his De Natura Fossilium (1546):
Metall ist ein mineralischer Körper, der von Natur aus entweder flüssig oder etwas hart ist. Letzterer kann durch die Hitze des Feuers geschmolzen werden, aber wenn er wieder abgekühlt ist und alle Hitze verloren hat, wird er wieder hart und nimmt seine eigentliche Form wieder an. In dieser Hinsicht unterscheidet er sich von dem Stein, der im Feuer schmilzt, denn obwohl er seine Härte wiedererlangt, verliert er seine ursprüngliche Form und seine Eigenschaften.
Traditionell gibt es sechs verschiedene Arten von Metallen, nämlich Gold, Silber, Kupfer, Eisen, Zinn und Blei. In Wirklichkeit gibt es noch weitere, denn Quecksilber ist ein Metall, auch wenn die Alchemisten in diesem Punkt anderer Meinung sind, und Wismut ist ebenfalls ein Metall. Die alten griechischen Schriftsteller scheinen das Wismut nicht gekannt zu haben, weshalb Ammonius zu Recht feststellt, dass es viele Arten von Metallen, Tieren und Pflanzen gibt, die uns unbekannt sind. Stibium, wenn es im Schmelztiegel geschmolzen und veredelt wird, hat ebenso viel Recht, als ein echtes Metall angesehen zu werden, wie es die Schriftsteller dem Blei zugestehen. Wenn man beim Schmelzen dem Zinn einen gewissen Anteil hinzufügt, erhält man eine Buchhändlerlegierung, aus der die Schrift hergestellt wird, die von denen verwendet wird, die Bücher auf Papier drucken.
Jedes Metall hat seine eigene Form, die es bewahrt, wenn es von den Metallen getrennt wird, die mit ihm vermischt wurden. Daher ist weder Elektrum noch Stannum [gemeint ist nicht unser Zinn] an sich ein echtes Metall, sondern eine Legierung aus zwei Metallen. Elektrum ist eine Legierung aus Gold und Silber, Stannum aus Blei und Silber. Wenn aber das Silber vom Elektrum getrennt wird, so bleibt das Gold und nicht das Elektrum; wenn das Silber vom Stannum weggenommen wird, so bleibt das Blei und nicht das Stannum.
Ob Messing jedoch als einheimisches Metall vorkommt oder nicht, lässt sich nicht mit Sicherheit feststellen. Wir kennen nur das künstliche Messing, das aus Kupfer besteht, das mit der Farbe des Minerals Galmei gefärbt ist. Sollte es jedoch ausgegraben werden, so wäre es ein echtes Metall. Schwarzes und weißes Kupfer scheinen sich von der roten Art zu unterscheiden.
Metall ist also von Natur aus entweder fest, wie ich gesagt habe, oder flüssig, wie in dem einzigartigen Fall des Quecksilbers.
Doch nun genug zu den einfachen Arten. ⓘ
Platin, das dritte Edelmetall nach Gold und Silber, wurde zwischen 1736 und 1744 in Ecuador von dem spanischen Astronomen Antonio de Ulloa und seinem Kollegen, dem Mathematiker Jorge Juan y Santacilia, entdeckt. Ulloa war der erste, der 1748 eine wissenschaftliche Beschreibung des Metalls verfasste. ⓘ
Im Jahr 1789 isolierte der deutsche Chemiker Martin Heinrich Klaproth ein Uranoxid, das er für das Metall selbst hielt. Klaproth wurde später als Entdecker des Urans angesehen. Erst 1841 stellte der französische Chemiker Eugène-Melchior Péligot die erste Probe von Uranmetall her. Henri Becquerel entdeckte dann 1896 die Radioaktivität mit Hilfe von Uran. ⓘ
In den 1790er Jahren beobachteten Joseph Priestley und der niederländische Chemiker Martinus van Marum die transformative Wirkung von Metalloberflächen bei der Dehydrierung von Alkohol, eine Entwicklung, die 1831 zur großtechnischen Synthese von Schwefelsäure unter Verwendung eines Platinkatalysators führte. ⓘ
1803 entdeckten Jöns Jakob Berzelius und Wilhelm Hisinger im schwedischen Bastnäs und Martin Heinrich Klaproth in Deutschland unabhängig voneinander Cer als erstes der Lanthanidenmetalle. Die Lanthanidmetalle wurden bis in die 1960er Jahre weitgehend als Kuriositäten betrachtet, als Methoden entwickelt wurden, um sie effizienter voneinander zu trennen. In der Folge fanden sie Verwendung in Mobiltelefonen, Magneten, Lasern, Leuchtmitteln, Batterien, Katalysatoren und anderen Anwendungen, die moderne Technologien ermöglichen. ⓘ
Weitere Metalle, die in dieser Zeit entdeckt und hergestellt wurden, waren Kobalt, Nickel, Mangan, Molybdän, Wolfram und Chrom sowie einige der Platingruppenmetalle, Palladium, Osmium, Iridium und Rhodium. ⓘ
Leichtmetalle
Alle bis 1809 entdeckten Metalle wiesen eine relativ hohe Dichte auf; ihre Schwere wurde als einziges Unterscheidungsmerkmal angesehen. Ab 1809 wurden Leichtmetalle wie Natrium, Kalium und Strontium isoliert. Ihre geringe Dichte stellte die herkömmliche Auffassung von der Natur der Metalle in Frage. Sie verhielten sich jedoch chemisch wie Metalle und wurden später auch als solche anerkannt. ⓘ
Aluminium wurde 1824 entdeckt, aber erst 1886 wurde ein industrielles Produktionsverfahren in großem Maßstab entwickelt. Die Preise für Aluminium fielen und Aluminium wurde in den 1890er Jahren und zu Beginn des 20. Jahrhunderts in großem Umfang für Schmuck, Alltagsgegenstände, Brillengestelle, optische Instrumente, Geschirr und Folien verwendet. Die Fähigkeit des Aluminiums, mit anderen Metallen harte und dennoch leichte Legierungen zu bilden, verschaffte dem Metall damals viele Verwendungsmöglichkeiten. Während des Ersten Weltkriegs forderten die großen Regierungen große Mengen Aluminium für leichte und stabile Flugzeugzellen an. Das heute am häufigsten verwendete Metall für die elektrische Energieübertragung ist aluminiumleiterstahlverstärkt. Auch Leiter aus einer Aluminiumlegierung werden häufig verwendet. Aluminium wird verwendet, weil es etwa halb so viel wiegt wie ein Kupferkabel mit vergleichbarem Widerstand (obwohl es wegen der geringeren spezifischen Leitfähigkeit einen größeren Durchmesser hat) und außerdem billiger ist. Kupfer war in der Vergangenheit beliebter und wird immer noch verwendet, vor allem bei niedrigeren Spannungen und zur Erdung. ⓘ
Reines metallisches Titan (99,9 %) wurde zwar erstmals 1910 hergestellt, aber erst 1932 außerhalb des Labors verwendet. In den 1950er und 1960er Jahren leistete die Sowjetunion im Rahmen von Programmen im Zusammenhang mit dem Kalten Krieg Pionierarbeit bei der Verwendung von Titan in militärischen und U-Boot-Anwendungen. Ab den frühen 1950er Jahren wurde Titan in großem Umfang in der militärischen Luftfahrt eingesetzt, insbesondere in Hochleistungsflugzeugen wie dem F-100 Super Sabre und den Lockheed A-12 und SR-71. ⓘ
Metallic scandium was produced for the first time in 1937. The first pound of 99% pure scandium metal was produced in 1960. Production of aluminum-scandium alloys began in 1971 following a U.S. patent. Aluminum-scandium alloys were also developed in the USSR. ⓘ
The age of steel

The modern era in steelmaking began with the introduction of Henry Bessemer's Bessemer process in 1855, the raw material for which was pig iron. His method let him produce steel in large quantities cheaply, thus mild steel came to be used for most purposes for which wrought iron was formerly used. Das Gilchrist-Thomas-Verfahren (oder Basis-Bessemer-Verfahren) war eine Verbesserung des Bessemer-Verfahrens, indem der Konverter mit einem basischen Material ausgekleidet wurde, um Phosphor zu entfernen. ⓘ
Aufgrund seiner hohen Zugfestigkeit und niedrigen Kosten wurde Stahl zu einem wichtigen Bestandteil von Gebäuden, Infrastruktur, Werkzeugen, Schiffen, Autos, Maschinen, Geräten und Waffen. ⓘ
1872 ließen die Engländer Clark und Woods eine Legierung patentieren, die man heute als rostfreien Stahl bezeichnen würde. Die Korrosionsbeständigkeit von Eisen-Chrom-Legierungen wurde bereits 1821 vom französischen Metallurgen Pierre Berthier erkannt. Er stellte fest, dass sie gegen einige Säuren resistent sind, und schlug ihre Verwendung in Besteck vor. Die Metallurgen des 19. Jahrhunderts waren nicht in der Lage, die Kombination aus niedrigem Kohlenstoffgehalt und hohem Chromanteil herzustellen, die in den meisten modernen nichtrostenden Stählen zu finden ist, und die hochchromhaltigen Legierungen, die sie herstellen konnten, waren zu spröde, um praktikabel zu sein. Erst 1912 begann in England, Deutschland und den Vereinigten Staaten die Industrialisierung der nichtrostenden Stahllegierungen. ⓘ
Die letzten stabilen metallischen Elemente
Um 1900 waren noch drei Metalle mit einer geringeren Ordnungszahl als Blei (#82), dem schwersten stabilen Metall, zu entdecken: die Elemente 71, 72 und 75. ⓘ
Von Welsbach, in 1906, proved that the old ytterbium also contained a new element (#71), which he named cassiopeium. Urbain proved this simultaneously, but his samples were very impure and only contained trace quantities of the new element. Despite this, his chosen name lutetium was adopted. ⓘ
In 1908, Ogawa found element 75 in thorianite but assigned it as element 43 instead of 75 and named it nipponium. In 1925 Walter Noddack, Ida Eva Tacke, and Otto Berg announced its separation from gadolinite and gave it the present name, rhenium. ⓘ
Georges Urbain claimed to have found element 72 in rare-earth residues, while Vladimir Vernadsky independently found it in orthite. Neither claim was confirmed due to World War I, and neither could be confirmed later, as the chemistry they reported does not match that now known for hafnium. After the war, in 1922, Coster and Hevesy found it by X-ray spectroscopic analysis in Norwegian zircon. Hafnium was thus the last stable element to be discovered. ⓘ
Bis zum Ende des Zweiten Weltkriegs hatten Wissenschaftler vier Post-Uran-Elemente synthetisiert, die alle radioaktive (instabile) Metalle sind: Neptunium (1940), Plutonium (1940-41) sowie Curium und Americium (1944), die die Elemente 93 bis 96 darstellen. Die ersten beiden dieser Elemente wurden schließlich auch in der Natur gefunden. Curium und Americium waren Nebenprodukte des Manhattan-Projekts, in dessen Rahmen 1945 die erste Atombombe der Welt gebaut wurde. Die Bombe beruhte auf der Kernspaltung von Uran, einem Metall, von dem man annahm, dass es fast 150 Jahre zuvor entdeckt worden war. ⓘ
Entwicklungen nach dem Zweiten Weltkrieg
Superlegierungen
Superlegierungen, die aus Kombinationen von Fe, Ni, Co und Cr sowie geringeren Mengen von W, Mo, Ta, Nb, Ti und Al bestehen, wurden kurz nach dem Zweiten Weltkrieg für den Einsatz in Hochleistungsmotoren entwickelt, die bei hohen Temperaturen (über 650 °C) betrieben werden. Sie behalten unter diesen Bedingungen über einen längeren Zeitraum den größten Teil ihrer Festigkeit und kombinieren gute Tieftemperaturduktilität mit Korrosions- und Oxidationsbeständigkeit. Superlegierungen sind heute in einer Vielzahl von Anwendungen zu finden, z. B. in Land-, See- und Luftfahrtturbinen sowie in Chemie- und Erdölanlagen. ⓘ
Transcurium-Metalle
Die erfolgreiche Entwicklung der Atombombe am Ende des Zweiten Weltkriegs löste weitere Anstrengungen zur Synthese neuer Elemente aus, von denen fast alle Metalle sind oder sein sollen und die alle radioaktiv sind. Erst 1949 wurde das Element 97 (Berkelium), das auf das Element 96 (Curium) folgte, durch Beschuss eines Americium-Targets mit Alphateilchen synthetisiert. Im Jahr 1952 wurde das Element 100 (Fermium) in den Trümmern der ersten Wasserstoffbombenexplosion gefunden; Wasserstoff, ein Nichtmetall, war fast 200 Jahre zuvor als Element identifiziert worden. Seit 1952 sind die Elemente 101 (Mendelevium) bis 118 (Oganesson) synthetisiert worden. ⓘ
Metallische Gläser in Masse
Ein metallisches Glas (auch amorphes oder glasartiges Metall genannt) ist ein festes metallisches Material, in der Regel eine Legierung, mit einer ungeordneten Struktur im atomaren Maßstab. Bei den meisten reinen und legierten Metallen sind die Atome in ihrem festen Zustand in einer hoch geordneten kristallinen Struktur angeordnet. Amorphe Metalle haben eine nichtkristalline, glasartige Struktur. Im Gegensatz zu gewöhnlichen Gläsern, wie z. B. Fensterglas, die in der Regel elektrische Isolatoren sind, haben amorphe Metalle eine gute elektrische Leitfähigkeit. Amorphe Metalle werden auf verschiedene Weise hergestellt, z. B. durch extrem schnelles Abkühlen, physikalische Gasphasenabscheidung, Festkörperreaktionen, Ionenbestrahlung und mechanische Legierung. Das erste berichtete metallische Glas war eine Legierung (Au75Si25), die 1960 am Caltech hergestellt wurde. In jüngerer Zeit wurden Chargen von amorphem Stahl mit der dreifachen Festigkeit von herkömmlichen Stahllegierungen hergestellt. Die wichtigsten Anwendungen beruhen derzeit auf den besonderen magnetischen Eigenschaften einiger ferromagnetischer metallischer Gläser. Der geringe Magnetisierungsverlust wird in Transformatoren mit hohem Wirkungsgrad genutzt. Wegen dieser magnetischen Eigenschaften werden metallische Gläser häufig für Diebstahlsicherungsetiketten und andere Warensicherungssysteme verwendet. ⓘ
Formgedächtnis-Legierungen
Bei einer Formgedächtnislegierung (SMA) handelt es sich um eine Legierung, die sich ihre ursprüngliche Form "merkt" und nach einer Verformung bei Erwärmung wieder in ihre vorverformte Form zurückkehrt. Der Formgedächtniseffekt wurde erstmals 1932 in einer Au-Cd-Legierung beobachtet, doch erst 1962, als der Effekt zufällig in einer Ni-Ti-Legierung entdeckt wurde, begann die Forschung ernsthaft, und es dauerte weitere zehn Jahre, bis kommerzielle Anwendungen möglich wurden. SMAs werden in der Robotik, der Automobilindustrie, der Luft- und Raumfahrt und der Biomedizin eingesetzt. Es gibt noch eine andere Art von SMA, eine so genannte ferromagnetische Formgedächtnislegierung (FSMA), die ihre Form unter starken Magnetfeldern ändert. Diese Materialien sind von besonderem Interesse, da die magnetische Reaktion in der Regel schneller und effizienter ist als temperaturbedingte Reaktionen. ⓘ
Quasikristalline Legierungen

1984 entdeckte der israelische Chemiker Dan Shechtman eine Aluminium-Mangan-Legierung mit fünffacher Symmetrie, was gegen die damalige kristallografische Konvention verstieß, die besagte, dass kristalline Strukturen nur zwei-, drei-, vier- oder sechsfache Symmetrie aufweisen dürfen. Aus Angst vor der Reaktion der wissenschaftlichen Gemeinschaft brauchte er zwei Jahre, um die Ergebnisse zu veröffentlichen, für die er 2011 mit dem Nobelpreis für Chemie ausgezeichnet wurde. Seitdem wurden Hunderte von Quasikristallen gemeldet und bestätigt. Sie kommen in vielen Metalllegierungen (und einigen Polymeren) vor. Quasikristalle werden am häufigsten in Aluminiumlegierungen gefunden (Al-Li-Cu, Al-Mn-Si, Al-Ni-Co, Al-Pd-Mn, Al-Cu-Fe, Al-Cu-V usw.), aber auch zahlreiche andere Zusammensetzungen sind bekannt (Cd-Yb, Ti-Zr-Ni, Zn-Mg-Ho, Zn-Mg-Sc, In-Ag-Yb, Pd-U-Si usw.). Quasikristalle haben praktisch unendlich große Einheitszellen. Ikosaeder Al63Cu24Fe13, der erste in der Natur gefundene Quasikristall, wurde 2009 entdeckt. Die meisten Quasikristalle haben keramikähnliche Eigenschaften, darunter eine niedrige elektrische Leitfähigkeit (die sich den Werten von Isolatoren annähert) und eine geringe Wärmeleitfähigkeit, eine hohe Härte, Sprödigkeit und Korrosionsbeständigkeit sowie Antihafteigenschaften. Quasikristalle wurden zur Entwicklung von Wärmedämmung, LEDs, Dieselmotoren und neuen Materialien, die Wärme in Strom umwandeln, verwendet. Neue Anwendungen könnten sich den niedrigen Reibungskoeffizienten und die Härte einiger quasikristalliner Materialien zunutze machen, z. B. die Einbettung von Partikeln in Kunststoff, um starke, strapazierfähige Kunststoffzahnräder mit geringer Reibung herzustellen. Weitere potenzielle Anwendungen sind selektive Solarabsorber für die Energieumwandlung, Breitwellenreflektoren sowie Knochenreparatur- und Prothesenanwendungen, bei denen Biokompatibilität, geringe Reibung und Korrosionsbeständigkeit erforderlich sind. ⓘ
Komplexe metallische Legierungen
Komplexe metallische Legierungen (CMA) sind intermetallische Verbindungen, die sich durch große Einheitszellen mit einigen Dutzend bis zu Tausenden von Atomen, durch das Vorhandensein gut definierter Atomcluster (häufig mit ikosaedrischer Symmetrie) und durch partielle Unordnung in ihren Kristallgittern auszeichnen. Sie bestehen aus zwei oder mehr metallischen Elementen, manchmal mit Zusatz von Metalloiden oder Chalkogeniden. Dazu gehört zum Beispiel NaCd2 mit 348 Natriumatomen und 768 Cadmiumatomen in der Einheitszelle. Linus Pauling versuchte 1923, die Struktur von NaCd2 zu beschreiben, was ihm aber erst 1955 gelang. Das Interesse an CMAs, die zunächst als "giant unit cell crystals" bezeichnet wurden, erwachte erst 2002 mit der Veröffentlichung eines Artikels mit dem Titel "Structurally Complex Alloy Phases" auf der 8th International Conference on Quasicrystals. Potenzielle Anwendungen von CMAs sind u. a. Wärmedämmung, Solarheizung, magnetische Kühlschränke, Nutzung von Abwärme zur Stromerzeugung und Beschichtungen für Turbinenschaufeln in Militärtriebwerken. ⓘ
Hochentrope Legierungen
Hochentrope Legierungen (HEAs) wie AlLiMgScTi bestehen aus gleichen oder nahezu gleichen Mengen von fünf oder mehr Metallen. Im Vergleich zu herkömmlichen Legierungen mit nur einem oder zwei Basismetallen weisen HEAs ein deutlich besseres Verhältnis von Festigkeit zu Gewicht, eine höhere Zugfestigkeit und eine größere Beständigkeit gegen Bruch, Korrosion und Oxidation auf. Obwohl HEAs bereits 1981 beschrieben wurden, entwickelte sich das Interesse an ihnen erst in den 2010er Jahren; aufgrund ihres Potenzials für wünschenswerte Eigenschaften stehen sie weiterhin im Mittelpunkt der Forschung in Materialwissenschaft und -technik. ⓘ
MAX-Phasen-Legierungen
| MAX | M | A | X ⓘ |
|---|---|---|---|
| Hf2SnC | Hf | Sn | C |
| Ti4AlN3 | Ti | Al | N |
| Ti3SiC2 | Ti | Si | C |
| Ti2AlC | Ti | Al | C |
| Cr2AlC2 | Cr | Al | C |
| Ti3AlC2 | Ti | Al | C |
In einer MAX-Phasen-Legierung ist M ein frühes Übergangsmetall, A ein Element der Gruppe A (meist der Gruppen IIIA und IVA oder der Gruppen 13 und 14), und X ist entweder Kohlenstoff oder Stickstoff. Beispiele sind Hf2SnC und Ti4AlN3. Solche Legierungen weisen einige der besten Eigenschaften von Metallen und Keramiken auf. Zu diesen Eigenschaften gehören eine hohe elektrische und thermische Leitfähigkeit, Temperaturwechselbeständigkeit, Schadenstoleranz, Bearbeitbarkeit, hohe elastische Steifigkeit und niedrige thermische Ausdehnungskoeffizienten.</ref> Aufgrund ihrer ausgezeichneten elektrischen Leitfähigkeit können sie auf Metallglanz poliert werden. Bei mechanischen Tests wurde festgestellt, dass polykristalline Ti3SiC2-Zylinder bei Raumtemperatur wiederholt mit Spannungen von bis zu 1 GPa zusammengedrückt werden können und sich nach Wegnahme der Last vollständig erholen. Einige MAX-Phasen sind auch sehr beständig gegen chemische Angriffe (z. B. Ti3SiC2) und Hochtemperaturoxidation an der Luft (Ti2AlC, Cr2AlC2 und Ti3AlC2). Potenzielle Anwendungen für MAX-Phasen-Legierungen sind u. a.: zähe, maschinell bearbeitbare, thermoschockbeständige feuerfeste Materialien, Hochtemperatur-Heizelemente, Beschichtungen für elektrische Kontakte und neutronenbestrahlungsbeständige Teile für nukleare Anwendungen. MAX-Phasen-Legierungen wurden zwar bereits in den 1960er Jahren entdeckt, die erste Veröffentlichung zu diesem Thema erfolgte jedoch erst 1996. ⓘ
Physikalische Eigenschaften
Wärmeleiteigenschaften
Die für die Wärmeleitung relevanten Eigenschaften wie Dichte, Wärmekapazität, Wärmeleitfähigkeit und Temperaturleitfähigkeit variieren stark. So hat etwa Silber mit 427 W/(m·K) eine ca. 50-fach höhere Wärmeleitfähigkeit als Mangan, siehe Liste mit Werten. ⓘ
Physikalische Eigenschaften einiger Metalle. Die höchsten und niedrigsten Werte sind farblich markiert. Element Lithium Aluminium Chrom Eisen Kupfer Zink Silber Zinn Caesium Wolfram Osmium Gold Quecksilber Blei Schmelzpunkt in °C (1013 hPa) 180,54 660,2 1907 1538 1084,62 419,53 961,78 231,93 28,44 3422 3130 1064,18 −38,83 327,43 Siedepunkt in °C (1013 hPa) 1330 2470 2482 3000 2595 907 2210 2602 690 5930 5000 2970 357 1744 Dichte in g/cm3 (20 °C, 1013 hPa) 0,534 2,6989 7,14 7,874 8,92 7,14 10,49 α-Zinn: 5,769 β-Zinn: 7,265
1,90 19,25 22,59 19,32 13,5459 11,342 Mohshärte 0,6 2,75 8,5 4,0 3,0 2,5 2,5 1,5 0,2 7,5 7,0 2,5 1,5 Elektrische Leitfähigkeit in 106 S/m 10,6 37,7 7,87 10,0 58,1 16,7 61,35 8,69 4,76 18,52 10,9 45,5 1,04 4,76 Wärmeleitfähigkeit in W/(m·K) 85 235 94 80 400 120 430 67 36 170 88 320 8,3 35 Ordnungszahl 3 13 24 26 29 30 47 50 55 74 76 79 80 82 Atommasse in u 6,94 26,982 51,996 55,845 63,546 65,38 107,868 118,710 132,905 183,84 190,23 196,967 200,592 207,2 Elektronegativität 0,98 1,61 1,66 1,83 1,9 1,65 1,93 1,96 0,79 2,36 2,2 2,54 2,0 2,33 Kristallsystem(1) cl cl cl cl cF hcp cF α-Zinn: A4 β-Zinn: tl
cl cl hcp cF P3 cF
- (1) cl: kubisch raumzentriert, cF: kubisch flächenzentriert, hcp: hexagonal dichteste Kugelpackung, A4: Diamantstruktur, tl: tetragonal innenzentriert, P3: rhomboedrisch ⓘ
Chemische Eigenschaften
In Verbindung mit Nichtmetallen treten die Metalle im Allgemeinen als Kationen auf, d. h., die äußeren Elektronen werden vollständig an die Nichtmetallatome abgegeben und es bildet sich eine Ionenverbindung (Salz). In einem Ionengitter werden die Ionen nur durch elektrostatische Kräfte zusammengehalten. ⓘ
Bei Verbindungen mit Übergangsmetallen und bei größeren Anionen (wie dem Sulfid-Ion) können alle Übergangsstufen zur Atombindung vorkommen. ⓘ
Mit Nichtmetallen wie Wasserstoff, Kohlenstoff und Stickstoff werden auch Einlagerungsverbindungen gebildet, wobei sich die Nichtmetallatome in Lücken des Metallgitters befinden, ohne dieses wesentlich zu verändern. Diese Einlagerungsverbindungen behalten die typischen Metalleigenschaften wie die Elektrische Leitfähigkeit. ⓘ
Metallkationen, v. a. die der Nebengruppenmetalle, bilden mit Basen (Wasser, Ammoniak, Halogeniden, Cyaniden u. v. a.) Komplexverbindungen, deren Stabilität nicht allein durch die elektrostatische Anziehung erklärt werden kann. ⓘ
Metalle in höheren Oxidationsstufen bilden auch Komplexanionen, z. B.:
- Chromtrioxid löst sich in Kalilauge unter Bildung von Kaliumchromat und Wasser. ⓘ
Metall in der Astrophysik
In der Astrophysik ist Metall anders definiert, siehe dazu Metallizität; hier bezeichnet es jedes chemische Element oberhalb einer bestimmten Ordnungszahl (meist höher als Helium). Das sind alle durch Kernfusion in Sternen oder durch Supernovae entstandenen Elemente, wogegen Wasserstoff und Helium (zusammen mit einigen Spuren von Lithium) als durch den Urknall entstanden gedacht werden. Die Metallizität eines Sterns hängt mit seinem Entstehungszeitpunkt zusammen (siehe Population). ⓘ
Es wird angenommen, dass Wasserstoff im Inneren von hinreichend schweren Gasplaneten in den metallischen Zustand (im Sinne der chemischen Metalldefinition) übergehen kann; dieser metallische Wasserstoff ist wahrscheinlich auch für das extrem starke Magnetfeld des Jupiter verantwortlich. Metallischer Wasserstoff trägt aber nicht zur astrophysikalischen Metallizität des Objekts bei, in dem er vorkommt. ⓘ
Heraldik
Als Metalle werden in der Heraldik die Tinkturen (Wappenfarben) Gold und Silber bezeichnet. Bei Wappenmalereien wird als Ersatz für Gold die Farbe Gelb und als Ersatz für Silber die Farbe Weiß verwendet. ⓘ