Chemie
| Teil einer Serie über ⓘ |
| Chemie |
|---|
 |
|
|
Die Chemie ist die wissenschaftliche Untersuchung der Eigenschaften und des Verhaltens der Materie. Sie ist eine Naturwissenschaft, die sich mit den Elementen, aus denen die Materie besteht, bis hin zu den aus Atomen, Molekülen und Ionen zusammengesetzten Verbindungen befasst: mit ihrer Zusammensetzung, ihrer Struktur, ihren Eigenschaften, ihrem Verhalten und den Veränderungen, die sie bei einer Reaktion mit anderen Stoffen erfahren. ⓘ
Vom Umfang ihres Faches her nimmt die Chemie eine Zwischenstellung zwischen der Physik und der Biologie ein. Sie wird manchmal als zentrale Wissenschaft bezeichnet, weil sie die Grundlage für das Verständnis sowohl grundlegender als auch angewandter wissenschaftlicher Disziplinen auf einer fundamentalen Ebene bietet. So erklärt die Chemie beispielsweise Aspekte des Pflanzenwachstums (Botanik), die Entstehung von Eruptivgestein (Geologie), die Bildung von Ozon in der Atmosphäre und den Abbau von Umweltschadstoffen (Ökologie), die Eigenschaften der Erde auf dem Mond (Kosmochemie), die Wirkungsweise von Medikamenten (Pharmakologie) und die Sammlung von DNA-Beweisen an einem Tatort (Forensik). ⓘ
Die Chemie befasst sich unter anderem mit der Frage, wie Atome und Moleküle über chemische Bindungen zusammenwirken, um neue chemische Verbindungen zu bilden. Es gibt zwei Arten von chemischen Bindungen: 1. primäre chemische Bindungen - z. B. kovalente Bindungen, bei denen Atome ein oder mehrere Elektronen teilen; ionische Bindungen, bei denen ein Atom ein oder mehrere Elektronen an ein anderes Atom abgibt, um Ionen (Kationen und Anionen) zu bilden; metallische Bindungen - und 2. sekundäre chemische Bindungen - z. B. Wasserstoffbrückenbindungen; Van-der-Waals-Kraft-Bindungen; Ionen-Ionen-Wechselwirkung; Ionen-Dipol-Wechselwirkung. ⓘ


Die Chemie in ihrer heutigen Form als exakte Naturwissenschaft entstand im 17. und 18. Jahrhundert allmählich aus der Anwendung rationalen Schlussfolgerns, basierend auf Beobachtungen und Experimenten der Alchemie. Einige der ersten bedeutenden Chemiker waren Robert Boyle, Humphry Davy, Jöns Jakob Berzelius, Joseph Louis Gay-Lussac, Joseph Louis Proust, Marie und Antoine Lavoisier und Justus von Liebig. ⓘ
Die chemische Industrie zählt zu den wichtigsten Industriezweigen. Sie stellt Stoffe her, die zur Herstellung von Alltagsgegenständen (z. B. Grundchemikalien, Kunststoffe, Lacke), Lebensmitteln (auch als Hilfsmittel dazu wie Düngemittel und Pestizide) oder zur Verbesserung der Gesundheit (z. B. Pharmazeutika) benötigt werden. ⓘ
Etymologie
Das Wort Chemie geht auf eine Abwandlung des Wortes Alchemie in der Renaissance zurück, das sich auf eine frühere Reihe von Praktiken bezog, die Elemente der Chemie, Metallurgie, Philosophie, Astrologie, Astronomie, Mystik und Medizin umfassten. Die Alchemie wird oft mit dem Bestreben in Verbindung gebracht, Blei oder andere unedle Metalle in Gold zu verwandeln, obwohl die Alchemisten auch an vielen Fragen der modernen Chemie interessiert waren. ⓘ
Das moderne Wort Alchemie wiederum leitet sich von dem arabischen Wort al-kīmīā (الكیمیاء) ab. Dies könnte ägyptischen Ursprungs sein, da al-kīmīā vom altgriechischen χημία abgeleitet ist, das wiederum vom Wort Kemet abgeleitet ist, dem alten Namen für Ägypten in der ägyptischen Sprache. Alternativ kann al-kīmīā auch von χημεία "zusammengewürfelt" abgeleitet werden. ⓘ
Moderne Grundsätze

Das derzeitige Modell der atomaren Struktur ist das quantenmechanische Modell. Die traditionelle Chemie beginnt mit der Untersuchung von Elementarteilchen, Atomen, Molekülen, Substanzen, Metallen, Kristallen und anderen Aggregaten der Materie. Die Materie kann in festem, flüssigem, gasförmigem und plasmatischem Zustand, einzeln oder in Kombination untersucht werden. Die Wechselwirkungen, Reaktionen und Umwandlungen, die in der Chemie untersucht werden, sind in der Regel das Ergebnis von Wechselwirkungen zwischen Atomen, die zu einer Umstrukturierung der chemischen Bindungen führen, die die Atome zusammenhalten. Solche Verhaltensweisen werden in einem Chemielabor untersucht. ⓘ
Im Chemielabor werden stereotyp verschiedene Formen von Laborgeräten aus Glas verwendet. Glasgeräte sind jedoch kein zentrales Element der Chemie, und ein großer Teil der experimentellen (wie auch der angewandten/industriellen) Chemie wird ohne sie durchgeführt. ⓘ

Eine chemische Reaktion ist eine Umwandlung einiger Stoffe in einen oder mehrere andere Stoffe. Die Grundlage einer solchen chemischen Umwandlung ist die Umordnung der Elektronen in den chemischen Bindungen zwischen den Atomen. Sie kann symbolisch durch eine chemische Gleichung dargestellt werden, die in der Regel Atome als Subjekte enthält. Die Anzahl der Atome auf der linken und rechten Seite der Gleichung für eine chemische Umwandlung ist gleich. (Wenn die Anzahl der Atome auf beiden Seiten ungleich ist, wird die Umwandlung als Kernreaktion oder radioaktiver Zerfall bezeichnet). Die Art der chemischen Reaktionen, die ein Stoff durchlaufen kann, und die damit einhergehenden Energieänderungen werden durch bestimmte Grundregeln eingeschränkt, die als chemische Gesetze bezeichnet werden. ⓘ
Energie- und Entropiebetrachtungen sind in fast allen chemischen Studien von großer Bedeutung. Chemische Stoffe werden nach ihrer Struktur, ihrer Phase und ihrer chemischen Zusammensetzung klassifiziert. Sie können mit den Mitteln der chemischen Analyse, z. B. Spektroskopie und Chromatographie, analysiert werden. Wissenschaftler, die sich mit chemischer Forschung befassen, werden als Chemiker bezeichnet. Die meisten Chemiker spezialisieren sich auf eine oder mehrere Teildisziplinen. Mehrere Konzepte sind für das Studium der Chemie von grundlegender Bedeutung; einige davon sind: ⓘ
Materie
In der Chemie wird Materie als alles definiert, was eine Ruhemasse und ein Volumen hat (es nimmt Raum ein) und aus Teilchen besteht. Die Teilchen, aus denen die Materie besteht, haben ebenfalls eine Ruhemasse - nicht alle Teilchen haben eine Ruhemasse, wie z. B. das Photon. Materie kann ein reiner chemischer Stoff oder ein Gemisch von Stoffen sein. ⓘ
Atom

Das Atom ist die Grundeinheit der Chemie. Es besteht aus einem dichten Kern, dem so genannten Atomkern, der von einem Raum umgeben ist, der von einer Elektronenwolke eingenommen wird. Der Kern besteht aus positiv geladenen Protonen und ungeladenen Neutronen (zusammen Nukleonen genannt), während die Elektronenwolke aus negativ geladenen Elektronen besteht, die den Kern umkreisen. In einem neutralen Atom gleichen die negativ geladenen Elektronen die positive Ladung der Protonen aus. Der Kern ist dicht; die Masse eines Nukleons beträgt etwa das 1.836-fache der Masse eines Elektrons, der Radius eines Atoms ist jedoch etwa 10.000-mal so groß wie der seines Kerns. ⓘ
Das Atom ist auch die kleinste Einheit, die die chemischen Eigenschaften des Elements beibehält, wie Elektronegativität, Ionisierungspotenzial, bevorzugte Oxidationsstufe(n), Koordinationszahl und bevorzugte Bindungsarten (z. B. metallisch, ionisch, kovalent). ⓘ
Element

Ein chemisches Element ist ein reiner Stoff, der aus einer einzigen Atomart besteht, die durch eine bestimmte Anzahl von Protonen in den Atomkernen gekennzeichnet ist, die als Ordnungszahl bezeichnet und durch das Symbol Z dargestellt wird. Obwohl alle Atomkerne eines Elements die gleiche Ordnungszahl haben, müssen sie nicht unbedingt die gleiche Massenzahl haben; Atome eines Elements, die unterschiedliche Massenzahlen haben, werden als Isotope bezeichnet. So sind zum Beispiel alle Atome mit 6 Protonen in ihren Kernen Atome des chemischen Elements Kohlenstoff, aber die Atome des Kohlenstoffs können eine Massenzahl von 12 oder 13 haben. ⓘ
Die Standarddarstellung der chemischen Elemente ist das Periodensystem, in dem die Elemente nach ihrer Ordnungszahl geordnet sind. Das Periodensystem ist in Gruppen (Spalten) und Perioden (Zeilen) unterteilt. Das Periodensystem ist nützlich, um periodische Trends zu erkennen. ⓘ
Verbindung
Eine Verbindung ist eine reine chemische Substanz, die aus mehr als einem Element besteht. Die Eigenschaften einer Verbindung haben wenig Ähnlichkeit mit denen ihrer Elemente. Die Standardnomenklatur für Verbindungen wird von der Internationalen Union für reine und angewandte Chemie (IUPAC) festgelegt. Organische Verbindungen werden nach dem System der organischen Nomenklatur benannt. Die Namen für anorganische Verbindungen werden nach dem System der anorganischen Nomenklatur erstellt. Wenn eine Verbindung mehr als eine Komponente hat, werden sie in zwei Klassen eingeteilt: die elektropositiven und die elektronegativen Komponenten. Darüber hinaus hat der Chemical Abstracts Service eine Methode zur Indexierung chemischer Substanzen entwickelt. In diesem Schema ist jede chemische Substanz durch eine Nummer identifizierbar, die als CAS-Registernummer bekannt ist. ⓘ
Molekül

Ein Molekül ist der kleinste unteilbare Teil eines reinen chemischen Stoffes, der über einzigartige chemische Eigenschaften verfügt, d. h. über das Potenzial, eine bestimmte Anzahl chemischer Reaktionen mit anderen Stoffen einzugehen. Diese Definition eignet sich jedoch nur für Stoffe, die aus Molekülen bestehen, was auf viele Stoffe nicht zutrifft (siehe unten). Moleküle bestehen in der Regel aus einer Reihe von Atomen, die durch kovalente Bindungen miteinander verbunden sind, so dass die Struktur elektrisch neutral ist und alle Valenzelektronen entweder in Bindungen oder als einsame Paare mit anderen Elektronen gepaart sind. ⓘ
Moleküle sind also im Gegensatz zu Ionen elektrisch neutrale Einheiten. Wenn diese Regel gebrochen wird und das "Molekül" eine Ladung erhält, wird das Ergebnis manchmal als Molekülion oder polyatomares Ion bezeichnet. Die diskrete und getrennte Natur des molekularen Konzepts erfordert jedoch in der Regel, dass molekulare Ionen nur in gut getrennter Form vorliegen, beispielsweise als gerichteter Strahl in einem Vakuum in einem Massenspektrometer. Geladene polyatomare Ansammlungen in Festkörpern (z. B. gewöhnliche Sulfat- oder Nitrat-Ionen) werden in der Chemie im Allgemeinen nicht als "Moleküle" betrachtet. Einige Moleküle enthalten ein oder mehrere ungepaarte Elektronen, wodurch Radikale entstehen. Die meisten Radikale sind vergleichsweise reaktiv, aber einige, wie z. B. Stickstoffmonoxid (NO), können stabil sein. ⓘ

Die "inerten" oder Edelgaselemente (Helium, Neon, Argon, Krypton, Xenon und Radon) bestehen aus einzelnen Atomen als kleinste diskrete Einheit, während die anderen isolierten chemischen Elemente entweder aus Molekülen oder aus Netzwerken von Atomen bestehen, die auf irgendeine Weise miteinander verbunden sind. Identifizierbare Moleküle bilden bekannte Stoffe wie Wasser, Luft und viele organische Verbindungen wie Alkohol, Zucker, Benzin und die verschiedenen Arzneimittel. ⓘ
Allerdings bestehen nicht alle Stoffe oder chemischen Verbindungen aus einzelnen Molekülen, und die meisten festen Stoffe, aus denen die feste Kruste, der Mantel und der Kern der Erde bestehen, sind chemische Verbindungen ohne Moleküle. Diese anderen Arten von Stoffen, wie z. B. ionische Verbindungen und Netzwerkfeststoffe, sind so organisiert, dass es keine identifizierbaren Moleküle an sich gibt. Stattdessen spricht man bei diesen Stoffen von Formeleinheiten oder Einheitszellen als kleinste sich wiederholende Struktur innerhalb des Stoffes. Beispiele für solche Stoffe sind Mineralsalze (z. B. Kochsalz), Feststoffe wie Kohlenstoff und Diamant, Metalle und bekannte Kieselsäure- und Silikatminerale wie Quarz und Granit. ⓘ
Eines der wichtigsten Merkmale eines Moleküls ist seine Geometrie, auch Struktur genannt. Während die Struktur von zwei-, drei- oder vieratomigen Molekülen trivial sein kann (linear, winkelpyramidal usw.), kann die Struktur von mehratomigen Molekülen, die aus mehr als sechs Atomen (verschiedener Elemente) bestehen, entscheidend für ihre chemische Natur sein. ⓘ
Substanz und Gemisch
  | |
  | |
  | |
| Beispiele für reine chemische Stoffe. Von links nach rechts: die Elemente Zinn (Sn) und Schwefel (S), Diamant (ein Allotrop des Kohlenstoffs), Saccharose (reiner Zucker) sowie Natriumchlorid (Salz) und Natriumbicarbonat (Backpulver), die beide ionische Verbindungen sind. |
Ein chemischer Stoff ist eine Art von Materie mit einer bestimmten Zusammensetzung und einer Reihe von Eigenschaften. Eine Ansammlung von Stoffen wird als Gemisch bezeichnet. Beispiele für Gemische sind Luft und Legierungen. ⓘ
Mol und Menge eines Stoffes
Das Mol ist eine Maßeinheit, die eine Stoffmenge (auch chemische Menge genannt) angibt. Ein Mol ist so definiert, dass es genau 6,02214076×1023 Teilchen (Atome, Moleküle, Ionen oder Elektronen) enthält, wobei die Anzahl der Teilchen pro Mol als Avogadro-Konstante bezeichnet wird. Die molare Konzentration ist die Menge einer bestimmten Substanz pro Lösungsvolumen und wird üblicherweise in mol/dm3 angegeben. ⓘ
Phase

Zusätzlich zu den spezifischen chemischen Eigenschaften, die verschiedene chemische Klassifizierungen unterscheiden, können Chemikalien in mehreren Phasen vorliegen. In den meisten Fällen sind die chemischen Klassifizierungen unabhängig von diesen Massenphasenklassifizierungen; einige exotischere Phasen sind jedoch mit bestimmten chemischen Eigenschaften unvereinbar. Eine Phase ist eine Reihe von Zuständen eines chemischen Systems, die über einen Bereich von Bedingungen wie Druck oder Temperatur hinweg ähnliche strukturelle Eigenschaften aufweisen. ⓘ
Physikalische Eigenschaften wie Dichte und Brechungsindex fallen in der Regel in die für die Phase charakteristischen Werte. Die Phase der Materie wird durch den Phasenübergang definiert, d. h. wenn die in das System eingebrachte oder aus dem System entnommene Energie in die Umgestaltung der Struktur des Systems fließt, anstatt die Massebedingungen zu verändern. ⓘ
Manchmal kann die Unterscheidung zwischen den Phasen kontinuierlich sein, anstatt eine diskrete Grenze zu haben", in diesem Fall wird die Materie als überkritischer Zustand betrachtet. Wenn drei Zustände auf der Grundlage der Bedingungen zusammentreffen, spricht man von einem Tripelpunkt, und da dieser unveränderlich ist, ist dies eine bequeme Art, eine Reihe von Bedingungen zu definieren. ⓘ
Die bekanntesten Beispiele für Phasen sind Feststoffe, Flüssigkeiten und Gase. Viele Stoffe weisen mehrere feste Phasen auf. So gibt es beispielsweise drei Phasen von festem Eisen (alpha, gamma und delta), die sich je nach Temperatur und Druck unterscheiden. Ein Hauptunterschied zwischen den festen Phasen ist die Kristallstruktur bzw. die Anordnung der Atome. Eine weitere in der Chemie häufig anzutreffende Phase ist die wässrige Phase, d. h. der Zustand von in wässriger Lösung (d. h. in Wasser) gelösten Substanzen. ⓘ
Zu den weniger bekannten Phasen gehören Plasmen, Bose-Einstein-Kondensate und fermionische Kondensate sowie die paramagnetischen und ferromagnetischen Phasen von magnetischen Materialien. Während die meisten bekannten Phasen dreidimensionale Systeme betreffen, ist es auch möglich, Analoga in zweidimensionalen Systemen zu definieren, was aufgrund seiner Bedeutung für Systeme in der Biologie Beachtung gefunden hat. ⓘ
Bindung
Atome, die in Molekülen oder Kristallen aneinander haften, gelten als miteinander verbunden. Eine chemische Bindung kann als mehrpoliges Gleichgewicht zwischen den positiven Ladungen in den Kernen und den negativen Ladungen, die um sie herum schwingen, veranschaulicht werden. Die Energien und Verteilungen sind mehr als nur Anziehung und Abstoßung, sie charakterisieren die Verfügbarkeit eines Elektrons zur Bindung an ein anderes Atom. ⓘ
Bei der chemischen Bindung kann es sich um eine kovalente Bindung, eine Ionenbindung, eine Wasserstoffbindung oder einfach um eine Van-der-Waals-Bindung handeln. Jeder dieser Bindungsarten wird ein bestimmtes Potenzial zugeschrieben. Diese Potenziale erzeugen die Wechselwirkungen, die die Atome in Molekülen oder Kristallen zusammenhalten. Bei vielen einfachen Verbindungen können die Valenzbindungstheorie, das Valenzschalen-Elektronenpaar-Abstoßungsmodell (VSEPR) und das Konzept der Oxidationszahl zur Erklärung der Molekülstruktur und -zusammensetzung verwendet werden. ⓘ
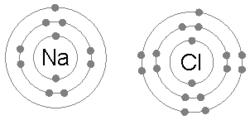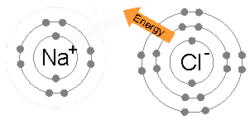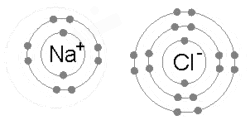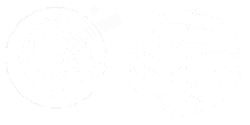
Eine Ionenbindung entsteht, wenn ein Metall ein oder mehrere seiner Elektronen verliert und zu einem positiv geladenen Kation wird, während die Elektronen von einem Nichtmetallatom aufgenommen werden und zu einem negativ geladenen Anion werden. Die beiden gegensätzlich geladenen Ionen ziehen sich gegenseitig an, und die Ionenbindung ist die elektrostatische Anziehungskraft zwischen ihnen. Zum Beispiel verliert Natrium (Na), ein Metall, ein Elektron und wird zu einem Na+ Kation, während Chlor (Cl), ein Nichtmetall, dieses Elektron gewinnt und zu Cl- wird. Die Ionen werden durch elektrostatische Anziehung zusammengehalten, und es entsteht die Verbindung Natriumchlorid (NaCl), auch Kochsalz genannt. ⓘ

Bei einer kovalenten Bindung teilen sich zwei Atome ein oder mehrere Valenzelektronenpaare: Die sich daraus ergebende elektrisch neutrale Gruppe von gebundenen Atomen wird als Molekül bezeichnet. Die Atome teilen sich die Valenzelektronen so, dass für jedes Atom eine Edelgas-Elektronenkonfiguration (acht Elektronen in der äußersten Schale) entsteht. Atome, die dazu neigen, sich so zu verbinden, dass sie jeweils acht Elektronen in ihrer Valenzschale haben, folgen der Oktettregel. Einige Elemente wie Wasserstoff und Lithium benötigen jedoch nur zwei Elektronen in ihrer äußersten Schale, um diese stabile Konfiguration zu erreichen; diese Atome folgen der Duett-Regel und erreichen auf diese Weise die Elektronenkonfiguration des Edelgases Helium, das zwei Elektronen in seiner äußeren Schale hat. ⓘ
In ähnlicher Weise können Theorien aus der klassischen Physik zur Vorhersage vieler ionischer Strukturen verwendet werden. Bei komplizierteren Verbindungen, wie z. B. Metallkomplexen, ist die Theorie der Valenzbindung weniger anwendbar, und es werden im Allgemeinen alternative Ansätze wie die Molekülorbitaltheorie verwendet. Siehe Diagramm zu elektronischen Orbitalen. ⓘ
Energie
Im Kontext der Chemie ist Energie eine Eigenschaft eines Stoffes, die sich aus seiner atomaren, molekularen oder aggregierten Struktur ergibt. Da eine chemische Umwandlung mit einer Änderung einer oder mehrerer dieser Strukturarten einhergeht, ist sie stets mit einer Erhöhung oder Verringerung der Energie der beteiligten Stoffe verbunden. Ein Teil der Energie wird zwischen der Umgebung und den Reaktionspartnern in Form von Wärme oder Licht übertragen; daher können die Produkte einer Reaktion mehr oder weniger Energie haben als die Reaktionspartner. ⓘ
Eine Reaktion wird als exergonisch bezeichnet, wenn der Endzustand auf der Energieskala niedriger liegt als der Ausgangszustand; bei endergonischen Reaktionen ist die Situation umgekehrt. Eine Reaktion wird als exotherm bezeichnet, wenn die Reaktion Wärme an die Umgebung abgibt; bei endothermen Reaktionen nimmt die Reaktion Wärme aus der Umgebung auf. ⓘ
Chemische Reaktionen sind immer nur möglich, wenn die Reaktanten eine Energiebarriere, die so genannte Aktivierungsenergie, überwinden. Die Geschwindigkeit einer chemischen Reaktion (bei einer gegebenen Temperatur T) ist mit der Aktivierungsenergie E durch den Boltzmannschen Populationsfaktor - d. h. die Wahrscheinlichkeit, dass ein Molekül bei der gegebenen Temperatur T eine Energie größer oder gleich E hat. Diese exponentielle Abhängigkeit der Reaktionsgeschwindigkeit von der Temperatur ist als Arrhenius-Gleichung bekannt. Die für das Auftreten einer chemischen Reaktion erforderliche Aktivierungsenergie kann in Form von Wärme, Licht, Elektrizität oder mechanischer Kraft in Form von Ultraschall vorliegen. ⓘ
Ein verwandtes Konzept, die freie Energie, die auch Entropieüberlegungen einbezieht, ist in der chemischen Thermodynamik ein sehr nützliches Mittel zur Vorhersage der Durchführbarkeit einer Reaktion und zur Bestimmung des Gleichgewichtszustands einer chemischen Reaktion. Eine Reaktion ist nur dann durchführbar, wenn die Gesamtänderung der freien Gibbs-Energie negativ ist, Wenn sie gleich Null ist, befindet sich die chemische Reaktion im Gleichgewicht. ⓘ
Es gibt nur eine begrenzte Anzahl möglicher Energiezustände für Elektronen, Atome und Moleküle. Diese werden durch die Regeln der Quantenmechanik bestimmt, die eine Quantisierung der Energie eines gebundenen Systems erfordern. Die Atome/Moleküle, die sich in einem höheren Energiezustand befinden, werden als angeregt bezeichnet. Die Moleküle/Atome eines Stoffes, die sich in einem angeregten Energiezustand befinden, sind oft sehr viel reaktionsfreudiger, d. h., sie sind für chemische Reaktionen leichter zugänglich. ⓘ
Die Phase eines Stoffes wird immer von seiner Energie und der Energie seiner Umgebung bestimmt. Wenn die zwischenmolekularen Kräfte eines Stoffes so groß sind, dass die Energie der Umgebung nicht ausreicht, um sie zu überwinden, befindet er sich in einer geordneteren Phase, wie z. B. in einer flüssigen oder festen Phase, wie dies bei Wasser (H2O) der Fall ist, das bei Raumtemperatur flüssig ist, weil seine Moleküle durch Wasserstoffbrücken gebunden sind. Schwefelwasserstoff (H2S) hingegen ist bei Raumtemperatur und Normaldruck ein Gas, da seine Moleküle durch schwächere Dipol-Dipol-Wechselwirkungen gebunden sind. ⓘ
Die Übertragung von Energie von einem chemischen Stoff auf einen anderen hängt von der Größe der von einem Stoff abgegebenen Energiequanten ab. Wärmeenergie lässt sich jedoch oft leichter von einem Stoff auf einen anderen übertragen, da die Phononen, die für die Schwingungs- und Rotationsenergieniveaus in einem Stoff verantwortlich sind, viel weniger Energie haben als Photonen, die für die elektronische Energieübertragung herangezogen werden. Da Schwingungs- und Rotationsenergieniveaus enger beieinander liegen als elektronische Energieniveaus, lässt sich Wärme im Vergleich zu Licht oder anderen Formen elektronischer Energie leichter zwischen Stoffen übertragen. So wird beispielsweise ultraviolette elektromagnetische Strahlung nicht so effizient von einem Stoff auf einen anderen übertragen wie thermische oder elektrische Energie. ⓘ
Das Vorhandensein charakteristischer Energieniveaus für verschiedene chemische Stoffe ist für deren Identifizierung durch die Analyse von Spektrallinien nützlich. In der chemischen Spektroskopie werden häufig verschiedene Arten von Spektren verwendet, z. B. IR, Mikrowellen, NMR, ESR usw. Die Spektroskopie wird auch eingesetzt, um die Zusammensetzung von weit entfernten Objekten - wie Sternen und fernen Galaxien - durch die Analyse ihrer Strahlungsspektren zu bestimmen. ⓘ

Der Begriff chemische Energie wird häufig verwendet, um das Potenzial einer chemischen Substanz zur Umwandlung durch eine chemische Reaktion oder zur Umwandlung anderer chemischer Substanzen anzugeben. ⓘ
Reaktion

Wenn sich ein chemischer Stoff durch die Wechselwirkung mit einem anderen Stoff oder mit Energie umwandelt, spricht man von einer chemischen Reaktion. Eine chemische Reaktion ist also ein Konzept, das sich auf die "Reaktion" eines Stoffes bezieht, wenn er in engen Kontakt mit einem anderen Stoff kommt, sei es als Gemisch oder als Lösung, sei es unter Einwirkung einer Energieform oder beidem. Dabei kommt es zu einem Energieaustausch zwischen den Bestandteilen der Reaktion sowie mit der Systemumgebung, bei der es sich um bestimmte Gefäße - häufig Laborglas - handeln kann. ⓘ
Chemische Reaktionen können zur Bildung oder Dissoziation von Molekülen führen, d. h. zum Auseinanderbrechen von Molekülen, um zwei oder mehr Moleküle zu bilden, oder zur Neuanordnung von Atomen in oder zwischen Molekülen. Chemische Reaktionen beinhalten in der Regel den Aufbau oder das Aufbrechen von chemischen Bindungen. Oxidation, Reduktion, Dissoziation, Säure-Base-Neutralisierung und molekulare Umlagerung sind einige der gebräuchlichsten Arten von chemischen Reaktionen. ⓘ
Eine chemische Reaktion kann symbolisch durch eine chemische Gleichung dargestellt werden. Während bei einer nicht nuklearen chemischen Reaktion die Anzahl und die Art der Atome auf beiden Seiten der Gleichung gleich sind, gilt dies bei einer Kernreaktion nur für die Kernteilchen, nämlich Protonen und Neutronen. ⓘ
Die Abfolge der Schritte, in denen die Umstrukturierung chemischer Bindungen im Verlauf einer chemischen Reaktion stattfinden kann, wird als ihr Mechanismus bezeichnet. Man kann sich vorstellen, dass eine chemische Reaktion in einer Reihe von Schritten abläuft, von denen jeder eine andere Geschwindigkeit haben kann. So können im Verlauf einer Reaktion viele Reaktionszwischenprodukte mit unterschiedlicher Stabilität entstehen. Reaktionsmechanismen werden vorgeschlagen, um die Kinetik und den relativen Produktmix einer Reaktion zu erklären. Viele Physikalische Chemiker haben sich darauf spezialisiert, die Mechanismen verschiedener chemischer Reaktionen zu erforschen und vorzuschlagen. Verschiedene empirische Regeln, wie die Woodward-Hoffmann-Regeln, sind oft sehr nützlich, wenn man einen Mechanismus für eine chemische Reaktion vorschlägt. ⓘ
Nach dem goldenen Buch der IUPAC ist eine chemische Reaktion "ein Prozess, der zu einer Umwandlung von chemischen Spezies führt". Dementsprechend kann eine chemische Reaktion eine Elementarreaktion oder eine schrittweise Reaktion sein. Eine weitere Einschränkung besteht darin, dass diese Definition auch Fälle einschließt, in denen die Umwandlung von Konformeren experimentell beobachtbar ist. An solchen nachweisbaren chemischen Reaktionen sind in der Regel Gruppen von molekularen Einheiten im Sinne dieser Definition beteiligt, doch ist es häufig konzeptionell zweckmäßig, den Begriff auch für Veränderungen zu verwenden, die einzelne molekulare Einheiten betreffen (d. h. "mikroskopische chemische Ereignisse"). ⓘ
Ionen und Salze

Ein Ion ist eine geladene Spezies, ein Atom oder ein Molekül, das ein oder mehrere Elektronen verloren oder gewonnen hat. Wenn ein Atom ein Elektron verliert und somit mehr Protonen als Elektronen hat, ist das Atom ein positiv geladenes Ion oder Kation. Wenn ein Atom ein Elektron gewinnt und somit mehr Elektronen als Protonen hat, ist das Atom ein negativ geladenes Ion oder Anion. Kationen und Anionen können ein kristallines Gitter aus neutralen Salzen bilden, wie z. B. die Na+ und Cl- Ionen, die Natriumchlorid (NaCl) bilden. Beispiele für mehratomige Ionen, die sich bei Säure-Base-Reaktionen nicht aufspalten, sind Hydroxid (OH-) und Phosphat (PO43-). ⓘ
Plasma besteht aus gasförmiger Materie, die in der Regel durch hohe Temperaturen vollständig ionisiert wurde. ⓘ
Azidität und Basizität

Eine Substanz kann oft als Säure oder als Base klassifiziert werden. Es gibt verschiedene Theorien, die das Säure-Base-Verhalten erklären. Die einfachste ist die Arrhenius-Theorie, die besagt, dass eine Säure eine Substanz ist, die Hydronium-Ionen produziert, wenn sie in Wasser gelöst wird, und eine Base eine Substanz ist, die Hydroxid-Ionen produziert, wenn sie in Wasser gelöst wird. Nach der Säure-Base-Theorie von Brønsted-Lowry sind Säuren Stoffe, die in einer chemischen Reaktion ein positives Wasserstoffion an einen anderen Stoff abgeben; eine Base ist demnach der Stoff, der dieses Wasserstoffion aufnimmt. ⓘ
Eine dritte gängige Theorie ist die Lewis-Säure-Base-Theorie, die auf der Bildung neuer chemischer Bindungen beruht. Die Lewis-Theorie besagt, dass eine Säure ein Stoff ist, der in der Lage ist, während der Bindungsbildung ein Elektronenpaar von einem anderen Stoff aufzunehmen, während eine Base ein Stoff ist, der ein Elektronenpaar zur Bildung einer neuen Bindung bereitstellen kann. Nach dieser Theorie sind die entscheidenden Dinge, die ausgetauscht werden, Ladungen. Es gibt noch mehrere andere Möglichkeiten, einen Stoff als Säure oder Base einzustufen, wie die Geschichte dieses Konzepts zeigt. ⓘ
Die Säurestärke wird im Allgemeinen mit zwei Methoden gemessen. Eine Messung, die auf der Arrhenius-Definition des Säuregehalts beruht, ist der pH-Wert, der die Konzentration der Hydroniumionen in einer Lösung auf einer negativen logarithmischen Skala angibt. Lösungen mit einem niedrigen pH-Wert haben also eine hohe Hydroniumionenkonzentration und können als saurer bezeichnet werden. Die andere Messgröße, die auf der Brønsted-Lowry-Definition beruht, ist die Säuredissoziationskonstante (Ka), die die relative Fähigkeit einer Substanz misst, als Säure gemäß der Brønsted-Lowry-Definition einer Säure zu wirken. Das heißt, Stoffe mit einer höheren Ka spenden bei chemischen Reaktionen eher Wasserstoffionen als Stoffe mit niedrigeren Ka-Werten. ⓘ
Redox
Redoxreaktionen (Reduktion-Oxidation) umfassen alle chemischen Reaktionen, bei denen Atome ihren Oxidationszustand ändern, indem sie entweder Elektronen gewinnen (Reduktion) oder verlieren (Oxidation). Stoffe, die die Fähigkeit haben, andere Stoffe zu oxidieren, werden als oxidativ bezeichnet und als Oxidationsmittel, Oxidationsmittel oder Oxidationsmittel bezeichnet. Ein Oxidationsmittel entzieht einem anderen Stoff Elektronen. Stoffe, die in der Lage sind, andere Stoffe zu reduzieren, werden als Reduktionsmittel, Reduktionsstoffe oder Reduktionsmittel bezeichnet. ⓘ
Ein Reduktionsmittel überträgt Elektronen auf eine andere Substanz und wird somit selbst oxidiert. Und weil es Elektronen "spendet", wird es auch als Elektronendonator bezeichnet. Oxidation und Reduktion beziehen sich eigentlich auf eine Änderung der Oxidationszahl - eine tatsächliche Übertragung von Elektronen kann nie stattfinden. Oxidation ist daher besser definiert als eine Erhöhung der Oxidationszahl und Reduktion als eine Verringerung der Oxidationszahl. ⓘ
Gleichgewicht
Obwohl der Begriff Gleichgewicht in allen Wissenschaften weit verbreitet ist, taucht er in der Chemie immer dann auf, wenn mehrere verschiedene Zustände der chemischen Zusammensetzung möglich sind, z. B. in einem Gemisch aus mehreren chemischen Verbindungen, die miteinander reagieren können, oder wenn eine Substanz in mehr als einer Art von Phase vorhanden sein kann. ⓘ
Ein System aus chemischen Stoffen im Gleichgewicht ist, obwohl es eine unveränderte Zusammensetzung aufweist, meist nicht statisch; die Moleküle der Stoffe reagieren weiterhin miteinander, so dass ein dynamisches Gleichgewicht entsteht. Der Begriff beschreibt also einen Zustand, in dem die Parameter wie die chemische Zusammensetzung im Laufe der Zeit unverändert bleiben. ⓘ
Chemische Gesetze
Chemische Reaktionen unterliegen bestimmten Gesetzen, die in der Chemie zu grundlegenden Konzepten geworden sind. Einige von ihnen sind:
- Avogadrosches Gesetz
- Beer-Lambert-Gesetz
- Boyle'sches Gesetz (1662, Beziehung zwischen Druck und Volumen)
- Charles'sches Gesetz (1787, Zusammenhang zwischen Volumen und Temperatur)
- Ficksches Gesetz der Diffusion
- Gay-Lussac's Gesetz (1809, Beziehung zwischen Druck und Temperatur)
- Das Prinzip von Le Chatelier
- Henrysches Gesetz
- Hesssches Gesetz
- Der Energieerhaltungssatz führt zu den wichtigen Konzepten des Gleichgewichts, der Thermodynamik und der Kinetik.
- Der Satz von der Erhaltung der Masse bleibt in isolierten Systemen auch in der modernen Physik erhalten. Die spezielle Relativitätstheorie zeigt jedoch, dass aufgrund der Masse-Energie-Äquivalenz immer dann, wenn einem nicht isolierten System nicht-materielle "Energie" (Wärme, Licht, kinetische Energie) entzogen wird, auch etwas Masse verloren geht. Hohe Energieverluste führen zu einem Verlust von wägbaren Mengen an Masse, ein wichtiges Thema in der Kernchemie.
- Gesetz der eindeutigen Zusammensetzung, obwohl in vielen Systemen (insbesondere Biomakromolekülen und Mineralien) die Verhältnisse dazu neigen, große Zahlen zu erfordern, und häufig als Bruch dargestellt werden.
- Gesetz der multiplen Proportionen
- Raoultsches Gesetz ⓘ
Geschichte
Die Geschichte der Chemie reicht von sehr alten Zeiten bis in die Gegenwart. Seit mehreren Jahrtausenden vor Christus nutzten die Zivilisationen Technologien, die schließlich die Grundlage für die verschiedenen Zweige der Chemie bilden sollten. Beispiele dafür sind die Gewinnung von Metallen aus Erzen, die Herstellung von Töpferwaren und Glasuren, die Gärung von Bier und Wein, die Gewinnung von Chemikalien aus Pflanzen für Medizin und Parfüm, die Verarbeitung von Fett zu Seife, die Herstellung von Glas und von Legierungen wie Bronze. Der Chemie ging ihre Urwissenschaft, die Alchemie, voraus, die ein intuitiver, aber nicht wissenschaftlicher Ansatz zum Verständnis der Bestandteile der Materie und ihrer Wechselwirkungen ist. Es gelang ihr nicht, die Natur der Materie und ihre Umwandlungen zu erklären, aber durch die Durchführung von Experimenten und die Aufzeichnung der Ergebnisse legten die Alchemisten den Grundstein für die moderne Chemie. Die Chemie als ein von der Alchemie getrenntes Wissensgebiet begann sich herauszubilden, als Robert Boyle in seinem Werk The Sceptical Chymist (1661) eine klare Unterscheidung zwischen beiden vornahm. Während sich sowohl die Alchemie als auch die Chemie mit der Materie und ihren Umwandlungen befassen, bestand der entscheidende Unterschied in der wissenschaftlichen Methode, die die Chemiker bei ihrer Arbeit anwandten. Man geht davon aus, dass die Chemie mit den Arbeiten von Antoine Lavoisier zu einer etablierten Wissenschaft wurde, der ein Gesetz zur Erhaltung der Masse entwickelte, das sorgfältige Messungen und quantitative Beobachtungen chemischer Phänomene erforderte. Die Geschichte der Chemie ist mit der Geschichte der Thermodynamik verflochten, insbesondere durch die Arbeit von Willard Gibbs. ⓘ
Definition
Die Definition der Chemie hat sich im Laufe der Zeit geändert, da neue Entdeckungen und Theorien die Funktionalität der Wissenschaft erweitern. Der Begriff "Chymie" bezeichnete nach Ansicht des bekannten Wissenschaftlers Robert Boyle im Jahr 1661 das Thema der materiellen Prinzipien von gemischten Körpern. Der Chemiker Christopher Glaser beschrieb 1663 die "Chymie" als eine wissenschaftliche Kunst, durch die man lernt, Körper aufzulösen und ihnen die verschiedenen Substanzen ihrer Zusammensetzung zu entziehen, sie wieder zu vereinigen und sie zu einer höheren Vollkommenheit zu erheben. ⓘ
Die Definition des Wortes "Chemie" von Georg Ernst Stahl aus dem Jahr 1730 bezeichnete die Kunst, gemischte, zusammengesetzte oder aggregierte Körper in ihre Prinzipien aufzulösen und solche Körper aus diesen Prinzipien zusammenzusetzen. Im Jahr 1837 bezeichnete Jean-Baptiste Dumas mit dem Wort "Chemie" die Wissenschaft, die sich mit den Gesetzen und Wirkungen molekularer Kräfte befasst. Diese Definition entwickelte sich weiter, bis sie 1947 die Wissenschaft von den Stoffen bezeichnete: ihre Struktur, ihre Eigenschaften und die Reaktionen, durch die sie in andere Stoffe umgewandelt werden - eine Charakterisierung, die von Linus Pauling übernommen wurde. In jüngerer Zeit, im Jahr 1998, erweiterte Professor Raymond Chang die Definition von "Chemie" auf das Studium der Materie und der Veränderungen, denen sie unterliegt. ⓘ
Fachgebiet
Frühe Zivilisationen wie die Ägypter, Babylonier und Inder sammelten praktisches Wissen über die Kunst der Metallurgie, Töpferei und Färberei, entwickelten aber keine systematische Theorie. ⓘ
Eine grundlegende chemische Hypothese entstand erstmals im klassischen Griechenland mit der Theorie der vier Elemente, die von Aristoteles endgültig aufgestellt wurde und besagt, dass Feuer, Luft, Erde und Wasser die grundlegenden Elemente sind, aus denen sich alles in Kombination bildet. Der griechische Atomismus geht auf das Jahr 440 v. Chr. zurück und taucht in den Werken von Philosophen wie Demokrit und Epikur auf. Im Jahr 50 v. Chr. erweiterte der römische Philosoph Lukrez diese Theorie in seinem Buch De rerum natura (Über die Natur der Dinge). Im Gegensatz zu modernen Wissenschaftskonzepten war der griechische Atomismus rein philosophischer Natur und hatte wenig mit empirischen Beobachtungen und chemischen Experimenten zu tun. ⓘ
Eine frühe Form des Gedankens der Massenerhaltung ist die Vorstellung, dass in der antiken griechischen Philosophie "nichts von nichts kommt", die bei Empedokles (ca. 4. Jahrhundert v. Chr.) zu finden ist: Jh. v. Chr.) zu finden ist: "Denn es ist unmöglich, dass etwas aus dem, was nicht ist, entsteht, und es ist nicht möglich, dass das, was ist, völlig zerstört wird", und Epikur (3. Jh. v. Chr.), der bei der Beschreibung der Natur des Universums schrieb, dass "die Gesamtheit der Dinge immer so war, wie sie jetzt ist, und immer so sein wird". ⓘ

In der hellenistischen Welt verbreitete sich zunächst die Kunst der Alchemie, die Magie und Okkultismus mit dem Studium natürlicher Substanzen vermischte, mit dem Ziel, Elemente in Gold zu verwandeln und das Elixier des ewigen Lebens zu entdecken. Die Arbeiten, insbesondere die Entwicklung der Destillation, wurden in der frühen byzantinischen Periode fortgesetzt. Der berühmteste Praktiker war der griechisch-ägyptische Zosimos von Panopolis aus dem 4. Nach den muslimischen Eroberungen wurde die Alchemie in der gesamten arabischen Welt weiterentwickelt und praktiziert. Von dort und aus den byzantinischen Überresten gelangte sie durch lateinische Übersetzungen ins Europa des Mittelalters und der Renaissance. ⓘ
Die arabischen Werke, die Jabir ibn Hayyan zugeschrieben werden, führten eine systematische Klassifizierung chemischer Substanzen ein und enthielten Anleitungen zur chemischen Gewinnung einer anorganischen Verbindung (Salmiak oder Ammoniumchlorid) aus organischen Substanzen (wie Pflanzen, Blut und Haaren). Einige arabische Jabirian-Werke (z. B. das "Buch der Barmherzigkeit" und das "Buch der Siebzig") wurden später unter dem latinisierten Namen "Geber" ins Lateinische übersetzt, und im Europa des 13. Jahrhunderts begann ein anonymer Schriftsteller, der gewöhnlich als Pseudo-Geber bezeichnet wird, unter diesem Namen alchemistische und metallurgische Schriften zu verfassen. Später bestritten einflussreiche muslimische Philosophen wie Abū al-Rayhān al-Bīrūnī und Avicenna die Theorien der Alchemie, insbesondere die Theorie der Transmutation von Metallen. ⓘ
Unter dem Einfluss der von Sir Francis Bacon und anderen propagierten neuen empirischen Methoden begann eine Gruppe von Chemikern in Oxford, Robert Boyle, Robert Hooke und John Mayow, die alten alchemistischen Traditionen in eine wissenschaftliche Disziplin umzugestalten. Insbesondere Boyle gilt aufgrund seines wichtigsten Werks, dem Chemie-Klassiker The Sceptical Chymist, in dem er zwischen den Behauptungen der Alchemie und den empirischen wissenschaftlichen Entdeckungen der neuen Chemie unterscheidet, als Gründervater der Chemie. Er formulierte das Boyle'sche Gesetz, lehnte die klassischen "vier Elemente" ab und schlug eine mechanistische Alternative von Atomen und chemischen Reaktionen vor, die strengen Experimenten unterzogen werden konnte. ⓘ

Die Phlogistontheorie (eine Substanz, die allen Verbrennungsvorgängen zugrunde liegt) wurde von dem Deutschen Georg Ernst Stahl zu Beginn des 18. Jahrhunderts aufgestellt und erst gegen Ende des Jahrhunderts von dem französischen Chemiker Antoine Lavoisier, dem chemischen Gegenstück zu Newton in der Physik, überwunden; er trug mehr als jeder andere dazu bei, die neue Wissenschaft auf eine angemessene theoretische Grundlage zu stellen, indem er den Grundsatz der Massenerhaltung erläuterte und ein neues System der chemischen Nomenklatur entwickelte, das bis heute verwendet wird. ⓘ
Vor seiner Arbeit waren jedoch bereits viele wichtige Entdeckungen gemacht worden, insbesondere in Bezug auf die Natur der "Luft", die sich aus vielen verschiedenen Gasen zusammensetzt. Der schottische Chemiker Joseph Black (der erste experimentelle Chemiker) und der Flame Jan Baptist van Helmont entdeckten 1754 Kohlendioxid oder das, was Black als "feste Luft" bezeichnete; Henry Cavendish entdeckte Wasserstoff und erläuterte seine Eigenschaften, und Joseph Priestley und unabhängig davon Carl Wilhelm Scheele isolierten reinen Sauerstoff. ⓘ
Der englische Wissenschaftler John Dalton stellte die moderne Atomtheorie auf, nach der alle Stoffe aus unteilbaren Atomen" bestehen und die verschiedenen Atome unterschiedliche Atomgewichte haben. ⓘ
Die Entwicklung der elektrochemischen Theorie chemischer Verbindungen erfolgte zu Beginn des 19. Jahrhunderts durch die Arbeit von zwei Wissenschaftlern, Jöns Jacob Berzelius und Humphry Davy, die durch die vorherige Erfindung der Voltasche Säule durch Alessandro Volta ermöglicht wurde. Davy entdeckte neun neue Elemente, darunter die Alkalimetalle, indem er sie mit elektrischem Strom aus ihren Oxiden herauslöste. ⓘ

Der Brite William Prout schlug erstmals vor, alle Elemente nach ihrem Atomgewicht zu ordnen, da alle Atome ein Gewicht hatten, das ein genaues Vielfaches des Atomgewichts von Wasserstoff war. J.A.R. Newlands entwarf eine frühe Tabelle der Elemente, die dann in den 1860er Jahren von Dmitri Mendelejew und unabhängig davon von mehreren anderen Wissenschaftlern, darunter Julius Lothar Meyer, zum modernen Periodensystem der Elemente weiterentwickelt wurde. Die reaktionsträgen Gase, die später als Edelgase bezeichnet wurden, wurden Ende des Jahrhunderts von William Ramsay in Zusammenarbeit mit Lord Rayleigh entdeckt, wodurch die Grundstruktur des Periodensystems vervollständigt wurde. ⓘ

Unten: Beobachtete Ergebnisse: Ein kleiner Teil der Teilchen wurde abgelenkt, was auf eine kleine, konzentrierte Ladung hinweist. ⓘ
Jahrhunderts wurden die theoretischen Grundlagen der Chemie dank einer Reihe bemerkenswerter Entdeckungen, mit denen es gelang, die innere Struktur der Atome zu erforschen und zu entdecken, endlich verstanden. Im Jahr 1897 entdeckte J.J. Thomson von der Universität Cambridge das Elektron, und bald darauf untersuchten der französische Wissenschaftler Becquerel sowie das Ehepaar Pierre und Marie Curie das Phänomen der Radioaktivität. In einer Reihe bahnbrechender Streuexperimente entdeckte Ernest Rutherford an der Universität Manchester die innere Struktur des Atoms und die Existenz des Protons, klassifizierte und erklärte die verschiedenen Arten der Radioaktivität und wandelte erfolgreich das erste Element um, indem er Stickstoff mit Alphateilchen beschoss. ⓘ
Seine Arbeiten über die Atomstruktur wurden von seinen Schülern, dem dänischen Physiker Niels Bohr, Henry Moseley und Otto Hahn, weiterentwickelt, die zu den Begründern der aufkommenden Kernchemie wurden. Die elektronische Theorie der chemischen Bindungen und Molekülorbitale wurde von den amerikanischen Wissenschaftlern Linus Pauling und Gilbert N. Lewis entwickelt. ⓘ
Das Jahr 2011 wurde von den Vereinten Nationen zum Internationalen Jahr der Chemie erklärt. Es handelt sich um eine Initiative der Internationalen Union für reine und angewandte Chemie und der Organisation der Vereinten Nationen für Erziehung, Wissenschaft und Kultur, an der sich chemische Gesellschaften, Wissenschaftler und Institutionen auf der ganzen Welt beteiligen und die auf Einzelinitiativen zur Organisation lokaler und regionaler Aktivitäten beruht. ⓘ
Die organische Chemie wurde von Justus von Liebig und anderen entwickelt, nachdem Friedrich Wöhler die Harnstoffsynthese durchgeführt hatte. Weitere entscheidende Fortschritte des 19. Jahrhunderts waren das Verständnis der Valenzbindung (Edward Frankland im Jahr 1852) und die Anwendung der Thermodynamik auf die Chemie (J. W. Gibbs und Svante Arrhenius in den 1870er Jahren). ⓘ
Praxis
Teildisziplinen
Die Chemie ist in der Regel in mehrere große Teildisziplinen unterteilt. Darüber hinaus gibt es mehrere disziplinübergreifende und spezialisiertere Hauptbereiche der Chemie.
- Die analytische Chemie befasst sich mit der Analyse von Materialproben, um ein Verständnis ihrer chemischen Zusammensetzung und Struktur zu gewinnen. Die analytische Chemie umfasst standardisierte experimentelle Methoden in der Chemie. Diese Methoden können in allen Teildisziplinen der Chemie eingesetzt werden, mit Ausnahme der rein theoretischen Chemie.
- Biochemie ist die Lehre von den chemischen Stoffen, chemischen Reaktionen und chemischen Wechselwirkungen, die in lebenden Organismen stattfinden. Biochemie und organische Chemie sind eng miteinander verbunden, wie z. B. in der medizinischen Chemie oder der Neurochemie. Die Biochemie ist auch mit der Molekularbiologie und der Genetik verbunden.
- Die anorganische Chemie befasst sich mit den Eigenschaften und Reaktionen von anorganischen Verbindungen. Die Unterscheidung zwischen organischen und anorganischen Disziplinen ist nicht absolut, und es gibt viele Überschneidungen, vor allem in der Unterdisziplin der metallorganischen Chemie.
- Die Materialchemie befasst sich mit der Herstellung, der Charakterisierung und dem Verständnis von Substanzen mit einer nützlichen Funktion. Das Gebiet ist ein neuer Studienbereich in Graduiertenprogrammen und integriert Elemente aus allen klassischen Bereichen der Chemie mit einem Schwerpunkt auf grundlegenden Fragen, die für Materialien einzigartig sind. Zu den wichtigsten Studiensystemen gehören die Chemie kondensierter Phasen (Feststoffe, Flüssigkeiten, Polymere) und die Grenzflächen zwischen verschiedenen Phasen.
- Neurochemie ist das Studium der Neurochemikalien, einschließlich der Transmitter, Peptide, Proteine, Lipide, Zucker und Nukleinsäuren, ihrer Wechselwirkungen und der Rolle, die sie bei der Bildung, Erhaltung und Veränderung des Nervensystems spielen.
- Die Kernchemie befasst sich mit der Frage, wie subatomare Teilchen zusammenkommen und Kerne bilden. Die moderne Transmutation ist ein wichtiger Bestandteil der Kernchemie, und die Tabelle der Nuklide ist ein wichtiges Ergebnis und Werkzeug für diesen Bereich.
- Die organische Chemie ist die Lehre von der Struktur, den Eigenschaften, der Zusammensetzung, den Mechanismen und den Reaktionen organischer Verbindungen. Eine organische Verbindung ist definiert als jede Verbindung, die auf einem Kohlenstoffgerüst basiert.
- Die physikalische Chemie befasst sich mit den physikalischen und grundlegenden Grundlagen chemischer Systeme und Prozesse. Insbesondere die Energetik und Dynamik solcher Systeme und Prozesse sind für physikalische Chemiker von Interesse. Wichtige Untersuchungsgebiete sind chemische Thermodynamik, chemische Kinetik, Elektrochemie, statistische Mechanik, Spektroskopie und in jüngster Zeit auch Astrochemie. Die physikalische Chemie hat große Überschneidungen mit der Molekularphysik. In der physikalischen Chemie wird bei der Ableitung von Gleichungen die Infinitesimalrechnung verwendet. Sie wird gewöhnlich mit der Quantenchemie und der theoretischen Chemie in Verbindung gebracht. Die Physikalische Chemie ist eine von der Chemischen Physik getrennte Disziplin, aber auch hier gibt es sehr starke Überschneidungen.
- Theoretische Chemie ist das Studium der Chemie anhand grundlegender theoretischer Überlegungen (in der Regel aus der Mathematik oder Physik). Insbesondere die Anwendung der Quantenmechanik auf die Chemie wird als Quantenchemie bezeichnet. Seit dem Ende des Zweiten Weltkriegs hat die Entwicklung von Computern eine systematische Entwicklung der computergestützten Chemie ermöglicht, d. h. die Kunst der Entwicklung und Anwendung von Computerprogrammen zur Lösung chemischer Probleme. Die theoretische Chemie hat große Überschneidungen mit der (theoretischen und experimentellen) Physik der kondensierten Materie und der Molekularphysik. ⓘ
Andere Disziplinen innerhalb der Chemie werden traditionell nach der Art der untersuchten Materie oder der Art der Untersuchung gruppiert. Dazu gehören die anorganische Chemie, die sich mit anorganischer Materie befasst, die organische Chemie, die sich mit organischer (kohlenstoffbasierter) Materie befasst, die Biochemie, die sich mit Substanzen befasst, die in biologischen Organismen vorkommen, die physikalische Chemie, die sich mit chemischen Prozessen befasst und dabei physikalische Konzepte wie Thermodynamik und Quantenmechanik anwendet, und die analytische Chemie, die sich mit der Analyse von Materialproben befasst, um deren chemische Zusammensetzung und Struktur zu verstehen. In den letzten Jahren haben sich viele weitere Spezialdisziplinen herausgebildet, z. B. die Neurochemie, die sich mit der chemischen Untersuchung des Nervensystems befasst (siehe Teildisziplinen). ⓘ
Andere Disziplinen sind Elektrochemie, Femtochemie, Aromachemie, Fließchemie, Histochemie, Geschichte der Chemie, Hydrierungschemie, mathematische Chemie, Molekularmechanik, Naturstoffchemie, metallorganische Chemie, Petrochemie, Photochemie, physikalisch-organische Chemie, Polymerchemie, Radiochemie, Sonochemie, supramolekulare Chemie, synthetische Chemie und viele andere. ⓘ
Interdisziplinär
Zu den interdisziplinären Bereichen gehören Agrochemie, Astrochemie (und Kosmochemie), Atmosphärenchemie, chemische Verfahrenstechnik, chemische Biologie, Chemoinformatik, Umweltchemie, Geochemie, grüne Chemie, Immunchemie, Meereschemie, Materialwissenschaften, Mechanochemie, medizinische Chemie, Molekularbiologie, Nanotechnologie, Önologie, Pharmakologie, Phytochemie, Festkörperchemie, Oberflächenwissenschaften, Thermochemie und viele andere. ⓘ
Industrie
Die chemische Industrie stellt weltweit einen wichtigen Wirtschaftszweig dar. Die 50 größten Chemieproduzenten der Welt erwirtschafteten 2013 einen Umsatz von 980,5 Milliarden US-Dollar mit einer Gewinnspanne von 10,3 %. ⓘ
Fachgesellschaften
- Amerikanische Chemische Gesellschaft
- Amerikanische Gesellschaft für Neurochemie
- Chemisches Institut von Kanada
- Chemische Gesellschaft von Peru
- Internationale Union für reine und angewandte Chemie
- Königliches Australisches Chemisches Institut
- Königlich Niederländische Chemische Gesellschaft
- Königliche Gesellschaft für Chemie
- Gesellschaft der Chemischen Industrie
- Weltverband der Theoretischen und Computergestützten Chemiker
- Liste der Chemie-Gesellschaften ⓘ
Wirtschaftliche Bedeutung der Chemie

Die chemische Industrie ist – gerade auch in Deutschland – ein sehr bedeutender Wirtschaftszweig: In Deutschland lag der Umsatz der 20 umsatzstärksten deutschen Chemieunternehmen 2017 bei über 250 Milliarden Euro, die Zahl der Beschäftigten lag nach der Wiedervereinigung Deutschlands bei über 700.000 und ist Stand 2017 auf über 900.000 angewachsen. Sie stellt einerseits Grundchemikalien wie beispielsweise Schwefelsäure oder Ammoniak her, oft in Mengen von Millionen von Tonnen jährlich, die sie dann zum Beispiel zur Produktion von Düngemitteln und Kunststoffen verwendet. Andererseits produziert die chemische Industrie viele komplexe Stoffe, unter anderem pharmazeutische Wirkstoffe (Arzneistoffe) und Pflanzenschutzmittel (Pestizide), maßgeschneidert für spezielle Anwendungen. Auch die Herstellung von Computern, Kraft- und Schmierstoffen für die Automobilindustrie und vielen anderen technischen Produkten ist ohne industriell hergestellte Chemikalien unmöglich. ⓘ
Ausbildung
Schulunterricht

Es ist Aufgabe des Chemieunterrichts, einen Einblick in stoffliche Zusammensetzung, Stoffgruppen und stoffliche Vorgänge der Natur zu geben. Stoffumwandlungen in der belebten und unbelebten Natur beruhen ebenfalls auf chemischen Reaktionen und sollten als solche erkannt werden können. Ebenso sollte aus der Vermittlung naturwissenschaftlicher Erkenntnisse Verständnis für die moderne Technik und eine positive Einstellung dazu aufgebaut werden, da gerade die Chemie durch Einführung neuer Produkte einen wesentlichen Beitrag zur Verbesserung der Lebensbedingungen des Menschen geleistet hat. Nicht zuletzt dient der Chemieunterricht auch dazu, die Schüler zu mündigen Verbrauchern zu erziehen. Er wird aus diesem Grund nach Lehrplänen (Curricula) und pädagogischen Konzepten gestaltet (Chemiedidaktik). ⓘ
Beruf
Es ist möglich als Chemielaborant in Betrieb und Berufsschule im so genannten Dualen System ausgebildet zu werden. Ein weiterer Ausbildungsberuf für die Arbeit im Chemielabor ist der Chemisch Technische Assistent (CTA). Der Chemikant (auch Chemie- und Pharmatechnologe oder früher Chemiefacharbeiter) ist ein Ausbildungsberuf für Mitarbeiter in der chemischen Industrie. ⓘ
Viele Universitäten bieten einen Studiengang Chemie an. Ein Großteil der Chemiker schließt im Anschluss an das Studium eine Promotion an. ⓘ
Berühmte Chemiker
- Bedeutende Chemiker (chronologisch) (nach Geburtsdatum geordnet)
- Bedeutende Chemiker (alphabetisch)
- Bedeutende Chemiker (Kategorien) (nach den Fachgebieten geordnet, dort alphabetisch)
- Liste der Nobelpreisträger für Chemie ⓘ