Keratine

Keratin (/ˈkɛrətɪn/) gehört zu einer Familie von faserartigen Strukturproteinen, die auch als Skleroproteine bezeichnet werden. Alpha-Keratin (α-Keratin) ist eine Art von Keratin, das bei Wirbeltieren vorkommt. Es ist das wichtigste Strukturmaterial, aus dem Schuppen, Haare, Nägel, Federn, Hörner, Krallen, Hufe und die äußere Hautschicht der Wirbeltiere bestehen. Keratin schützt auch die Epithelzellen vor Beschädigung oder Stress. Keratin ist in Wasser und organischen Lösungsmitteln extrem unlöslich. Keratinmonomere schließen sich zu Bündeln zusammen, um Zwischenfilamente zu bilden, die zäh sind und starke, nicht mineralisierte Epidermisanhangsgebilde bilden, die bei Reptilien, Vögeln, Amphibien und Säugetieren vorkommen. Eine übermäßige Keratinisierung trägt zur Festigung bestimmter Gewebe bei, wie z. B. bei den Hörnern von Rindern und Nashörnern und dem Osteoderm von Gürteltieren. Die einzige andere biologische Substanz, von der bekannt ist, dass sie der Zähigkeit von keratinisiertem Gewebe nahe kommt, ist Chitin. Es gibt zwei Arten von Keratin: die primitiven, weicheren Formen, die bei allen Wirbeltieren vorkommen, und die härteren, abgeleiteten Formen, die nur bei Sauropsiden (Reptilien und Vögeln) zu finden sind. ⓘ
Spinnenseide wird als Keratin eingestuft, obwohl sich die Produktion des Proteins möglicherweise unabhängig von diesem Prozess bei Wirbeltieren entwickelt hat. ⓘ
Keratin (von griechisch κέρας kéras „Horn“, Genitiv kératos) ist ein Sammelbegriff für verschiedene wasserunlösliche Faserproteine, die von Tieren gebildet werden und die Hornsubstanz charakterisieren. Entsprechend ihrer molekularen Konformation als α-Helix oder β-Faltblatt unterscheidet man α- und β-Keratine. ⓘ
Keratine sind der Hauptbestandteil von Säugetierhaaren, Finger- und Zehennägeln, Krallen, Klauen, Hufen, Hörnern, Nasenhörnern der Nashörner, Stacheln der Igel, Barten der Wale, Schnäbeln und Federn der Vögel, Hornschuppen und äußerer Panzerbedeckung der Reptilien. Sie bilden Intermediärfilamente der Epidermis aus und sorgen somit für ihre Reißfestigkeit. ⓘ
Beispiele für das Vorkommen
Alpha-Keratine (α-Keratine) finden sich bei allen Wirbeltieren. Sie bilden das Haar (einschließlich Wolle), die äußere Schicht der Haut, Hörner, Nägel, Krallen und Hufe von Säugetieren und die Schleimfäden von Schleimaalen. Keratinfilamente sind in Keratinozyten in der verhornten Schicht der Epidermis reichlich vorhanden; es handelt sich dabei um Proteine, die keratinisiert wurden. Sie sind auch in Epithelzellen im Allgemeinen vorhanden. So reagieren beispielsweise Thymusepithelzellen der Maus mit Antikörpern gegen Keratin 5, Keratin 8 und Keratin 14. Diese Antikörper werden als Fluoreszenzmarker zur Unterscheidung von Untergruppen der Thymusepithelzellen der Maus in genetischen Studien über den Thymus verwendet. ⓘ
Die härteren Beta-Keratine (β-Keratine) kommen nur bei den Sauropsiden vor, d. h. bei allen lebenden Reptilien und Vögeln. Sie finden sich in den Nägeln, Schuppen und Krallen der Reptilien, in einigen Reptilienpanzern (Testudinen, wie z. B. Schildkröte, Sumpfschildkröte, Sumpfschildkröte) und in den Federn, Schnäbeln und Krallen der Vögel. Diese Keratine werden hauptsächlich in Form von Beta-Schichten gebildet. Beta-Folien finden sich jedoch auch in α-Keratinen. Die Bartenplatten der sich filtrierend ernährenden Wale bestehen aus Keratin. Neuere Forschungen haben gezeigt, dass sich sauropside β-Keratine auf genetischer und struktureller Ebene grundlegend von α-Keratinen unterscheiden. Um Verwechslungen mit α-Keratinen zu vermeiden, wurde der neue Begriff Corneous Beta Protein (CBP) vorgeschlagen. ⓘ
Keratine (auch als Cytokeratine bezeichnet) sind Polymere aus Typ-I- und Typ-II-Intermediärfilamenten, die bisher nur bei Chordaten (Wirbeltiere, Amphoxen, Urochordaten) gefunden wurden. Nematoden und viele andere Tiere, die keine Chordaten sind, scheinen nur Intermediärfilamente vom Typ VI zu besitzen, Fasern, die den Zellkern strukturieren. ⓘ
Gene


Das menschliche Genom kodiert 54 funktionelle Keratin-Gene, die in zwei Clustern auf den Chromosomen 12 und 17 liegen. Dies lässt vermuten, dass sie aus einer Reihe von Genduplikationen auf diesen Chromosomen hervorgegangen sind. ⓘ
Zu den Keratinen gehören die folgenden Proteine: KRT23, KRT24, KRT25, KRT26, KRT27, KRT28, KRT31, KRT32, KRT33A, KRT33B, KRT34, KRT35, KRT36, KRT37, KRT38, KRT39, KRT40, KRT71, KRT72, KRT73, KRT74, KRT75, KRT76, KRT77, KRT78, KRT79, KRT8, KRT80, KRT81, KRT82, KRT83, KRT84, KRT85 und KRT86 wurden zur Beschreibung der Keratine in der Vergangenheit verwendet 20. ⓘ

Struktur der Proteine
Die ersten Sequenzen der Keratine wurden von Israel Hanukoglu und Elaine Fuchs (1982, 1983) bestimmt. Diese Sequenzen zeigten, dass es zwei unterschiedliche, aber homologe Keratinfamilien gibt, die als Typ-I- und Typ-II-Keratine bezeichnet wurden. Durch die Analyse der Primärstrukturen dieser Keratine und anderer Intermediärfilamentproteine schlugen Hanukoglu und Fuchs ein Modell vor, bei dem Keratine und Intermediärfilamentproteine eine zentrale Domäne mit ~310 Resten und vier Segmenten in α-helicaler Konformation enthalten, die durch drei kurze Linkersegmente getrennt sind, von denen man annimmt, dass sie in Beta-Turn-Konformation vorliegen. Dieses Modell wurde durch die Bestimmung der Kristallstruktur einer helikalen Domäne von Keratinen bestätigt. ⓘ
Faserige Keratinmoleküle wickeln sich zu einem sehr stabilen, linkshändigen superhelicalen Motiv auf, um zu multimerisieren und Filamente zu bilden, die aus mehreren Kopien des Keratinmonomers bestehen. ⓘ
Die Hauptkraft, die die Coiled-Coil-Struktur aufrechterhält, sind hydrophobe Wechselwirkungen zwischen apolaren Resten entlang der Keratin-Helixsegmente. ⓘ
Der begrenzte Innenraum ist der Grund dafür, dass die Dreifachhelix des (nicht verwandten) Strukturproteins Kollagen, das in Haut, Knorpel und Knochen vorkommt, ebenfalls einen hohen Anteil an Glycin aufweist. Das Bindegewebsprotein Elastin hat ebenfalls einen hohen Anteil an Glycin und Alanin. Seidenfibroin, das zu den β-Keratinen zählt, kann diese beiden Stoffe zu 75-80 % enthalten, mit 10-15 % Serin, wobei der Rest sperrige Seitengruppen aufweist. Die Ketten sind antiparallel, mit einer abwechselnden C → N-Orientierung. Ein Übergewicht an Aminosäuren mit kleinen, nicht reaktiven Seitengruppen ist charakteristisch für Strukturproteine, bei denen die H-gebundene enge Packung wichtiger ist als die chemische Spezifität. ⓘ
Disulfidbrücken
Zusätzlich zu den intra- und intermolekularen Wasserstoffbrückenbindungen zeichnen sich Keratine durch das Vorhandensein großer Mengen der schwefelhaltigen Aminosäure Cystein aus, die für die Disulfidbrücken erforderlich ist, die durch dauerhafte, thermisch stabile Vernetzung zusätzliche Festigkeit und Steifigkeit verleihen - ähnlich wie Schwefelbrücken, die nicht zu den Proteinen gehören, vulkanisierten Gummi stabilisieren. Menschliches Haar besteht zu etwa 14 % aus Cystein. Der stechende Geruch von brennendem Haar und Haut ist auf die entstehenden flüchtigen Schwefelverbindungen zurückzuführen. Ausgedehnte Disulfidbindungen tragen zur Unlöslichkeit von Keratinen bei, außer in einigen wenigen Lösungsmitteln wie Dissoziierungs- oder Reduktionsmitteln. ⓘ
Die flexibleren und elastischeren Keratine der Haare haben weniger Disulfidbrücken zwischen den Ketten als die Keratine in den Fingernägeln, Hufen und Krallen von Säugetieren (homologe Strukturen), die härter sind und eher ihren Analoga in anderen Wirbeltierklassen ähneln. Haare und andere α-Keratine bestehen aus α-helikal gewickelten Einzelproteinsträngen (mit regelmäßiger H-Bindung innerhalb der Kette), die dann weiter zu superhelikalen Seilen verdrillt sind, die weiter gewickelt werden können. Bei den β-Keratinen von Reptilien und Vögeln sind die β-Faltblätter miteinander verdrillt und anschließend durch Disulfidbrücken stabilisiert und gehärtet. ⓘ
Filamentbildung
Es wurde vorgeschlagen, dass Keratine in "harte" und "weiche" Formen oder "Cytokeratine" und "andere Keratine" unterteilt werden können. Dieses Modell wird heute als richtig angesehen. Ein neuer Kernzusatz von 2006 zur Beschreibung der Keratine trägt dem Rechnung. ⓘ
Keratinfilamente sind intermediäre Filamente. Wie alle intermediären Filamente bilden Keratinproteine filamentöse Polymere in einer Reihe von Zusammensetzungsschritten, die mit der Dimerisierung beginnen; Dimere setzen sich zu Tetrameren und Oktameren zusammen und schließlich, wenn die derzeitige Hypothese zutrifft, zu Einheitslängen-Filamenten (ULF), die in der Lage sind, sich Ende an Ende zu langen Filamenten zu verbinden. ⓘ
Paarung
Ihre Faserstruktur verstärkt die Festigkeit der Keratine: Die einzelnen Aminosäureketten bilden eine rechtsgängige α-Helix. Zwei dieser Helices lagern sich zu einer linksgängigen Superhelix und zwei dieser Superhelices beim α-Keratin zu einer Protofibrille zusammen. Mehrere Protofibrillen vereinigen sich zu einer Mikrofibrille, diese lagern sich zu Bündeln zusammen und bilden Makrofibrillen aus. Die Fasern sind umso steifer, je stärker ihre Komponenten durch Disulfidbrücken der Aminosäure L-Cystein quervernetzt sind. So enthält das Keratin in Hörnern und Klauen mehr Disulfidbrücken als das in Wolle und Haaren. Leonor Michaelis entdeckte, dass Disulfidbrücken durch Thioglykolsäure reduziert werden. Dies war die biochemische Grundlage für die Dauerwelle. ⓘ
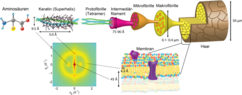
Vor der Verhornung sowie allgemein in Epithelien der Wirbeltiere und anderer Tiergruppen liegen α-Keratine (oder Cytokeratine) in Form lose organisierter Keratinfilamente vor. Diese gehören zu den Intermediärfilamenten, die zusammen mit Mikrotubuli und Mikrofilamenten das Zytoskelett der eukaryotischen Zellen bilden. Derzeit sind 20 Cytokeratin-Proteine bekannt (siehe Tabelle), deren Molekülmasse zwischen 40 und 68 kDa liegt. KRT1 bis KRT8 werden zur neutral-basischen Typ-A-Subfamilie, KRT9 bis KRT20 zur sauren Typ-B-Subfamilie gezählt. Diese bilden paarweise in den Intermediärfilamenten einen Heterodimer-Komplex aus einem Typ-A- und einem Typ-B-Cytokeratin. Die Verteilungsmuster dieser Komplexe unterscheiden sich in verschiedenen epithelialen Zellen erheblich, sodass mit einem Antikörpernachweis gegen die Subtypen KRT1 bis KRT20 die Herkunft dieser Cytokeratine eingegrenzt werden kann. Dies macht man sich in der Medizin in der pathologischen Diagnostik zunutze, um die Herkunft von Tumormetastasen zu bestimmen. Mutationen in verschiedenen Keratin-Genen sind für eine Reihe seltener Erbkrankheiten (Ichthyose) verantwortlich. ⓘ
| A (neutral- basisch) |
B (sauer) |
Vorkommen | Pathologie |
|---|---|---|---|
| KRT1, KRT2 | KRT9, KRT10 | mehrschichtig-verhornendes Epithel (Epidermis) | Ichthyosis hystrix Curth-Macklin; bullöse kongenitale ichthyosiforme Erythrodermie Brocq (EHK); keratosis palmoplantaris striata III; weitere Ichthyosen (BCIE; AEI; CRIE) |
| KRT3 | KRT12 | Hornhaut (Cornea) | Korneale Dystrophie |
| KRT4 | KRT13 | mehrschichtig-unverhorntes Epithel | Naevus spongiosus albus |
| KRT5 | KRT14, KRT15 | Basalzellen komplexer Epithelien sowie Myoepithelzellen | Epidermolysis bullosa simplex; Dowling-Degos-Krankheit; Naegeli-Syndrom |
| KRT6A | KRT16, KRT17 | mehrschichtig-unverhorntes Plattenepithel, Proliferation | Pachyonychia congenita; div. Nävus, Keratoderma |
| KRT7 | KRT19 | einschichtiges Epithel, luminale Drüsenzellen | |
| KRT8 | KRT18, KRT20 | einschichtiges Epithel, luminale Drüsenzellen |
Ein Beispiel für ein β-Keratin ist das Fibroin oder Seidenprotein der Spinnennetze und der Seide. Im Unterschied zu den α- oder Cytokeratinen ist es kein intrazelluläres Strukturprotein, sondern ein Ausscheidungsprodukt der Spinndrüsen. Wegen seiner Faltblattstruktur ist es sehr viel weniger dehnbar als die helikal gebauten α-Keratine.

Verhornung
Verhornung ist der Prozess der Bildung einer epidermalen Barriere in geschichtetem Plattenepithelgewebe. Auf zellulärer Ebene, ist die Verhornung gekennzeichnet durch:
- die Produktion von Keratin
- Produktion von kleinen prolinreichen (SPRR) Proteinen und Transglutaminase, die schließlich eine verhornte Zellhülle unter der Plasmamembran bilden
- terminale Differenzierung
- Verlust von Zellkernen und Organellen in den letzten Stadien der Verhornung
Der Stoffwechsel wird eingestellt, und die Zellen werden fast vollständig mit Keratin ausgefüllt. Während des Prozesses der epithelialen Differenzierung werden die Zellen verhornt, indem Keratinprotein in längere Keratin-Zwischenfilamente eingebaut wird. Schließlich verschwinden der Zellkern und die zytoplasmatischen Organellen, der Stoffwechsel wird eingestellt und die Zellen durchlaufen einen programmierten Tod, wenn sie vollständig verhornt sind. In vielen anderen Zelltypen, wie z. B. den Zellen der Dermis, fungieren Keratinfilamente und andere Intermediärfilamente als Teil des Zytoskeletts, um die Zelle mechanisch gegen physischen Stress zu stabilisieren. Dies geschieht durch Verbindungen zu Desmosomen, Zell-Zell-Grenzflächen, und Hemidesmosomen, Haftstrukturen der Zellgrundmembran. ⓘ
Die Zellen der Epidermis enthalten eine Strukturmatrix aus Keratin, die diese äußerste Schicht der Haut nahezu wasserdicht macht und zusammen mit Kollagen und Elastin der Haut ihre Festigkeit verleiht. Reibung und Druck führen zu einer Verdickung der äußeren, verhornten Schicht der Epidermis und bilden schützende Schwielen, die bei Sportlern und an den Fingerspitzen von Musikern, die Saiteninstrumente spielen, nützlich sind. Die keratinisierten Epidermiszellen werden ständig abgestoßen und ersetzt. ⓘ
Diese harten, integumentären Strukturen entstehen durch die interzelluläre Verkittung von Fasern, die aus abgestorbenen, verhornten Zellen gebildet werden, die von spezialisierten Betten tief in der Haut stammen. Die Haare wachsen ständig, und die Federn mausern und regenerieren sich. Die Proteine, aus denen sie bestehen, können phylogenetisch homolog sein, unterscheiden sich aber in ihrer chemischen Struktur und supermolekularen Organisation. Die evolutionären Beziehungen sind komplex und nur teilweise bekannt. Für die β-Keratine in Federn wurden mehrere Gene identifiziert, und dies ist wahrscheinlich charakteristisch für alle Keratine. ⓘ
Seide
Die von Insekten und Spinnen produzierten Seidenfibroine werden oft als Keratine eingestuft, obwohl unklar ist, ob sie phylogenetisch mit den Wirbeltierkeratinen verwandt sind. ⓘ
Die in Insektenpuppen, Spinnennetzen und Eihüllen vorkommende Seide besteht ebenfalls aus verdrehten β-Faltblättern, die in zu größeren supermolekularen Aggregaten gewickelte Fasern eingebaut sind. Die Struktur der Spinndüsen an den Schwänzen der Spinnen und die Beiträge ihrer inneren Drüsen ermöglichen eine bemerkenswerte Kontrolle der schnellen Extrusion. Spinnenseide ist in der Regel etwa 1 bis 2 Mikrometer (µm) dick, verglichen mit etwa 60 µm bei menschlichem Haar und mehr bei einigen Säugetieren. Die biologisch und kommerziell nützlichen Eigenschaften von Seidenfasern hängen von der Organisation mehrerer benachbarter Proteinketten in harten, kristallinen Bereichen unterschiedlicher Größe ab, die sich mit flexiblen, amorphen Bereichen abwechseln, in denen die Ketten zufällig gewickelt sind. Ähnlich verhält es sich mit synthetischen Polymeren wie Nylon, das als Seidenersatz entwickelt wurde. Die Seide aus dem Hornissenkokon besteht aus ca. 10 µm großen Doppelstücken mit Kern und Umhüllung, die in bis zu 10 Lagen angeordnet sein können, auch in Form von Plättchen mit unterschiedlicher Form. Ausgewachsene Hornissen verwenden Seide auch als Klebstoff, ebenso wie Spinnen. ⓘ
Klinische Bedeutung
Ein abnormales Wachstum von Keratin kann bei einer Reihe von Erkrankungen wie Keratose, Hyperkeratose und Keratodermie auftreten. ⓘ
Mutationen in der Keratin-Genexpression können u. a. zu folgenden Erkrankungen führen
- Epidermolysis bullosa simplex
- Ichthyosis bullosa von Siemens
- Epidermolytische Hyperkeratose
- Steatocystoma multiplex
- Keratose pharyngis
- Rhabdoide Zellbildung bei großzelligem Lungenkarzinom mit rhabdoidem Phänotyp ⓘ
Mehrere Krankheiten, wie Fußpilz und Ringelflechte, werden durch infektiöse Pilze verursacht, die sich von Keratin ernähren. ⓘ
Keratin ist sehr widerstandsfähig gegen Verdauungssäuren, wenn es mit der Nahrung aufgenommen wird. Katzen nehmen im Rahmen ihres Putzverhaltens regelmäßig Haare auf, was zur allmählichen Bildung von Haarballen führt, die oral ausgeschieden oder mit dem Kot ausgeschieden werden können. Beim Menschen kann die Trichophagie zum Rapunzel-Syndrom führen, einer extrem seltenen, aber potenziell tödlichen Darmerkrankung. ⓘ
Diagnostische Verwendung
Die Keratinexpression ist hilfreich bei der Bestimmung des epithelialen Ursprungs von anaplastischen Krebsarten. Zu den Tumoren, die Keratin exprimieren, gehören Karzinome, Thymome, Sarkome und trophoblastische Neoplasmen. Darüber hinaus ermöglicht das genaue Expressionsmuster der Keratin-Subtypen bei der Beurteilung von Metastasen eine Vorhersage über den Ursprung des Primärtumors. So exprimieren hepatozelluläre Karzinome typischerweise CK8 und CK18 und Cholangiokarzinome CK7, CK8 und CK18, während Metastasen von kolorektalen Karzinomen CK20, aber nicht CK7 exprimieren. ⓘ
Technische Verwendung
Aus keratinhaltigen Naturstoffen werden L-Cystein, L-Tyrosin und andere proteinogene Aminosäuren im technischen Maßstab hergestellt. Dazu werden die Naturstoffe zuerst mit Salzsäure hydrolysiert. Das Hydrolysat wird mit Ammoniak neutralisiert. Die L-Aminosäuren werden dann aufgrund ihrer unterschiedlichen Löslichkeiten abgetrennt oder nach dem Prinzip der Ionenaustausch-Chromatographie isoliert. ⓘ
Verwendung finden Keratinprodukte (z. B. Schafwollvliese) beim Abbau von Formaldehyd. Hier hat das deutsche Wollforschungsinstitut an der RWTH Aachen zusammen mit dem eco Institut Köln in langfristiger Forschungsarbeit den Nachweis erbracht, dass solche Produkte in der Lage sind, Formaldehyd aus der Raumluft zu entfernen. Formaldehydbelastete Kindergärten, Schulen und Privathäuser (viele Fertighäuser der 1970er- und 1980er-Jahre) wurden in den letzten Jahren auf diese Weise bereits saniert. ⓘ