Alkene

In der organischen Chemie ist ein Alken ein Kohlenwasserstoff mit einer Kohlenstoff-Kohlenstoff-Doppelbindung. ⓘ
Alken wird häufig als Synonym für Olefin verwendet, d. h. für jeden Kohlenwasserstoff, der eine oder mehrere Doppelbindungen enthält. Es werden zwei allgemeine Typen von Monoalkenen unterschieden: endständige und innere. Die endständigen Alkene werden auch als α-Olefine bezeichnet und sind nützlicher. ⓘ
Die Internationale Union für reine und angewandte Chemie (IUPAC) empfiehlt jedoch, die Bezeichnung "Alken" nur für azyklische Kohlenwasserstoffe mit nur einer Doppelbindung zu verwenden, "Alkadien", "Alkatrien" usw. oder "Polyen" für azyklische Kohlenwasserstoffe mit zwei oder mehr Doppelbindungen, "Cycloalken", "Cycloalkadien" usw. für zyklische Kohlenwasserstoffe und "Olefin" für die allgemeine Klasse - zyklisch oder azyklisch, mit einer oder mehreren Doppelbindungen. ⓘ
Azyklische Alkene mit nur einer Doppelbindung und ohne andere funktionelle Gruppen (auch als Monoene bezeichnet) bilden eine homologe Reihe von Kohlenwasserstoffen mit der allgemeinen Formel CnH2n, wobei n 2 oder mehr ist (d. h. zwei Wasserstoffatome weniger als das entsprechende Alkan). Wenn n vier oder mehr ist, sind Isomere möglich, die sich durch die Position und Konformation der Doppelbindung unterscheiden. ⓘ
Alkene sind im Allgemeinen farblose, unpolare Verbindungen, die den Alkanen etwas ähneln, aber reaktionsfreudiger sind. Die ersten Vertreter der Reihe sind bei Raumtemperatur gasförmig oder flüssig. Das einfachste Alken, Ethen (C2H4) (oder "Ethen" in der IUPAC-Nomenklatur), ist die organische Verbindung, die in großem Umfang industriell hergestellt wird. ⓘ
Aromatische Verbindungen werden oft als zyklische Alkene bezeichnet, ihre Struktur und Eigenschaften sind jedoch so unterschiedlich, dass sie nicht als Alkene oder Olefine eingestuft werden. Kohlenwasserstoffe mit zwei sich überschneidenden Doppelbindungen (C=C=C) werden als Allene bezeichnet - die einfachste Verbindung dieser Art wird selbst als Alken bezeichnet -, während Kohlenwasserstoffe mit drei oder mehr sich überschneidenden Bindungen (C=C=C=C, C=C=C=C=C=C usw.) als Kumolene bezeichnet werden. Einige Autoren betrachten Allene und Cumolene nicht als "Alkene". ⓘ
| Alkene ⓘ |
| Allgemeine Strukturformel für Alkene mit der charakteristischen C=C-Doppelbindung zwischen zwei sp2-hybridisierten Kohlenstoffatomen (blau markiert). Dabei gilt: R1 bis R4 sind Wasserstoffatome oder Alkyl-Reste. In Dienen ist einer der Reste R1 bis R4 eine Alkenylgruppe. |
| Ethen – auch Ethylen genannt – ist das einfachste Alken. |
| Propen, oft Propylen genannt. |
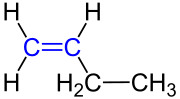
| 1-Buten oder But-1-en |
| Isobuten, korrekter IUPAC-Name: 2-Methylpropen. |
| cis-2-Buten oder (Z)-2-Buten |
| trans-2-Buten oder (E)-2-Buten |
Die Alkene bilden eine homologe Reihe mit der allgemeinen Summenformel CnH2n beginnend mit dem Ethen. Der veraltete Name Olefine ergibt sich aus dem alten Namen Olefin von Ethen, da es mit Halogenen ölige, wasserunlösliche Flüssigkeiten bildet, die aus Halogenalkanen bestehen. Es gibt auch cyclische Alkene, die Cycloalkene, deren wichtigster Vertreter das Cyclohexen ist. ⓘ
Strukturelle Isomerie
Alkene mit vier oder mehr Kohlenstoffatomen können verschiedene Strukturisomere bilden. Die meisten Alkene sind auch Isomere von Cycloalkanen. Es folgen azyklische Alken-Strukturisomere mit nur einer Doppelbindung:
- C2H4: nur Ethylen
- C3H6: nur Propylen
- C4H8: 3 Isomere: 1-Buten, 2-Buten und Isobutylen
- C5H10: 5 Isomere: 1-Penten, 2-Penten, 2-Methyl-1-Buten, 3-Methyl-1-Buten, 2-Methyl-2-Buten
- C6H12: 13 Isomere:
1-Hexen, cis-2-Hexen, trans-2-Hexen, cis-3-Hexen, trans-3-Hexen, 2-Methyl-1-Penten, 3-Methyl-1-Penten, 4-Methyl-1-Penten, 2-Methyl-2-Penten, 3-Methyl-2-Penten, 4-Methyl-2-Penten, 2 3-Dimethyl-1-Buten, 2 3-Dimethyl-2-Buten
- C7H14: 27 Isomere (berechnet)
- C12H24: 2.281 Isomere (berechnet)
- C31H62: 193.706.542.776 Isomere (berechnet) ⓘ
Viele dieser Moleküle weisen eine cis-trans-Isomerie auf. Insbesondere in den größeren Molekülen (ab C5) können auch chirale Kohlenstoffatome vorhanden sein. Die Zahl der potenziellen Isomere nimmt mit zusätzlichen Kohlenstoffatomen rasch zu. ⓘ
Die Alkene sind von Ethen (C2H4) bis Buten (C4H8) gasförmig und damit leichtflüchtig. Von Penten mit 5 bis zu Pentadecen mit 15 Kohlenstoff-Atomen sind die Alkene flüssig. Alkene mit mehr als 15 Kohlenstoffatomen sind fest (jeweils unter Normbedingungen). In Wasser sind Alkene schwer löslich, sie verbrennen mit rußender Flamme. Die Alkene sind reaktionsfreudig. Die schwache Doppelbindung bietet einen Angriffspunkt für Reagenzien, genauer ist es die π-Bindung, welche elektrophil angegriffen wird. Alkene reagieren mit Halogenen zu Dihalogenalkanen. Dies geschieht durch eine elektrophile Addition. ⓘ
Hier die wichtigsten Alkene von Ethen (C2H4) bis Decen (C10H20) mit Namen und Summenformeln:
- Ethen: C2H4
- Propen: C3H6
- Buten: C4H8
- Penten: C5H10
- Hexen: C6H12
- Hepten: C7H14
- Octen: C8H16
- Nonen: C9H18
- Decen: C10H20 ⓘ
Von Buten und den höheren Alkenen gibt es jeweils mehrere Strukturisomere. Die allgemeine Summenformel der unsubstituierten Alkene lautet: CnH2n. ⓘ
Struktur und Bindung
Bindung

Eine Kohlenstoff-Kohlenstoff-Doppelbindung besteht aus einer Sigma-Bindung und einer pi-Bindung. Diese Doppelbindung ist stärker als eine kovalente Einfachbindung (611 kJ/mol für C=C gegenüber 347 kJ/mol für C-C), aber nicht doppelt so stark. Doppelbindungen sind kürzer als Einfachbindungen mit einer durchschnittlichen Bindungslänge von 1,33 Å (133 pm) gegenüber 1,53 Å für eine typische C-C-Einfachbindung. ⓘ
Jedes Kohlenstoffatom der Doppelbindung nutzt seine drei sp2-Hybridorbitale, um Sigma-Bindungen zu drei Atomen (dem anderen Kohlenstoffatom und zwei Wasserstoffatomen) zu bilden. Die unhybridisierten 2p-Atomorbitale, die senkrecht zu der Ebene liegen, die durch die Achsen der drei sp²-Hybridorbitale gebildet wird, verbinden sich zu einer pi-Bindung. Diese Bindung liegt außerhalb der C-C-Hauptachse, wobei sich die Hälfte der Bindung auf einer Seite des Moleküls und die andere Hälfte auf der anderen Seite befindet. Mit einer Stärke von 65 kcal/mol ist die pi-Bindung deutlich schwächer als die sigma-Bindung. ⓘ
Eine Drehung um die Kohlenstoff-Kohlenstoff-Doppelbindung ist nur eingeschränkt möglich, da es energetisch aufwändig ist, die Ausrichtung der p-Orbitale an den beiden Kohlenstoffatomen zu durchbrechen. Folglich wandeln sich cis- oder trans-Isomere so langsam um, dass sie bei Umgebungsbedingungen ohne Isomerisierung gehandhabt werden können. Komplexere Alkene können mit der E-Z-Schreibweise für Moleküle mit drei oder vier verschiedenen Substituenten (Seitengruppen) benannt werden. Bei den Isomeren des Butens beispielsweise befinden sich die beiden Methylgruppen des (Z)-But-2-ens (auch bekannt als cis-2-Buten) auf der gleichen Seite der Doppelbindung, und bei (E)-But-2-en (auch bekannt als trans-2-Buten) befinden sich die Methylgruppen auf entgegengesetzten Seiten. Diese beiden Isomere von Buten haben unterschiedliche Eigenschaften. ⓘ
Form
Wie vom VSEPR-Modell der Elektronenpaarabstoßung vorhergesagt, schließt die Molekülgeometrie von Alkenen Bindungswinkel um jedes Kohlenstoffatom in einer Doppelbindung von etwa 120° ein. Der Winkel kann aufgrund der sterischen Belastung durch nicht gebundene Wechselwirkungen zwischen funktionellen Gruppen, die an die Kohlenstoffatome der Doppelbindung gebunden sind, variieren. Beispielsweise beträgt der C-C-C-Bindungswinkel in Propylen 123,9°. ⓘ
Bei verbrückten Alkenen besagt die Bredt'sche Regel, dass eine Doppelbindung am Brückenkopf eines verbrückten Ringsystems nur dann auftreten kann, wenn die Ringe groß genug sind. Folgt man Fawcett und definiert S als die Gesamtzahl der Nicht-Brückenkopf-Atome in den Ringen, so erfordern bicyclische Systeme S ≥ 7 für Stabilität und tricyclische Systeme S ≥ 11. ⓘ
Physikalische Eigenschaften
Viele der physikalischen Eigenschaften von Alkenen und Alkanen sind ähnlich: Sie sind farblos, unpolar und brennbar. Der physikalische Zustand hängt von der Molekülmasse ab: Wie die entsprechenden gesättigten Kohlenwasserstoffe sind die einfachsten Alkene (Ethylen, Propylen und Buten) bei Raumtemperatur Gase. Lineare Alkene mit etwa fünf bis sechzehn Kohlenstoffatomen sind flüssig, und höhere Alkene sind wachsartige Feststoffe. Der Schmelzpunkt der Feststoffe steigt ebenfalls mit zunehmender Molekülmasse. ⓘ
Alkene haben im Allgemeinen einen stärkeren Geruch als ihre entsprechenden Alkane. Ethylen hat einen süßlichen und muffigen Geruch. Die Bindung von Kupferionen an das Olefin im Geruchsrezeptor MOR244-3 von Säugetieren ist für den Geruch von Alkenen (wie auch von Thiolen) verantwortlich. Insbesondere gestreckte Alkene wie Norbornen und trans-Cycloocten sind für ihren starken, unangenehmen Geruch bekannt, was mit den stärkeren π-Komplexen zusammenhängt, die sie mit Metallionen einschließlich Kupfer bilden. ⓘ
Reaktionen
Alkene sind relativ stabile Verbindungen, die jedoch reaktiver sind als Alkane. Bei den meisten Reaktionen von Alkenen handelt es sich um Additionen an diese pi-Bindung, wobei neue Einfachbindungen entstehen. Alkene dienen als Ausgangsstoff für die petrochemische Industrie, da sie an einer Vielzahl von Reaktionen teilnehmen können, insbesondere an der Polymerisation und Alkylierung. ⓘ
Mit Ausnahme von Ethylen haben Alkene zwei Reaktivitätsorte: die Kohlenstoff-Kohlenstoff-pi-Bindung und das Vorhandensein von allylischen CH-Zentren. Erstere dominiert, aber auch die allylischen Zentren sind wichtig. ⓘ
Additionsreaktionen
Alkene reagieren in zahlreichen Additionsreaktionen, die durch Öffnung der Doppelbindung ablaufen. Die meisten dieser Additionsreaktionen folgen dem Mechanismus der elektrophilen Addition. Beispiele sind Hydrohalogenierung, Halogenierung, Halohydrinbildung, Oxymercurierung, Hydroborierung, Dichlorkohlenstoffaddition, Simmons-Smith-Reaktion, katalytische Hydrierung, Epoxidierung, radikalische Polymerisation und Hydroxylierung.
Hydrierung und verwandte Hydroelementierungen
Die Hydrierung von Alkenen führt zu den entsprechenden Alkanen. Die Reaktion wird manchmal unter Druck und bei erhöhter Temperatur durchgeführt. Es werden fast immer metallische Katalysatoren benötigt. Gängige industrielle Katalysatoren basieren auf Platin, Nickel und Palladium. Eine großtechnische Anwendung ist die Herstellung von Margarine. ⓘ
Neben der Addition von H-H über die Doppelbindung können auch viele andere H-X hinzugefügt werden. Diese Verfahren sind oft von großer wirtschaftlicher Bedeutung. Ein Beispiel ist die Addition von H-SiR3, d. h. die Hydrosilylierung. Diese Reaktion wird zur Herstellung von Organosiliziumverbindungen verwendet. Eine andere Reaktion ist die Hydrocyanierung, die Addition von H-CN an die Doppelbindung. ⓘ
Beispiel:
Hydratisierung
Bei der Hydratation, der Addition von Wasser an die Doppelbindung von Alkenen, werden Alkohole gebildet. Die Reaktion wird durch Phosphorsäure oder Schwefelsäure katalysiert. Diese Reaktion wird in industriellem Maßstab zur Herstellung von synthetischem Ethanol durchgeführt. ⓘ
- CH2=CH2 + H2O → CH3-CH2OH ⓘ
Alkene können auch über die Oxymercurierungs-Demercurierungs-Reaktion, die Hydroborierungs-Oxidations-Reaktion oder durch Mukaiyama-Hydratisierung in Alkohole umgewandelt werden. ⓘ
Halogenierung
Zum unspezifischen Nachweis der Doppelbindung, besonders zur Unterscheidung von den Alkanen, wird ein Alken (z. B. Ethen) in braunes Bromwasser eingeleitet. Dabei kann die Reaktion auch ohne das Hinzufügen von Energie, wie z. B. Licht, ablaufen. Das Alken-Molekül addiert an jedem C-Atom der C=C-Doppelbindung nach dem Reaktionsmechanismus der elektrophilen Addition ein Brom-Atom; als Reaktionsprodukt bildet sich das entsprechende Halogenalkan. Zum Beispiel:
Das Bromwasser entfärbt sich aufgrund dieser Reaktion, ein eingeleitetes Alkan würde das braune Bromwasser nicht entfärben. Phenole und viele reduzierende Verbindungen entfärben jedoch ebenfalls eine Bromlösung. ⓘ
Die sogenannte Baeyer-Probe dient zum allgemeinen Nachweis von C=C-Doppelbindungen bzw. Alkenen. Das Alken wird in eine Kaliumpermanganat-Lösung im schwach alkalischen oder sauren Milieu eingeleitet, worauf sich die Lösung braun färbt bzw. farblos wird. Es entstehen ein Alkohol und Braunstein bzw. Mangan(II)-Ionen. ⓘ
Bei der elektrophilen Halogenierung führt die Addition von elementarem Brom oder Chlor an Alkene zur Bildung von vicinalen Dibrom- bzw. Dichloralkanen (1,2-Dihalogenide bzw. Ethylendihalogenide). Die Entfärbung einer Bromlösung in Wasser ist ein analytischer Test für das Vorhandensein von Alkenen:
- CH2=CH2 + Br2 → BrCH2-CH2Br ⓘ
Ähnliche Reaktionen werden auch als quantitatives Maß für die Ungesättigtheit verwendet, ausgedrückt als Bromzahl und Jodzahl einer Verbindung oder eines Gemisches. ⓘ
Hydrohalogenierung
Unter Hydrohalogenierung versteht man die Addition von Halogenwasserstoffen, wie HCl oder HI, an Alkene, um die entsprechenden Halogenalkane zu erhalten:
- CH3-CH=CH2 + HI → CH3-CHI-CH2-H ⓘ
Wenn die beiden Kohlenstoffatome an der Doppelbindung mit einer unterschiedlichen Anzahl von Wasserstoffatomen verbunden sind, befindet sich das Halogen bevorzugt an dem Kohlenstoff mit weniger Wasserstoffsubstituenten. Dieses Muster ist als Markovnikovsche Regel bekannt. Die Verwendung von Radikalinitiatoren oder anderen Verbindungen kann zum gegenteiligen Produktergebnis führen. Insbesondere Bromwasserstoffsäure neigt dazu, in Gegenwart verschiedener Verunreinigungen oder sogar von Luftsauerstoff Radikale zu bilden, was zu einer Umkehrung des Markovnikov-Ergebnisses führt:
- CH3-CH=CH2 + HBr → CH3-CHH-CH2-Br ⓘ
Bildung von Halohydrin
Alkene reagieren mit Wasser und Halogenen durch eine Additionsreaktion zu Halohydrinen. Es treten Markovnikov-Regiochemie und Anti-Stereochemie auf. ⓘ
- CH2=CH2 + X2 + H2O → XCH2-CH2OH + HX ⓘ
Oxidation
Alkene reagieren mit Percarbonsäuren und sogar Wasserstoffperoxid unter Bildung von Epoxiden:
- RCH=CH2 + RCO3H → RCHOCH2 + RCO2H ⓘ
Für Ethylen wird die Epoxidierung in großem Maßstab industriell mit Sauerstoff in Gegenwart von Katalysatoren durchgeführt:
- C2H4 + 1/2 O2 → C2H4O ⓘ
Alkene reagieren mit Ozon, was zur Spaltung der Doppelbindung führt. Dieser Vorgang wird als Ozonolyse bezeichnet. Häufig wird bei der Reaktion ein mildes Reduktionsmittel, wie z. B. Dimethylsulfid (SMe2), eingesetzt:
- RCH=CHR' + O3 + SMe2 → RCHO + R'CHO + O=SMe2
- R2C=CHR' + O3 → R2CHO + R'CHO + O=SMe2 ⓘ
Bei der Behandlung mit einer heißen konzentrierten, angesäuerten Lösung von KMnO4 werden Alkene zu Ketonen und/oder Carbonsäuren gespalten. Die Stöchiometrie der Reaktion ist von den Bedingungen abhängig. Diese Reaktion und die Ozonolyse können dazu verwendet werden, die Position einer Doppelbindung in einem unbekannten Alken zu bestimmen. ⓘ
Durch Verwendung von Osmiumtetroxid oder anderen Oxidationsmitteln kann die Oxidation am vicinalen Diol gestoppt werden, anstatt das Alken vollständig zu spalten:
- R'CH=CR2 + 1/2 O2 + H2O → R'CH(OH)-C(OH)R2
Diese Reaktion wird als Dihydroxylierung bezeichnet. ⓘ
In Gegenwart eines geeigneten Photosensibilisators, z. B. Methylenblau, und Licht können Alkene mit reaktiven Sauerstoffspezies reagieren, die durch den Photosensibilisator erzeugt werden, z. B. Hydroxylradikale, Singulett-Sauerstoff oder Superoxidionen. Die Reaktionen des angeregten Sensibilisators können einen Elektronen- oder Wasserstofftransfer beinhalten, in der Regel mit einem reduzierenden Substrat (Typ-I-Reaktion) oder eine Wechselwirkung mit Sauerstoff (Typ-II-Reaktion). Diese verschiedenen alternativen Prozesse und Reaktionen können durch die Wahl spezifischer Reaktionsbedingungen gesteuert werden und führen zu einer breiten Palette von Produkten. Ein gängiges Beispiel ist die [4+2]-Cycloaddition von Singulett-Sauerstoff mit einem Dien wie Cyclopentadien unter Bildung eines Endoperoxids:
Ein weiteres Beispiel ist die Schenck-en-Reaktion, bei der Singulett-Sauerstoff mit einer Allylstruktur reagiert und ein transponiertes Allylperoxid bildet:
Polymerisation
Endständige Alkene sind Vorstufen von Polymeren durch sogenannte Polymerisationen. Einige Polymerisationen sind von großer wirtschaftlicher Bedeutung, da sie zu den Kunststoffen Polyethylen und Polypropylen führen. Polymere aus Alkenen werden gewöhnlich als Polyolefine bezeichnet, obwohl sie keine Olefine enthalten. Die Polymerisation kann über verschiedene Mechanismen ablaufen. Auch aus konjugierten Dienen wie Buta-1,3-Dien und Isopren (2-Methylbuta-1,3-Dien) entstehen Polymere, ein Beispiel ist Naturkautschuk. ⓘ
Metallkomplexierung
Alkene sind Liganden in Übergangsmetall-Alken-Komplexen. Die beiden Kohlenstoffzentren sind über die C-C pi- und pi*-Orbitale an das Metall gebunden. Mono- und Diolefine werden häufig als Liganden in stabilen Komplexen verwendet. Cyclooctadien und Norbornadien sind beliebte Chelatbildner, und sogar Ethylen selbst wird manchmal als Ligand verwendet, z. B. in Zeise's Salz. Darüber hinaus sind Metall-Alken-Komplexe Zwischenprodukte in vielen metallkatalysierten Reaktionen wie Hydrierung, Hydroformylierung und Polymerisation. ⓘ
Überblick über die Reaktionen
| Name der Reaktion | Produkt | Bemerkung ⓘ |
|---|---|---|
| Hydrierung | Alkane | Addition von Wasserstoff |
| Hydroalkenylierung | Alkene | Hydrometallierung / Insertion / Beta-Eliminierung durch Metallkatalysator |
| Halogen-Additionsreaktion | 1,2-Dihalogenid | elektrophile Addition von Halogenen |
| Hydrohalogenierung (Markovnikov) | Halogenalkane | Addition von Halogenwasserstoffsäuren |
| Anti-Markovnikov-Hydrohalogenierung | Halogenalkane | durch freie Radikale vermittelte Addition von Halogenwasserstoffsäuren |
| Hydroaminierung | Amine | Addition einer N-H-Bindung an eine C-C-Doppelbindung |
| Hydroformylierung | Aldehyde | industrieller Prozess, Addition von CO und H2 |
| Hydrocarboxylierung und Koch-Reaktion | Carbonsäure | industrielles Verfahren, Zugabe von CO und H2O. |
| Carboalkoxylierung | Ester | industrielles Verfahren, Zugabe von CO und Alkohol. |
| Alkylierung | Ester | industrielles Verfahren: Alkylierung von Alken mit Carbonsäure und Siliciumwolframsäure als Katalysator. |
| Scharflose Bishydroxylierung | Diole | Oxidation, Reagenz: Osmiumtetroxid, chiraler Ligand |
| Woodward cis-Hydroxylierung | Diole | Oxidation, Reagenzien: Iod, Silberacetat |
| Ozonolyse | Aldehyde oder Ketone | Reagenz: Ozon |
| Olefin-Metathese | Alkene | Umlagerung von zwei Alkenen zu zwei neuen Alkenen |
| Diels-Alder-Reaktion | Cyclohexene | Cycloaddition mit einem Dien |
| Pauson-Khand-Reaktion | Cyclopentenone | Cycloaddition mit einem Alkin und CO |
| Hydroborierung-Oxidation | Alkohole | Reagenzien: Boran, dann ein Peroxid |
| Oxymercuration-Reduktion | Alkohole | elektrophile Addition von Quecksilberacetat, dann Reduktion |
| Prins-Reaktion | 1,3-Diole | elektrophile Addition mit Aldehyd oder Keton |
| Paterno-Büchi-Reaktion | Oxetane | photochemische Reaktion mit Aldehyd oder Keton |
| Epoxidierung | Epoxid | elektrophile Addition eines Peroxids |
| Cyclopropanierung | Cyclopropane | Addition von Carbenen oder Carbenoiden |
| Hydroacylierung | Ketone | oxidative Addition / reduktive Eliminierung durch Metallkatalysator |
| Hydrophosphinierung | Phosphine |
Die Oxidation erfolgt entweder mit Osmiumtetroxid oder mit alkalischer Kaliumpermanganatlösung. Zuerst entsteht unter einer cis-Addition ein cyclischer Ester, die Hydrolyse führt zu einem cis-1,2-Diol. ⓘ
Synthese
Industrielle Methoden
Alkene werden durch Kracken von Kohlenwasserstoffen hergestellt. Rohstoffe sind in den USA und im Nahen Osten meist Erdgaskondensate (hauptsächlich Ethan und Propan) und in Europa und Asien Naphtha. Die Alkane werden bei hohen Temperaturen gespalten, häufig in Gegenwart eines Zeolith-Katalysators, um ein Gemisch aus hauptsächlich aliphatischen Alkenen und Alkanen mit geringerem Molekulargewicht zu erzeugen. Das Gemisch ist rohstoff- und temperaturabhängig und wird durch fraktionierte Destillation getrennt. Dieses Verfahren wird hauptsächlich für die Herstellung kleiner Alkene (bis zu sechs Kohlenstoffe) verwendet. ⓘ
Damit verbunden ist die katalytische Dehydrierung, bei der ein Alkan bei hohen Temperaturen Wasserstoff verliert, um ein entsprechendes Alken zu erzeugen. Dies ist die Umkehrung der katalytischen Hydrierung von Alkenen. ⓘ
Dieser Prozess wird auch als Reforming bezeichnet. Beide Prozesse sind endotherm und werden bei hohen Temperaturen durch die Entropie in Richtung des Alkens getrieben. ⓘ
Die katalytische Synthese höherer α-Alkene (vom Typ RCH=CH2) kann auch durch eine Reaktion von Ethylen mit der metallorganischen Verbindung Triethylaluminium in Gegenwart von Nickel, Kobalt oder Platin erfolgen. ⓘ
Eliminierungsreaktionen
Eine der wichtigsten Methoden zur Alkensynthese im Labor ist die Raumeliminierung von Alkylhalogeniden, Alkoholen und ähnlichen Verbindungen. Am häufigsten ist die β-Eliminierung über den E2- oder E1-Mechanismus, aber auch α-Eliminierungen sind bekannt. ⓘ
Der E2-Mechanismus bietet für die meisten Alkensynthesen eine zuverlässigere β-Eliminierungsmethode als E1. Die meisten E2-Eliminierungen beginnen mit einem Alkylhalogenid oder einem Alkylsulfonatester (wie z. B. einem Tosylat oder Triflat). Wenn ein Alkylhalogenid verwendet wird, nennt man die Reaktion eine Dehydrohalogenierung. Bei unsymmetrischen Produkten überwiegen in der Regel die stärker substituierten Alkene (mit weniger Wasserstoff am C=C) (siehe Zaitsevsche Regel). Zwei gängige Methoden für Eliminierungsreaktionen sind die Dehydrohalogenierung von Alkylhalogeniden und die Dehydratisierung von Alkoholen. Ein typisches Beispiel ist unten dargestellt; beachten Sie, dass das H nach Möglichkeit gegen die abspaltende Gruppe gerichtet ist, auch wenn dies zu dem weniger stabilen Z-Isomer führt. ⓘ
Alkene können aus Alkoholen durch Dehydratisierung synthetisiert werden. In diesem Fall geht Wasser über den E1-Mechanismus verloren. Bei der Dehydratisierung von Ethanol beispielsweise entsteht Ethylen:
- CH3CH2OH → H2C=CH2 + H2O ⓘ
Ein Alkohol kann auch in eine bessere Abgangsgruppe (z. B. Xanthat) umgewandelt werden, so dass eine mildere Syn-Eliminierung wie die Tschaugaev-Eliminierung und die Grieco-Eliminierung möglich ist. Verwandte Reaktionen sind die Eliminierung durch β-Halogenether (Boord-Olefinsynthese) und Ester (Esterpyrolyse). ⓘ
Alkene können indirekt aus Alkylaminen hergestellt werden. Das Amin oder Ammoniak ist keine geeignete Abgangsgruppe, so dass das Amin zunächst entweder alkyliert (wie bei der Hofmann-Eliminierung) oder zu einem Aminoxid oxidiert wird (Cope-Reaktion), um eine reibungslose Eliminierung zu ermöglichen. Die Cope-Reaktion ist eine Syn-Eliminierung, die z. B. bei 150 °C oder darunter stattfindet:
Die Hofmann-Eliminierung ist insofern ungewöhnlich, als das weniger substituierte (nicht-Zaitsev) Alken in der Regel das Hauptprodukt ist. ⓘ
Alkene werden aus α-Halogensulfonen in der Ramberg-Bäcklund-Reaktion über ein dreigliedriges Ringsulfon-Zwischenprodukt erzeugt. ⓘ
Synthese aus Carbonylverbindungen
Eine weitere wichtige Methode für die Alkensynthese ist der Aufbau einer neuen Kohlenstoff-Kohlenstoff-Doppelbindung durch Kopplung einer Carbonylverbindung (z. B. eines Aldehyds oder Ketons) an ein Carbanionäquivalent. Solche Reaktionen werden manchmal als Olefinierungen bezeichnet. Die bekannteste dieser Methoden ist die Wittig-Reaktion, aber es sind auch andere verwandte Methoden bekannt, darunter die Horner-Wadsworth-Emmons-Reaktion. ⓘ
Bei der Wittig-Reaktion wird ein Aldehyd oder Keton mit einem Wittig-Reagenz (oder Phosphoran) des Typs Ph3P=CHR umgesetzt, wobei ein Alken und Ph3P=O entstehen. Das Wittig-Reagenz selbst lässt sich leicht aus Triphenylphosphin und einem Alkylhalogenid herstellen. Die Reaktion ist recht allgemein, und viele funktionelle Gruppen werden toleriert, sogar Ester, wie in diesem Beispiel:
Mit der Wittig-Reaktion verwandt ist die Peterson-Olefinierung, bei der Reagenzien auf Siliziumbasis anstelle von Phosphoran verwendet werden. Bei dieser Reaktion kann man zwischen E- und Z-Produkten wählen. Wenn ein E-Produkt gewünscht wird, ist eine weitere Alternative die Julia-Olefinierung, bei der das aus einem Phenylsulfon erzeugte Carbanion verwendet wird. Die Takai-Olefinierung, die auf einem Organochrom-Zwischenprodukt basiert, liefert ebenfalls E-Produkte. Eine Titanverbindung, das Tebbe-Reagenz, eignet sich für die Synthese von Methylenverbindungen; in diesem Fall reagieren sogar Ester und Amide. ⓘ
Ein Paar von Ketonen oder Aldehyden kann deoxygeniert werden, um ein Alken zu erzeugen. Symmetrische Alkene können aus einem einzigen Aldehyd oder Keton hergestellt werden, das mit sich selbst gekoppelt ist, und zwar durch Reduktion mit einem Titanmetall (McMurry-Reaktion). Sollen verschiedene Ketone gekoppelt werden, ist eine kompliziertere Methode erforderlich, wie die Barton-Kellogg-Reaktion. ⓘ
Ein einzelnes Keton kann auch über sein Tosylhydrazon mit Natriummethoxid (Bamford-Stevens-Reaktion) oder einem Alkyllithium (Shapiro-Reaktion) in das entsprechende Alken überführt werden. ⓘ
Synthese aus Alkenen
Die Bildung längerer Alkene durch schrittweise Polymerisation kleinerer Alkene ist attraktiv, da Ethylen (das kleinste Alken) sowohl preiswert als auch leicht verfügbar ist und jährlich Hunderte von Millionen Tonnen produziert werden. Das Ziegler-Natta-Verfahren ermöglicht die Bildung sehr langer Ketten, wie sie beispielsweise für Polyethylen verwendet werden. Sind kürzere Ketten erwünscht, wie z. B. bei der Herstellung von Tensiden, dann sind Verfahren mit einer Olefinmetathese wie das Shell-Verfahren für höhere Olefine wichtig. ⓘ
Die Olefinmetathese wird auch kommerziell für die Umwandlung von Ethylen und 2-Buten in Propylen eingesetzt. Bei diesem Verfahren werden Rhenium- und Molybdän-haltige heterogene Katalysatoren eingesetzt:
- CH2=CH2 + CH3CH=CHCH3 → 2 CH2=CHCH3 ⓘ
Die durch Übergangsmetalle katalysierte Hydrovinylierung ist ein weiteres wichtiges Verfahren zur Synthese von Alken, das vom Alken selbst ausgeht. Dabei werden ein Wasserstoff und eine Vinylgruppe (oder eine Alkenylgruppe) über eine Doppelbindung addiert. ⓘ
Aus Alkenen
Die Reduktion von Alkenen ist eine nützliche Methode für die stereoselektive Synthese von disubstituierten Alkenen. Ist das cis-Alken erwünscht, wird üblicherweise die Hydrierung in Gegenwart des Lindlar-Katalysators (ein heterogener Katalysator, der aus Palladium besteht, das auf Kalziumkarbonat abgeschieden und mit verschiedenen Formen von Blei behandelt wird) verwendet, obwohl die Hydroborierung mit anschließender Hydrolyse einen alternativen Ansatz darstellt. Die Reduktion des Alkins durch Natriummetall in flüssigem Ammoniak ergibt das trans-Alken. ⓘ
Zur Herstellung von mehrfach substituierten Alkenen kann die Carbometallierung von Alkinen zu einer großen Vielfalt von Alkenderivaten führen. ⓘ
Umlagerungen und verwandte Reaktionen
Alkene können aus anderen Alkenen über Umlagerungsreaktionen synthetisiert werden. Neben der Olefinmetathese (siehe oben) können viele pericyclische Reaktionen wie die Ene-Reaktion und die Cope-Umlagerung eingesetzt werden. ⓘ
Bei der Diels-Alder-Reaktion wird ein Cyclohexen-Derivat aus einem Dien und einem reaktiven oder elektronenarmen Alken hergestellt. ⓘ
IUPAC-Nomenklatur
Obwohl die Nomenklatur nicht weithin befolgt wird, ist ein Alken nach der IUPAC ein azyklischer Kohlenwasserstoff mit nur einer Doppelbindung zwischen den Kohlenstoffatomen. Olefine umfassen eine größere Gruppe von zyklischen und azyklischen Alkenen sowie von Dienen und Polyenen. ⓘ
Um den Wortstamm der IUPAC-Namen für geradkettige Alkene zu bilden, ändert man den Infix -an- des Elternteils in -en-. Zum Beispiel ist CH3-CH3 das Alkan EthANe. Der Name von CH2=CH2 ist daher ethENe. ⓘ
Bei geradkettigen Alkenen mit 4 oder mehr Kohlenstoffatomen ist die Verbindung mit diesem Namen nicht vollständig identifiziert. Für diese Fälle und für verzweigte azyklische Alkene gelten die folgenden Regeln:
- Suchen Sie die längste Kohlenstoffkette des Moleküls. Wenn diese Kette keine Doppelbindung enthält, benennen Sie die Verbindung nach den Regeln für die Benennung von Alkanen. Andernfalls:
- Nummeriere die Kohlenstoffe in dieser Kette, beginnend mit dem Ende, das der Doppelbindung am nächsten liegt.
- Definieren Sie die Position k der Doppelbindung als die Nummer des ersten Kohlenstoffs.
- Benennen Sie die Seitengruppen (mit Ausnahme von Wasserstoff) nach den entsprechenden Regeln.
- Definieren Sie die Position jeder Seitengruppe als die Nummer des Kohlenstoffs der Kette, an den sie gebunden ist.
- Schreiben Sie die Position und den Namen jeder Seitengruppe.
- Schreiben Sie die Namen der Alkane mit der gleichen Kette, indem Sie das Suffix "-an" durch "k-en" ersetzen. ⓘ
Die Position der Doppelbindung wird oft vor dem Namen der Kette (z. B. "2-Penten") und nicht vor dem Suffix ("Pent-2-en") eingefügt. ⓘ
Die Positionen müssen nicht angegeben werden, wenn sie eindeutig sind. Beachten Sie, dass die Doppelbindung eine andere Kettennummerierung implizieren kann als die für das entsprechende Alkan verwendete: (H
3C)
3C-CH
2-CH
3 ist "2,2-Dimethylpentan", während (H
3C)
3C-CH=CH
2 "3,3-Dimethyl-1-penten" ist. ⓘ
Für Polyene und Cycloalkene gelten komplexere Regeln. ⓘ

Cis-trans-Isomerie
Wenn die Doppelbindung eines azyklischen Mono-ens nicht die erste Bindung der Kette ist, ist der Name, wie er oben konstruiert wurde, wegen der Cis-trans-Isomerie immer noch nicht vollständig. Dann muss man angeben, ob die beiden an die Doppelbindung angrenzenden C-C-Einfachbindungen auf derselben Seite ihrer Ebene liegen oder auf gegenüberliegenden Seiten. Bei Monoalkenen wird die Konfiguration oft durch die Vorsilben cis- (von lateinisch "diesseits") oder trans- ("jenseits", "auf der anderen Seite") vor dem Namen angegeben, wie z. B. bei cis-2-Penten oder trans-2-Buten. ⓘ

Im Allgemeinen liegt eine cis-trans-Isomerie vor, wenn an jedes der beiden Kohlenstoffatome in der Doppelbindung zwei verschiedene Atome oder Gruppen gebunden sind. Um diese Fälle zu berücksichtigen, empfiehlt die IUPAC die allgemeinere E-Z-Notation anstelle der Präfixe cis und trans. Diese Notation berücksichtigt die Gruppe mit der höchsten CIP-Priorität in jedem der beiden Kohlenstoffe. Befinden sich diese beiden Gruppen auf gegenüberliegenden Seiten der Ebene der Doppelbindung, so wird die Konfiguration mit E (aus dem Deutschen gegen") bezeichnet; befinden sie sich auf derselben Seite, so wird sie mit Z (aus dem Deutschen zusammen") bezeichnet. Diese Bezeichnung kann mit der Eselsbrücke "Z bedeutet 'on ze zame zide'" gelernt werden. ⓘ

Gruppen, die C=C-Doppelbindungen enthalten
Die IUPAC kennt zwei Namen für Kohlenwasserstoffgruppen, die Kohlenstoff-Kohlenstoff-Doppelbindungen enthalten: die Vinylgruppe und die Allylgruppe. ⓘ
Siehe auch
- Alpha-Olefin
- Annulene
- Aromatischer Kohlenwasserstoff ("Aren")
- Dendralene
- Nitroalken
- Radialene ⓘ
Links zur Nomenklatur
- Regel A-3. Ungesättigte Verbindungen und einwertige Radikale [1] IUPAC Blaubuch.
- Regel A-4. Zweiwertige und mehrwertige Radikale [2] IUPAC Blaubuch.
- Regeln A-11.3, A-11.4, A-11.5 Ungesättigte monocyclische Kohlenwasserstoffe und Substituenten [3] IUPAC Blaubuch.
- Regel A-23. Hydrierte Verbindungen von kondensierten polyzyklischen Kohlenwasserstoffen [4] IUPAC Blaubuch. ⓘ
Verwendung
Aufgrund der recht reaktiven Doppelbindung sind Alkene wichtige Ausgangsstoffe für viele andere Grundstoffe der chemischen Industrie. ⓘ
Alkene werden als Treibstoffe und zur Herstellung von Halogenkohlenwasserstoffen, Alkoholen, Ketonen, Glycolen, Olefinoxiden, Kunststoffen und Waschmittelkomponenten gebraucht. Propen wird für die Synthese von z. B. Glycerin, Phenol, Isopropylalkohol, Epoxidharzen verwendet und für die Polymerisation von Polypropylen benötigt. ⓘ
Herstellungsverfahren
β-Eliminierungen
Allgemein können Verbindungen mit dem Strukturfragment CH–CX durch Abspaltung von HX zu einem Alken mit dem Strukturfragment C=C umgesetzt werden. Im Edukt mit dem Strukturfragment CH-CX sind dabei das H und die Gruppe X an direkt benachbarte C-Atome gebunden. ⓘ
Dehydratisierung
Die Dehydratisierung von Alkoholen findet in saurem Milieu statt. Aus tertiären Alkoholen lässt sich wesentlich leichter Wasser eliminieren als aus sekundären oder gar primären Alkoholen. ⓘ
Alkohole lassen sich auch bei erhöhten Temperaturen (z. B. ca. 200…250 °C) über porösen Katalysatoren mit hoher innerer Oberfläche (wie z. B. Aluminiumoxid Al2O3) zu Alkenen dehydratisieren. Sekundäre Alkohole vom Typ CH3–CHOH–CH2–R (R = Alkylrest) ergeben dabei ein Gemisch aus 1-Olefinen, cis-2- und trans-2-Olefinen:
Dehydrohalogenierung
Analog dazu lassen sich Halogenalkane zu Alkenen verwandeln. Diese als Dehydrohalogenierung bekannte Reaktion erfolgt, im Gegensatz zur Dehydratisierung von Alkoholen, unter basischen Bedingungen. Auch hier lassen sich tertiäre Halogenwasserstoffe leichter dehydrohalogenieren als sekundäre, und diese wiederum leichter als primäre Halogenwasserstoffe. ⓘ
Dehalogenierung
Als dritte mögliche β-Eliminierung gibt es die Dehalogenierung von 1,2-Dihalogenalkanen. Dabei wird in Alkoholen während der Anwesenheit von Zink zwei gleichartige Halogenatome von benachbarten Kohlenstoffatomen eliminiert. Dabei entsteht das Alken und das Halogen in molekularer Form:
Pyrolyse von quartären Ammoniumhydroxiden
Alkene entstehen bei der Pyrolyse von quartären Ammoniumhydroxiden, wenn mindestens eine Alkangruppe am Stickstoff 2 oder mehr C-Atome besitzt. Die Umsetzung ist wie folgt:
Typische Reaktionen
Addition von Halogenwasserstoffen
Die Addition von Halogenwasserstoffen verläuft ähnlich wie die Addition von Halogenen wie Brom. Obwohl bei der Addition an unsymmetrische Alkene theoretisch verschiedene Reaktionsprodukte denkbar sind, je nach dem, an welches an der Doppelbindung beteiligte C-Atom das Halogenatom angelagert wird, läuft die Additionsreaktion bevorzugt regioselektiv entsprechend der Markownikow-Regel ab. ⓘ
Mit einer regioselektiven Reaktion bezeichnet man eine chemische Veränderung, die vorzugsweise an einer von mehreren möglichen Stellen eintritt. Es bildet sich durch Reaktion mit dem Proton H+ der Halogenwasserstoffsäure als Zwischenprodukt stets das stabilste Carbeniumion. Mesomerieeffekte sind für diese Betrachtung stets wichtiger als induktive Effekte. Das Halogenid addiert sich dann an das C+ des Carbeniumions. Wenn keine Mesomeriestabilisierung des Carbeniumions möglich ist, kann die Markownikow-Regel angewandt werden: Bei unsymmetrischen Alkenen erfolgt die elektrophile Addition von Halogenwasserstoffen so, dass das Halogen bevorzugt an das Kohlenstoffatom bindet, das die wenigsten Wasserstoffatome besitzt; das Wasserstoff-Atom dagegen an das wasserstoffreichste Kohlenstoff-Atom. Grund dafür ist, dass Alkylgruppen als Elektronendonatoren wirken (+I-Effekt und Hyperkonjugation) und dadurch die Verteilung (Delokalisation) der positiven Ladung begünstigen. Die Stabilität der positiven Carbeniumionen ist umso größer, je mehr Alkylgruppen an dem geladenen Kohlenstoffatom gebunden sind. Deshalb ist ein tertiäres Carbeniumion stabiler als ein Sekundäres und Primäres. Dasselbe gilt ebenfalls für Radikale (siehe Abweichung #2), da diese auch unter Elektronenmangel leiden. ⓘ
Abweichungen von der Markownikow-Regel treten unter anderem bei radikalischen Addition und der Hydroborierung auf. Bei diesen Reaktionen entsteht das Anti-Markownikow-Produkt:
- Bei der Hydroborierung wird das Boratom (Elektrophil) an das negativer teilgeladene Kohlenstoffatom (niedriger substituiert) der Doppelbindung addiert, wohingegen das Wasserstoffatom (Nucleophil) an dem positiv teilgeladenen Kohlenstoffatom (höher substituiert) addiert wird. Da das Wasserstoffatom meistens das Elektrophil ist, bewirkt dieser Rollentausch einen Bruch der Regel.
- Bei der radikalischen Addition von z. B. Bromwasserstoff greift nicht die Doppelbindung das Elektrophil (Wasserstoff) an, sondern ein Bromradikal die Doppelbindung. Dabei bindet das Bromatom an dem niedriger substituierten Kohlenstoffatom, damit das Radikal am höhersubstituierten entsteht. Durch Hyperkonjugation mit den Substituenten und durch +I-Effekt kann so der Elektronenmangel am Radikal stabilisiert werden. Erst danach greift dieses Radikal ein weiteres H-Br Molekül an und erlangt so sein Wasserstoffatom, das sich dann am höhersubstituierten Kohlenstoffatom befindet und somit gegen die Regel verstößt. ⓘ
Reaktion mit konzentrierter Schwefelsäure
Die Anlagerung erfolgt nach der Markownikow-Regel, es sei denn Mesomerieeffekte dominieren. Technisch dient dieses Verfahren zur Darstellung von Alkoholen aus Alkenen. Alkylschwefelsäure ist durch Hydrolyse leicht in Alkohole zu überführen. ⓘ
Reaktion mit Hypochloriger Säure
Diese Reaktion ist regioselektiv. Das Chloratom lagert sich an das C-Atom an, welches die meisten Wasserstoff-Atome trägt, wenn keine mesomeren Effekte auftreten. Ebenso läuft die Reaktion mit Nitrosylchlorid und Nitrosylbromid an Alkene unter Addition. ⓘ
Ozonierung von C=C-Doppelbindungen
Wenn Ozon in wasserfreie Alkene geleitet wird, bilden sich Ozonide, die im trockenen Zustand explosiv sind. Die Ozonolyse spaltet dabei die Doppelbindung komplett und ist somit für die Ermittlung des Aufbaus einer Kohlenstoffkette eine wichtige Reaktion, da die Spaltprodukte Aufschluss über die Lage der Doppelbindung geben. Das Ozon kann durch Entladung aus Luftsauerstoff in einem Ozonisator erzeugt werden. ⓘ
Umwandlung von cis- in trans-Alkene und umgekehrt
(E)-Alkene [Beispiel: (E)-Stilben, Schmelzpunkt 124 °C ] lassen sich photochemisch in (Z)-Alkene [Beispiel: (Z)-Stilben, Schmelzpunkt 1 °C ] umwandeln. Die Reaktion ist umkehrbar. – In seltenen Ausnahmefällen (Beispiel: Ranitidin) ist die Energiebarriere für die Umwandlung speziell substituierter Alkene bei Raumtemperatur so niedrig, dass sich die (E)-Form spontan in die (Z)-Form umwandelt und umgekehrt. Mit anderen Worten: (E)-Isomer und (Z)-Isomer können in seltenen Ausnahmefällen im Gleichgewicht miteinander stehen. ⓘ









![Generation of singlet oxygen and its [4+2]-cycloaddition with cyclopentadiene](https://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/langde-350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)













