Elektrolyseur
Die Polymerelektrolytmembran-Elektrolyse (PEM-Elektrolyse) ist die Elektrolyse von Wasser in einer Zelle, die mit einem festen Polymerelektrolyten (SPE) ausgestattet ist, der für die Leitung der Protonen, die Abtrennung der Produktgase und die elektrische Isolierung der Elektroden verantwortlich ist. Der PEM-Elektrolyseur wurde eingeführt, um die Probleme der Teillast, der geringen Stromdichte und des Niederdruckbetriebs zu überwinden, die derzeit den alkalischen Elektrolyseur plagen. Er arbeitet mit einer Protonenaustauschermembran. ⓘ
Die Elektrolyse von Wasser ist eine wichtige Technologie für die Herstellung von Wasserstoff als Energieträger. Mit schnellen dynamischen Reaktionszeiten, großen Betriebsbereichen und hohen Wirkungsgraden ist die Wasserelektrolyse eine vielversprechende Technologie für die Energiespeicherung in Verbindung mit erneuerbaren Energiequellen. In Bezug auf Nachhaltigkeit und Umweltauswirkungen gilt die PEM-Elektrolyse als vielversprechende Technik für die hochreine und effiziente Wasserstofferzeugung, da sie nur Sauerstoff als Nebenprodukt abgibt und keine Kohlenstoffemissionen verursacht. ⓘ
Als Elektrolyseur wird eine Vorrichtung bezeichnet, in der mit Hilfe elektrischen Stromes eine chemische Reaktion, also eine Stoffumwandlung, herbeigeführt wird: Es findet eine Elektrolyse statt. ⓘ
Im Zuge der Energiewende könnten Elektrolyseure zur Erzeugung von Wasserstoff in naher Zukunft eine bedeutende Rolle einnehmen. Entsprechend der Vielfalt an unterschiedlichen Elektrolysen gibt es auch eine Vielzahl von Elektrolyseuren: Bei der Chloralkali-Elektrolyse beispielsweise solche mit Membranen, Diaphragmen oder Quecksilberzellen. ⓘ
Geschichte
Die PEM-Elektrolyse wurde erstmals in den 1960er Jahren von General Electric eingeführt und entwickelt, um die Nachteile der alkalischen Elektrolysetechnik zu überwinden. Die anfänglichen Leistungen betrugen 1,0 A/cm2 bei 1,88 V, was im Vergleich zur damaligen alkalischen Elektrolysetechnologie sehr effizient war. In den späten 1970er Jahren wiesen die alkalischen Elektrolyseure Leistungen von etwa 0,215 A/cm2 bei 2,06 V auf, was in den späten 1970er und frühen 1980er Jahren zu einem plötzlichen Interesse an Polymerelektrolyten für die Wasserelektrolyse führte. Die PEM-Wasserelektrolysetechnik ähnelt der PEM-Brennstoffzellentechnik, bei der feste polysulfonierte Membranen wie Nafion oder Fumapem als Elektrolyt (Protonenleiter) verwendet wurden. ⓘ
Einen ausführlichen Überblick über die historischen Leistungen von der frühen Forschung bis zu den heutigen finden Sie in chronologischer Reihenfolge mit vielen der Betriebsbedingungen in dem 2013 erschienenen Bericht von Carmo et al. ⓘ
Vorteile der PEM-Elektrolyse
Einer der größten Vorteile der PEM-Elektrolyse ist ihre Fähigkeit, mit hohen Stromdichten zu arbeiten. Dies kann zu geringeren Betriebskosten führen, insbesondere bei Systemen, die mit sehr dynamischen Energiequellen wie Wind und Sonne gekoppelt sind, bei denen plötzliche Spitzen in der Energiezufuhr andernfalls zu nicht erfasster Energie führen würden. Der Polymerelektrolyt ermöglicht es dem PEM-Elektrolyseur, mit einer sehr dünnen Membran (~100-200 μm) zu arbeiten und dennoch hohe Drücke zuzulassen, was zu geringen ohmschen Verlusten führt, die in erster Linie durch die Leitung von Protonen durch die Membran (0,1 S/cm) und einen komprimierten Wasserstoffausstoß verursacht werden. ⓘ
Die Polymerelektrolytmembran weist aufgrund ihrer festen Struktur eine geringe Gasübergangsrate auf, was zu einer sehr hohen Produktgasreinheit führt. Die Aufrechterhaltung einer hohen Gasreinheit ist wichtig für die Speichersicherheit und für die direkte Nutzung in einer Brennstoffzelle. Die Sicherheitsgrenzen für H2 in O2 liegen bei Standardbedingungen bei 4 Mol-% H2 in O2. ⓘ
Wissenschaft
Ein Elektrolyseur ist ein elektrochemisches Gerät, das Strom und Wasser in Wasserstoff und Sauerstoff umwandelt. Diese Gase können dann als Energiespeicher für eine spätere Verwendung genutzt werden. Diese Nutzung kann von der Stabilisierung des Stromnetzes durch dynamische Stromquellen wie Windturbinen und Solarzellen bis hin zur lokalen Wasserstoffproduktion als Kraftstoff für Brennstoffzellenfahrzeuge reichen. Der PEM-Elektrolyseur verwendet einen festen Polymerelektrolyten (SPE), um Protonen von der Anode zur Kathode zu leiten und gleichzeitig die Elektroden elektrisch zu isolieren. Unter Standardbedingungen beträgt die für die Zersetzung von Wasser erforderliche Enthalpie 285,9 kJ/mol. Ein Teil der für eine anhaltende Elektrolysereaktion erforderlichen Energie wird durch thermische Energie bereitgestellt, der Rest durch elektrische Energie. ⓘ
Reaktionen
Der tatsächliche Wert der Leerlaufspannung eines in Betrieb befindlichen Elektrolyseurs liegt zwischen 1,23 V und 1,48 V, je nachdem, wie die Zelle/der Stack die zugeführte Wärmeenergie nutzt. Dies ist jedoch recht schwierig zu bestimmen oder zu messen, da ein in Betrieb befindlicher Elektrolyseur auch andere Spannungsverluste aufgrund interner elektrischer Widerstände, der Protonenleitfähigkeit, des Massentransports durch die Zelle und der Katalysatorausnutzung, um nur einige zu nennen, aufweist. ⓘ
Anodenreaktion
Die halbe Reaktion, die auf der Anodenseite eines PEM-Elektrolyseurs stattfindet, wird gemeinhin als Sauerstoffentwicklungsreaktion (OER) bezeichnet. Hier wird der flüssige Reaktant Wasser dem Katalysator zugeführt, wo das zugeführte Wasser zu Sauerstoff, Protonen und Elektronen oxidiert wird. ⓘ
Kathodische Reaktion
Die auf der Kathodenseite eines PEM-Elektrolyseurs stattfindende Halbreaktion wird gemeinhin als Wasserstoff-Evolutionsreaktion (HER) bezeichnet. Hier werden die zugeführten Elektronen und die Protonen, die durch die Membran geleitet wurden, kombiniert, um gasförmigen Wasserstoff zu erzeugen. ⓘ
Die nachstehende Abbildung zeigt eine Vereinfachung der Funktionsweise der PEM-Elektrolyse, wobei die einzelnen Halbreaktionen zusammen mit der vollständigen Reaktion eines PEM-Elektrolyseurs dargestellt sind. In diesem Fall ist der Elektrolyseur mit einem Solarmodul zur Erzeugung von Wasserstoff gekoppelt, das Solarmodul könnte jedoch durch eine beliebige Stromquelle ersetzt werden. ⓘ

Zweiter Hauptsatz der Thermodynamik
Gemäß dem zweiten Hauptsatz der Thermodynamik beträgt die Reaktionsenthalpie:
Wobei die freie Gibbs-Energie der Reaktion ist, die Temperatur der Reaktion ist und die Änderung der Entropie des Systems ist. ⓘ
Die Gesamtreaktion der Zelle mit den thermodynamischen Energieeinträgen ist dann wie folgt:
ⓘFehler beim Parsen (Syntaxfehler): {\displaystyle \ce{ H2O (l) ->[+\Überschrift{237.2 \ce{kJ / mol}}^{\ce{Elektrizität}}][+\Unterschrift{48.6 \ce{kJ / mol}}_{\ce{Wärme}}] {H2} + 1/2 O2 }}
Die oben dargestellten thermischen und elektrischen Inputs stellen die minimale Energiemenge dar, die durch Elektrizität zugeführt werden kann, um eine Elektrolysereaktion zu erhalten. Unter der Annahme, dass die maximale Menge an Wärmeenergie (48,6 kJ/mol) der Reaktion zugeführt wird, kann die reversible Zellspannung berechnet werden. ⓘ
Leerlaufspannung (OCV)
| ⓘ |
wobei die Anzahl der Elektronen ist und die Faradaysche Konstante ist. Die Berechnung der Zellspannung unter der Annahme, dass es keine Irreversibilitäten gibt und die gesamte Wärmeenergie durch die Reaktion genutzt wird, wird als unterer Heizwert (LHV) bezeichnet. Bei der alternativen Berechnung mit dem höheren Heizwert (HHV) wird davon ausgegangen, dass die gesamte Energie zum Antrieb der Elektrolysereaktion von der elektrischen Komponente der erforderlichen Energie geliefert wird, was zu einer höheren reversiblen Zellspannung führt. Bei Verwendung des HHV wird die Spannungsberechnung als thermoneutrale Spannung bezeichnet. ⓘ
| ⓘ |
Spannungsverluste
Die Leistung von Elektrolysezellen wird wie die von Brennstoffzellen in der Regel anhand von Polarisationskurven verglichen, die durch Auftragen von Zellspannungen gegen Stromdichten ermittelt werden. Die primären Quellen für eine erhöhte Spannung in einem PEM-Elektrolyseur (das Gleiche gilt auch für PEM-Brennstoffzellen) können in drei Hauptbereiche unterteilt werden: Ohmsche Verluste, Aktivierungsverluste und Massentransportverluste. Aufgrund der umgekehrten Funktionsweise zwischen einer PEM-Brennstoffzelle und einem PEM-Elektrolyseur ist der Grad der Auswirkung dieser verschiedenen Verluste bei den beiden Verfahren unterschiedlich. ⓘ
Die Leistung eines PEM-Elektrolysesystems kann durch Auftragen der Überspannung gegen die Stromdichte der Zelle verglichen werden. Daraus ergibt sich im Wesentlichen eine Kurve, die die Leistung pro Quadratzentimeter Zellfläche darstellt, die zur Erzeugung von Wasserstoff und Sauerstoff erforderlich ist. Im Gegensatz zur PEM-Brennstoffzelle gilt: Je besser der PEM-Elektrolyseur ist, desto niedriger ist die Zellspannung bei einer bestimmten Stromdichte. Die folgende Abbildung ist das Ergebnis einer Simulation des Forschungszentrums Jülich für einen 25 cm2 großen PEM-Elektrolyseur im thermoneutralen Betrieb und zeigt die wichtigsten Quellen für Spannungsverluste und ihre Beiträge für verschiedene Stromdichten. ⓘ
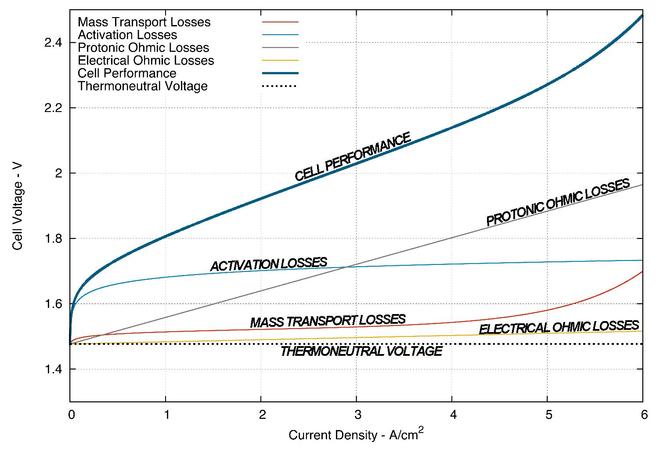
Ohmsche Verluste
Bei den ohmschen Verlusten handelt es sich um ein elektrisches Überpotenzial, das durch den Innenwiderstand der Zellkomponenten in den Elektrolyseprozess eingebracht wird. Dieser Verlust erfordert dann eine zusätzliche Spannung, um die Elektrolysereaktion aufrechtzuerhalten. Die Vorhersage dieses Verlustes folgt dem Ohmschen Gesetz und steht in einem linearen Verhältnis zur Stromdichte des betriebenen Elektrolyseurs. ⓘ
Der Energieverlust durch den elektrischen Widerstand geht nicht vollständig verloren. Der durch den Widerstand bedingte Spannungsabfall ist mit der Umwandlung der elektrischen Energie in Wärmeenergie durch einen als Joule-Erwärmung bekannten Prozess verbunden. Ein großer Teil dieser Wärmeenergie wird mit dem zugeführten Reaktionswasser abgeführt und geht an die Umwelt verloren, ein kleiner Teil dieser Energie wird jedoch als Wärmeenergie im Elektrolyseprozess wiedergewonnen. Die Menge an Wärmeenergie, die zurückgewonnen werden kann, hängt von vielen Aspekten des Systembetriebs und der Zellkonstruktion ab. ⓘ
Die ohmschen Verluste aufgrund der Protonenleitung tragen zum Verlust des Wirkungsgrads bei, der ebenfalls dem ohmschen Gesetz folgt, allerdings ohne den Jouleschen Wärmeeffekt. Die Protonenleitfähigkeit der PEM ist stark abhängig von der Hydratation, der Temperatur, der Wärmebehandlung und dem ionischen Zustand der Membran. ⓘ
Faradaische Verluste und Crossover
Faradaische Verluste beschreiben die Wirkungsgradverluste, die mit dem Strom korreliert sind, der zugeführt wird, ohne dass am kathodischen Gasausgang Wasserstoff entsteht. Der erzeugte Wasserstoff und Sauerstoff können durch die Membran dringen, was als Crossover bezeichnet wird. Es entstehen Gemische beider Gase an den Elektroden. An der Kathode kann Sauerstoff an der Platinoberfläche des kathodischen Katalysators katalytisch mit Wasserstoff umgesetzt werden. An der Anode reagieren Wasserstoff und Sauerstoff nicht an dem Iridiumoxid-Katalysator. Daher kann es zu Sicherheitsrisiken durch explosive anodische Gemische von Wasserstoff und Sauerstoff kommen. Die zugeführte Energie für die Wasserstofferzeugung geht verloren, wenn der Wasserstoff durch die Reaktion mit Sauerstoff an der Kathode verloren geht und die Permeation von der Kathode über die Membran zur Anode entspricht. Das Verhältnis der Menge an verlorenem und produziertem Wasserstoff bestimmt also die Faradayverluste. Beim Betrieb des Elektrolyseurs unter Druck nehmen die Crossover- und die damit verbundenen Faradaic-Effizienzverluste zu. ⓘ
Wasserstoffkompression bei der Wasserelektrolyse
Die Wasserstoffentwicklung bei der Druckelektrolyse ist vergleichbar mit einem isothermen Kompressionsprozess, der hinsichtlich des Wirkungsgrades einer mechanischen isotropen Kompression vorzuziehen ist. Allerdings steigt der Beitrag der oben erwähnten faradischen Verluste mit dem Betriebsdruck. Um komprimierten Wasserstoff zu erzeugen, muss daher die in-situ-Kompression während der Elektrolyse und die anschließende Verdichtung des Gases unter Effizienzgesichtspunkten betrachtet werden. ⓘ
Betrieb des PEM-Elektrolysesystems

Die Fähigkeit des PEM-Elektrolyseurs, nicht nur unter hochdynamischen Bedingungen, sondern auch im Teillast- und Überlastbereich zu arbeiten, ist einer der Gründe für das in letzter Zeit wieder erwachte Interesse an dieser Technologie. Der Bedarf eines Stromnetzes ist relativ stabil und vorhersehbar, doch bei der Kopplung mit Energiequellen wie Wind- und Solarenergie stimmt der Bedarf des Netzes nur selten mit der Erzeugung erneuerbarer Energie überein. Das bedeutet, dass die aus erneuerbaren Energiequellen wie Wind und Sonne erzeugte Energie von einem Puffer oder einer Möglichkeit zur Speicherung von Energie in Schwachlastzeiten profitiert. Ab 2021 ist der größte PEM-Elektrolyseur 20 MW groß. ⓘ
PEM-Wirkungsgrad
Zur Bestimmung des elektrischen Wirkungsgrads der PEM-Elektrolyse kann der HHV-Wert herangezogen werden. Der Grund dafür ist, dass die Katalysatorschicht mit Wasser in Form von Dampf interagiert. Da der Prozess bei PEM-Elektrolyseuren bei 80 °C abläuft, kann die Abwärme durch das System umgeleitet werden, um den Dampf zu erzeugen, was zu einem höheren elektrischen Gesamtwirkungsgrad führt. Bei alkalischen Elektrolyseuren muss der LHV verwendet werden, da für den Prozess in diesen Elektrolyseuren Wasser in flüssiger Form benötigt wird und die Alkalität das Aufbrechen der Bindung, die die Wasserstoff- und Sauerstoffatome zusammenhält, erleichtert. Der niedrigere Wärmewert muss auch für Brennstoffzellen verwendet werden, da der Wasserdampf der Ausgang und nicht der Eingang ist. ⓘ
Die PEM-Elektrolyse hat in der Praxis einen elektrischen Wirkungsgrad von etwa 80 %, d. h. es wird Wasserstoff pro Einheit des für die Reaktion verwendeten Stroms erzeugt. Es wird erwartet, dass der Wirkungsgrad der PEM-Elektrolyse bis zum Jahr 2030 82-86 % erreichen wird, wobei gleichzeitig die Langlebigkeit erhalten bleibt, da die Fortschritte in diesem Bereich weiterhin rasant sind. ⓘ
Hochtemperaturelektrolyseure arbeiten bei Arbeitstemperaturen von etwa 900 °C. Dabei wird ein Teil der notwendigen Reaktionsenthalpie als Wärme eingekoppelt. Dies führt dazu, dass der Strombedarf für die Elektrolyse sinkt und damit der Wirkungsgrad gegenüber der wässrigen, alkalischen Elektrolyse steigt. Mit Hochtemperatur-Elektrolyseuren können Wirkungsgrade bis ca. 90 % bezogen auf den Brennwert erreicht werden. ⓘ
Die Wasserelektrolyse, die Zerlegung von Wasser in Wasserstoff und Sauerstoff, geschieht nach folgender Reaktionsgleichung:
Der elektrische Energiebedarf zur Herstellung von 1 Kubikmeter Wasserstoff im Normzustand definiert den Wirkungsgrad eines Elektrolyseurs: In einem modernen Hochdruck-Elektrolyseur liegt dieser Energiebedarf unter einem Druck von 12 bar bei etwa 4,8 kWh pro m3 im Normzustand; damit liegt der Wirkungsgrad bei 62,5 % (bezogen auf den unteren Heizwert von Wasserstoff). ⓘ
Mehrere Anlagenhersteller (z. B. H-Tec, Electrolyser Corp., ABB (Unternehmensteil aus Brown Boveri), Air Liquide (Unternehmenssparte aus Lurgi), De Nora, Epoch Energy Technology Corp.) bieten große Elektrolysegeräte mit einem Wirkungsgrad von über 80 % an. ⓘ
Man unterscheidet folgende Arten von Elektrolyseuren für die Wasserelektrolyse: ⓘ
Alkalischer Elektrolyseur
Beim alkalischen Elektrolyseur wird bei einer Gleichspannung von mindestens 1,5 Volt an der Kathode Wasserstoff und an der Anode Sauerstoff gebildet. Die alkalische Reaktionsgleichung lautet:
Als Elektrolyt dient Kalilauge (Kaliumhydroxid-Lösung, KOH) mit einer Konzentration von 20–40 %. Eine gasdichte Membran, das sogenannte Diaphragma, lässt zwar den Transport von OH−-Ionen zu, verhindert aber gleichzeitig die Vermischung der entstehenden Produktgase. ⓘ
Als Elektroden werden sogenannte „DSA-Elektroden“ (Dimensionsstabile Anoden, meist Titanelektroden mit einer Rutheniumoxid-Beschichtung) eingesetzt. Dies sind Streckmetalle, die mit einem Edelmetall-Katalysatoroxid – z. B. Ruthenium- oder Iridiumoxid – beschichtet werden. Es gibt aber auch Systeme mit Raney-Nickel-Katalysatoren in einer Gasdiffusionselektrode. Alkalische Elektrolyseure sind in großem Maßstab weltweit im Einsatz. ⓘ
Hochtemperatur-Co-Elektrolyse
Bei der Hochtemperatur-Co-Elektrolyse werden Wasser und Kohlendioxid gemeinsam zu Synthesegas reduziert. Zum Verfahren erschienen ab 2010 vermehrt wissenschaftliche Publikationen und Studien. Die Solid Oxide Electrolyser Cell (SOEC) wurde 1980 zum Patent angemeldet, ab 2008 wurden diverse Patente zur Beschaffenheit vom Elektroden dafür eingereicht und später erteilt. ⓘ
Molybdänsulfid als Katalysator
Forscher der ETH Lausanne entdeckten 2011 durch Zufall bei einem Experiment, dass Molybdänsulfid als effizienter Katalysator anstelle von Platin eingesetzt werden kann. Molybdänsulfid ist wesentlich kostengünstiger als Platin, sodass sich die Investitionen für einen Elektrolyseur verringern. ⓘ
Nickel-Eisen-Elektrolyseur
2017 wurde ein Elektrolyseur auf Basis eines Nickel-Eisen-Akkumulators vorgestellt, der die Eigenschaften eines herkömmlichen Akkumulators und eines Elektrolyseurs verbindet. Die von den Forschern Battolyseur getaufte Anlage kann zunächst wie ein herkömmlicher Akkumulator geladen und entladen werden. Erreicht der Akkumulator seine Kapazitätsgrenze und wird weiter Strom zugeführt, wird stattdessen Wasserstoff produziert. Aufgrund seiner technischen Eigenschaften gilt diese Bauform als sehr gut geeignet für die Speicherung von Energie im Rahmen der Energiewende. ⓘ
Traditionelle Elektrolyseure
Der Hofmannsche Wasserzersetzungsapparat wurde im 19. Jahrhundert entwickelt. Neben der traditionellen Wasserelektrolyse haben sich weitere Verfahren wie die Schmelzflusselektrolyse entwickelt. ⓘ
Anwendungsgebiete
Elektrolyseure werden typischerweise bei fast allen Power-to-X-Technologien für die Erzeugung von Wasserstoff verwendet, idealerweise entsteht so rein grüner Wasserstoff. Daraus kann in weiteren möglichen Stufen, entweder mit Power-to-Gas oder Power-to-Liquid gasförmige oder flüssige Energieträger erzeugt werden. Diese Technologien sollen zukünftig als Ersatz für fossile Energieträger dienen. Damit könnte zumindest teilweise ein Ersatz von Erdöl und Kohle erreicht werden, um Treibhausgase zu vermeiden. Vorzugsweise kann das bei Vorhandensein von überschüssiger Energie, in Zeiten hoher Solarstrom- oder Windkrafterzeugung geschehen. So können Elektrolyseure als regelbare Last zur Netzstabilisierung eingesetzt werden. ⓘ



















