Nervenzelle
| Neuron ⓘ | |
|---|---|
 Anatomie eines multipolaren Neurons | |
| Anatomische Begriffe der Neuroanatomie (Bearbeiten auf Wikidata) |
Ein Neuron oder eine Nervenzelle ist eine elektrisch erregbare Zelle, die mit anderen Zellen über spezielle Verbindungen, die Synapsen, kommuniziert. Das Neuron ist der Hauptbestandteil des Nervengewebes in allen Tieren außer Schwämmen und Placozoa. Pflanzen und Pilze haben keine Nervenzellen. ⓘ
Neuronen werden in der Regel nach ihrer Funktion in drei Typen eingeteilt. Sensorische Neuronen reagieren auf Reize wie Berührungen, Geräusche oder Licht, die die Zellen der Sinnesorgane beeinflussen, und sie senden Signale an das Rückenmark oder das Gehirn. Motorische Neuronen empfangen Signale vom Gehirn und vom Rückenmark und steuern alles von Muskelkontraktionen bis zur Drüsenproduktion. Interneuronen verbinden Neuronen mit anderen Neuronen in derselben Region des Gehirns oder Rückenmarks. Wenn mehrere Neuronen miteinander verbunden sind, bilden sie einen so genannten neuronalen Schaltkreis. ⓘ
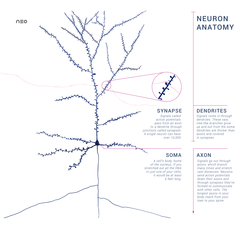
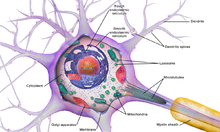
Ein typisches Neuron besteht aus einem Zellkörper (Soma), Dendriten und einem einzelnen Axon. Das Soma ist eine kompakte Struktur und das Axon und die Dendriten sind Fäden, die aus dem Soma herausragen. Die Dendriten verzweigen sich in der Regel stark und erstrecken sich einige hundert Mikrometer vom Soma entfernt. Das Axon verlässt das Soma an einer Schwellung, die als Axonhügel bezeichnet wird, und legt beim Menschen bis zu einem Meter zurück, bei anderen Arten sogar mehr. Es verzweigt sich, behält aber normalerweise einen konstanten Durchmesser bei. An der äußersten Spitze der Axonverzweigungen befinden sich Axonendigungen, an denen das Neuron ein Signal über die Synapse an eine andere Zelle weiterleiten kann. Neuronen können keine Dendriten oder kein Axon haben. Der Begriff Neurit wird verwendet, um entweder einen Dendriten oder ein Axon zu beschreiben, insbesondere wenn die Zelle undifferenziert ist. ⓘ
Die meisten Neuronen empfangen Signale über die Dendriten und das Soma und senden Signale über das Axon aus. Bei den meisten Synapsen kreuzen die Signale vom Axon eines Neurons zum Dendriten eines anderen. Synapsen können jedoch auch ein Axon mit einem anderen Axon oder einen Dendriten mit einem anderen Dendriten verbinden. ⓘ
Die Signalübertragung erfolgt zum Teil auf elektrischem und zum Teil auf chemischem Wege. Neuronen sind elektrisch erregbar, was auf die Aufrechterhaltung von Spannungsgradienten über ihre Membranen zurückzuführen ist. Ändert sich die Spannung in einem kurzen Intervall um einen ausreichend großen Betrag, erzeugt das Neuron einen elektrochemischen Alles-oder-Nichts-Impuls, der als Aktionspotenzial bezeichnet wird. Dieses Potenzial wandert schnell entlang des Axons und aktiviert die synaptischen Verbindungen, sobald es sie erreicht. Synaptische Signale können erregend oder hemmend sein und die Nettospannung, die das Soma erreicht, erhöhen oder verringern. ⓘ
In den meisten Fällen werden Neuronen während der Gehirnentwicklung und in der Kindheit von neuralen Stammzellen gebildet. Im Erwachsenenalter hört die Neurogenese in den meisten Bereichen des Gehirns weitgehend auf. ⓘ
Eine Nervenzelle, auch Neuron (von altgriechisch νεῦρον neũron, deutsch ‚Flechse‘, ‚Sehne‘; ‚Nerv‘) genannt, ist eine auf Erregungsleitung und Erregungsübertragung spezialisierte Zelle, die als Zelltyp in Gewebetieren und damit in nahezu allen vielzelligen Tieren vorkommt. Die Gesamtheit aller Nervenzellen eines Tieres bildet zusammen mit den Gliazellen das Nervensystem.

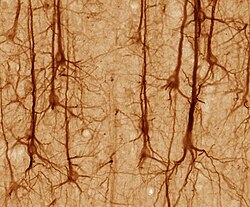
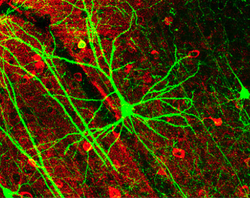
Die Pyramidenzelle mit großem Dendritenbaum in der Bildmitte exprimiert hier grün fluoreszierendes Protein. Rot gefärbt sind GABA-produzierende Interneuronen zu erkennen.
(Länge des Maßstabs unten rechts: 100 µm) ⓘ

Die Axonenden stehen über Synapsen, an denen die Erregung selten unmittelbar elektrisch weitergegeben, sondern meist mittels Botenstoffen (Neurotransmittern) chemisch übertragen wird, in Kontakt zu anderen Nervenzellen, Muskelzellen (neuromuskuläre Endplatte) oder zu Drüsenzellen. Einige Nervenzellen können auch Signalstoffe in die Blutbahn abgeben, z. B. modifizierte Neuronen im Nebennierenmark oder im Hypothalamus als Sekretion von Neurohormonen. ⓘ
Schätzungen nach besteht das menschliche Gehirn bei einer Masse von anderthalb Kilogramm aus fast neunzig Milliarden Nervenzellen und etwa ähnlich vielen Gliazellen. ⓘ
Die Nervenzelle ist die strukturelle und funktionelle Grundeinheit des Nervensystems. Ihre Bezeichnung als Neuron geht auf Heinrich Wilhelm Waldeyer (1881) zurück. ⓘ
Das Nervensystem
Neuronen sind die Hauptbestandteile des Nervensystems, zusammen mit den Gliazellen, die ihnen strukturelle und metabolische Unterstützung bieten. Das Nervensystem besteht aus dem zentralen Nervensystem, zu dem das Gehirn und das Rückenmark gehören, und dem peripheren Nervensystem, zu dem das autonome und das somatische Nervensystem gehören. Bei Wirbeltieren gehören die meisten Neuronen zum Zentralnervensystem, einige befinden sich jedoch in peripheren Ganglien, und viele sensorische Neuronen sind in Sinnesorganen wie der Netzhaut und der Cochlea zu finden. ⓘ
Die Axone können sich zu Faszikeln bündeln, aus denen die Nerven im peripheren Nervensystem bestehen (so wie Drahtlitzen Kabel bilden). Axonbündel im zentralen Nervensystem werden als Trakte bezeichnet. ⓘ
Anatomie und Histologie

Neuronen sind hoch spezialisiert auf die Verarbeitung und Weiterleitung von Zellsignalen. Angesichts der Vielfalt ihrer Funktionen, die sie in verschiedenen Teilen des Nervensystems ausüben, gibt es eine große Bandbreite an Formen, Größen und elektrochemischen Eigenschaften. So kann das Soma eines Neurons einen Durchmesser von 4 bis 100 Mikrometern haben. ⓘ
- Das Soma ist der Körper des Neurons. Da es den Zellkern enthält, findet hier der größte Teil der Proteinsynthese statt. Der Kern kann einen Durchmesser von 3 bis 18 Mikrometern haben.
- Die Dendriten eines Neurons sind zelluläre Fortsätze mit vielen Verzweigungen. Diese Gesamtform und -struktur wird metaphorisch als dendritischer Baum bezeichnet. Hier findet der größte Teil des Inputs für das Neuron über den dendritischen Stachel statt.
- Das Axon ist ein feinerer, kabelartiger Fortsatz, der zehn-, hundert- oder sogar zehntausendmal so lang sein kann wie der Durchmesser des Somas. Das Axon leitet in erster Linie Nervensignale vom Soma weg und trägt einige Arten von Informationen zurück zum Soma. Viele Neuronen haben nur ein Axon, aber dieses Axon kann - und wird in der Regel - weit verzweigt sein, um die Kommunikation mit vielen Zielzellen zu ermöglichen. Der Teil des Axons, an dem es aus dem Soma austritt, wird Axonhügel genannt. Der Axonhügel ist nicht nur eine anatomische Struktur, sondern weist auch die größte Dichte an spannungsabhängigen Natriumkanälen auf. Damit ist er der am leichtesten zu erregende Teil des Neurons und die Zone, in der das Axon Spikes auslöst. Elektrophysiologisch gesehen hat er das negativste Schwellenpotenzial.
- Während das Axon und der Axonhügel im Allgemeinen am Informationsabfluss beteiligt sind, kann diese Region auch Input von anderen Neuronen erhalten.
- Die Axonendigung befindet sich an dem vom Soma am weitesten entfernten Ende des Axons und enthält Synapsen. Synaptische Boutons sind spezialisierte Strukturen, in denen Neurotransmitter freigesetzt werden, um mit den Zielneuronen zu kommunizieren. Zusätzlich zu den synaptischen Boutons am Axonende kann ein Neuron auch en passant Boutons haben, die sich entlang des Axons befinden. ⓘ
Die gängige Sichtweise des Neurons schreibt seinen verschiedenen anatomischen Komponenten bestimmte Funktionen zu; Dendriten und Axone wirken jedoch oft in einer Weise, die ihrer so genannten Hauptfunktion zuwiderläuft. ⓘ

Axone und Dendriten im zentralen Nervensystem sind in der Regel nur etwa einen Mikrometer dick, während einige im peripheren Nervensystem viel dicker sind. Das Soma hat in der Regel einen Durchmesser von 10-25 Mikrometern und ist oft nicht viel größer als der Zellkern, den es enthält. Das längste Axon eines menschlichen Motoneurons kann über einen Meter lang sein und reicht von der Basis der Wirbelsäule bis zu den Zehen. ⓘ
Sensorische Neuronen können Axone haben, die von den Zehen bis zur hinteren Säule des Rückenmarks verlaufen und bei Erwachsenen über 1,5 Meter lang sind. Giraffen haben einzelne Axone von mehreren Metern Länge, die über die gesamte Länge ihres Halses verlaufen. Vieles von dem, was man über die Funktion von Axonen weiß, stammt aus dem Studium des Riesenaxons des Tintenfisches, das aufgrund seiner relativ enormen Größe (0,5-1 Millimeter dick, mehrere Zentimeter lang) ein ideales Versuchsobjekt darstellt. ⓘ
Vollständig ausdifferenzierte Neuronen sind dauerhaft postmitotisch, aber Stammzellen im erwachsenen Gehirn können während des gesamten Lebens eines Organismus funktionelle Neuronen regenerieren (siehe Neurogenese). Astrozyten sind sternförmige Gliazellen. Es wurde beobachtet, dass sie sich aufgrund ihrer stammzellähnlichen Eigenschaft der Pluripotenz in Neuronen verwandeln können. ⓘ
Membrane
Wie alle tierischen Zellen ist der Zellkörper eines jeden Neurons von einer Plasmamembran umschlossen, einer Doppelschicht aus Lipidmolekülen, in die viele Arten von Proteinstrukturen eingebettet sind. Eine Lipiddoppelschicht ist ein starker elektrischer Isolator, aber in Neuronen sind viele der in die Membran eingebetteten Proteinstrukturen elektrisch aktiv. Dazu gehören Ionenkanäle, die es elektrisch geladenen Ionen ermöglichen, durch die Membran zu fließen, und Ionenpumpen, die Ionen chemisch von einer Seite der Membran zur anderen transportieren. Die meisten Ionenkanäle sind nur für bestimmte Arten von Ionen durchlässig. Einige Ionenkanäle sind spannungsgesteuert, d. h., sie können durch Veränderung der Spannungsdifferenz an der Membran zwischen offenem und geschlossenem Zustand umgeschaltet werden. Andere sind chemisch gesteuert, d. h. sie können durch Wechselwirkungen mit Chemikalien, die durch die extrazelluläre Flüssigkeit diffundieren, zwischen offenem und geschlossenem Zustand umgeschaltet werden. Zu den Ionenmaterialien gehören Natrium, Kalium, Chlorid und Kalzium. Die Wechselwirkungen zwischen Ionenkanälen und Ionenpumpen erzeugen eine Spannungsdifferenz über der Membran, die bei der Basislinie typischerweise etwas weniger als 1/10 Volt beträgt. Diese Spannung hat zwei Funktionen: Zum einen dient sie als Stromquelle für eine Reihe von spannungsabhängigen Proteinmaschinerien, die in die Membran eingebettet sind; zum anderen bildet sie die Grundlage für die elektrische Signalübertragung zwischen verschiedenen Teilen der Membran. ⓘ
Histologie und innere Struktur
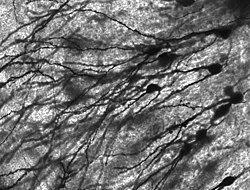

Zahlreiche mikroskopische Klumpen, die Nissl-Körper (oder Nissl-Substanz) genannt werden, werden sichtbar, wenn Nervenzellkörper mit einem basophilen ("basenliebenden") Farbstoff angefärbt werden. Diese Strukturen bestehen aus dem rauen endoplasmatischen Retikulum und der damit verbundenen ribosomalen RNA. Benannt nach dem deutschen Psychiater und Neuropathologen Franz Nissl (1860-1919), sind sie an der Proteinsynthese beteiligt, und ihr Auftreten lässt sich dadurch erklären, dass Nervenzellen sehr stoffwechselaktiv sind. Basophile Farbstoffe wie Anilin oder (schwach) Hämatoxylin heben negativ geladene Komponenten hervor und binden so an das Phosphatgerüst der ribosomalen RNA. ⓘ
Der Zellkörper eines Neurons wird durch ein komplexes Geflecht von Strukturproteinen, den Neurofilamenten, gestützt, die zusammen mit den Neurotubuli (neuronalen Mikrotubuli) zu größeren Neurofibrillen zusammengesetzt sind. Einige Neuronen enthalten auch Pigmentkörnchen wie Neuromelanin (ein bräunlich-schwarzes Pigment, das bei der Synthese von Katecholaminen entsteht) und Lipofuszin (ein gelblich-braunes Pigment), die sich beide mit zunehmendem Alter ansammeln. Andere Strukturproteine, die für die neuronale Funktion wichtig sind, sind Aktin und das Tubulin der Mikrotubuli. β-Tubulin der Klasse III ist fast ausschließlich in Neuronen zu finden. Aktin findet sich während der neuronalen Entwicklung vor allem an den Spitzen von Axonen und Dendriten. Dort kann die Aktindynamik durch ein Zusammenspiel mit Mikrotubuli moduliert werden. ⓘ
Zwischen Axonen und Dendriten gibt es unterschiedliche interne strukturelle Merkmale. Typische Axone enthalten fast keine Ribosomen, mit Ausnahme einiger im Anfangsabschnitt. Dendriten enthalten granuläres endoplasmatisches Retikulum oder Ribosomen, die mit zunehmender Entfernung vom Zellkörper in abnehmender Menge vorhanden sind. ⓘ
Klassifizierung
Neuronen variieren in Form und Größe und können nach ihrer Morphologie und Funktion klassifiziert werden. Der Anatom Camillo Golgi teilte die Neuronen in zwei Typen ein: Typ I mit langen Axonen, die dazu dienen, Signale über große Entfernungen zu übertragen, und Typ II mit kurzen Axonen, die oft mit Dendriten verwechselt werden können. Zellen des Typs I können anhand der Lage des Somas weiter unterteilt werden. Die grundlegende Morphologie der Neuronen des Typs I, zu denen die Motoneuronen der Wirbelsäule gehören, besteht aus einem Zellkörper, dem Soma, und einem langen, dünnen Axon, das von einer Myelinscheide umhüllt ist. Der Dendritenbaum wickelt sich um den Zellkörper und empfängt Signale von anderen Neuronen. Das Ende des Axons hat verzweigte Axonendigungen, die Neurotransmitter in einen Spalt, den so genannten synaptischen Spalt, zwischen den Endigungen und den Dendriten des nächsten Neurons abgeben. ⓘ
Strukturelle Klassifizierung
Polarität

1 Unipolares Neuron
2 Bipolares Neuron
3 Multipolares Neuron
4 Pseudounipolares Neuron ⓘ
Die meisten Neuronen können anatomisch wie folgt charakterisiert werden:
- Unipolar: einzelner Fortsatz
- Bipolar: 1 Axon und 1 Dendrit
- Multipolar: 1 Axon und 2 oder mehr Dendriten
- Golgi I: Neuronen mit lang ausladenden Axonfortsätzen; Beispiele sind Pyramidenzellen, Purkinje-Zellen und Vorderhornzellen
- Golgi II: Neuronen, deren Axonfortsatz lokal vorsteht; das beste Beispiel ist die Körnerzelle
- Anaxonisch: wenn das Axon nicht von dem/den Dendriten unterschieden werden kann
- Pseudounipolar: 1 Fortsatz, der dann sowohl als Axon als auch als Dendrit dient ⓘ
Die im Nervensystem anzutreffenden Neuronen können sich auf mehrere Weise in Aufbau und Funktion unterscheiden. Optisch lassen sie sich dabei gut durch die Art und Anzahl ihrer Fortsätze klassifizieren. ⓘ
Andere
Einige einzigartige neuronale Typen können anhand ihrer Lage im Nervensystem und ihrer besonderen Form identifiziert werden. Einige Beispiele sind:
- Korbzellen, Interneuronen, die ein dichtes Geflecht von Endigungen um das Soma von Zielzellen bilden und in der Hirnrinde und im Kleinhirn vorkommen
- Betz-Zellen, große motorische Neuronen
- Lugaro-Zellen, Interneuronen des Kleinhirns
- Mittelstachelige Neuronen, die meisten Neuronen im Corpus striatum
- Purkinje-Zellen, große Neuronen im Kleinhirn, eine Art mehrpoliges Golgi I-Neuron
- Pyramidenzellen, Neuronen mit dreieckigem Soma, ein Typ von Golgi I
- Renshaw-Zellen, Neuronen, deren beide Enden mit den Alpha-Motorneuronen verbunden sind
- Unipolare Bürstenzellen, Interneuronen mit einem einzigen Dendriten, der in einem bürstenartigen Büschel endet
- Körnerzellen, eine Art von Golgi II-Neuronen
- Vordere Hornzellen, Motoneuronen im Rückenmark
- Spindelzellen, Interneuronen, die weit voneinander entfernte Bereiche des Gehirns miteinander verbinden ⓘ
Funktionelle Klassifizierung
Richtung
- Afferente Neuronen leiten Informationen aus Geweben und Organen in das zentrale Nervensystem weiter und werden auch als sensorische Neuronen bezeichnet.
- Efferente Neuronen (motorische Neuronen) leiten Signale vom zentralen Nervensystem an die Effektorzellen weiter.
- Interneuronen verbinden Neuronen innerhalb bestimmter Regionen des zentralen Nervensystems. ⓘ
Die Begriffe afferent und efferent beziehen sich auch allgemein auf Neuronen, die Informationen zum Gehirn bringen bzw. aus dem Gehirn senden. ⓘ
Wirkung auf andere Neuronen
Ein Neuron beeinflusst andere Neuronen, indem es einen Neurotransmitter freisetzt, der sich an chemische Rezeptoren bindet. Die Wirkung auf das postsynaptische Neuron wird durch die Art des Rezeptors bestimmt, der aktiviert wird, nicht durch das präsynaptische Neuron oder durch den Neurotransmitter. Ein Neurotransmitter kann als Schlüssel und ein Rezeptor als Schloss betrachtet werden: derselbe Neurotransmitter kann mehrere Arten von Rezeptoren aktivieren. Rezeptoren lassen sich grob in erregende (die eine Erhöhung der Feuerungsrate bewirken), hemmende (die eine Verringerung der Feuerungsrate bewirken) oder modulierende (die lang anhaltende Wirkungen haben, die nicht direkt mit der Feuerungsrate zusammenhängen) einteilen. ⓘ
Die beiden häufigsten (über 90 %) Neurotransmitter im Gehirn, Glutamat und GABA, haben weitgehend einheitliche Wirkungen. Glutamat wirkt auf verschiedene Arten von Rezeptoren und hat eine erregende Wirkung auf ionotrope Rezeptoren und eine modulierende Wirkung auf metabotrope Rezeptoren. In ähnlicher Weise wirkt GABA auf mehrere Rezeptortypen, die jedoch alle eine hemmende Wirkung haben (zumindest bei erwachsenen Tieren). Aufgrund dieser Konsistenz bezeichnen Neurowissenschaftler Zellen, die Glutamat freisetzen, als "erregende Neuronen" und Zellen, die GABA freisetzen, als "hemmende Neuronen". Einige andere Arten von Neuronen haben konsistente Wirkungen, zum Beispiel "erregende" motorische Neuronen im Rückenmark, die Acetylcholin freisetzen, und "hemmende" spinale Neuronen, die Glycin freisetzen. ⓘ
Die Unterscheidung zwischen erregenden und hemmenden Neurotransmittern ist nicht absolut. Vielmehr hängt sie von der Klasse der chemischen Rezeptoren ab, die auf dem postsynaptischen Neuron vorhanden sind. Im Prinzip kann ein einziges Neuron, das einen einzigen Neurotransmitter freisetzt, erregende Wirkungen auf einige Ziele haben, hemmende Wirkungen auf andere und modulierende Wirkungen auf wieder andere. So setzen beispielsweise Photorezeptorzellen in der Netzhaut bei Abwesenheit von Licht ständig den Neurotransmitter Glutamat frei. Sogenannte OFF-Bipolarzellen werden, wie die meisten Neuronen, durch das freigesetzte Glutamat erregt. Benachbarte Zielneuronen, die so genannten ON-Bipolarzellen, werden dagegen durch Glutamat gehemmt, da ihnen die typischen ionotropen Glutamatrezeptoren fehlen und sie stattdessen eine Klasse von hemmenden metabotropen Glutamatrezeptoren exprimieren. Bei Licht hören die Photorezeptoren auf, Glutamat freizusetzen, wodurch die bipolaren ON-Zellen von der Hemmung befreit und aktiviert werden; gleichzeitig wird die Erregung der bipolaren OFF-Zellen aufgehoben und sie werden zum Schweigen gebracht. ⓘ
Es ist möglich, die Art der hemmenden Wirkung eines präsynaptischen Neurons auf ein postsynaptisches Neuron anhand der Proteine zu identifizieren, die das präsynaptische Neuron exprimiert. Parvalbumin-exprimierende Neuronen dämpfen typischerweise das Ausgangssignal des postsynaptischen Neurons im visuellen Kortex, während Somatostatin-exprimierende Neuronen typischerweise dendritische Eingänge zum postsynaptischen Neuron blockieren. ⓘ
Entladungsmuster
Neuronen haben intrinsische elektroresponsive Eigenschaften wie intrinsische Transmembranspannungs-Oszillationsmuster. Neuronen können also nach ihren elektrophysiologischen Merkmalen klassifiziert werden:
- Tonisches oder regelmäßiges Spiking. Einige Neuronen sind typischerweise ständig (tonisch) aktiv und feuern mit einer konstanten Frequenz. Beispiel: Interneuronen im Neurostriatum.
- Phasisch oder Bursting. Neuronen, die in Schüben feuern, werden als phasisch bezeichnet.
- Schnelles Spiking. Einige Neuronen zeichnen sich durch eine hohe Feuerrate aus, z. B. einige Arten von kortikalen inhibitorischen Interneuronen, Zellen im Globus pallidus, retinale Ganglienzellen. ⓘ
Neurotransmitter
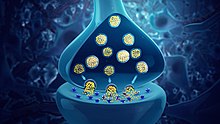
Neurotransmitter sind chemische Botenstoffe, die von einem Neuron zu einem anderen Neuron oder zu einer Muskel- oder Drüsenzelle weitergeleitet werden. ⓘ
- Cholinerge Neuronen - Acetylcholin. Acetylcholin wird von präsynaptischen Neuronen in den synaptischen Spalt freigesetzt. Es wirkt als Ligand sowohl für ligandengesteuerte Ionenkanäle als auch für metabotrope (GPCRs) Muskarinrezeptoren. Nikotinrezeptoren sind pentamere ligandengesteuerte Ionenkanäle, die aus Alpha- und Beta-Untereinheiten bestehen und Nikotin binden. Durch die Ligandenbindung wird der Kanal geöffnet, was zu einer Na+-Depolarisierung führt und die Wahrscheinlichkeit einer präsynaptischen Neurotransmitterfreisetzung erhöht. Acetylcholin wird aus Cholin und Acetylcoenzym A synthetisiert.
- Adrenerge Neuronen - Noradrenalin. Noradrenalin (Noradrenalin) wird von den meisten postganglionären Neuronen im sympathischen Nervensystem an zwei Gruppen von GPCRs freigesetzt: Alpha-Adrenozeptoren und Beta-Adrenozeptoren. Noradrenalin ist einer der drei gebräuchlichen Katecholamin-Neurotransmitter und der häufigste von ihnen im peripheren Nervensystem; wie andere Katecholamine wird es aus Tyrosin synthetisiert.
- GABAerge Neuronen - Gamma-Aminobuttersäure. GABA ist neben Glycin einer von zwei Neuroinhibitoren im zentralen Nervensystem (ZNS). GABA hat eine ähnliche Funktion wie ACh, indem es Anionenkanäle öffnet, die den Eintritt von Cl--Ionen in das postsynaptische Neuron ermöglichen. Cl- bewirkt eine Hyperpolarisation innerhalb des Neurons, wodurch die Wahrscheinlichkeit der Auslösung eines Aktionspotenzials sinkt, da die Spannung negativer wird (damit ein Aktionspotenzial ausgelöst werden kann, muss eine positive Spannungsschwelle erreicht werden). GABA wird aus Glutamat-Neurotransmittern durch das Enzym Glutamat-Decarboxylase synthetisiert.
- Glutamatergische Neuronen - Glutamat. Glutamat ist neben Aspartat einer der beiden primären erregenden Aminosäure-Neurotransmitter. Glutamatrezeptoren gehören zu einer von vier Kategorien, von denen drei ligandengesteuerte Ionenkanäle sind und einer ein G-Protein-gekoppelter Rezeptor ist (oft als GPCR bezeichnet). ⓘ
- AMPA- und Kainat-Rezeptoren fungieren als Kationenkanäle, die für Na+-Kationenkanäle durchlässig sind und eine schnelle erregende synaptische Übertragung vermitteln.
- NMDA-Rezeptoren sind ein weiterer Kationenkanal, der durchlässiger für Ca2+ ist. Die Funktion von NMDA-Rezeptoren hängt von der Bindung des Glycinrezeptors als Co-Agonist in der Kanalpore ab. Ohne die Anwesenheit beider Liganden funktionieren NMDA-Rezeptoren nicht.
- Metabotrope Rezeptoren, GPCRs, modulieren die synaptische Übertragung und die postsynaptische Erregbarkeit.
- Glutamat kann Exzitotoxizität verursachen, wenn der Blutfluss zum Gehirn unterbrochen wird, was zu Hirnschäden führt. Wenn der Blutfluss unterdrückt wird, wird Glutamat aus präsynaptischen Neuronen freigesetzt, was zu einer stärkeren Aktivierung von NMDA- und AMPA-Rezeptoren führt, als dies außerhalb von Stresssituationen der Fall ist, was zu einem erhöhten Ca2+- und Na+-Eintritt in das postsynaptische Neuron und zu Zellschäden führt. Glutamat wird durch das Enzym Glutamatsynthase aus der Aminosäure Glutamin synthetisiert. ⓘ
- Dopaminerge Neuronen - Dopamin. Dopamin ist ein Neurotransmitter, der auf Gs-Rezeptoren vom Typ D1 (D1 und D5) wirkt, die cAMP und PKA erhöhen, und auf Rezeptoren vom Typ D2 (D2, D3 und D4), die Gi-Rezeptoren aktivieren, die cAMP und PKA verringern. Dopamin steht in Verbindung mit Stimmung und Verhalten und moduliert sowohl die prä- als auch die postsynaptische Neurotransmission. Der Verlust von Dopamin-Neuronen in der Substantia nigra wurde mit der Parkinson-Krankheit in Verbindung gebracht. Dopamin wird aus der Aminosäure Tyrosin synthetisiert. Tyrosin wird durch Tyrosinhydroxlase in Levodopa (oder L-DOPA) umgewandelt, und Levodopa wird dann durch die aromatische Aminosäure Decarboxylase in Dopamin umgewandelt.
- Serotonergische Neuronen - Serotonin. Serotonin (5-Hydroxytryptamin, 5-HT) kann erregend oder hemmend wirken. Von seinen vier 5-HT-Rezeptorklassen sind 3 GPCR und 1 ist ein ligandengesteuerter Kationenkanal. Serotonin wird aus Tryptophan durch Tryptophan-Hydroxylase und anschließend durch Decarboxylase synthetisiert. Ein Mangel an 5-HT an postsynaptischen Neuronen wurde mit Depressionen in Verbindung gebracht. Zur Behandlung werden Medikamente eingesetzt, die den präsynaptischen Serotonintransporter blockieren, wie z. B. Prozac und Zoloft.
- Purinerge Neuronen - ATP. ATP ist ein Neurotransmitter, der sowohl an ligandengesteuerten Ionenkanälen (P2X-Rezeptoren) als auch an GPCR-Rezeptoren (P2Y) wirkt. ATP ist jedoch am besten als Cotransmitter bekannt. Eine solche purinerge Signalübertragung kann auch durch andere Purine wie Adenosin vermittelt werden, das insbesondere an P2Y-Rezeptoren wirkt.
- Histaminerge Neuronen - Histamin. Histamin ist ein Monoamin-Neurotransmitter und Neuromodulator. Histamin produzierende Neuronen befinden sich im Nucleus tuberomammillaris des Hypothalamus. Histamin ist an der Erregung und der Regulierung des Schlaf-Wach-Verhaltens beteiligt. ⓘ
Multimodell-Klassifizierung
Seit 2012 bemüht sich die Gemeinschaft der zellulären und computergestützten Neurowissenschaften um eine universelle Klassifizierung von Neuronen, die sowohl für alle Neuronen im Gehirn als auch für alle Arten gilt. Dazu werden die drei wesentlichen Eigenschaften aller Neuronen berücksichtigt: Elektrophysiologie, Morphologie und das individuelle Transkriptom der Zellen. Diese Klassifizierung ist nicht nur universell, sondern hat auch den Vorteil, dass sie auch Astrozyten klassifizieren kann. Eine Methode namens Patch-Seq, bei der alle drei Eigenschaften gleichzeitig gemessen werden können, wird vom Allen Institute for Brain Science ausgiebig genutzt. ⓘ
Konnektivität
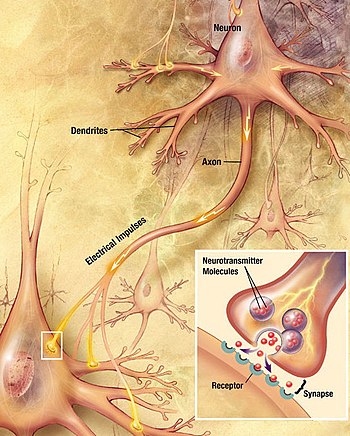

Neuronen kommunizieren miteinander über Synapsen, bei denen entweder das Axonende einer Zelle mit dem Dendriten, dem Soma oder - seltener - dem Axon eines anderen Neurons in Kontakt kommt. Neuronen wie die Purkinje-Zellen im Kleinhirn können mehr als 1000 dendritische Verzweigungen haben, die mit Zehntausenden anderer Zellen in Verbindung stehen; andere Neuronen, wie die magnozellulären Neuronen des supraoptischen Kerns, haben nur einen oder zwei Dendriten, von denen jeder Tausende von Synapsen erhält. ⓘ
Synapsen können erregend oder hemmend wirken, indem sie die Aktivität des Zielneurons entweder erhöhen oder verringern. Einige Neuronen kommunizieren auch über elektrische Synapsen, d. h. direkte, elektrisch leitende Verbindungen zwischen Zellen. ⓘ
Wenn ein Aktionspotenzial das Axonende erreicht, öffnet es spannungsgesteuerte Kalziumkanäle, so dass Kalziumionen in das Ende eindringen können. Das Kalzium bewirkt, dass die mit Neurotransmitter-Molekülen gefüllten synaptischen Vesikel mit der Membran verschmelzen und ihren Inhalt in den synaptischen Spalt abgeben. Die Neurotransmitter diffundieren durch den synaptischen Spalt und aktivieren Rezeptoren auf dem postsynaptischen Neuron. Ein hoher zytosolischer Kalziumspiegel im Axonende löst die mitochondriale Kalziumaufnahme aus, die wiederum den mitochondrialen Energiestoffwechsel aktiviert, um ATP zur Unterstützung der kontinuierlichen Neurotransmission zu produzieren. ⓘ
Eine Autapse ist eine Synapse, bei der sich das Axon eines Neurons mit seinen eigenen Dendriten verbindet. ⓘ
Das menschliche Gehirn hat etwa 8,6 x 1010 (sechsundachtzig Milliarden) Neuronen. Jedes Neuron hat im Durchschnitt 7.000 synaptische Verbindungen zu anderen Neuronen. Man schätzt, dass das Gehirn eines dreijährigen Kindes etwa 1015 Synapsen (1 Billiarde) hat. Diese Zahl nimmt mit dem Alter ab und stabilisiert sich im Erwachsenenalter. Die Schätzungen für einen Erwachsenen variieren und reichen von 1014 bis 5 x 1014 Synapsen (100 bis 500 Billionen). ⓘ

Nicht-elektrochemische Signalübertragung
Studien legen nahe, dass Neuronen in gesunden menschlichen Gehirnen über die elektrische und chemische Signalübertragung hinaus auch durch andere Mittel kommunizieren können:
- Kraft, die durch die Vergrößerung der dendritischen Stacheln erzeugt wird
- die Übertragung von Proteinen - transneuronal transportierte Proteine (TNTPs) ⓘ
Sie können auch durch Eingaben aus der Umwelt und durch Hormone moduliert werden, die von anderen Teilen des Organismus freigesetzt werden und die mehr oder weniger direkt von den Neuronen beeinflusst werden können. Dies gilt auch für Neurotrophine wie BDNF. Auch das Darmmikrobiom ist mit dem Gehirn verbunden. ⓘ
Mechanismen zur Ausbreitung von Aktionspotenzialen
1937 schlug John Zachary Young vor, das Riesenaxon des Tintenfisches zur Untersuchung der elektrischen Eigenschaften von Neuronen zu verwenden. Es ist größer als menschliche Neuronen, aber ihnen ähnlich, so dass es leichter zu untersuchen ist. Durch das Einführen von Elektroden in das Riesenaxon des Tintenfisches konnten genaue Messungen des Membranpotenzials vorgenommen werden. ⓘ
Die Zellmembran des Axons und des Somas enthält spannungsgesteuerte Ionenkanäle, die es dem Neuron ermöglichen, ein elektrisches Signal (ein Aktionspotenzial) zu erzeugen und weiterzuleiten. Einige Neuronen erzeugen auch unterschwellige Membranpotentialschwankungen. Diese Signale werden durch ladungstragende Ionen wie Natrium (Na+), Kalium (K+), Chlorid (Cl-) und Calcium (Ca2+) erzeugt und weitergeleitet. ⓘ
Ein Neuron kann durch verschiedene Reize aktiviert werden, die zu einer elektrischen Aktivität führen, z. B. durch Druck, Dehnung, chemische Transmitter und Veränderungen des elektrischen Potenzials an der Zellmembran. Stimuli bewirken, dass sich bestimmte Ionenkanäle innerhalb der Zellmembran öffnen, was zu einem Ionenfluss durch die Zellmembran führt und das Membranpotenzial verändert. Neuronen müssen die spezifischen elektrischen Eigenschaften beibehalten, die ihren Neuronentyp definieren. ⓘ
Dünne Neuronen und Axone benötigen weniger Stoffwechselaufwand, um Aktionspotenziale zu erzeugen und weiterzuleiten, aber dickere Axone leiten Impulse schneller weiter. Um den Stoffwechselaufwand zu minimieren und gleichzeitig eine schnelle Weiterleitung zu gewährleisten, haben viele Neuronen isolierende Myelinhüllen um ihre Axone. Diese Hüllen werden von Gliazellen gebildet: Oligodendrozyten im zentralen Nervensystem und Schwann-Zellen im peripheren Nervensystem. Durch die Hülle können sich Aktionspotenziale schneller ausbreiten als in nicht myelinisierten Axonen desselben Durchmessers, wobei weniger Energie verbraucht wird. Die Myelinscheide in peripheren Nerven verläuft normalerweise in etwa 1 mm langen Abschnitten entlang des Axons, unterbrochen von nicht ummantelten Ranvier-Knoten, die eine hohe Dichte an spannungsgesteuerten Ionenkanälen enthalten. Multiple Sklerose ist eine neurologische Erkrankung, die auf eine Demyelinisierung der Axone im zentralen Nervensystem zurückzuführen ist. ⓘ
Einige Neuronen erzeugen keine Aktionspotenziale, sondern ein abgestuftes elektrisches Signal, das wiederum eine abgestufte Freisetzung von Neurotransmittern bewirkt. Bei solchen nicht-spikenden Neuronen handelt es sich in der Regel um sensorische Neuronen oder Interneuronen, da sie keine Signale über weite Strecken übertragen können. ⓘ
Neuronale Kodierung
Die neuronale Kodierung befasst sich mit der Art und Weise, wie sensorische und andere Informationen im Gehirn durch Neuronen dargestellt werden. Das Hauptziel der Untersuchung der neuronalen Kodierung besteht darin, die Beziehung zwischen dem Reiz und den individuellen oder gemeinsamen neuronalen Reaktionen sowie die Beziehungen zwischen den elektrischen Aktivitäten der Neuronen innerhalb des Ensembles zu charakterisieren. Es wird davon ausgegangen, dass Neuronen sowohl digitale als auch analoge Informationen kodieren können. ⓘ
Alles-oder-nichts-Prinzip

Die Weiterleitung von Nervenimpulsen ist ein Beispiel für eine Alles-oder-nichts-Antwort. Mit anderen Worten: Wenn ein Neuron überhaupt reagiert, dann muss es vollständig reagieren. Eine stärkere Stimulationsintensität, z. B. ein helleres Bild oder ein lauterer Ton, führt nicht zu einem stärkeren Signal, kann aber die Feuerungsfrequenz erhöhen. Rezeptoren reagieren auf unterschiedliche Weise auf Reize. Langsam anpassende oder tonische Rezeptoren reagieren auf gleichbleibende Reize und erzeugen eine gleichbleibende Feuerungsrate. Tonische Rezeptoren reagieren meist auf eine erhöhte Reizintensität, indem sie ihre Feuerfrequenz erhöhen, normalerweise als Potenzfunktion des Reizes, aufgetragen gegen die Impulse pro Sekunde. Dies kann mit einer intrinsischen Eigenschaft des Lichts verglichen werden, bei der eine höhere Intensität einer bestimmten Frequenz (Farbe) mehr Photonen erfordert, da die Photonen für eine bestimmte Frequenz nicht "stärker" werden können. ⓘ
Andere Rezeptortypen sind schnell anpassende oder phasische Rezeptoren, bei denen das Feuern bei gleichbleibendem Reiz abnimmt oder aufhört; ein Beispiel dafür ist die Haut, die bei Berührung Neuronen zum Feuern bringt, aber wenn das Objekt gleichmäßig Druck ausübt, hören die Neuronen auf zu feuern. Die Neuronen der Haut und der Muskeln, die auf Druck und Vibration reagieren, haben filternde Hilfsstrukturen, die ihre Funktion unterstützen. ⓘ
Das pazinische Korpuskel ist eine solche Struktur. Es hat konzentrische Schichten wie eine Zwiebel, die sich um die Axonendigung herum bilden. Wenn Druck ausgeübt und das Korpuskel verformt wird, wird ein mechanischer Reiz auf das Axon übertragen, das daraufhin feuert. Wenn der Druck konstant ist, endet der Reiz; daher reagieren diese Neuronen typischerweise mit einer vorübergehenden Depolarisation während der anfänglichen Verformung und erneut, wenn der Druck weggenommen wird, wodurch das Korpuskel erneut seine Form ändert. Andere Arten der Anpassung sind wichtig für die Erweiterung der Funktion einer Reihe anderer Neuronen. ⓘ
Etymologie und Schreibweise
Der deutsche Anatom Heinrich Wilhelm Waldeyer führte 1891 den Begriff Neuron ein, der auf das altgriechische νεῦρον neuron "Sehne, Strang, Nerv" zurückgeht. ⓘ
Das Wort wurde im Französischen mit der Schreibweise neurone übernommen. Diese Schreibweise wurde auch von vielen Schriftstellern im Englischen verwendet, ist aber im amerikanischen Sprachgebrauch selten geworden und im britischen Sprachgebrauch unüblich. ⓘ
Geschichte
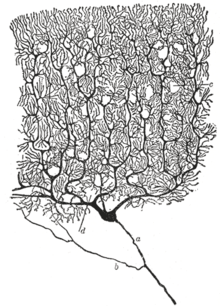
Die Stellung des Neurons als primäre Funktionseinheit des Nervensystems wurde erstmals Ende des 19. Jahrhunderts durch die Arbeiten des spanischen Anatomen Santiago Ramón y Cajal erkannt. ⓘ
Um die Struktur der einzelnen Neuronen sichtbar zu machen, verbesserte Ramón y Cajal ein von Camillo Golgi entwickeltes Silberfärbeverfahren. Bei dem verbesserten Verfahren handelt es sich um eine Technik, die als "doppelte Imprägnierung" bezeichnet wird und noch immer in Gebrauch ist. ⓘ
1888 veröffentlichte Ramón y Cajal eine Arbeit über das Kleinhirn der Vögel. Darin stellte er fest, dass er keine Beweise für eine Anastomose zwischen Axonen und Dendriten finden konnte, und bezeichnete jedes Nervenelement als "einen absolut autonomen Kanton". Dies wurde als Neuronen-Doktrin bekannt, einer der zentralen Lehrsätze der modernen Neurowissenschaften. ⓘ
Im Jahr 1891 schrieb der deutsche Anatom Heinrich Wilhelm Waldeyer eine sehr einflussreiche Abhandlung über die Neuronenlehre, in der er den Begriff Neuron einführte, um die anatomische und physiologische Einheit des Nervensystems zu beschreiben. ⓘ
Die Silberimprägnierfärbung ist eine nützliche Methode für neuroanatomische Untersuchungen, da sie aus unbekannten Gründen nur einen kleinen Prozentsatz der Zellen in einem Gewebe färbt und so die gesamte Mikrostruktur einzelner Neuronen ohne große Überschneidungen mit anderen Zellen sichtbar macht. ⓘ
Neuronen-Lehre
Die Neuronenlehre ist die heute grundlegende Vorstellung, dass Neuronen die grundlegenden strukturellen und funktionellen Einheiten des Nervensystems sind. Die Theorie wurde von Santiago Ramón y Cajal im späten 19. Jahrhundert aufgestellt. Sie besagt, dass es sich bei Neuronen um diskrete Zellen handelt (die nicht in einem Geflecht verbunden sind), die als metabolisch getrennte Einheiten agieren. ⓘ
Spätere Entdeckungen führten zu einer Verfeinerung der Lehrmeinung. So spielen zum Beispiel Gliazellen, die nicht zu den Neuronen gehören, eine wesentliche Rolle bei der Informationsverarbeitung. Auch sind elektrische Synapsen, also direkte zytoplasmatische Verbindungen zwischen Neuronen, weiter verbreitet als bisher angenommen. Tatsächlich können Neuronen sogar noch engere Verbindungen eingehen: Das Riesenaxon des Tintenfisches entsteht durch die Fusion mehrerer Axone. ⓘ
Ramón y Cajal postulierte auch das Gesetz der dynamischen Polarisierung, das besagt, dass ein Neuron Signale an seinen Dendriten und seinem Zellkörper empfängt und sie als Aktionspotentiale entlang des Axons in eine Richtung weiterleitet: weg vom Zellkörper. Das Gesetz der dynamischen Polarisierung hat wichtige Ausnahmen: Dendriten können als synaptische Ausgangsstellen von Neuronen dienen und Axone können synaptische Eingänge empfangen. ⓘ
Kompartimentelle Modellierung von Neuronen
Obwohl Neuronen oft als "Grundeinheiten" des Gehirns bezeichnet werden, führen sie interne Berechnungen durch. Neuronen integrieren Eingaben innerhalb der Dendriten, und diese Komplexität geht in Modellen verloren, die Neuronen als fundamentale Einheit annehmen. Dendritische Verzweigungen können als räumliche Kompartimente modelliert werden, deren Aktivität aufgrund passiver Membraneigenschaften zusammenhängt, aber auch je nach Input von Synapsen unterschiedlich sein kann. Die kompartimentelle Modellierung von Dendriten ist besonders hilfreich, um das Verhalten von Neuronen zu verstehen, die zu klein sind, um sie mit Elektroden aufzuzeichnen, wie es bei Drosophila melanogaster der Fall ist. ⓘ
Neuronen im Gehirn
Die Anzahl der Neuronen im Gehirn variiert von Spezies zu Spezies dramatisch. Beim Menschen gibt es schätzungsweise 10-20 Milliarden Neuronen in der Großhirnrinde und 55-70 Milliarden Neuronen im Kleinhirn. Im Gegensatz dazu hat der Fadenwurm Caenorhabditis elegans nur 302 Neuronen, was ihn zu einem idealen Modellorganismus macht, da die Wissenschaftler alle seine Neuronen kartieren konnten. Die Fruchtfliege Drosophila melanogaster, die häufig in biologischen Experimenten untersucht wird, hat etwa 100 000 Neuronen und zeigt viele komplexe Verhaltensweisen. Viele Eigenschaften der Neuronen, von der Art der verwendeten Neurotransmitter bis hin zur Zusammensetzung der Ionenkanäle, sind bei allen Arten gleich, so dass Wissenschaftler Prozesse, die in komplexeren Organismen ablaufen, in viel einfacheren Versuchssystemen untersuchen können. ⓘ
Neurologische Störungen
Die Charcot-Marie-Tooth-Krankheit (CMT) ist eine heterogene, vererbte Nervenerkrankung (Neuropathie), die durch den Verlust von Muskelgewebe und Berührungsempfindungen gekennzeichnet ist, vor allem in den Füßen und Beinen, in fortgeschrittenen Stadien auch in den Händen und Armen. Diese derzeit unheilbare Krankheit ist eine der häufigsten neurologischen Erbkrankheiten, von der 36 von 100 000 Menschen betroffen sind. ⓘ
Die Alzheimer-Krankheit (AD), auch einfach Alzheimer genannt, ist eine neurodegenerative Erkrankung, die durch eine fortschreitende kognitive Verschlechterung gekennzeichnet ist, die mit einer Abnahme der Aktivitäten des täglichen Lebens und neuropsychiatrischen Symptomen oder Verhaltensänderungen einhergeht. Das auffälligste Frühsymptom ist der Verlust des Kurzzeitgedächtnisses (Amnesie), der sich in der Regel als leichte Vergesslichkeit äußert, die mit dem Fortschreiten der Krankheit immer ausgeprägter wird, wobei ältere Erinnerungen relativ gut erhalten bleiben. Mit dem Fortschreiten der Erkrankung dehnt sich die kognitive (intellektuelle) Beeinträchtigung auf die Bereiche Sprache (Aphasie), geschickte Bewegungen (Apraxie) und Erkennen (Agnosie) aus, und Funktionen wie Entscheidungsfindung und Planung werden beeinträchtigt. ⓘ
Die Parkinson-Krankheit (PD), auch als Parkinson bekannt, ist eine degenerative Erkrankung des zentralen Nervensystems, die häufig die motorischen Fähigkeiten und die Sprache beeinträchtigt. Die Parkinson-Krankheit gehört zu einer Gruppe von Erkrankungen, die als Bewegungsstörungen bezeichnet werden. Sie ist gekennzeichnet durch Muskelsteifigkeit, Zittern, eine Verlangsamung der körperlichen Bewegung (Bradykinesie) und in extremen Fällen durch einen Verlust der körperlichen Bewegung (Akinesie). Die primären Symptome sind das Ergebnis einer verminderten Stimulation des motorischen Kortex durch die Basalganglien, die normalerweise durch eine unzureichende Bildung und Wirkung von Dopamin verursacht wird, das in den dopaminergen Neuronen des Gehirns produziert wird. Zu den sekundären Symptomen können kognitive Funktionsstörungen auf hohem Niveau und subtile Sprachprobleme gehören. Morbus Parkinson ist sowohl chronisch als auch fortschreitend. ⓘ
Myasthenia gravis ist eine neuromuskuläre Erkrankung, die zu schwankender Muskelschwäche und Ermüdbarkeit bei einfachen Tätigkeiten führt. Die Schwäche wird in der Regel durch zirkulierende Antikörper verursacht, die Acetylcholinrezeptoren an der postsynaptischen neuromuskulären Verbindung blockieren und so die stimulierende Wirkung des Neurotransmitters Acetylcholin hemmen. Die Myasthenie wird mit Immunsuppressiva, Cholinesterasehemmern und in ausgewählten Fällen mit einer Thymektomie behandelt. ⓘ
Demyelinisierung
Unter Demyelinisierung versteht man die Entmarkung, d. h. den Verlust der Myelinscheide, die die Nerven isoliert. Wenn sich das Myelin abbaut, kann die Signalübertragung entlang des Nervs beeinträchtigt werden oder verloren gehen, und der Nerv verkümmert schließlich. Dies führt zu bestimmten neurodegenerativen Erkrankungen wie Multipler Sklerose und chronisch entzündlicher demyelinisierender Polyneuropathie. ⓘ
Axonale Degeneration
Obwohl die meisten Verletzungsreaktionen einen Kalziumeinstrom beinhalten, der das Wiederverschließen der abgetrennten Teile fördert, führen axonale Verletzungen zunächst zu einer akuten axonalen Degeneration, d. h. einer schnellen Trennung der proximalen und distalen Enden, die innerhalb von 30 Minuten nach der Verletzung auftritt. Die Degeneration geht mit einer Schwellung des Axolemmas einher und führt schließlich zu einer wulstartigen Bildung. Nach der Degeneration des Axolemmas kommt es zu einem körnigen Zerfall des axonalen Zytoskeletts und der inneren Organellen. Zu den frühen Veränderungen gehört die Ansammlung von Mitochondrien in den paranodalen Regionen an der Verletzungsstelle. Das endoplasmatische Retikulum wird abgebaut, die Mitochondrien quellen auf und zerfallen schließlich. Der Zerfall ist abhängig von Ubiquitin und Calpain-Proteasen (verursacht durch den Zufluss von Kalziumionen), was darauf hindeutet, dass die axonale Degeneration ein aktiver Prozess ist, der eine vollständige Fragmentierung bewirkt. Dieser Prozess dauert im PNS etwa 24 Stunden und im ZNS länger. Die Signalwege, die zur Degeneration des Axolemmas führen, sind unbekannt. ⓘ
Neurogenese
Neuronen entstehen durch den Prozess der Neurogenese, bei dem sich neurale Stammzellen teilen, um differenzierte Neuronen zu erzeugen. Sobald die Neuronen vollständig ausdifferenziert sind, sind sie nicht mehr in der Lage, eine Mitose zu durchlaufen. Die Neurogenese findet bei den meisten Organismen in erster Linie im Embryo statt. ⓘ
Die Neurogenese kann auch im Erwachsenenalter stattfinden, und Studien über das Alter menschlicher Neuronen deuten darauf hin, dass dieser Prozess nur bei einer Minderheit der Zellen stattfindet und dass die überwiegende Mehrheit der Neuronen im Neokortex vor der Geburt gebildet wird und ohne Ersatz bestehen bleibt. Das Ausmaß der adulten Neurogenese beim Menschen und ihr Beitrag zur Kognition sind umstritten, wobei 2018 widersprüchliche Berichte veröffentlicht wurden. ⓘ
Der Körper enthält eine Vielzahl von Stammzelltypen, die die Fähigkeit haben, sich in Neuronen zu differenzieren. Forscher haben einen Weg gefunden, menschliche Hautzellen durch Transdifferenzierung in Nervenzellen umzuwandeln, bei der "Zellen gezwungen werden, neue Identitäten anzunehmen". ⓘ
Während der Neurogenese im Gehirn von Säugetieren gehen Vorläufer- und Stammzellen von proliferativen Teilungen zu differenzierenden Teilungen über. Auf diese Weise entstehen die Neuronen und Gliazellen, die die Kortikalschichten bevölkern. Epigenetische Veränderungen spielen eine Schlüsselrolle bei der Regulierung der Genexpression in sich differenzierenden neuralen Stammzellen und sind entscheidend für die Bestimmung des Zellschicksals im sich entwickelnden und erwachsenen Säugetiergehirn. Zu den epigenetischen Modifikationen gehören die Cytosin-Methylierung der DNA zur Bildung von 5-Methylcytosin und die 5-Methylcytosin-Demethylierung. Diese Modifikationen sind entscheidend für die Bestimmung des Zellschicksals im sich entwickelnden und erwachsenen Säugetiergehirn. Die DNA-Cytosin-Methylierung wird durch DNA-Methyltransferasen (DNMTs) katalysiert. Die Demethylierung von Methylcytosin wird in mehreren Stufen durch TET-Enzyme katalysiert, die oxidative Reaktionen durchführen (z. B. 5-Methylcytosin zu 5-Hydroxymethylcytosin), sowie durch Enzyme des DNA-Basen-Exzisionsreparaturweges (BER). ⓘ
In verschiedenen Stadien der Entwicklung des Nervensystems von Säugetieren werden zwei DNA-Reparaturprozesse für die Reparatur von DNA-Doppelstrangbrüchen eingesetzt. Dabei handelt es sich um die homologe Rekombinationsreparatur, die in proliferierenden neuralen Vorläuferzellen zum Einsatz kommt, und die nicht-homologe Endverbindung, die vor allem in späteren Entwicklungsstadien verwendet wird. ⓘ
Regeneration von Nerven
Periphere Axone können nachwachsen, wenn sie durchtrennt werden, aber ein Neuron kann funktionell nicht durch ein Neuron eines anderen Typs ersetzt werden (Llinás'sches Gesetz). ⓘ
Aufbau
| Aufbau einer Nervenzelle ⓘ |
|---|

Die Dendriten
Vom Zellkörper einer Nervenzelle gehen verschiedene plasmatische Fortsätze aus. Die Dendriten (griechisch δένδρον dendron, deutsch ‚Baum‘) sind fein verästelte Nervenzellfortsätze, die vom Soma auswachsen und Kontaktstellen für andere Zellen bilden, deren Erregung hier auf die Nervenzelle übertragen werden kann. Über eine Synapse wird das Neuron mit einer bestimmten Zelle verknüpft und nimmt mit der lokal zugeordneten postsynaptischen Membranregion eines Dendriten Signale auf. Der Dendritenbaum einer einzigen Nervenzelle kann mehrere Tausend solcher synaptischen Kontakte aufweisen, über die ihr verschiedene Signale zufließen, die je lokal als bestimmte Veränderungen des postsynaptischen Membranpotentials abgebildet werden. Die einzelnen Kontaktstellen können jeweils unterschiedlich gestaltet werden; bei manchen Neuronen finden sich dafür besondere Ausbildungen in Form dendritischer Dornen. Allein die synaptische Aktivierung am Dendriten vermag schon Veränderungen zu bewirken, die noch lange anhalten können (siehe synaptische Plastizität). ⓘ
Der Axonhügel
Einen besonderen, von Nissl-Schollen freien Bereich des Zellkörpers bildet der Ursprungskegel des Neuriten oder Axonhügel, aus dem das eine Axon einer Nervenzelle hervorgeht. Hier ist das Schwellenpotential deutlich niedriger, sodass postsynaptische Potentiale am ehesten an dieser Stelle des Perikaryons ein Aktionspotential auszulösen vermögen. Die im anschließenden ersten Abschnitt des Axons, seinem Initialsegment, gebildeten Aktionspotentiale werden über das Axon fortgeleitet. Der Axonhügel ist damit jener Ort, an dem postsynaptische Potentialänderungen integriert und in Serien von Aktionspotentialen überführt werden und somit analoge in digitale Signale umcodiert. Durch sein niedriges Schwellenpotential und die Lage des Axonhügels wird sichergestellt, dass im Falle einer Erregung der Nervenzelle Aktionspotentiale an dieser Stelle entstehen und über ihr Axon weitergeleitet werden. ⓘ
Neurotransmitter
Neurotransmitter dienen an chemischen Synapsen als Botenstoffe für die Erregungsübertragung von einer Nervenzelle auf eine andere Zelle (Transmission). Die Transmitter werden bei Erregung der „Senderzelle“ präsynaptisch ausgeschüttet, überbrücken den synaptischen Spalt zwischen den Zellen und werden postsynaptisch von der „Empfängerzelle“ mittels besonderer Rezeptorproteine empfangen. Diese erkennen das jeweilige Transmittermolekül spezifisch an seiner räumlichen Form und Ladungsverteilung durch komplementäre Strukturen und binden es reversibel. ⓘ
Die Bindung führt zu einer Umbildung der Rezeptorstruktur (Konformationsänderung). Dies kann direkt (ionotrop) auslösend oder mittelbar (metabotrop) anstoßend die Öffnung von Ionenkanälen in der Membran beeinflussen, dadurch kurzzeitig Ionenströme zulassen und damit vorübergehend eine Änderung des Membranpotentials dieser Region herbeiführen. Je nach Ausstattung der postsynaptischen Membran wird als lokale Antwort dann eine Potentialdifferenz (postsynaptisches Potential, PSP) hervorgerufen, welche entweder die Erregung der Empfängerzelle begünstigt bzw. auslöst (erregend, exzitatorisches PSP) oder aber deren Erregung für kurze Zeit erschwert bzw. verhindert (hemmend, inhibitorisches PSP). ⓘ

1. Axon eines Motoneurons
2. Motorische Endplatte
3. Muskelfaser
4. Myofibrille ⓘ
Die mittels des Transmitters übertragene Erregung wirkt an einer chemischen Synapse also entweder erregend oder hemmend auf die nachgeordnete Zelle, was durch die Rezeptortypen und die Ionensorten der beeinflussten Membrankanäle in der jeweils verknüpften Zelle festgelegt wird. Bei neuromuskulären Synapsen beispielsweise werden Impulse erregter Nervenzellen an motorischen Endplatten mittels Acetylcholin (ACh) als Transmittersubstanz auf Muskelfasern übertragen und wirken auf diese Effektoren erregend, das postsynaptische Endplattenpotential kann also ein Aktionspotential dieser Zellen auslösen. In den Muskelzellen führt dieses zur Kontraktion, was sich am zugehörigen Erfolgsorgan als Verkürzung des Muskels zeigen kann. Begrenzt wird die Wirkung des möglicherweise erneut bindenden Transmitters hier vor allem durch dessen enzymatische Zerlegung (Acetylcholinesterase) im synaptischen Spalt. ⓘ
Unterscheidung der Nervenzellen in Bau und Funktion
Unipolare Nervenzellen
Es gibt unipolare Nervenzellen, die nur mit einem einzigen, kurzen Fortsatz ausgestattet sind, der in der Regel dem Neurit bzw. Axon entspricht. Man findet sie beispielsweise als primäre Sinneszellen in der Netzhaut des Auges. ⓘ
Bipolare Nervenzellen
Eine Bipolare Nervenzelle ist ein Neuron mit zwei Fortsätzen. Bipolare Zellen sind spezialisierte Sensorneuronen für die Vermittlung bestimmter Sinne. Als solche sind sie Teil der sensoriellen Informationsübertragung für Geruchssinn, Sehsinn, Geschmackssinn, Tastsinn, Gehör und Gleichgewichtssinn. ⓘ
Als Beispiele werden meistens die bipolaren Zellen der Retina und der Ganglien des Hör-Gleichgewichtsnervs angegeben. Wenn genauere Angaben fehlen, bezieht sich der Begriff gewöhnlich auf die zur Netzhaut gehörenden Zellen. ⓘ
Multipolare Nervenzellen
Eine sehr häufig vorkommende Gruppe sind die multipolaren Nervenzellen. Sie besitzen zahlreiche Dendriten und ein Axon. Diesen Zelltyp findet man zum Beispiel als motorische Nervenzelle im Rückenmark. ⓘ
Pseudounipolare Nervenzellen
Ebenfalls über zwei Fortsätze verfügen die pseudounipolaren Nervenzellen. Dort jedoch gehen Dendrit und Axon nahe dem Zellkörper ineinander über. Man findet sie bei sensiblen Nervenzellen, deren Perikaryen in den Spinalganglien liegen. Die Erregung durchläuft so nicht erst das Perikaryon, sondern geht direkt vom dendritischen auf das neuritische Axon über. ⓘ
Unterscheidung nach Myelinisierung
Eine weitere optische Unterscheidungsmöglichkeit ist die Ausprägung der Myelinscheide durch Schwannsche Zellen im Bereich des Axons. Es existiert hier sowohl eine markhaltige als auch eine marklose Form, wobei diejenigen Nervenfasern als markhaltig bezeichnet werden, deren Axone mit einer starken Myelinscheide umhüllt sind. Ist diese Myelinscheide sehr dünn, wird die betreffende Nervenfaser als markarm oder marklos bezeichnet (bei ausdifferenzierten Zellen). ⓘ
Pathologie der Nervenzelle
Pigmentablagerungen
In bestimmten Kernen des zentralen Nervensystems werden im Normalzustand Ablagerungen von Pigment innerhalb der Nervenzellen beobachtet. Besonders auffällig ist das Neuromelanin in der Substantia nigra und dem Locus caeruleus, das den Neuronen ein charakteristisches braun-schwarzes Aussehen verleiht und diese Kerngebiete bereits mit bloßem Auge erkennen lässt. Der Anteil des gelblichen Lipofuszin nimmt mit dem Alter zu und wird insbesondere im Nucleus dentatus des Kleinhirns und dem unteren Kern der Olive beobachtet. Bei bestimmten dementiellen Erkrankungen, wie dem Morbus Alzheimer werden charakteristische eosinophile Einschlusskörperchen der Nervenzellen beobachtet. ⓘ
Wirkung von Giften
Nervengifte wirken in der Regel auf die vorhandenen Eiweißstrukturen der Zelle und stören auf diese Weise den Informationsaustausch unter den Neuronen. Es gibt zahlreiche Beispiele für solche Neurotoxine, eins davon ist Diisopropylfluorphosphat (DFP). Gelangt DFP in den Körper, so bindet es dort irreversibel an das Enzym Acetylcholinesterase, welches für den Abbau von Acetylcholin in der Synapse von beispielsweise Motoneuronen verantwortlich ist. Dadurch steigt die Konzentration des Transmitters Acetylcholin im synaptischen Spalt und es kommt zu einer Dauererregung der innervierten Muskelzelle. Die folgende Übererregung kann im betroffenen Organismus zu schweren Krämpfen und bis zum letalen Ausgang (Tod) führen. ⓘ
Tetrodotoxin (TTX, Gift des Kugelfisches) blockiert Natriumkanäle. Tetraethylammonium (TEA) blockiert Kaliumkanäle. ⓘ
- Einige bekannte Gifte sind
| Gift | Vorkommen ⓘ |
|---|---|
| Alkylphosphate | Pflanzengifte, Kampfgase |
| Ameisensäure | Brennnesseln |
| Hyoscyamin | Tollkirschen |
| Botulinumtoxin | verdorbene Lebensmittel |
| Curare | Pflanzengift |
| Nikotin | Pflanzen |
| Muskarin | Pilzgifte |
Beispiele spezialisierter Nervenzelltypen
| Abbildung | Name | Lokalisation ⓘ |
|---|---|---|
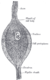 |
Ganglienzellen | Retina |
| Motoneuronen | Rückenmark, Muskeln | |
 |
Pyramidenzellen | Cortex, Hippocampus |
| Körnerzellen | Cortex, Hippocampus, Kleinhirn, Riechkolben | |
 |
Purkinjezelle | Kleinhirn |
| Riechzellen | Epithel der Nasenschleimhaut |