Kleinhirn
| Kleinhirn ⓘ | |
|---|---|
 Zeichnung des menschlichen Gehirns, mit Kleinhirn und Pons | |
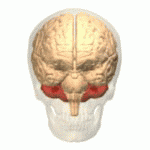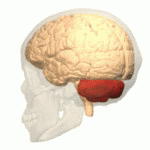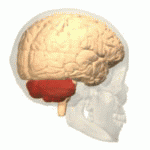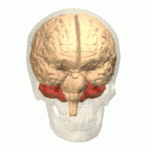 Lage des menschlichen Kleinhirns (in rot) | |
| Einzelheiten | |
| Teil des | Hinterhirn |
| Arterie | SCA, AICA, PICA |
| Ader | superior, inferior |
| Bezeichner | |
| Lateinisch | Kleinhirn |
| Anatomische Begriffe der Neuroanatomie (Bearbeiten auf Wikidata) | |
Das Cerebellum (lateinisch für "kleines Gehirn") ist ein wichtiger Bestandteil des Hinterhirns aller Wirbeltiere. Obwohl es in der Regel kleiner als das Großhirn ist, kann es bei einigen Tieren wie den Mormyridenfischen genauso groß oder sogar größer sein. Beim Menschen spielt das Kleinhirn eine wichtige Rolle bei der motorischen Kontrolle. Es ist möglicherweise auch an einigen kognitiven Funktionen wie Aufmerksamkeit und Sprache sowie an der emotionalen Kontrolle beteiligt, z. B. an der Regulierung von Angst- und Lustreaktionen, aber seine bewegungsbezogenen Funktionen sind am besten belegt. Das menschliche Kleinhirn initiiert keine Bewegungen, trägt aber zu Koordination, Präzision und genauem Timing bei: Es empfängt Eingaben von sensorischen Systemen des Rückenmarks und von anderen Teilen des Gehirns und integriert diese Eingaben zur Feinabstimmung der motorischen Aktivität. Eine Schädigung des Kleinhirns führt beim Menschen zu Störungen der Feinmotorik, des Gleichgewichts, der Körperhaltung und des motorischen Lernens. ⓘ
Anatomisch gesehen sieht das menschliche Kleinhirn wie eine separate Struktur aus, die an der Unterseite des Gehirns unterhalb der Großhirnhemisphären liegt. Seine Rindenoberfläche ist mit fein verteilten, parallelen Rillen bedeckt, die in auffälligem Kontrast zu den breiten, unregelmäßigen Furchen der Großhirnrinde stehen. Diese parallelen Rillen verbergen die Tatsache, dass die Kleinhirnrinde in Wirklichkeit eine durchgehende dünne Gewebeschicht ist, die wie eine Ziehharmonika eng gefaltet ist. Innerhalb dieser dünnen Schicht befinden sich mehrere Arten von Neuronen mit einer sehr regelmäßigen Anordnung, wobei die wichtigsten die Purkinje-Zellen und die Körnerzellen sind. Diese komplexe neuronale Organisation führt zu einer enormen Signalverarbeitungsfähigkeit, aber fast der gesamte Output der Kleinhirnrinde läuft über eine Reihe kleiner tiefer Kerne, die in der weißen Substanz im Inneren des Kleinhirns liegen. ⓘ
Zusätzlich zu seiner direkten Rolle bei der motorischen Kontrolle ist das Kleinhirn für verschiedene Arten des motorischen Lernens notwendig, insbesondere für das Lernen der Anpassung an Veränderungen der sensomotorischen Beziehungen. Es wurden mehrere theoretische Modelle entwickelt, um die sensomotorische Kalibrierung mit Hilfe der synaptischen Plastizität im Kleinhirn zu erklären. Diese Modelle gehen auf die von David Marr und James Albus formulierten Modelle zurück, die auf der Beobachtung beruhen, dass jede Purkinje-Zelle des Kleinhirns zwei völlig unterschiedliche Arten von Input erhält: der eine besteht aus Tausenden von schwachen Inputs von den parallelen Fasern der Körnerzellen, der andere ist ein extrem starker Input von einer einzigen Kletterfaser. Das Grundkonzept der Marr-Albus-Theorie besteht darin, dass die kletternde Faser als "Lehrsignal" dient, das eine lang anhaltende Veränderung der Stärke der parallelen Fasereingänge bewirkt. Beobachtungen von Langzeitdepressionen bei parallelen Fasereingängen haben Theorien dieser Art unterstützt, ihre Gültigkeit bleibt jedoch umstritten. ⓘ
Das Kleinhirn oder Cerebellum ist ein Teil des Gehirns von Wirbeltieren, der gemeinsam mit dem Brücke (Pons) genannten Bereich des Hirnstamms das Hinterhirn (Metencephalon) bildet. Hinterhirn und Markhirn (Myelencephalon oder Verlängertes Mark) bilden zusammen das Rautenhirn (Rhombencephalon). Das Kleinhirn entwickelt sich über der Rautengrube aus der Kleinhirnplatte und ist bei Wirbeltierarten verschieden stark ausgebildet. Es liegt beim Menschen unterhalb der Okzipitallappen des Großhirns in der hinteren Schädelgrube dem Hirnstamm rückenseits auf. ⓘ
Das menschliche Kleinhirn ist dem Volumen nach kleiner als das Großhirn, hat aber eine deutlich höhere Zelldichte. Beim Erwachsenen macht es mit rund 150 g etwa ein Zehntel des durchschnittlichen Hirngewichts aus, doch enthält es mit knapp 70 Milliarden Nervenzellen etwa vier Fünftel, also den Großteil aller zentralnervösen Neuronen. Die Oberfläche der Kleinhirnrinde ist in feine blattförmige Windungen (Folia cerebelli) gefaltet und entspricht etwa 50–75 % der Rindenoberfläche der Großhirnhemispären. ⓘ
Das Kleinhirn erfüllt wichtige Aufgaben bei der Steuerung der Motorik: Es ist zuständig für Koordination, Feinabstimmung, unbewusste Planung und das Erlernen von Bewegungsabläufen. Zudem wird ihm neuerdings eine Schlüsselrolle in der kognitiven Evolution des Menschen zugeschrieben und in absoluter Größe und relativ zur Neokortexgröße nahm es zu. ⓘ
Struktur
Auf der Ebene der groben Anatomie besteht das Kleinhirn aus einer eng gefalteten Kortexschicht mit weißer Substanz darunter und einem flüssigkeitsgefüllten Ventrikel an der Basis. Vier tiefe Kleinhirnkerne sind in die weiße Substanz eingebettet. Jeder Teil des Kortex besteht aus denselben kleinen neuronalen Elementen, die in einer stark stereotypen Geometrie angeordnet sind. Auf einer mittleren Ebene können das Kleinhirn und seine Hilfsstrukturen in mehrere hundert oder tausend unabhängig voneinander funktionierende Module unterteilt werden, die als "Mikrozonen" oder "Mikrokompartimente" bezeichnet werden. ⓘ
Grobe Anatomie
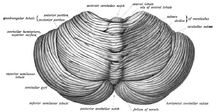
Das Kleinhirn befindet sich in der hinteren Schädelgrube (Fossa cranialis posterior). Vor dem Kleinhirn liegen der vierte Ventrikel, die Pons und die Medulla. Vom darüber liegenden Großhirn ist es durch eine Schicht aus lederartiger Dura mater, dem Tentorium cerebelli, getrennt; alle seine Verbindungen zu anderen Teilen des Gehirns verlaufen durch die Pons. Anatomen klassifizieren das Kleinhirn als Teil des Mittelhirns, zu dem auch die Pons gehört; das Mittelhirn ist der obere Teil des Rhombencephalons oder "Hinterhirns". Wie die Großhirnrinde ist das Kleinhirn in zwei Kleinhirnhemisphären unterteilt; es enthält auch eine schmale Mittellinie (das Vermis). Die Gesamtstruktur wird durch eine Reihe von großen Falten in 10 kleinere "Läppchen" unterteilt. Aufgrund seiner großen Anzahl winziger Körnerzellen enthält das Kleinhirn mehr Neuronen als der Rest des Gehirns, nimmt aber nur 10 % des gesamten Gehirnvolumens ein. Die Anzahl der Neuronen im Kleinhirn ist mit der Anzahl der Neuronen im Neokortex verwandt. Die Anzahl der Neuronen im Kleinhirn ist etwa 3,6-mal so hoch wie im Neokortex, ein Verhältnis, das bei vielen Säugetierarten gleich ist. ⓘ
Das ungewöhnliche Aussehen des Kleinhirns verbirgt die Tatsache, dass der größte Teil seines Volumens aus einer sehr eng gefalteten Schicht grauer Substanz besteht: der Kleinhirnrinde. Jeder Grat oder Gyrus in dieser Schicht wird als Folium bezeichnet. Man schätzt, dass die menschliche Kleinhirnrinde, wenn sie vollständig entfaltet wäre, eine Schicht von Nervengewebe von etwa 1 m Länge und durchschnittlich 5 cm Breite ergeben würde - eine Gesamtoberfläche von etwa 500 cm², verpackt in einem Volumen von 6 cm × 5 cm × 10 cm. Unter der grauen Substanz des Kortex liegt die weiße Substanz, die größtenteils aus myelinisierten Nervenfasern besteht, die zum und vom Kortex verlaufen. Eingebettet in die weiße Substanz - die wegen ihres verzweigten, baumartigen Aussehens im Querschnitt manchmal als Lebensbaum bezeichnet wird - befinden sich vier tiefe Kleinhirnkerne, die aus grauer Substanz bestehen. ⓘ
Drei paarige Kleinhirnstiele verbinden das Kleinhirn mit verschiedenen Teilen des Nervensystems. Es handelt sich dabei um den oberen Kleinhirnstiel, den mittleren Kleinhirnstiel und den unteren Kleinhirnstiel, die nach ihrer Lage zum Wurmfortsatz benannt sind. Der obere Kleinhirnstiel ist hauptsächlich ein Ausgang zur Großhirnrinde und leitet efferente Fasern über Thalamuskerne zu den oberen motorischen Neuronen in der Großhirnrinde. Die Fasern stammen aus den tiefen Kleinhirnkernen. Der mittlere Kleinhirnstiel ist mit dem Pons verbunden und erhält seinen gesamten Input vom Pons, hauptsächlich von den pontinen Kernen. Der Input für den Pons kommt von der Großhirnrinde und wird von den pontinen Kernen über transversale pontine Fasern an das Kleinhirn weitergeleitet. Der mittlere Pedunculus ist der größte der drei und seine afferenten Fasern sind in drei separaten Faszikeln gruppiert, die ihre Eingänge zu verschiedenen Teilen des Kleinhirns führen. Der untere Kleinhirnstiel erhält Input von afferenten Fasern aus den vestibulären Kernen, dem Rückenmark und dem Tegmentum. Der Output des unteren Kleinhirnstiels erfolgt über efferente Fasern zu den vestibulären Kernen und der retikulären Formation. Das gesamte Kleinhirn erhält vom Nucleus olivaris inferior über den Pedunculus cerebellaris inferior einen modulierenden Input. ⓘ
Die pontinen Afferenzen bilden in ihrer Gesamtheit den Pedunculus cerebellaris medius. Als einzige afferente Bahn verläuft der Tractus spinocerebellaris anterior im Pedunculus cerebellaris superior, alle anderen genannten Afferenzen verlaufen im unteren Kleinhirnstiel. ⓘ
Im Tractus vestibulocerebellaris laufen nicht nur sekundäre Fasern, die in den Vestibulariskernen umgeschaltet wurden, sondern auch direkte Fasern aus dem Gleichgewichtsorgan. Neben dem Lobus flocculonodularis enden Teile der Bahn auch im Ncl. fastigii und der Uvula, einem Teil des Wurms. ⓘ
Die Tractus spinocerebellaris anterior und posterior leiten im Wesentlichen nur Informationen aus der unteren Extremität. Für die obere Extremität gibt es zwei analoge Bahnen. Anteile der Hinterstrangbahn, die in einem Teil des Ncl. cuneatus im Hirnstamm verschaltet werden, dem Ncl. cuneatus accessorius, laufen als Tractus cuneocerebellaris zum Kleinhirn und entsprechen der posterioren Kleinhirnseitenstrangbahn. Analog zur anterioren Bahn gibt es ab dem Zervikalmark noch einen Tractus spinocerebellaris superior. Die posteriore Bahn leitet eher die hochaufgelöste Propriozeption, die Information aus der anterioren Bahn kommt eher von größeren rezeptiven Feldern. ⓘ
Propriozeption aus dem Gesichtsbereich verläuft aus den Trigeminuskernen im Hirnstamm als Tractus trigeminocerebellaris zum Kleinhirn. ⓘ
Unterabteilungen

Anhand des Aussehens der Oberfläche lassen sich im Kleinhirn drei Lappen unterscheiden: der vordere Lappen (oberhalb der Primärspalte), der hintere Lappen (unterhalb der Primärspalte) und der flocculonoduläre Lappen (unterhalb der Hinterspalte). Diese Lappen unterteilen das Kleinhirn von rostral nach kaudal (beim Menschen von oben nach unten). In Bezug auf die Funktion gibt es jedoch eine wichtigere Unterscheidung entlang der medial-lateralen Dimension. Lässt man den flocculonodulären Lappen außer Acht, der unterschiedliche Verbindungen und Funktionen hat, kann das Kleinhirn funktionell in einen medialen Sektor, das so genannte Spinocerebellum, und einen größeren lateralen Sektor, das Cerebrocerebellum, unterteilt werden. Ein schmaler Streifen vorspringenden Gewebes entlang der Mittellinie wird als Kleinhirnwurm bezeichnet (Vermis ist das lateinische Wort für "Wurm"). ⓘ
Die kleinste Region, der Flocculonodulare Lappen, wird oft als Vestibulocerebellum bezeichnet. Er ist der evolutionsgeschichtlich älteste Teil (Archicerebellum) und ist vor allem am Gleichgewicht und an der räumlichen Orientierung beteiligt; seine primären Verbindungen bestehen zu den vestibulären Kernen, obwohl er auch visuelle und andere sensorische Signale empfängt. Eine Schädigung dieser Region führt zu Störungen des Gleichgewichts und des Gangbildes. ⓘ
Die mediale Zone des vorderen und hinteren Lappens bildet das Spinocerebellum, das auch als Paläocerebellum bezeichnet wird. Dieser Teil des Kleinhirns hat vor allem die Aufgabe, die Bewegungen des Körpers und der Gliedmaßen fein abzustimmen. Er erhält propriozeptiven Input von den dorsalen Säulen des Rückenmarks (einschließlich des spinozerebellären Trakts) und vom Nervus trigeminus cranialis sowie von visuellen und auditiven Systemen. Es sendet Fasern zu den tiefen Kleinhirnkernen, die ihrerseits sowohl zur Großhirnrinde als auch zum Hirnstamm projizieren und so die absteigenden motorischen Systeme modulieren. ⓘ
Die laterale Zone, die beim Menschen bei weitem den größten Teil ausmacht, bildet das Kleinhirn, auch Neozerebellum genannt. Es erhält seinen Input ausschließlich von der Großhirnrinde (insbesondere vom Parietallappen) über die pontinen Kerne (die kortikoponto-zerebelläre Bahnen bilden) und sendet seinen Output hauptsächlich an den ventrolateralen Thalamus (der wiederum mit den motorischen Arealen des prämotorischen Kortex und dem primären motorischen Areal der Großhirnrinde verbunden ist) und an den Nucleus red. Es besteht Uneinigkeit darüber, wie die Funktionen des lateralen Kleinhirns am besten zu beschreiben sind: Man nimmt an, dass es an der Planung einer bevorstehenden Bewegung, an der Auswertung von sensorischen Informationen für eine Handlung und an einer Reihe rein kognitiver Funktionen beteiligt ist, wie z. B. der Bestimmung des Verbs, das am besten zu einem bestimmten Substantiv passt (wie in "sitzen" für "Stuhl"). ⓘ
Mikroanatomie
Zwei Arten von Neuronen spielen im Kleinhirnschaltkreis eine wichtige Rolle: Purkinje-Zellen und Körnerzellen. Drei Arten von Axonen spielen ebenfalls eine wichtige Rolle: Moosfasern und Kletterfasern (die von außen in das Kleinhirn eindringen) und Parallelfasern (die Axone der Körnerzellen). Es gibt zwei Hauptwege durch den Kleinhirnkreislauf, die von Moosfasern und Kletterfasern ausgehen und beide schließlich in den tiefen Kleinhirnkernen enden. ⓘ
Moosfasern projizieren direkt zu den tiefen Kernen, führen aber auch zu folgendem Weg: Moosfasern → Körnerzellen → Parallelfasern → Purkinje-Zellen → tiefe Kerne. Kletterfasern projizieren zu Purkinje-Zellen und senden auch Kollateralen direkt zu den tiefen Kernen. Die Eingänge der Moosfasern und der Kletterfasern tragen jeweils faserspezifische Informationen; das Kleinhirn empfängt auch dopaminerge, serotonerge, noradrenerge und cholinerge Eingänge, die vermutlich eine globale Modulation bewirken. ⓘ
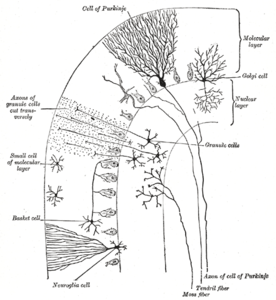
Die Kleinhirnrinde ist in drei Schichten unterteilt. Unten liegt die dicke Körnerschicht, die dicht mit Körnerzellen und Interneuronen, hauptsächlich Golgi-Zellen, aber auch Lugaro-Zellen und unipolaren Bürstenzellen, besetzt ist. In der Mitte liegt die Purkinje-Schicht, eine schmale Zone, die die Zellkörper der Purkinje-Zellen und Bergmann-Gliazellen enthält. Ganz oben liegt die Molekularschicht, die die abgeflachten Dendritenbäume der Purkinje-Zellen und die riesige Anordnung paralleler Fasern enthält, die die Dendritenbäume der Purkinje-Zellen in rechten Winkeln durchdringen. In dieser äußersten Schicht der Kleinhirnrinde befinden sich auch zwei Arten von hemmenden Interneuronen: stellate Zellen und Korbzellen. Sowohl Stellat- als auch Korbzellen bilden GABA-erge Synapsen an Dendriten von Purkinje-Zellen.
- (-): Hemmende Verbindung
- MF: Moosfaser
- DCN: Tiefe Kleinhirnkerne
- IO: Inferiore Olive
- CF: Kletternde Faser
- CFC: Kletternde Faser Kollateral
- GC: Körnerzelle
- PF: Parallele Faser
- PC: Purkinje-Zelle
- GgC: Golgi-Zelle
- SC: Stellat-Zelle
- BC: Korbzelle
Trotz der vielen verschiedenen Zelltypen ist das Verschaltungsprinzip der Kleinhirnrinde relativ einfach. Die Aufgabe des Kleinhirns ist vor allem eine Feinabstimmung der Motorik, sprich eine Hemmung überschwänglicher „Grobmotorik“. Die Informationen über den Bewegungsplan werden der Kleinhirnrinde über die Kletterfasern und Moosfasern zugeleitet (die nebenbei Kollateralen an die Kleinhirnkerne abgeben). Die „Ergebnisse“ der Kleinhirnarbeit werden über die Projektionen der Kleinhirnkerne aus dem Kleinhirn herausgeleitet. ⓘ
Der grobe Bewegungsplan wird durch die erregenden Kletter- und Moosfasern (hier indirekt über die Glomerula cerebellaria und die Körnerzellen) zur Purkinjezelle gebracht, deren Aufgabe nun die Hemmung überschwänglicher Motorik ist. Das Ergebnis ist eine absolute Hemmung, sprich keine Motorik. Aufgrund dessen wird nun die Purkinjezelle wiederum selektiv von den Golgizellen, Korbzellen und Sternzellen gehemmt, so dass nun eine feinmotorische Bewegung zu den Kleinhirnkernen und damit aus dem Kleinhirn herausgeschickt wird. Sprich, die Purkinjezelle wird von außerhalb erregt und hemmt die Kleinhirnkerne, wobei sie selber auch selektiv gehemmt wird, damit überhaupt Bewegung stattfindet. ⓘ
Neben den geschilderten klassischen Verschaltungen der Rinde finden sich auch monoaminerge Afferenzen aus der Formatio reticularis, insbesondere mit dem Transmitter Serotonin aus den Raphe-Kernen und mit dem Transmitter Noradrenalin aus dem Locus caeruleus. Sie scheinen eher modulatorische Aufgaben zu besitzen. ⓘ
Molekulare Schicht
Die oberste, äußerste Schicht der Kleinhirnrinde ist die Molekularschicht. Diese Schicht enthält die abgeflachten Dendritenbäume der Purkinje-Zellen und die riesige Anordnung paralleler Fasern aus der Granularschicht, die die Dendritenbäume der Purkinje-Zellen im rechten Winkel durchdringen. Die Molekularschicht enthält auch zwei Arten von hemmenden Interneuronen: Stellatazellen und Korbzellen. Sowohl Stellat- als auch Korbzellen bilden GABA-erge Synapsen an den Dendriten der Purkinje-Zellen. ⓘ
Purkinje-Schicht

Purkinje-Zellen gehören zu den markantesten Neuronen des Gehirns und zu den frühesten Typen, die erkannt wurden - sie wurden erstmals 1837 von dem tschechischen Anatomen Jan Evangelista Purkyně beschrieben. Sie zeichnen sich durch die Form ihres Dendritenbaums aus: Die Dendriten verzweigen sich sehr stark, sind aber in einer Ebene senkrecht zu den Kleinhirnfalten stark abgeflacht. So bilden die Dendriten einer Purkinje-Zelle ein dichtes, flächiges Netz, durch das parallele Fasern im rechten Winkel verlaufen. Die Dendriten sind mit dendritischen Stacheln bedeckt, von denen jeder einen synaptischen Input von einer parallelen Faser erhält. Purkinje-Zellen erhalten mehr synaptische Eingänge als jeder andere Zelltyp im Gehirn - Schätzungen der Anzahl der Stacheln auf einer einzigen menschlichen Purkinje-Zelle gehen bis zu 200.000. Die großen, kugelförmigen Zellkörper der Purkinje-Zellen sind in einer schmalen Schicht (eine Zelle dick) der Kleinhirnrinde, der so genannten Purkinje-Schicht, zusammengefasst. Nachdem sie Kollateralen ausgesendet haben, die nahegelegene Teile der Hirnrinde beeinflussen, wandern ihre Axone in die tiefen Kleinhirnkerne, wo sie in einer Größenordnung von jeweils 1.000 Kontakten mit verschiedenen Arten von Kernzellen stehen, die alle in einem kleinen Bereich liegen. Purkinje-Zellen verwenden GABA als Neurotransmitter und üben daher eine hemmende Wirkung auf ihre Ziele aus. ⓘ
Purkinje-Zellen bilden das Herzstück des zerebellären Schaltkreises, und aufgrund ihrer Größe und ihrer ausgeprägten Aktivitätsmuster ist es relativ einfach, ihre Reaktionsmuster bei verhaltensauffälligen Tieren mit extrazellulären Aufzeichnungstechniken zu untersuchen. Purkinje-Zellen senden normalerweise auch ohne synaptischen Input Aktionspotenziale mit hoher Rate aus. Bei wachen, sich verhaltenden Tieren sind mittlere Raten von etwa 40 Hz typisch. Die Spike-Trains zeigen eine Mischung aus so genannten einfachen und komplexen Spikes. Ein einfacher Spike ist ein einzelnes Aktionspotenzial, dem eine Refraktärzeit von etwa 10 ms folgt; ein komplexer Spike ist eine stereotype Abfolge von Aktionspotenzialen mit sehr kurzen Intervallen zwischen den Spikes und abnehmender Amplitude. Physiologische Studien haben gezeigt, dass komplexe Spikes (die bei einer Grundfrequenz von etwa 1 Hz und nie mit einer Frequenz von mehr als 10 Hz auftreten) zuverlässig mit einer kletternden Faseraktivierung verbunden sind, während einfache Spikes durch eine Kombination aus Grundaktivität und parallelem Fasereingang erzeugt werden. Auf komplexe Spikes folgt oft eine Pause von mehreren hundert Millisekunden, in der die Aktivität einfacher Spikes unterdrückt wird. ⓘ
Ein spezifisches, erkennbares Merkmal der Purkinje-Neuronen ist die Expression von Calbindin. Die Calbindin-Färbung des Rattenhirns nach einseitiger chronischer Ischiasnerv-Verletzung deutet darauf hin, dass Purkinje-Neuronen im erwachsenen Gehirn neu gebildet werden und die Organisation neuer Kleinhirnläppchen einleiten können. ⓘ

Granuläre Schicht

Kleinhirn-Körnerzellen gehören im Gegensatz zu Purkinje-Zellen zu den kleinsten Neuronen des Gehirns. Sie sind auch die zahlreichsten Neuronen des Gehirns: Beim Menschen wird ihre Gesamtzahl auf etwa 50 Milliarden geschätzt, was bedeutet, dass etwa 3/4 der Neuronen des Gehirns Kleinhirn-Körnerzellen sind. Ihre Zellkörper sind in einer dicken Schicht an der Unterseite der Kleinhirnrinde angeordnet. Eine Körnerzelle besitzt nur vier bis fünf Dendriten, die jeweils in einer Erweiterung enden, die als dendritische Kralle bezeichnet wird. Diese Erweiterungen sind Orte des erregenden Inputs von Moosfasern und des hemmenden Inputs von Golgi-Zellen. ⓘ
Die dünnen, unmyelinisierten Axone der Körnerzellen steigen vertikal zur oberen (molekularen) Schicht des Kortex auf, wo sie sich in zwei Zweige aufspalten, wobei jeder Zweig horizontal verläuft und eine parallele Faser bildet; durch die Aufspaltung des vertikalen Zweigs in zwei horizontale Äste entsteht die charakteristische "T"-Form. Eine menschliche Parallelfaser verläuft von der Spaltung aus durchschnittlich 3 mm in jede Richtung, was einer Gesamtlänge von etwa 6 mm entspricht (etwa 1/10 der Gesamtbreite der Kortikalisschicht). Während ihres Verlaufs durchqueren die parallelen Fasern die dendritischen Bäume der Purkinje-Zellen, wobei sie mit einer von 3-5 Zellen in Kontakt treten und insgesamt 80-100 synaptische Verbindungen mit den dendritischen Stacheln der Purkinje-Zellen herstellen. Die Körnerzellen verwenden Glutamat als Neurotransmitter und üben daher erregende Wirkungen auf ihre Ziele aus. ⓘ

Die Körnerzellen erhalten ihren gesamten Input von den Moosfasern, sind aber (beim Menschen) 200 zu 1 in der Überzahl. Die Informationen im Aktivitätszustand der Körnerzellenpopulation sind also die gleichen wie die Informationen in den Mossy-Fasern, aber in einer viel umfassenderen Weise umkodiert. Da die Körnerzellen so klein und dicht gepackt sind, ist es schwierig, ihre Spike-Aktivität bei verhaltensfähigen Tieren aufzuzeichnen, so dass nur wenige Daten als Grundlage für Theorien zur Verfügung stehen. Das populärste Konzept ihrer Funktion wurde 1969 von David Marr vorgeschlagen, der vermutete, dass sie Kombinationen von Moosfasereingängen kodieren könnten. Da jede Körnerzelle nur von 4-5 Moosfasern Input erhält, würde eine Körnerzelle nicht reagieren, wenn nur ein einziger ihrer Inputs aktiv wäre, aber sie würde reagieren, wenn mehr als einer aktiv wäre. Dieses kombinatorische Kodierungsschema würde es dem Kleinhirn potenziell ermöglichen, viel feinere Unterscheidungen zwischen Eingangsmustern zu treffen, als es die Moosfasern allein erlauben würden. ⓘ
Moosige Fasern
Die Moosfasern treten von ihren Ursprungsorten in die Körnerschicht ein. Viele stammen aus den pontinen Kernen, andere aus dem Rückenmark, den vestibulären Kernen usw. Im menschlichen Kleinhirn wird die Gesamtzahl der Mossy-Fasern auf 200 Millionen geschätzt. Diese Fasern bilden erregende Synapsen mit den Körnerzellen und den Zellen der tiefen Kleinhirnkerne. Innerhalb der Körnerschicht bildet eine Moosfaser eine Reihe von Vergrößerungen, die Rosetten genannt werden. Die Kontakte zwischen den Moosfasern und den Dendriten der Körnerzellen finden in Strukturen statt, die Glomeruli genannt werden. Jeder Glomerulus hat in seinem Zentrum eine Moosfaserrosette und bis zu 20 dendritische Krallen von Körnerzellen, die mit ihr in Kontakt stehen. Terminale von Golgi-Zellen infiltrieren die Struktur und bilden hemmende Synapsen an den Dendriten der Körnerzellen. Das gesamte Gebilde ist von einer Hülle aus Gliazellen umgeben. Jede Moosfaser sendet kollaterale Verzweigungen zu mehreren Kleinhirnfolien, die insgesamt 20-30 Rosetten bilden; eine einzige Moosfaser steht also mit schätzungsweise 400-600 Körnerzellen in Kontakt. ⓘ
Kletternde Fasern
Purkinje-Zellen erhalten über Kletterfasern auch Input aus dem Nucleus olivaris inferior auf der kontralateralen Seite des Hirnstamms. Obwohl der Nucleus olivaris inferior in der Medulla oblongata liegt und Input aus dem Rückenmark, dem Hirnstamm und der Großhirnrinde erhält, geht sein Output ausschließlich an das Kleinhirn. Eine kletternde Faser gibt Kollateralen zu den tiefen Kleinhirnkernen ab, bevor sie in die Kleinhirnrinde eintritt, wo sie sich in etwa 10 Endäste aufspaltet, von denen jeder eine einzelne Purkinje-Zelle versorgt. In auffälligem Kontrast zu den über 100.000 Eingängen von parallelen Fasern erhält jede Purkinje-Zelle einen Eingang von genau einer kletternden Faser; aber diese einzelne Faser "klettert" die Dendriten der Purkinje-Zelle hinauf, windet sich um sie herum und bildet dabei insgesamt bis zu 300 Synapsen. Der Netzeingang ist so stark, dass ein einzelnes Aktionspotenzial einer Kletterfaser in der Lage ist, einen ausgedehnten komplexen Spike in der Purkinje-Zelle zu erzeugen: einen Ausbruch von mehreren Spikes in einer Reihe mit abnehmender Amplitude, gefolgt von einer Pause, in der die Aktivität unterdrückt wird. Die Synapsen der kletternden Fasern bedecken den Zellkörper und die proximalen Dendriten; in diesem Bereich gibt es keine parallelen Fasereingänge. ⓘ
Kletterfasern feuern mit geringer Rate, aber ein einzelnes Kletterfaser-Aktionspotenzial löst in einer Ziel-Purkinje-Zelle einen Ausbruch mehrerer Aktionspotenziale aus (ein komplexer Spike). Der Kontrast zwischen parallelen und kletternden Fasereingängen zu Purkinje-Zellen (über 100.000 des einen Typs gegenüber genau einem des anderen) ist vielleicht das provokanteste Merkmal der Kleinhirnanatomie und hat einen Großteil der Theoriebildung motiviert. Tatsächlich ist die Funktion der Kletterfasern das umstrittenste Thema im Kleinhirn. Es gibt zwei Denkschulen: Die eine folgt Marr und Albus in der Annahme, dass der Input der Kletterfasern in erster Linie als Lehrsignal dient, die andere vertritt die Ansicht, dass seine Funktion darin besteht, den Output des Kleinhirns direkt zu beeinflussen. Beide Ansichten wurden in zahlreichen Veröffentlichungen ausführlich verteidigt. In einem Bericht heißt es: "Beim Versuch, die verschiedenen Hypothesen über die Funktion der Kletterfasern zusammenzufassen, hat man das Gefühl, eine Zeichnung von Escher zu betrachten. Jede Sichtweise scheint eine bestimmte Sammlung von Befunden zu erklären, aber wenn man versucht, die verschiedenen Ansichten zusammenzufügen, ergibt sich kein kohärentes Bild davon, was die Kletterfasern tun. Für die meisten Forscher signalisieren die kletternden Fasern Fehler in der motorischen Leistung, entweder auf die übliche Weise der Modulation der Entladungsfrequenz oder als einmalige Ankündigung eines "unerwarteten Ereignisses". Für andere Forscher liegt die Botschaft im Grad der Synchronität und Rhythmik einer Population von Kletterfasern." ⓘ
Tiefe Kerne

Die tiefen Kerne des Kleinhirns sind Ansammlungen von grauer Substanz, die innerhalb der weißen Substanz im Kern des Kleinhirns liegen. Mit Ausnahme der nahe gelegenen vestibulären Kerne sind sie die einzige Quelle für den Output des Kleinhirns. Diese Kerne erhalten kollaterale Projektionen von Moosfasern und Kletterfasern sowie einen hemmenden Input von den Purkinje-Zellen der Kleinhirnrinde. Die vier Kerne (dentate, globose, emboliform und fastigial) kommunizieren jeweils mit verschiedenen Teilen des Gehirns und der Kleinhirnrinde. (Der globöse und der emboliforme Kern werden auch als im interponierten Kern vereint bezeichnet). Der Nucleus fastigialis und der Nucleus interposus gehören zum Spinocerebellum. Der Nucleus dentatus, der bei Säugetieren viel größer ist als die anderen Kerne, ist als dünne, gewundene Schicht der grauen Substanz ausgebildet und kommuniziert ausschließlich mit den seitlichen Teilen der Kleinhirnrinde. Der Flocculus des flocculonodulären Lappens ist der einzige Teil der Kleinhirnrinde, der nicht in den tiefen Kern projiziert, sondern in die vestibulären Kerne mündet. ⓘ
Die meisten Neuronen in den tiefen Kernen haben große Zellkörper und kugelförmige Dendritenbäume mit einem Radius von etwa 400 μm und verwenden Glutamat als Neurotransmitter. Diese Zellen projizieren zu einer Vielzahl von Zielen außerhalb des Kleinhirns. Mit ihnen vermischt ist eine geringere Anzahl kleiner Zellen, die GABA als Neurotransmitter verwenden und ausschließlich in den Nucleus olivaris inferior projizieren, der Quelle der Kletterfasern. Die Projektion vom Nucleus olivaris liefert also eine hemmende Rückkopplung, die der erregenden Projektion der Kletterfasern zu den Kernen entspricht. Es gibt Hinweise darauf, dass jede kleine Gruppe von Kernzellen auf dieselbe Gruppe von Olivarzellen projiziert, die Kletterfasern zu ihr senden; es gibt eine starke und übereinstimmende Topographie in beide Richtungen. ⓘ
Wenn ein Purkinje-Zell-Axon in einen der tiefen Kerne eintritt, verzweigt es sich, um sowohl mit großen als auch mit kleinen Kernzellen in Kontakt zu treten, aber die Gesamtzahl der kontaktierten Zellen beträgt nur etwa 35 (bei Katzen). Umgekehrt erhält eine einzelne tiefe Kernzelle Input von etwa 860 Purkinje-Zellen (wiederum bei Katzen). ⓘ
Kompartimente

Aus der Sicht der groben Anatomie erscheint die Kleinhirnrinde als eine homogene Gewebeschicht, und aus der Sicht der Mikroanatomie scheinen alle Teile dieser Schicht die gleiche innere Struktur zu haben. Es gibt jedoch eine Reihe von Aspekten, in denen die Struktur des Kleinhirns kompartimentiert ist. Es gibt große Kompartimente, die allgemein als Zonen bezeichnet werden; diese können in kleinere Kompartimente unterteilt werden, die als Mikrozonen bezeichnet werden. ⓘ
Die ersten Hinweise auf eine kompartimentäre Struktur ergaben sich aus Untersuchungen der rezeptiven Felder von Zellen in verschiedenen Teilen der Kleinhirnrinde. Jeder Körperteil ist bestimmten Punkten im Kleinhirn zugeordnet, aber es gibt zahlreiche Wiederholungen der Grundkarte, die eine Anordnung bilden, die als "gebrochene Somatotopie" bezeichnet wurde. Ein deutlicherer Hinweis auf die Kompartimentierung ergibt sich aus der Immunfärbung des Kleinhirns für bestimmte Arten von Proteinen. Die bekanntesten dieser Marker werden "Zebrine" genannt, weil ihre Anfärbung ein komplexes Muster ergibt, das an die Streifen eines Zebras erinnert. Die von Zebrinen und anderen Kompartimentierungsmarkern erzeugten Streifen sind senkrecht zu den Kleinhirnfalten ausgerichtet, d. h. sie sind in mediolateraler Richtung schmal, in Längsrichtung jedoch viel breiter. Unterschiedliche Marker erzeugen unterschiedliche Streifensätze, deren Breite und Länge je nach Standort variieren, aber sie haben alle die gleiche allgemeine Form. ⓘ
Oscarsson schlug in den späten 1970er Jahren vor, dass diese kortikalen Zonen in kleinere Einheiten, so genannte Mikrozonen, unterteilt werden können. Eine Mikrozone ist definiert als eine Gruppe von Purkinje-Zellen, die alle das gleiche somatotopische rezeptive Feld haben. Es wurde festgestellt, dass Mikrozonen jeweils etwa 1000 Purkinje-Zellen enthalten, die in einem langen, schmalen Streifen angeordnet sind, der senkrecht zu den Rindenfalten verläuft. Wie das nebenstehende Diagramm zeigt, sind die Dendriten der Purkinje-Zellen in der gleichen Richtung abgeflacht, in der sich die Mikrozonen erstrecken, während parallele Fasern sie im rechten Winkel kreuzen. ⓘ
Die Mikrozonenstruktur wird nicht nur durch die rezeptiven Felder bestimmt: Der Input der Kletterfaser aus dem Nucleus olivaris inferior ist ebenso wichtig. Die Äste einer Kletterfaser (in der Regel etwa 10) aktivieren in der Regel Purkinje-Zellen, die zur selben Mikrozone gehören. Darüber hinaus neigen oliväre Neuronen, die Kletterfasern in dieselbe Mikrozone senden, dazu, durch Gap Junctions gekoppelt zu sein, die ihre Aktivität synchronisieren, was dazu führt, dass Purkinje-Zellen innerhalb einer Mikrozone korrelierte komplexe Spike-Aktivität auf einer Zeitskala von Millisekunden zeigen. Außerdem senden die Purkinje-Zellen, die zu einer Mikrozone gehören, ihre Axone alle zu demselben kleinen Cluster von Ausgangszellen in den tiefen Kleinhirnkernen. Schließlich sind die Axone der Korbzellen in Längsrichtung viel länger als in mediolateraler Richtung, so dass sie sich weitgehend auf eine einzige Mikrozone beschränken. All diese Strukturen haben zur Folge, dass die zellulären Interaktionen innerhalb einer Mikrozone viel stärker sind als die Interaktionen zwischen verschiedenen Mikrozonen. ⓘ
Im Jahr 2005 fassten Richard Apps und Martin Garwicz Beweise dafür zusammen, dass die Mikrozonen selbst Teil einer größeren Einheit sind, die sie als multizonalen Mikrokomplex bezeichnen. Ein solcher Mikrokomplex umfasst mehrere räumlich getrennte kortikale Mikrozonen, die alle auf dieselbe Gruppe tiefer Kleinhirnneuronen projizieren, sowie eine Gruppe gekoppelter olivärer Neuronen, die auf alle einbezogenen Mikrozonen sowie auf den tiefen Kernbereich projizieren. ⓘ
Blutversorgung
Die Durchblutung des Cerebellums erfolgt über drei paarig angelegte Arterien, diese sind von dorsal nach frontal die Arteria cerebelli posterior inferior (PICA), die Arteria cerebelli anterior inferior (AICA) sowie die Arteria cerebelli superior (SCA). Die Arteria cerebelli posterior inferior entspringt dabei als einzige der drei aus der Arteria vertebralis, sie ist nebenbei deren größter Abgang. Die Arteria cerebelli anterior inferior und die Arteria cerebelli superior sind dagegen Abgänge der Arteria basilaris. Diese etwa 3 bis 3,5 cm lange Arterie entsteht auf dem Clivus der Schädelbasis aus dem Zusammenschluss der rechten und linken Arteria vertebralis, etwa im Übergangsbereich zwischen Medulla oblongata und Pons. ⓘ
Jede Arterie steuert dabei zunächst einen bestimmten Teil des Cerebellums an: So kommt die SCA auf der superioren Oberfläche an, die PICA posterior-inferior und frontal von dieser, also anterior-inferior, die AICA. Alle Lagebezeichnungen beziehen sich auf das Cerebellum an sich, der kaudale Teil wird also von zwei Arterien angesteuert, der kraniale von einer. Die Äste der drei Arterien anastomosieren schließlich in der Pia mater und stellen so die Blutversorgung des Cerebellums sicher. ⓘ
Das Kleinhirn wird von drei paarigen Hauptarterien mit Blut versorgt: der Arteria cerebellaris superior (SCA), der Arteria cerebellaris anterior inferior (AICA) und der Arteria cerebellaris posterior inferior (PICA). Die SCA versorgt die obere Region des Kleinhirns. Sie teilt sich an der Oberseite und verzweigt sich in die Pia mater, wo die Äste mit denen der vorderen und hinteren Kleinhirnarterie anastomosieren. Die AICA versorgt den vorderen Teil der Unterfläche des Kleinhirns. Die PICA erreicht die Unterfläche, wo sie sich in einen medialen und einen lateralen Ast aufteilt. Der mediale Ast verläuft nach hinten zur Kleinhirnkerbe zwischen den beiden Hemisphären des Kleinhirns, während der laterale Ast die Unterseite des Kleinhirns bis zu seinem seitlichen Rand versorgt, wo er mit der AICA und der SCA anastomosiert. ⓘ
Funktion
Die deutlichsten Hinweise auf die Funktion des Kleinhirns ergeben sich aus der Untersuchung der Folgen einer Schädigung des Kleinhirns. Tiere und Menschen mit Kleinhirnfunktionsstörungen zeigen vor allem Probleme bei der motorischen Kontrolle auf derselben Körperseite wie der geschädigte Teil des Kleinhirns. Sie sind zwar weiterhin in der Lage, motorische Aktivitäten auszuführen, verlieren aber an Präzision und produzieren unregelmäßige, unkoordinierte oder falsch getimte Bewegungen. Ein Standardtest für die Funktion des Kleinhirns besteht darin, mit der Fingerspitze nach einem Ziel in Armlänge zu greifen: Eine gesunde Person bewegt die Fingerspitze in einer schnellen, geraden Bahn, während eine Person mit Kleinhirnschädigung langsam und unregelmäßig mit vielen Kurskorrekturen in der Mitte greift. Defizite bei nicht-motorischen Funktionen sind schwieriger zu erkennen. Die allgemeine Schlussfolgerung, die vor Jahrzehnten gezogen wurde, lautet daher, dass die grundlegende Funktion des Kleinhirns darin besteht, die detaillierte Form einer Bewegung zu kalibrieren, und nicht darin, Bewegungen zu initiieren oder zu entscheiden, welche Bewegungen ausgeführt werden sollen. ⓘ
Vor den 1990er Jahren wurde die Funktion des Kleinhirns fast durchgängig als rein motorisch angesehen, aber neuere Erkenntnisse haben diese Ansicht in Frage gestellt. Funktionelle Bildgebungsstudien haben gezeigt, dass die Aktivierung des Kleinhirns mit Sprache, Aufmerksamkeit und mentalen Bildern zusammenhängt; Korrelationsstudien haben Wechselwirkungen zwischen dem Kleinhirn und nicht-motorischen Bereichen der Großhirnrinde aufgezeigt; und eine Vielzahl nicht-motorischer Symptome wurde bei Menschen mit Schädigungen festgestellt, die auf das Kleinhirn beschränkt zu sein scheinen. Insbesondere das kognitiv-affektive Kleinhirnsyndrom oder Schmahmann-Syndrom ist bei Erwachsenen und Kindern beschrieben worden. Schätzungen auf der Grundlage einer funktionellen Kartierung des Kleinhirns mit Hilfe der funktionellen MRT deuten darauf hin, dass mehr als die Hälfte der Kleinhirnrinde mit Assoziationszonen der Großhirnrinde verbunden ist. ⓘ
Kenji Doya hat argumentiert, dass die Funktion des Kleinhirns am besten nicht anhand der Verhaltensweisen, die es beeinflusst, sondern anhand der neuronalen Berechnungen, die es durchführt, verstanden werden kann; das Kleinhirn besteht aus einer großen Anzahl von mehr oder weniger unabhängigen Modulen, die alle die gleiche geometrisch regelmäßige interne Struktur aufweisen und daher, so die Annahme, alle die gleichen Berechnungen durchführen. Wenn die Eingangs- und Ausgangsverbindungen eines Moduls mit motorischen Bereichen verbunden sind (was bei vielen der Fall ist), dann ist das Modul an motorischem Verhalten beteiligt; wenn die Verbindungen jedoch mit Bereichen bestehen, die an nicht-motorischer Kognition beteiligt sind, dann zeigt das Modul andere Arten von Verhaltenskorrelaten. So ist das Kleinhirn an der Regulierung vieler verschiedener funktioneller Eigenschaften wie Zuneigung, Emotion und Verhalten beteiligt. Doya schlägt vor, das Kleinhirn am besten als prädiktive Handlungsauswahl zu verstehen, die auf "internen Modellen" der Umwelt oder einem Gerät für überwachtes Lernen basiert, im Gegensatz zu den Basalganglien, die Verstärkungslernen durchführen, und der Großhirnrinde, die unüberwachtes Lernen durchführt. Drei Jahrzehnte Hirnforschung haben zu dem Vorschlag geführt, dass das Kleinhirn optimierte mentale Modelle erzeugt und eng mit der Großhirnrinde interagiert, wo aktualisierte interne Modelle als kreative Intuition ("a ha") im Arbeitsgedächtnis erlebt werden. ⓘ
Grundsätze
Die vergleichsweise einfache und regelmäßige Anatomie des Kleinhirns ließ schon früh die Hoffnung aufkommen, dass sie eine ähnlich einfache Rechenfunktion implizieren könnte, wie sie in einem der ersten Bücher über Elektrophysiologie des Kleinhirns, The Cerebellum as a Neuronal Machine von John C. Eccles, Masao Ito und János Szentágothai, zum Ausdruck kam. Obwohl ein vollständiges Verständnis der Funktion des Kleinhirns schwer zu erreichen ist, wurden mindestens vier Prinzipien als wichtig erkannt: (1) Feedforward-Verarbeitung, (2) Divergenz und Konvergenz, (3) Modularität und (4) Plastizität. ⓘ
- Feedforward-Verarbeitung: Das Kleinhirn unterscheidet sich von den meisten anderen Teilen des Gehirns (insbesondere von der Großhirnrinde) dadurch, dass die Signalverarbeitung fast ausschließlich feedforward ist, d. h., die Signale bewegen sich in einer Richtung durch das System, vom Eingang zum Ausgang, mit sehr wenig rekurrenter interner Übertragung. Der geringe Anteil an rekurrenter Übertragung besteht aus gegenseitiger Hemmung; es gibt keine wechselseitig erregenden Schaltkreise. Dieser Feedforward-Betriebsmodus bedeutet, dass das Kleinhirn, im Gegensatz zur Großhirnrinde, keine selbsterhaltenden Muster neuronaler Aktivität erzeugen kann. Die Signale treten in den Schaltkreis ein, werden von jeder Stufe in sequenzieller Reihenfolge verarbeitet und verlassen ihn dann wieder. Eccles, Ito und Szentágothai schrieben: "Diese Eliminierung jeglicher Möglichkeit von nachhallenden Ketten neuronaler Erregung ist zweifellos ein großer Vorteil für die Leistung des Kleinhirns als Computer, denn was der Rest des Nervensystems vom Kleinhirn benötigt, ist vermutlich keine Ausgabe, die den Betrieb komplexer nachhallender Schaltkreise im Kleinhirn zum Ausdruck bringt, sondern vielmehr eine schnelle und klare Antwort auf die Eingabe eines bestimmten Satzes von Informationen."
- Divergenz und Konvergenz: Im menschlichen Kleinhirn wird die Information von 200 Millionen Moosfasereingängen auf 40 Milliarden Körnerzellen erweitert, deren parallele Faserausgänge dann auf 15 Millionen Purkinje-Zellen konvergieren. Aufgrund der Art und Weise, wie sie in Längsrichtung aufgereiht sind, können die etwa 1000 Purkinje-Zellen, die zu einer Mikrozone gehören, Inputs von bis zu 100 Millionen parallelen Fasern erhalten und ihren eigenen Output auf eine Gruppe von weniger als 50 tiefen Kernzellen konzentrieren. Das Kleinhirnnetzwerk empfängt also eine bescheidene Anzahl von Inputs, verarbeitet diese sehr umfangreich durch sein streng strukturiertes internes Netzwerk und sendet die Ergebnisse über eine sehr begrenzte Anzahl von Ausgangszellen aus.
- Modularität: Das Kleinhirnsystem ist funktionell in mehr oder weniger unabhängige Module unterteilt, deren Zahl wahrscheinlich in die Hunderte oder Tausende geht. Alle Module haben eine ähnliche interne Struktur, aber unterschiedliche Ein- und Ausgänge. Ein Modul (ein multizonales Mikrokompartiment in der Terminologie von Apps und Garwicz) besteht aus einem kleinen Cluster von Neuronen im Nucleus olivaris inferior, einem Satz langer schmaler Streifen von Purkinje-Zellen in der Kleinhirnrinde (Mikrozonen) und einem kleinen Cluster von Neuronen in einem der tiefen Kleinhirnkerne. Die verschiedenen Module teilen sich den Input von Moosfasern und parallelen Fasern, aber in anderer Hinsicht scheinen sie unabhängig voneinander zu funktionieren - der Output eines Moduls scheint die Aktivität der anderen Module nicht wesentlich zu beeinflussen.
- Plastizität: Sowohl die Synapsen zwischen parallelen Fasern und Purkinje-Zellen als auch die Synapsen zwischen Moosfasern und tiefen Kernzellen sind anfällig für eine Veränderung ihrer Stärke. In einem einzigen Kleinhirnmodul konvergiert der Input von bis zu einer Milliarde paralleler Fasern auf eine Gruppe von weniger als 50 tiefen Kernzellen, und der Einfluss jeder parallelen Faser auf diese Kernzellen ist einstellbar. Diese Anordnung ermöglicht eine enorme Flexibilität bei der Feinabstimmung der Beziehung zwischen den Eingängen und Ausgängen des Kleinhirns. ⓘ
Lernen
Es gibt zahlreiche Hinweise darauf, dass das Kleinhirn bei einigen Arten des motorischen Lernens eine wesentliche Rolle spielt. Die Aufgaben, bei denen das Kleinhirn am deutlichsten ins Spiel kommt, sind solche, bei denen eine Feinabstimmung der Art und Weise, wie eine Handlung ausgeführt wird, erforderlich ist. Es ist jedoch sehr umstritten, ob das Lernen im Kleinhirn selbst stattfindet oder ob es lediglich dazu dient, Signale zu liefern, die das Lernen in anderen Gehirnstrukturen fördern. Die meisten Theorien, die das Lernen den Schaltkreisen des Kleinhirns zuordnen, leiten sich von den Ideen von David Marr und James Albus ab, die postulierten, dass kletternde Fasern ein Lernsignal liefern, das synaptische Veränderungen in parallelen Faser-Purkinje-Zell-Synapsen hervorruft. Marr ging davon aus, dass der Input von Kletterfasern dazu führt, dass synchron aktivierte parallele Fasereingänge verstärkt werden. Die meisten späteren Kleinhirn-Lernmodelle folgten jedoch Albus in der Annahme, dass die Aktivität der kletternden Fasern ein Fehlersignal ist und dazu führt, dass synchron aktivierte parallele Fasereingänge geschwächt werden. Einige dieser späteren Modelle, wie z. B. das Adaptive Filter-Modell von Fujita, versuchten, die Funktion des Kleinhirns mit Hilfe der Theorie der optimalen Steuerung zu verstehen. ⓘ
Die Idee, dass die Aktivität der kletternden Fasern als Fehlersignal fungiert, wurde in vielen experimentellen Studien untersucht, wobei einige diese Annahme stützten, andere sie jedoch in Frage stellten. In einer bahnbrechenden Studie von Gilbert und Thach aus dem Jahr 1977 zeigten Purkinje-Zellen von Affen, die eine Greifaufgabe erlernten, eine erhöhte Aktivität komplexer Spikes - die bekanntermaßen zuverlässig die Aktivität des Kletterfaser-Eingangs der Zelle anzeigt - während der Perioden, in denen die Leistung schlecht war. In mehreren Studien zum motorischen Lernen bei Katzen wurde komplexe Spike-Aktivität beobachtet, wenn eine beabsichtigte Bewegung nicht mit der tatsächlich ausgeführten Bewegung übereinstimmte. Studien über den vestibulo-okularen Reflex (der das visuelle Bild auf der Netzhaut stabilisiert, wenn der Kopf gedreht wird) ergaben, dass die Aktivität der Kletterfasern auf einen "Netzhautschlupf" hinweist, wenn auch nicht auf eine sehr einfache Weise. ⓘ
Eine der am ausführlichsten untersuchten Lernaufgaben des Kleinhirns ist das Augenblinzel-Konditionierungsparadigma, bei dem ein neutraler konditionierter Reiz (CS) wie ein Ton oder ein Licht wiederholt mit einem unkonditionierten Reiz (US) wie einem Luftstoß gepaart wird, der eine Blinzelreaktion auslöst. Nach solchen wiederholten Darbietungen von CS und US löst der CS schließlich ein Blinzeln vor dem US aus, eine konditionierte Reaktion oder CR. Experimente haben gezeigt, dass Läsionen, die entweder an einem spezifischen Teil des interposierten Kerns (einem der tiefen Kleinhirnkerne) oder an einigen spezifischen Punkten in der Kleinhirnrinde lokalisiert sind, das Erlernen einer bedingten Blinzelreaktion aufheben. Werden die kleinhirnspezifischen Ausgänge pharmakologisch inaktiviert, während die Eingänge und intrazellulären Schaltkreise intakt bleiben, findet das Lernen auch dann statt, wenn das Tier keine Reaktion zeigt, während bei einer Unterbrechung der intrazerebellären Schaltkreise kein Lernen stattfindet. ⓘ
Theorien und Berechnungsmodelle

Das umfangreiche Wissen über die anatomische Struktur und die Verhaltensfunktionen des Kleinhirns hat es zu einem fruchtbaren Boden für Theorien gemacht - es gibt vielleicht mehr Theorien über die Funktion des Kleinhirns als über jeden anderen Teil des Gehirns. Die grundlegendste Unterscheidung ist die zwischen "Lerntheorien" und "Leistungstheorien", d. h. Theorien, die die synaptische Plastizität im Kleinhirn nutzen, um seine Rolle beim Lernen zu erklären, und Theorien, die Aspekte des laufenden Verhaltens auf der Grundlage der Signalverarbeitung im Kleinhirn erklären. Mehrere Theorien beider Arten wurden als mathematische Modelle formuliert und mit Hilfe von Computern simuliert. ⓘ
Die vielleicht früheste "Leistungstheorie" war die Hypothese der "Verzögerungslinie" von Valentino Braitenberg. Die ursprüngliche Theorie von Braitenberg und Roger Atwood aus dem Jahr 1958 besagt, dass die langsame Ausbreitung von Signalen entlang paralleler Fasern zu vorhersehbaren Verzögerungen führt, die es dem Kleinhirn ermöglichen, zeitliche Beziehungen innerhalb eines bestimmten Fensters zu erkennen. Die experimentellen Daten stützten die ursprüngliche Form der Theorie nicht, aber Braitenberg setzte sich weiterhin für modifizierte Versionen ein. Die Hypothese, dass das Kleinhirn im Wesentlichen als Zeitmesssystem funktioniert, wurde auch von Richard Ivry vertreten. Eine weitere einflussreiche "Leistungstheorie" ist die Tensornetz-Theorie von Pellionisz und Llinás, die eine fortgeschrittene mathematische Formulierung der Idee lieferte, dass die grundlegende vom Kleinhirn durchgeführte Berechnung darin besteht, sensorische in motorische Koordinaten umzuwandeln. ⓘ
Die Theorien in der Kategorie "Lernen" gehen fast alle auf die Veröffentlichungen von Marr und Albus zurück. Marr schlug 1969 vor, dass das Kleinhirn ein Gerät ist, das lernt, elementare Bewegungen, die von Kletterfasern kodiert werden, mit Moosfasereingängen zu assoziieren, die den sensorischen Kontext kodieren. Albus schlug 1971 vor, dass eine Purkinje-Zelle im Kleinhirn als Perzeptron fungiert, ein neuronal inspiriertes abstraktes Lernsystem. Der grundlegendste Unterschied zwischen den Theorien von Marr und Albus besteht darin, dass Marr davon ausging, dass die Aktivität der kletternden Fasern zu einer Verstärkung der Synapsen der parallelen Fasern führen würde, während Albus vorschlug, dass sie geschwächt würden. Albus formulierte seine Version auch als Software-Algorithmus, den er CMAC (Cerebellar Model Articulation Controller) nannte und der in einer Reihe von Anwendungen getestet worden ist. ⓘ
Motorik
Vestibulocerebellum
Dieser Kleinhirnteil erhält aus dem Gleichgewichtsorgan Informationen über Körperlage und -bewegung. Diese nutzt er zum einen zur Steuerung der Halte- und Stützmotorik. Zum anderen ist er verantwortlich für die Feinabstimmung fast aller Augenbewegungen, die von den verschiedenen okulomotorischen Zentren im Hirnstamm generiert werden. ⓘ
Spinocerebellum
Das Spinocerebellum empfängt die Afferenzen aus dem Rückenmark, die Informationen über die Stellung von Gelenken und Muskeln geben. Außerdem erhält es kontinuierliche Rückmeldung über die zum Rückenmark und damit in die Peripherie gesendeten Bewegungssignale. Es gliedert sich nach den Efferenzen in zwei funktionell unterschiedliche Zonen. Der Vermis selbst, der in den Nucleus fastigii projiziert, ist vor allem für Stand-, Gang- und Stützmotorik verantwortlich. Die angrenzenden Hemisphärenanteile (intermediäre Zone, Projektion in Nucleus globosus und Nucleus emboliformis) sind entscheidend beteiligt an der Zielmotorik und der Bewegungsdurchführung. Diese Anteile sorgen dafür, dass eine Bewegung wie geplant abläuft, ihr Ziel exakt trifft, und sie sorgen für einen Abgleich von Efferenzen und Afferenzen, also dafür, dass die gesendeten Kommandos der tatsächlichen augenblicklichen Lage der Extremitäten entsprechen und ständig fein an die neue Lage angepasst werden. Hierunter fällt auch die für das Sprechen notwendige außerordentlich feine Abstimmung der beteiligten mimischen und Kehlkopfmuskulatur. ⓘ
Pontocerebellum
Das Pontocerebellum (auch Cerebrocerebellum) ist funktionell mit dem Großhirnkortex verbunden. Es empfängt Signale aus vielen Bereichen, vor allem den prämotorischen Zentren im Frontallappen (prämotorischer Cortex und supplementärmotorischer Cortex). Dort entstehen Bewegungsentwürfe, die Planung einer Bewegung. Diese eher groben Entwürfe werden zu den lateralen Kleinhirnhemisphären gesendet, wo sie weiter entwickelt, fein abgestimmt, moduliert, korrigiert, mit aus Vorerfahrungen gewonnenen internen Modellen abgeglichen werden und die geplante Aktivität der beteiligten Muskeln koordiniert wird. Hierbei hilft auch der Rückkopplungskreis über den Nucleus ruber und die Olive zurück zum Kleinhirn. Die Ergebnisse dieser Berechnungen gehen zum Thalamus, wo sie (mit den Ergebnissen des anderen großen subkortikalen motorischen Zentrums, der Basalganglien) integriert und zum motorischen Cortex weitergeleitet werden. ⓘ
Lernvorgänge
Das Kleinhirn spielt eine Schlüsselrolle beim impliziten Lernen und damit für das prozedurale Gedächtnis. Das bedeutet, dass gut trainierte, automatisierte Bewegungsabläufe ohne ein Nachdenken abrufbar sind, da ihre Wiederholung zu anhaltenden Veränderungen synaptischer Effizienzmuster im Kleinhirn geführt hat. Beispiele dafür sind die Koordination der Gesichtsmuskulatur beim Sprechen und die Bewegung der Finger beim Schreiben oder Spielen von Musikinstrumenten, aber auch die Koordination des gesamten Körpers wie beim Skifahren oder Tanzen. ⓘ
Das Kleinhirn ist darüber hinaus ein Ort assoziativen Lernens. Das am besten untersuchte Beispiel hierfür ist die Konditionierung des Lidschlussreflexes, welcher z. B. beim Einsetzen von Kontaktlinsen eine Rolle spielt. ⓘ
Klinische Bedeutung
Schädigungen des Kleinhirns führen häufig zu motorischen Symptomen, deren Ausprägung davon abhängt, welcher Teil des Kleinhirns betroffen ist und wie er geschädigt wurde. Eine Schädigung des flocculonodulären Lappens kann sich durch einen Verlust des Gleichgewichts und insbesondere durch einen veränderten, unregelmäßigen Gang mit einem weiten Stand aufgrund von Gleichgewichtsschwierigkeiten äußern. Eine Schädigung der lateralen Zone verursacht typischerweise Probleme bei geschickten willkürlichen und geplanten Bewegungen, die zu Fehlern bei Kraft, Richtung, Geschwindigkeit und Amplitude der Bewegungen führen können. Weitere Erscheinungsformen sind Hypotonie (verminderter Muskeltonus), Dysarthrie (Probleme bei der Sprachartikulation), Dysmetrie (Probleme bei der Beurteilung von Entfernungen oder Bewegungsbereichen), Dysdiadochokinese (Unfähigkeit, schnelle Wechselbewegungen wie z. B. Gehen auszuführen), gestörter Kontrollreflex oder Rebound-Phänomen und Intentionstremor (unwillkürliche Bewegung, die durch abwechselnde Kontraktionen entgegengesetzter Muskelgruppen verursacht wird). Eine Schädigung des Mittellinienbereichs kann die Bewegungen des ganzen Körpers beeinträchtigen, während eine Schädigung, die weiter seitlich lokalisiert ist, eher die feinen Bewegungen der Hände oder Gliedmaßen beeinträchtigt. Eine Schädigung des oberen Teils des Kleinhirns führt in der Regel zu Gangstörungen und anderen Problemen mit der Beinkoordination; eine Schädigung des unteren Teils führt eher zu unkoordinierten oder schlecht ausgerichteten Bewegungen der Arme und Hände sowie zu Schwierigkeiten mit der Geschwindigkeit. Dieser Komplex von motorischen Symptomen wird als Ataxie bezeichnet. ⓘ
Zur Feststellung von Kleinhirnproblemen umfasst die neurologische Untersuchung die Beurteilung des Gangs (ein breitbeiniger Gang ist ein Hinweis auf eine Ataxie), Fingerzeigentests und die Beurteilung der Körperhaltung. Bei Hinweisen auf eine Kleinhirnfunktionsstörung kann eine Magnetresonanztomographie durchgeführt werden, um ein detailliertes Bild der eventuell vorhandenen strukturellen Veränderungen zu erhalten. ⓘ
Die Liste der medizinischen Probleme, die zu einer Schädigung des Kleinhirns führen können, ist lang. Dazu gehören Schlaganfall, Blutungen, Hirnschwellung (Hirnödem), Tumore, Alkoholismus, physische Traumata wie Schusswunden oder Sprengstoffe und chronische degenerative Erkrankungen wie die olivopontozerebelläre Atrophie. Einige Formen des Migränekopfschmerzes können ebenfalls zu einer vorübergehenden Funktionsstörung des Kleinhirns führen, die unterschiedlich stark ausgeprägt sein kann. Infektionen können bei Prionenerkrankungen und dem Miller-Fisher-Syndrom, einer Variante des Guillain-Barré-Syndroms, zu Schädigungen des Kleinhirns führen. ⓘ
Bei einer Schädigung oder Funktionsstörung des Kleinhirns können je nach Lage und Ausdehnung des betroffenen Areals eine Reihe von charakteristischen Symptomen auftreten. Die allgemeinste Bezeichnung und Oberbegriff für die meisten Kleinhirnsymptome ist die Ataxie. ⓘ
Im Einzelnen können vorliegen:
- bei Läsionen des Vestibulocerebellums
- durch Störung der Koordination der Augenbewegung ein Nystagmus
- durch mangelnde Stützmotorik eine Rumpfataxie, die Unfähigkeit, die für das Stehen und Sitzen nötigen unbewussten Korrekturbewegungen der Rumpfmuskulatur ausreichend durchzuführen;
- bei Läsion der medianen (vermalen) Zone des Spinocerebellums
- eine Stand- und Gangataxie, ein unsicherer, wankender Stand und Gang wie beim Betrunkenen. ⓘ
- Bei Läsion der intermediären oder paravermalen Zone des Spinocerebellums steht die mangelnde Kontrolle und Koordination der Bewegungsdurchführung im Vordergrund, was sich durch eine Reihe von Symptomen äußert:
- Störungen der Zielmotorik: bei Hypermetrie über das Ziel hinausschießende bzw. bei Dysmetrie am Ziel vorbei treffende Bewegungen, z. B. beim Versuch, mit dem Finger die Nase zu treffen.
- Eng damit verbunden ist das Auftreten eines Intentionstremors, also eines Zitterns, das umso stärker wird, je näher die Hand dem Ziel kommt. Es wird durch nicht koordinierte und somit überschießende Korrekturbewegungen verursacht.
- Die Unfähigkeit, schnell nacheinander und abwechselnd antagonistische Bewegungen durchzuführen, bezeichnet man als Dysdiadochokinese. Das klassische Beispiel ist der Versuch, die Handfläche schnell auswärts und einwärts zu drehen.
- Schließlich verursacht die fehlende Feinabstimmung der komplexen, zum Sprechen nötigen Motorik ein als Dysarthrie bezeichnetes Krankheitsbild, das sich durch eine undeutliche, verwaschene, manchmal unverständliche Sprache auszeichnet. Hier ist aber nur die Sprechmotorik gestört, nicht die höheren sprachverstehenden und -formenden Zentren des Gehirns. Charcot beschreibt die typische cerebelläre Sprache als „skandierend“. ⓘ
- Die Läsion des Pontocerebellums betrifft die Bewegungsplanung.
- Es kann zu einer Asynergie kommen, bei der der Einsatz der einzelnen Muskeln nicht aufeinander abgestimmt und somit nicht synergistisch ist. Als Kompensation dieses Defizits kann es zur Dekomposition eines Bewegungsablaufs in Einzelbewegungen kommen, so dass zum Beispiel erst das Schultergelenk in die richtige Lage gebracht, dann der Arm gestreckt und erst dann die Hand bewegt wird, statt das parallel in einem fließenden Ablauf durchzuführen. ⓘ
Die Rhombencephalosynapsis ist eine seltene Fehlbildung, bei der die beiden Kleinhirnhemisphären verschmolzen sind und der Wurm unterentwickelt ist. ⓘ
Alterung
Das menschliche Kleinhirn verändert sich mit dem Alter. Diese Veränderungen können sich von denen in anderen Teilen des Gehirns unterscheiden. Nach einem epigenetischen Biomarker für das Gewebealter, der so genannten epigenetischen Uhr, ist das Kleinhirn bei Hundertjährigen die jüngste Hirnregion (und der jüngste Körperteil): Es ist etwa 15 Jahre jünger als bei Hundertjährigen erwartet. Außerdem zeigen die Genexpressionsmuster im menschlichen Kleinhirn weniger altersbedingte Veränderungen als in der Großhirnrinde. In einigen Studien wurde über eine Verringerung der Zellzahl oder des Gewebevolumens berichtet, aber die Menge der Daten zu dieser Frage ist nicht sehr groß. ⓘ
Entwicklungs- und degenerative Störungen

Angeborene Fehlbildungen, Erbkrankheiten und erworbene Erkrankungen können die Kleinhirnstruktur und folglich auch die Kleinhirnfunktion beeinträchtigen. Sofern die ursächliche Erkrankung nicht reversibel ist, besteht die einzige mögliche Behandlung darin, den Betroffenen zu helfen, mit ihren Problemen zu leben. Die Visualisierung des fetalen Kleinhirns mittels Ultraschalluntersuchung in der 18. bis 20. Schwangerschaftswoche kann mit einer Sensitivität von bis zu 99 % zum Screening auf fetale Neuralrohrdefekte verwendet werden. ⓘ
In der normalen Entwicklung stimuliert die endogene Sonic-Hedgehog-Signalgebung die schnelle Proliferation von Kleinhirn-Körnerzellen-Vorläuferzellen (CGNPs) in der äußeren Körnerschicht (EGL). Die Entwicklung des Kleinhirns erfolgt während der späten Embryogenese und der frühen postnatalen Periode, wobei die Proliferation der CGNPs in der EGL während der frühen Entwicklung (postnataler Tag 7 bei der Maus) ihren Höhepunkt erreicht. Wenn sich die CGNPs schließlich zu Kleinhirn-Körnerzellen (auch Kleinhirn-Körnerneuronen, CGNs genannt) differenzieren, wandern sie in die innere Körnerschicht (IGL) und bilden das reife Kleinhirn (bei der Maus bis zum 20. postnatalen Tag). Mutationen, die die Sonic-Hedgehog-Signalübertragung abnormal aktivieren, prädisponieren für Kleinhirnkrebs (Medulloblastom) bei Menschen mit Gorlin-Syndrom und in gentechnisch veränderten Mausmodellen. ⓘ
Eine angeborene Fehlbildung oder Unterentwicklung (Hypoplasie) des Kleinhirns ist ein Merkmal sowohl des Dandy-Walker-Syndroms als auch des Joubert-Syndroms. In sehr seltenen Fällen kann auch das gesamte Kleinhirn fehlen. Die neurologischen Erbkrankheiten Machado-Joseph-Krankheit, Ataxia telangiectasia und Friedreich-Ataxie verursachen eine fortschreitende Neurodegeneration, die mit einem Verlust des Kleinhirns einhergeht. Angeborene Hirnfehlbildungen außerhalb des Kleinhirns können ihrerseits zu einer Herniation von Kleinhirngewebe führen, wie dies bei einigen Formen der Arnold-Chiari-Malformation der Fall ist. ⓘ
Weitere Erkrankungen, die eng mit der Kleinhirndegeneration verbunden sind, sind die idiopathischen progressiven neurologischen Erkrankungen Multiple Systematrophie und Ramsay-Hunt-Syndrom Typ I sowie die Autoimmunerkrankung Paraneoplastische Kleinhirndegeneration, bei der Tumore an anderer Stelle im Körper eine Autoimmunreaktion auslösen, die zum Verlust von Nervenzellen im Kleinhirn führt. Eine Kleinhirnatrophie kann die Folge eines akuten Mangels an Vitamin B1 (Thiamin) sein, wie er bei der Beriberi und dem Wernicke-Korsakoff-Syndrom auftritt, oder eines Mangels an Vitamin E. ⓘ
Eine zerebelläre Atrophie wurde bei vielen anderen neurologischen Erkrankungen beobachtet, darunter die Huntington-Krankheit, Multiple Sklerose, essentieller Tremor, progressive Myoklonus-Epilepsie und die Niemann-Pick-Krankheit. Eine zerebelläre Atrophie kann auch als Folge der Exposition gegenüber Toxinen, einschließlich Schwermetallen, pharmazeutischen oder Freizeitdrogen auftreten. ⓘ
Schmerz
Es besteht ein allgemeiner Konsens darüber, dass das Kleinhirn an der Schmerzverarbeitung beteiligt ist. Das Kleinhirn erhält über die pontinen Kerne und die inferioren Oliven sowohl von den absteigenden kortiko-zerebellären Bahnen als auch von den aufsteigenden spino-zerebellären Bahnen Schmerzinformationen. Ein Teil dieser Informationen wird an das motorische System weitergeleitet und führt zu einer bewussten motorischen Schmerzvermeidung, die je nach Schmerzintensität abgestuft wird. ⓘ
Man geht davon aus, dass diese direkten und indirekten Schmerzeingänge ein langfristiges Schmerzvermeidungsverhalten auslösen, das zu chronischen Haltungsänderungen und folglich zu einer funktionellen und anatomischen Umgestaltung der vestibulären und propriozeptiven Kerne führt. Infolgedessen können chronische neuropathische Schmerzen eine makroskopische anatomische Umgestaltung des Hinterhirns, einschließlich des Kleinhirns, hervorrufen. Das Ausmaß dieses Umbaus und die Induktion von Neuronenvorläufer-Markern lassen auf einen Beitrag der adulten Neurogenese zu diesen Veränderungen schließen. ⓘ
Vergleichende Anatomie und Evolution
Die Schaltkreise im Kleinhirn sind in allen Wirbeltierklassen, einschließlich Fischen, Reptilien, Vögeln und Säugetieren, ähnlich. Eine analoge Gehirnstruktur gibt es auch bei Kopffüßern mit gut entwickelten Gehirnen, wie z. B. bei Kraken. Dies wurde als Beweis dafür genommen, dass das Kleinhirn wichtige Funktionen für alle Tierarten mit einem Gehirn erfüllt. ⓘ
Größe und Form des Kleinhirns sind bei den verschiedenen Wirbeltierarten sehr unterschiedlich. Bei Amphibien ist es wenig entwickelt, und bei Neunaugen und Schleimaalen ist das Kleinhirn kaum vom Hirnstamm zu unterscheiden. Obwohl das Kleinhirn bei diesen Gruppen vorhanden ist, handelt es sich bei den primären Strukturen um kleine, paarige Kerne, die dem Vestibulozerebellum entsprechen. Das Kleinhirn ist bei Reptilien etwas größer, bei Vögeln erheblich größer und bei Säugetieren noch größer. Die großen paarigen und gewundenen Lappen, die man beim Menschen findet, sind typisch für Säugetiere, aber bei anderen Gruppen besteht das Kleinhirn im Allgemeinen aus einem einzigen Mittellappen, der entweder glatt oder nur leicht gerillt ist. Bei Säugetieren ist das Neozerebellum der größte Teil des Kleinhirns, bei anderen Wirbeltieren ist es typischerweise das Spinozerebellum. ⓘ
Das Kleinhirn von Knorpel- und Knochenfischen ist außerordentlich groß und komplex. In mindestens einem wichtigen Punkt unterscheidet es sich in seiner inneren Struktur vom Kleinhirn der Säugetiere: Das Kleinhirn der Fische enthält keine diskreten tiefen Kleinhirnkerne. Stattdessen sind die primären Ziele der Purkinje-Zellen ein bestimmter Zelltyp, der über die Kleinhirnrinde verteilt ist und bei Säugetieren nicht vorkommt. Bei Mormyriden (einer Familie schwach elektrosensibler Süßwasserfische) ist das Kleinhirn wesentlich größer als der Rest des Gehirns. Der größte Teil des Kleinhirns ist eine spezielle Struktur, die Valvula, die eine ungewöhnlich regelmäßige Architektur aufweist und einen Großteil ihres Inputs aus dem elektrosensorischen System erhält. ⓘ
Das Kennzeichen des Kleinhirns von Säugetieren ist eine Ausdehnung der Seitenlappen, die hauptsächlich mit dem Neokortex interagieren. Als sich die Affen zu den Menschenaffen entwickelten, setzte sich die Ausdehnung der Seitenlappen fort, parallel zur Ausdehnung der Frontallappen des Neokortex. Bei den frühen Hominiden und beim Homo sapiens bis zum mittleren Pleistozän setzte sich die Ausdehnung des Kleinhirns fort, aber die Frontallappen expandierten schneller. Die jüngste Periode der menschlichen Evolution könnte jedoch tatsächlich mit einer Zunahme der relativen Größe des Kleinhirns verbunden gewesen sein, da der Neokortex seine Größe etwas reduzierte, während das Kleinhirn expandierte. Da sowohl die Entwicklung als auch die Ausführung motorischer Aufgaben, visuell-räumlicher Fähigkeiten und das Lernen im Kleinhirn stattfinden, geht man davon aus, dass das Wachstum des Kleinhirns in irgendeiner Form mit größeren kognitiven Fähigkeiten des Menschen zusammenhängt. Die seitlichen Hemisphären des Kleinhirns sind heute sowohl beim Menschen als auch beim Affen 2,7 Mal größer als beim Affen. Diese Veränderungen in der Größe des Kleinhirns lassen sich nicht durch eine größere Muskelmasse erklären. Sie zeigen, dass entweder die Entwicklung des Kleinhirns eng mit der des restlichen Gehirns verbunden ist oder dass neuronale Aktivitäten im Kleinhirn während der Evolution der Hominiden wichtig waren. Da das Kleinhirn eine wichtige Rolle bei kognitiven Funktionen spielt, könnte die Vergrößerung des Kleinhirns eine Rolle bei der kognitiven Entwicklung gespielt haben. ⓘ
Kleinhirnähnliche Strukturen
Die meisten Wirbeltierarten haben ein Kleinhirn und eine oder mehrere Kleinhirn-ähnliche Strukturen, also Gehirnbereiche, die dem Kleinhirn in Bezug auf Zytoarchitektur und Neurochemie ähneln. Die einzige kleinhirnähnliche Struktur, die bei Säugetieren zu finden ist, ist der dorsale Cochlea-Kern (DCN), einer der beiden primären sensorischen Kerne, die den Input direkt vom Hörnerv erhalten. Der DCN ist schichtförmig aufgebaut, wobei die unterste Schicht Körnerzellen enthält, die denen des Kleinhirns ähneln und parallele Fasern hervorbringen, die zur oberflächlichen Schicht aufsteigen und diese horizontal durchziehen. Die oberflächliche Schicht enthält eine Reihe von GABA-ergen Neuronen, die so genannten Cartwheel-Zellen, die anatomisch und chemisch den Purkinje-Zellen ähneln - sie erhalten Input von parallelen Fasern, haben aber keine Inputs, die Kletterfasern ähneln. Die Ausgangsneuronen des DCN sind Pyramidenzellen. Sie sind glutamaterg, ähneln aber auch in mancher Hinsicht den Purkinje-Zellen - sie haben stachelige, abgeflachte oberflächliche Dendritenbäume, die den Input von parallelen Fasern erhalten, aber sie haben auch basale Dendriten, die den Input von Hörnervenfasern erhalten, die im rechten Winkel zu den parallelen Fasern durch den DCN verlaufen. Der DCN ist bei Nagetieren und anderen Kleintieren am stärksten entwickelt, während er bei Primaten deutlich reduziert ist. Seine Funktion ist nicht genau bekannt; die gängigsten Spekulationen gehen davon aus, dass er auf die eine oder andere Weise mit dem räumlichen Hören zusammenhängt. ⓘ
Die meisten Fisch- und Amphibienarten verfügen über ein Seitenliniensystem, das Druckwellen im Wasser wahrnimmt. Einer der Hirnbereiche, der den primären Input des Seitenlinienorgans empfängt, der mediale oktavolaterale Nukleus, hat eine zerebellumähnliche Struktur mit Körnerzellen und parallelen Fasern. Bei elektrosensiblen Fischen geht der Input des elektrosensorischen Systems zum dorsalen oktavolateralen Kern, der ebenfalls eine kleinhirnähnliche Struktur aufweist. Bei Fischen mit Rochenflossen (der bei weitem größten Gruppe) besitzt der Sehnerv eine Schicht - die Randschicht -, die dem Kleinhirn ähnelt. ⓘ
Alle diese kleinhirnähnlichen Strukturen scheinen in erster Linie sensorisch und nicht motorisch orientiert zu sein. Alle haben Körnerzellen, aus denen parallele Fasern hervorgehen, die sich mit Purkinje-ähnlichen Neuronen mit veränderbaren Synapsen verbinden, aber keine hat Kletterfasern, die mit denen des Kleinhirns vergleichbar sind - stattdessen erhalten sie direkten Input von peripheren Sinnesorganen. Keine der Fasern hat eine nachgewiesene Funktion, aber die einflussreichste Spekulation ist, dass sie dazu dienen, sensorische Eingaben auf irgendeine raffinierte Weise umzuwandeln, vielleicht um Veränderungen der Körperhaltung zu kompensieren. Tatsächlich haben James M. Bower und andere teils auf der Grundlage dieser Strukturen, teils auf der Grundlage von Kleinhirnstudien argumentiert, dass das Kleinhirn selbst im Grunde eine sensorische Struktur ist und dass es zur motorischen Kontrolle beiträgt, indem es den Körper in einer Weise bewegt, die die resultierenden sensorischen Signale steuert. Entgegen Bowers Ansicht gibt es auch deutliche Hinweise darauf, dass das Kleinhirn die motorische Leistung bei Säugetieren direkt beeinflusst. ⓘ
Geschichte
Beschreibungen
Schon die frühesten Anatomen konnten das Kleinhirn an seinem charakteristischen Aussehen erkennen. Aristoteles und Herophilus (zitiert bei Galen) bezeichneten es als παρεγκεφαλίς (Parenkephalis), im Gegensatz zum ἐγκέφαλος (Enkephalos) oder eigentlichen Gehirn. Galens ausführliche Beschreibung ist die früheste, die erhalten geblieben ist. Er vermutete, dass das Kleinhirn die Quelle der motorischen Nerven ist. ⓘ
Weitere bedeutende Entwicklungen erfolgten erst in der Renaissance. Vesalius erörterte das Kleinhirn kurz, und die Anatomie wurde 1664 von Thomas Willis gründlicher beschrieben. Im 18. Jahrhundert wurden weitere anatomische Arbeiten durchgeführt, aber erst zu Beginn des 19. Jahrhunderts wurden die ersten Erkenntnisse über die Funktion des Kleinhirns gewonnen. Luigi Rolando stellte 1809 fest, dass eine Schädigung des Kleinhirns zu motorischen Störungen führt. Jean Pierre Flourens führte in der ersten Hälfte des 19. Jahrhunderts detaillierte experimentelle Arbeiten durch, aus denen hervorging, dass sich Tiere mit einer Kleinhirnschädigung zwar noch bewegen können, jedoch mit einem Verlust an Koordination (seltsame Bewegungen, ungeschickter Gang und Muskelschwäche), und dass die Erholung nach der Läsion nahezu vollständig sein kann, sofern die Läsion nicht sehr umfangreich ist. Zu Beginn des 20. Jahrhunderts war weitgehend anerkannt, dass die primäre Funktion des Kleinhirns in der motorischen Kontrolle besteht; in der ersten Hälfte des 20. Jahrhunderts wurden mehrere detaillierte Beschreibungen der klinischen Symptome im Zusammenhang mit Kleinhirnkrankheiten beim Menschen erstellt. ⓘ
Etymologie
Der Name Kleinhirn ist eine Verkleinerungsform von Cerebrum (Gehirn); er kann wörtlich mit kleines Gehirn übersetzt werden. Der lateinische Name ist eine direkte Übersetzung des altgriechischen παρεγκεφαλίς (parenkephalis), das in den Werken von Aristoteles, dem ersten bekannten Autor, der die Struktur beschrieb, verwendet wurde. In der englischsprachigen Literatur wird kein anderer Name verwendet, aber in der Vergangenheit wurde eine Vielzahl von griechischen oder lateinischen Namen verwendet, darunter cerebrum parvum, encephalion, encranion, cerebrum posterius und parencephalis. ⓘ
Aufbau
Gliazellen in der Rinde
Neben den im gesamten ZNS verbreiteten Oligodendrozyten, Astrozyten und Mikroglia finden sich in der Kleinhirnrinde zusätzlich drei spezielle Gliazelltypen:
- Flügelastrozyten haben Flügel- oder Schaufel-förmige Fortsätze, mit denen sie die Glomerula cerebellaria umgeben.
- Die Bergmann-Glia liegt zwischen den Purkinjezellen im Stratum purkinjense. In der Entwicklung des Kleinhirns dienen diese Zellen den auf- und abwandernden Neuronen als Leitstruktur. Im erwachsenen Kleinhirn bilden sie die Membrana gliae limitans superficialis.
- Die gefiederten Glia von Fañanas, die im Stratum moleculare sowie Stratum purkinjense liegen und sich histologisch nur mit einer speziellen Gold-Färbung darstellen lassen. Man unterscheidet dabei nach der Zahl der Ausläufer 3 Typen: Fañanas-Zellen mit einem, mit zwei und mit mehreren Ausläufern. ⓘ
Bahnen
Eingänge und Ausgänge des Kleinhirns sind eng mit den jeweiligen Funktionen verwoben, die weiter unter besprochen werden. ⓘ
Efferenzen
Alle Efferenzen gehen von den Kleinhirnkernen aus (mit Ausnahmen einiger direkter Bahnen vom Lobus flocculonodularis zu den Vestibulariskernen). Das Kleinhirn sendet zu vier Hirnregionen Fasern aus:
- Thalamus
- Nucleus ruber
- Formatio reticularis
- Vestibulariskerne, die Hirnstammzentren des Gleichgewichtsorgans. ⓘ
Alle vier Bahnen haben Bedeutung für die Steuerung der Motorik: Die drei letztgenannten Hirngebiete senden eigene Bahnen zum Rückenmark. Zudem läuft über den Nucleus ruber die oben erwähnte Rückkopplungsschleife zur Olive und zurück zum Kleinhirn. ⓘ
Grundsätzlich werden alle zum Cortex des Großhirns laufenden Bahnen im Thalamus umgeschaltet, auch die des Kleinhirns. Der Thalamus dient hier als Integrationszentrum für Impulse auch aus anderen motorischen Zentren (Basalganglien, Cortex selbst) und leitet die integrierten Impulse zu motorischen Cortexarealen, vor allem zum primär-motorischen Cortex weiter. Es konnte aber gezeigt werden, dass die Kleinhirnefferenzen nicht auf motorische Cortexareale beschränkt sind. ⓘ
Gliederung

Nach verschiedenen Kriterien lässt sich das Kleinhirn in jeweils drei bis vier Abschnitte einteilen. Am naheliegendsten ist die Einteilung nach anatomischen Abschnitten. Die funktionell bedeutendste und gebräuchlichste Unterscheidung ist aber die nach den Afferenzen, bei der das Kleinhirn nach der Herkunft der zuführenden Bahnen in drei Bereiche eingeteilt wird:
- Das Vestibulocerebellum, anatomisch der Lobus flocculonodularis, ist mit den Vestibulariskernen, den Hirnstammzentren des Gleichgewichtsorgans, verbunden;
- das Spinocerebellum, anatomisch der Wurm und angrenzende Bereiche, empfängt u. a. Informationen über Körperstellung aus dem Rückenmark;
- das Pontocerebellum, anatomisch den seitlichen Hemisphären entsprechend, empfängt die Fasern, die über die Brücke (Pons) aus dem Großhirn kommen. ⓘ
Häufig synonym gebraucht ist die Einteilung nach der Phylogenese, die sich nach der stammesgeschichtlichen Entwicklung des Kleinhirns richtet:
- Das Archicerebellum (entspricht dem Vestibulocerebellum) ist der evolutionsgeschichtlich älteste, bei allen Wirbeltieren vorhandene Teil des Kleinhirns,
- das Paläocerebellum (entspricht dem Spinocerebellum), stellt den mit der Entwicklung von Gliedmaßen verbundenen nächsten evolutionären Schritt dar, während
- das Neocerebellum (Pontocerebellum) den Anforderungen an komplexe Bewegungsabläufe geschuldet ist und nur bei höheren Säugern vorhanden bzw. in Ausmaß und Umfang der Faserverbindungen bei Primaten und dann beim Menschen einzigartig ist. ⓘ
Ein weiteres mögliches Kriterium unterteilt das Kleinhirn nach den Kleinhirnkernen, in die die jeweiligen Abschnitte projizieren. Dadurch wird das Spinocerebellum in zwei funktionell unterschiedliche Gebiete unterteilt. ⓘ
Auch wenn die oben genannten Einteilungen nach den verschiedenen Kriterien synonym gebraucht werden, so sind doch die beschriebenen Gebiete fast nie völlig deckungsgleich. Ausnahme ist das Vestibulocerebellum – Archicerebellum – Lobus flocculonodularis, wo die Übereinstimmung weitgehend vorhanden ist. In den anderen Gebieten kann man oft nur eine Überschneidung in der Größenordnung von achtzig Prozent feststellen. ⓘ
| Afferenzen | Phylogenese | Anatomie | Efferenzen | Anatomie (andere Richtung) ⓘ |
|---|---|---|---|---|
| Vestibulocerebellum | Archicerebellum | Lobus flocculonodularis | Nucleus fastigii und direkt zu den Vestibulariskernen | Lobus flocculonodularis |
| Spinocerebellum | Paläocerebellum | Vermis | Nucleus fastigii | Lobus anterior |
| mediale Hemisphären (auch paravermale oder intermediäre Zone) | Nucleus globosus und Nucleus emboliformis | |||
| Pontocerebellum | Neocerebellum | laterale Hemisphären | Nucleus dentatus | Lobus posterior |
Entwicklung
Entwicklung der äußeren Form


Das Kleinhirn entsteht aus dem Metencephalon, dem vierten Hirnbläschen. Zwischen Metencephalon und Myelencephalon liegt die durch die Absenkung der Brückenbeuge in der sechsten Woche ausgedehnte Rautengrube. Die Anlage des Kleinhirns entwickelt sich zu diesem Zeitpunkt im rostralen, dem Mesencephalon zugewandten Teil des Dachs der Rautengrube. Die ganz dorsolateralen Bereiche der Flügelplatte krümmen sich nach medial und bilden die Rautenlippen. ⓘ
Kaudal werden die Rautenlippen beider Seiten von der Deckplatte, des sehr dünnen Dachs der Rautengrube, getrennt, nach kranial laufen sie aber aufeinander zu und vereinigen sich direkt unterhalb des Mesencephalon. ⓘ
Durch weitere Wachstumsbewegungen, Absenkung der Brückenbeuge, Wachstum und Vorwölben der Rautenlippen nach dorsal verändert sich ihre Form zu einer transversal gestellten Platte, der Kleinhirnplatte. ⓘ
In seitlicher Richtung lassen sich nach zwölf Wochen medial der Vermis und lateral die Hemisphären unterscheiden. In Längsrichtung werden als Erstes der Nodulus und der Flocculus durch einen Spalt von Vermis und Hemisphären abgetrennt. Im Verlaufe des weiteren Wachstums treten nach und nach die restlichen charakteristischen Querfurchen auf. ⓘ