Nekrose
Nekrose (von altgriechisch νέκρωσις (nékrōsis) "Tod") ist eine Form der Zellverletzung, die zum vorzeitigen Absterben von Zellen in lebendem Gewebe durch Autolyse führt. Die Nekrose wird durch zell- oder gewebeexterne Faktoren wie Infektionen oder Traumata verursacht, die zu einer unkontrollierten Verdauung von Zellbestandteilen führen. Im Gegensatz dazu ist die Apoptose eine natürlich vorkommende, programmierte und gezielte Ursache für den Zelltod. Während die Apoptose oft positive Auswirkungen auf den Organismus hat, ist die Nekrose fast immer nachteilig und kann tödlich sein. ⓘ
Der Zelltod durch Nekrose folgt nicht dem apoptotischen Signaltransduktionsweg, sondern es werden verschiedene Rezeptoren aktiviert, die zum Verlust der Zellmembranintegrität und zur unkontrollierten Freisetzung von Zelltodprodukten in den extrazellulären Raum führen. Dies löst im umgebenden Gewebe eine Entzündungsreaktion aus, die Leukozyten und nahe gelegene Phagozyten anlockt, die die toten Zellen durch Phagozytose beseitigen. Die von den Leukozyten freigesetzten mikrobiellen Schadstoffe würden jedoch Kollateralschäden im umliegenden Gewebe verursachen. Dieser übermäßige Kollateralschaden hemmt den Heilungsprozess. So führt eine unbehandelte Nekrose zu einer Ansammlung von sich zersetzendem totem Gewebe und Zelltrümmern an oder in der Nähe der Stelle des Zelltods. Ein klassisches Beispiel ist die Gangrän. Aus diesem Grund ist es oft notwendig, nekrotisches Gewebe chirurgisch zu entfernen, ein Verfahren, das als Debridement bezeichnet wird. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| R02 | Gangrän, anderenorts nicht klassifiziert |
| ICD-10 online (WHO-Version 2019) | |
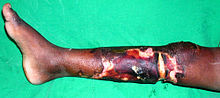
Unter einer Nekrose (auch Nekrobiose) (altgriechisch νέκρωσις nékrosis „das Töten“, auch „das Absterben einzelner Glieder“, zu νεκρόω nekróō „ich töte“) wird in der Biologie und Medizin das Absterben oder der Tod einzelner oder mehrerer Zellen verstanden. Die Nekrose ist pathologisch – das heißt, der Vorgang ist krankhaft und wird durch schädigende Einflüsse auf die Zelle ausgelöst: Nährstoff- und Sauerstoffmangel, Gifte, Radioaktivität und andere. Daraufhin kommt es im Gewebe zu einem Absterben der Zellen und nachfolgend meistens zu einer Entzündungsreaktion. Je nach Gewebsart und Schadensausmaß heilt die Nekrose durch Nachwachsen überlebender Zellen komplett ab, oder aber der abgestorbene Gewebeteil wird durch eine bindegewebige Narbe ersetzt (Beispiel: Herzmuskel nach einem Infarkt – mit entsprechenden Funktionseinschränkungen). ⓘ
Von der Nekrose abzugrenzen ist die Apoptose: Sie bezeichnet das „normale“ (physiologische) und kontrollierte Absterben einzelner Zellen, im Sinne des gesamten Organismus. ⓘ
Nekrosen werden nicht nur beim Menschen und bei Tieren, sondern ebenso bei Pflanzen beobachtet. ⓘ
Klassifizierung
Strukturelle Anzeichen, die auf eine irreversible Zellschädigung und das Fortschreiten der Nekrose hinweisen, sind u. a. eine dichte Verklumpung und fortschreitende Zerstörung des genetischen Materials sowie eine Zerstörung der Zell- und Organellenmembranen. ⓘ
Morphologische Muster
Es gibt sechs unterschiedliche morphologische Muster der Nekrose:
- Die koagulative Nekrose ist durch die Bildung einer gelatinösen (gelartigen) Substanz in abgestorbenen Geweben gekennzeichnet, bei der die Architektur des Gewebes erhalten bleibt und die lichtmikroskopisch beobachtet werden kann. Die Gerinnung ist das Ergebnis der Denaturierung von Proteinen, wodurch Albumin in einen festen und undurchsichtigen Zustand übergeht. Dieses Nekrosemuster tritt typischerweise in hypoxischen (sauerstoffarmen) Umgebungen auf, z. B. bei Infarkten. Koagulative Nekrosen treten vor allem in Geweben wie der Niere, dem Herzen und den Nebennieren auf. Schwere Ischämie verursacht am häufigsten diese Form der Nekrose.
- Die liquefaktive Nekrose (oder kolliquative Nekrose) ist im Gegensatz zur koagulativen Nekrose durch die Verdauung abgestorbener Zellen zu einer zähflüssigen Masse gekennzeichnet. Dies ist typisch für bakterielle und manchmal auch für Pilzinfektionen, da diese eine Entzündungsreaktion auslösen können. Die nekrotische Flüssigkeitsmasse ist aufgrund der abgestorbenen Leukozyten häufig cremegelb und wird gemeinhin als Eiter bezeichnet. Hypoxische Infarkte im Gehirn stellen sich als diese Art von Nekrose dar, da das Gehirn wenig Bindegewebe, aber große Mengen an Verdauungsenzymen und Lipiden enthält und die Zellen daher leicht von ihren eigenen Enzymen verdaut werden können.
- Die gangränöse Nekrose kann als eine Form der koagulativen Nekrose betrachtet werden, die mumifiziertem Gewebe ähnelt. Sie ist charakteristisch für die Ischämie der unteren Gliedmaßen und des Magen-Darm-Trakts. Kommt es zu einer überlagernden Infektion des abgestorbenen Gewebes, entsteht eine verflüssigende Nekrose (feuchte Gangrän).
- Die käsige Nekrose kann als eine Kombination aus koagulativer und liquefaktiver Nekrose angesehen werden, die typischerweise durch Mykobakterien (z. B. Tuberkulose), Pilze und bestimmte Fremdstoffe verursacht wird. Das nekrotische Gewebe erscheint weiß und brüchig, wie verklumpter Käse. Abgestorbene Zellen zerfallen, werden aber nicht vollständig verdaut und hinterlassen körnige Partikel. Die mikroskopische Untersuchung zeigt amorphe körnige Trümmer, die von einem ausgeprägten Entzündungsrand umgeben sind. Einige Granulome weisen dieses Nekrosemuster auf.
- Bei der Fettnekrose handelt es sich um eine spezialisierte Nekrose von Fettgewebe, die durch die Wirkung aktivierter Lipasen auf Fettgewebe wie die Bauchspeicheldrüse entsteht. In der Bauchspeicheldrüse führt sie zu einer akuten Pankreatitis, bei der die Pankreasenzyme in die Bauchhöhle austreten und die Membran verflüssigen, indem sie die Triglyceridester durch Fettverseifung in Fettsäuren spalten. Kalzium, Magnesium oder Natrium können sich an diese Läsionen binden und eine kreidig-weiße Substanz bilden. Die Kalkablagerungen sind mikroskopisch deutlich erkennbar und können groß genug sein, um bei Röntgenuntersuchungen sichtbar zu werden. Mit dem bloßen Auge erscheinen die Kalkablagerungen als körnige weiße Flecken.
- Die fibrinoide Nekrose ist eine besondere Form der Nekrose, die in der Regel durch eine immunvermittelte Gefäßschädigung verursacht wird. Sie ist gekennzeichnet durch Komplexe aus Antigen und Antikörpern, die als Immunkomplexe bezeichnet werden und sich zusammen mit Fibrin in den Arterienwänden ablagern. ⓘ
Andere klinische Klassifizierungen von Nekrosen
- Es gibt auch sehr spezifische Formen der Nekrose wie Gangrän (ein Begriff, der in der klinischen Praxis für Gliedmaßen verwendet wird, die eine schwere Hypoxie erlitten haben), gummiartige Nekrose (aufgrund von Spirochaetal-Infektionen) und hämorrhagische Nekrose (aufgrund der Verstopfung des venösen Abflusses eines Organs oder Gewebes).
- Einige Spinnenbisse können zu Nekrosen führen. In den Vereinigten Staaten führen nur Bisse der Braunen Einsiedlerspinne (Gattung Loxosceles) zuverlässig zu Nekrosen. In anderen Ländern sind auch Spinnen derselben Gattung, wie die Chilenische Einsiedlerspinne in Südamerika, dafür bekannt, dass sie Nekrosen verursachen. Behauptungen, dass gelbe Sackspinnen und Landstreicherspinnen ein nekrotisches Gift besitzen, wurden nicht bestätigt.
- Bei blinden Maulwürfen (Gattung Spalax) tritt der Prozess der Nekrose an die Stelle der systematischen Apoptose, die normalerweise bei vielen Organismen zum Einsatz kommt. Unter sauerstoffarmen Bedingungen, wie sie in den Höhlen der blinden Maulwürfe herrschen, werden die Zellen in der Regel der Apoptose zugeführt. In Anpassung an die höhere Neigung zum Zelltod entwickelten blinde Maulwürfe eine Mutation im Tumorsuppressorprotein p53 (das auch beim Menschen verwendet wird), um zu verhindern, dass Zellen der Apoptose unterzogen werden. Menschliche Krebspatienten haben ähnliche Mutationen, und man nahm an, dass blinde Maulwürfe anfälliger für Krebs sind, weil ihre Zellen keine Apoptose durchlaufen können. Nach einer bestimmten Zeit (einer Studie der Universität Rochester zufolge innerhalb von drei Tagen) setzen die Zellen blinder Maulwürfe jedoch Interferon-beta frei (das das Immunsystem normalerweise zur Bekämpfung von Viren einsetzt), um auf die durch die Unterdrückung der Apoptose verursachte übermäßige Zellvermehrung zu reagieren. In diesem Fall löst das Interferon-beta die Nekrose von Zellen aus, und dieser Mechanismus tötet auch Krebszellen in blinden Maulwürfen ab. Aufgrund solcher Tumorunterdrückungsmechanismen sind blinde Maulwürfe und andere Spalaciden resistent gegen Krebs. ⓘ
Verursacht
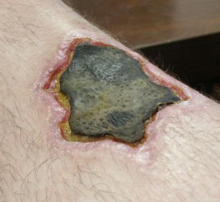
Nekrosen können durch äußere oder innere Faktoren verursacht werden. ⓘ
Externe Faktoren
Externe Faktoren können ein mechanisches Trauma (physische Beschädigung des Körpers, die einen Zellabbau verursacht), eine Beschädigung der Blutgefäße (die die Blutversorgung des zugehörigen Gewebes unterbrechen kann) und eine Ischämie sein. Thermische Einwirkungen (extrem hohe oder niedrige Temperaturen) können aufgrund der Zerstörung von Zellen zu Nekrosen führen. ⓘ
Bei Erfrierungen bilden sich Kristalle, die den Druck des verbleibenden Gewebes und der Flüssigkeit erhöhen, wodurch die Zellen platzen. Unter extremen Bedingungen sterben Gewebe und Zellen durch einen ungeregelten Prozess der Zerstörung von Membranen und Zytosol ab. ⓘ
Interne Faktoren
Zu den internen Faktoren, die eine Nekrose verursachen, gehören: trophäurotische Störungen (Krankheiten, die aufgrund einer fehlerhaften Nervenaktivität in einem Teil eines Organs auftreten, was zu einem Ausfall der Ernährung führt); Verletzungen und Lähmungen von Nervenzellen. Pankreasenzyme (Lipasen) sind die Hauptursache für Fettnekrosen. ⓘ
Die Nekrose kann durch Komponenten des Immunsystems aktiviert werden, z. B. durch das Komplementsystem, bakterielle Toxine, aktivierte natürliche Killerzellen und peritoneale Makrophagen. Pathogen-induzierte Nekroseprogramme in Zellen mit immunologischen Barrieren (Darmschleimhaut) können das Eindringen von Krankheitserregern durch die von der Entzündung betroffenen Oberflächen erleichtern. Toxine und Krankheitserreger können Nekrosen verursachen; Toxine wie Schlangengifte können Enzyme hemmen und den Zelltod verursachen. Nekrotische Wunden sind auch durch die Stiche der Vespa mandarinia entstanden. ⓘ
Pathologische Zustände sind durch eine unzureichende Sekretion von Zytokinen gekennzeichnet. Stickstoffmonoxid (NO) und reaktive Sauerstoffspezies (ROS) werden ebenfalls von einem intensiven nekrotischen Zelltod begleitet. Ein klassisches Beispiel für einen nekrotischen Zustand ist die Ischämie, die zu einer drastischen Verarmung an Sauerstoff, Glukose und anderen trophischen Faktoren führt und ein massives nekrotisches Absterben von Endothelzellen und nicht proliferierenden Zellen des umliegenden Gewebes (Neuronen, Kardiomyozyten, Nierenzellen usw.) auslöst. Jüngste zytologische Daten deuten darauf hin, dass der nekrotische Tod nicht nur bei pathologischen Ereignissen auftritt, sondern auch ein Bestandteil einiger physiologischer Prozesse ist. ⓘ
Der aktivierungsinduzierte Tod von primären T-Lymphozyten und anderen wichtigen Bestandteilen der Immunantwort ist kaspaseunabhängig und nekrotisch in der Morphologie; daher haben aktuelle Forscher gezeigt, dass der nekrotische Zelltod nicht nur bei pathologischen Prozessen, sondern auch bei normalen Prozessen wie der Gewebeerneuerung, der Embryogenese und der Immunantwort auftreten kann. ⓘ
Pathogenese
Wege
Bis vor kurzem dachte man, die Nekrose sei ein ungeregelter Prozess. Es gibt jedoch zwei breite Wege, auf denen Nekrose in einem Organismus auftreten kann. ⓘ
Der erste dieser beiden Wege beinhaltet zunächst die Onkose, bei der es zu einer Schwellung der Zellen kommt. Danach kommt es zur Blebierung der befallenen Zellen, gefolgt von der Pyknose, bei der die Zellkerne schrumpfen. Im letzten Schritt dieses Weges werden die Zellkerne in das Zytoplasma aufgelöst, was als Karyolyse bezeichnet wird. ⓘ
Der zweite Weg ist eine sekundäre Form der Nekrose, die nach Apoptose und Knospung auftritt. Bei diesen zellulären Veränderungen der Nekrose zerfällt der Zellkern in Fragmente (Karyorrhexis). ⓘ
Histopathologische Veränderungen
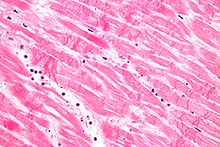
Der Zellkern verändert sich bei der Nekrose, und die Merkmale dieser Veränderung werden durch die Art und Weise bestimmt, in der seine DNA zerfällt:
- Karyolyse: Das Chromatin des Zellkerns verblasst durch den Verlust der DNA durch Abbau.
- Karyorrhexis: Der geschrumpfte Zellkern fragmentiert und löst sich vollständig auf.
- Pyknose: Der Zellkern schrumpft und das Chromatin kondensiert. ⓘ
Weitere typische zelluläre Veränderungen bei Nekrose sind:
- Zytoplasmatische Hypereosinophilie bei Proben mit H&E-Färbung. Sie ist als dunklere Färbung des Zytoplasmas zu erkennen.
- Die Zellmembran erscheint bei Betrachtung mit dem Elektronenmikroskop diskontinuierlich. Diese diskontinuierliche Membran wird durch Zellblebbing und den Verlust von Mikrovilli verursacht. ⓘ
In einem größeren histologischen Maßstab sind Pseudopalisaden (falsche Palisaden) hyperzelluläre Zonen, die typischerweise das nekrotische Gewebe umgeben. Eine pseudopalisierende Nekrose weist auf einen aggressiven Tumor hin. ⓘ
Pseudopalisading um eine Nekrose bei einem Glioblastom. ⓘ
Behandlung
Es gibt viele Ursachen für eine Nekrose, so dass die Behandlung davon abhängt, wie die Nekrose entstanden ist. Die Behandlung von Nekrosen umfasst in der Regel zwei verschiedene Verfahren: In der Regel muss zunächst die der Nekrose zugrunde liegende Ursache behandelt werden, bevor das abgestorbene Gewebe selbst behandelt werden kann.
- Das Debridement, d. h. die Entfernung von abgestorbenem Gewebe mit chirurgischen oder nicht-chirurgischen Mitteln, ist die Standardtherapie für Nekrosen. Je nach Schweregrad der Nekrose kann dies von der Entfernung kleiner Hautpartien bis hin zur vollständigen Amputation der betroffenen Gliedmaßen oder Organe reichen. Die chemische Entfernung nekrotischen Gewebes ist eine weitere Option, bei der enzymatische Debride (proteolytische, fibrinolytische oder Kollagenasen) eingesetzt werden, um die verschiedenen Bestandteile des abgestorbenen Gewebes zu entfernen. In ausgewählten Fällen wurde eine spezielle Madentherapie mit Lucilia sericata-Larven eingesetzt, um nekrotisches Gewebe und Infektionen zu entfernen.
- Im Falle einer Ischämie, zu der auch der Herzinfarkt gehört, führt die eingeschränkte Blutzufuhr zum Gewebe zu einer Hypoxie und zur Bildung reaktiver Sauerstoffspezies (ROS), die mit Proteinen und Membranen reagieren und diese schädigen. Antioxidative Behandlungen können eingesetzt werden, um die ROS abzufangen.
- Wunden, die durch physikalische Einwirkungen, einschließlich physischer Traumata und chemischer Verbrennungen, verursacht wurden, können mit Antibiotika und entzündungshemmenden Medikamenten behandelt werden, um bakterielle Infektionen und Entzündungen zu verhindern. Die Reinhaltung der Wunde von Infektionen verhindert auch Nekrosen.
- Chemische und toxische Stoffe (z. B. Arzneimittel, Säuren, Basen) reagieren mit der Haut und führen zu Hautverlust und schließlich zur Nekrose. Die Behandlung umfasst die Identifizierung und das Absetzen des schädigenden Agens, gefolgt von der Behandlung der Wunde, einschließlich der Verhinderung von Infektionen und möglicherweise dem Einsatz von immunsuppressiven Therapien wie entzündungshemmenden Medikamenten oder Immunsuppressiva. Im Falle eines Schlangenbisses wird die Ausbreitung der Toxine durch die Gabe von Gegengift gestoppt, während gleichzeitig Antibiotika verabreicht werden, um eine Infektion zu verhindern. ⓘ
Auch nachdem die ursprüngliche Ursache der Nekrose gestoppt wurde, verbleibt das nekrotische Gewebe im Körper. Die Immunreaktion des Körpers auf die Apoptose, die den automatischen Abbau und das Recycling von Zellmaterial beinhaltet, wird durch den nekrotischen Zelltod nicht ausgelöst, da der apoptotische Weg deaktiviert ist. ⓘ
In Pflanzen
Bei Kalziummangel kann kein Pektin synthetisiert werden, so dass die Zellwände nicht verklebt werden können, was zu einer Behinderung der Meristeme führt. Dies führt zur Nekrose von Stamm- und Wurzelspitzen und Blatträndern. Gewebsnekrosen können beispielsweise bei Arabidopsis thaliana durch Pflanzenpathogene entstehen. ⓘ
Bei Kakteen wie dem Saguaro und dem Cardon in der Sonoran-Wüste bilden sich regelmäßig nekrotische Flecken; eine Dipterenart namens Drosophila mettleri hat ein p450-Entgiftungssystem entwickelt, das es ihr ermöglicht, die in diesen Flecken freigesetzten Exsudate sowohl zum Nisten als auch zur Ernährung ihrer Larven zu nutzen. ⓘ
Nekroseformen
Koagulationsnekrose
Diese Form der Nekrose tritt beim Absterben proteinreichen Gewebes auf, wie der Muskulatur. Ein Paradebeispiel ist die Herzmuskulatur nach einem Herzinfarkt. Zuerst schwellen die Zellen an und übersäuern. Das führt zur Ausfällung und „Gerinnung“ (Koagulation) der Proteine und zur gesteigerten Eosinophilie des Zytoplasmas. Die histologische Gewebszeichnung wird undeutlicher und der Zellkern löst sich in mehreren Schritten auf: Initial kommt es zur Kernschrumpfung (Pyknose) und anschließend zu einem Zerbrechen des Kerns (Karyorrhexis). Letztlich verliert der Kern sein Chromatin und verblasst (Karyolyse). Makroskopisch (mit bloßem Auge) erscheint das nekrotische Gewebe lehmgelb und trocken (frühestens nach sechs Stunden). ⓘ
Aus den zerstörten Zellen werden entzündungsfördernde Stoffe frei, so dass Granulozyten angelockt werden. Diese wandern in das Gewebe ein und führen über die Freisetzung von Proteasen zur Auflösung des nekrotischen Gewebes. Zell- und Gewebsreste werden von Makrophagen phagozytiert. Makroskopisch entsteht ein roter Randsaum. Das nekrotische Areal büßt im Laufe des Prozesses jedoch an Festigkeit ein und kann einreißen. So kann beispielsweise die Herzwand nach einem ausgedehnten Infarkt rupturieren. Am Ende steht die narbige Abheilung des Gewebes. ⓘ
Kolliquationsnekrose
Sie ist typisch für Gewebe mit hohem Fettanteil und geringem Eiweißanteil, zum Beispiel im Gehirn bei Sauerstoffminderversorgung, oder für Gewebe mit hohem Proteasen-Anteil wie die Bauchspeicheldrüse. Auch führen Verätzungen durch Laugeneinwirkung oder eine Abszessbildung zu einer Kolliquationsnekrose. Beim Abszess ausschlaggebend sind die Proteasen der körpereigenen Immunzellen. Im Gegensatz zur Koagulationsnekrose kommt es nach einer initialen Zellschwellung zu einer Verflüssigung des Gewebes (Kolliquation) und anschließend zu einer Entzündungsreaktion (außer im Nervensystem). Makroskopisch erscheint das Gewebe matschig, schmierig und aufgeweicht. ⓘ
Sonderformen
Bei der Tuberkulose tritt durch die Besonderheiten der auslösenden Bakterien eine käsige Nekrose (auch Verkäsung genannt) auf. Gangrän kennzeichnet eine besondere Nekroseform, die schwarz ist und wie verbrannt aussehen kann. Die Gangrän ist trocken (trockene Gangrän), außer sie wird von Fäulnisbakterien befallen und entzündet sich (feuchte Gangrän). Bei der bereits im 19. Jahrhundert bekannten Fettnekrose oder Fettgewebsnekrose handelt es sich um den Tod von Fettzellen, zum Beispiel eine verkalkte Nekrose im Fettgewebe um die Bauchspeicheldrüse herum. Sie entsteht traumatisch oder enzymatisch durch freigesetzte Lipasen aus der Bauchspeicheldrüse im Rahmen einer Bauchspeicheldrüsenentzündung. Weitere Sonderformen sind die gummatöse Nekrose, die bei Syphilis auftritt, und die fibrinoide Nekrose, die für rheumatische Polyarthritis, Polyarteriitis nodosa oder für peptische Magenulcera typisch ist. ⓘ
Unter einer Panzernekrose versteht man absterbendes Panzergewebe bei Schildkröten, beispielsweise durch Nässe oder Pilze. ⓘ
Bei Zündholzherstellern im 19. Jahrhundert kamen als Berufskrankheit so genannte Phosphornekrosen vor. ⓘ
In seltenen Fällen treten Nekrosen als unerwünschte Arzneimittelwirkung auf. So können sub-therapeutische Konzentrationen von Antibiotika der Gruppe Fluorchinolone zu Nekrosen adulter Chondrozyten im gesunden adulten humanen Knorpel führen. Histologisch sind Nekrosen auch im Zusammenhang mit Fluorchinolon-bedingten Sehnen- und Nierenschäden dokumentiert. Nekrosen von Hepatozyten der Leber können mit einer Vergiftung durch Paracetamol assoziiert sein. 2011 wurden in den USA und Großbritannien etwa die Hälfte aller Fälle von akutem Leberversagen auf Paracetamol zurückgeführt. Nekrosen werden hierbei durch entstehende reaktive Metaboliten und dem darauf folgenden oxidativen Stress, dem Verlust des mitochondrialen Membranpotentials und dem Verlust der Fähigkeit der Mitochondrien, ATP zu synthetisieren, verursacht. Ebenso kann das Breitbandspektrum-Antiepileptikum Valproinsäure tödlich verlaufende Leberfunktionsstörungen auslösen, bei denen umfangreiche konfluente lytische Nekrosen von Leberacini beobachtet wurden. Lebernekrosen wurden ferner bei Diclofenac, Methyldopa, und Halothan dokumentiert. ⓘ



