ACE-Hemmer
| Angiotensin-Converting-Enzym-Hemmer ⓘ | |
|---|---|
| Wirkstoffklasse | |
 Captopril, der erste synthetische ACE-Hemmer | |
| Bezeichner der Klasse | |
| Verwendung | Bluthochdruck |
| ATC-Code | C09A |
| Biologisches Ziel | Angiotensin-konvertierendes Enzym |
| Klinische Daten | |
| Drogen.com | Medikamenten-Klassen |
| Verbraucher-Berichte | Beste kaufen Drogen |
| WebMD | MedicineNet RxList |
| Externe Links | |
| MeSH | D000806 |
Angiotensin-Converting-Enzym-Hemmer (ACE-Hemmer) sind eine Klasse von Medikamenten, die hauptsächlich zur Behandlung von Bluthochdruck und Herzinsuffizienz eingesetzt werden. Sie bewirken eine Entspannung der Blutgefäße und eine Verringerung des Blutvolumens, was zu einem niedrigeren Blutdruck und einem geringeren Sauerstoffbedarf des Herzens führt. ⓘ
ACE-Hemmer hemmen die Aktivität des Angiotensin-konvertierenden Enzyms, einer wichtigen Komponente des Renin-Angiotensin-Systems, das Angiotensin I in Angiotensin II umwandelt und Bradykinin hydrolysiert. Daher verringern ACE-Hemmer die Bildung von Angiotensin II, einem Vasokonstriktor, und erhöhen den Gehalt an Bradykinin, einem Peptid, das die Gefäße erweitert. Diese Kombination wirkt synergistisch bei der Senkung des Blutdrucks. Durch die Hemmung des ACE-Enzyms im Bradykinin-System sorgen die ACE-Hemmer für einen Anstieg des Bradykinin-Spiegels, der normalerweise abgebaut werden würde. Dieser Mechanismus kann die beiden häufigsten Nebenwirkungen von ACE-Hemmern erklären: Angioödeme und Husten. Bradykinin produziert Prostaglandin. ⓘ
Häufig verschriebene ACE-Hemmer sind Benazepril, Zofenopril, Perindopril, Trandolapril, Captopril, Enalapril, Lisinopril und Ramipril. ⓘ
ACE-Hemmer (kurz für Angiotensin-Converting-Enzym-Hemmer) sind gefäßerweiternde, damit den Gefäßwiderstand senkende, und die Freisetzung der blutdrucksteigernden Katecholamine Noradrenalin und Adrenalin hemmende Arzneistoffe, die insbesondere in der Therapie des Bluthochdruckes (arterielle Hypertonie) und der chronischen Herzinsuffizienz Anwendung finden. Sie sind Hemmstoffe (Inhibitoren) des Angiotensin-konvertierenden Enzyms (Angiotensin Converting Enzyme), das im Wesentlichen die Umwandlung von inaktivem Angiotensin-I in aktives Angiotensin-II bewirkt und ein Teil einer den Blutdruck steuernden Kaskade ist (Renin-Angiotensin-Aldosteron-System). ACE-hemmende Inhaltsstoffe wurden zuerst in Schlangengiften gefunden. Die wichtigsten in der Therapie verwendeten Wirkstoffe dieser Kategorie sind Captopril, Enalapril, Lisinopril, Perindopril und Ramipril. ⓘ
Medizinische Anwendung
ACE-Hemmer wurden ursprünglich für die Behandlung von Bluthochdruck zugelassen und können allein oder in Kombination mit anderen blutdrucksenkenden Medikamenten eingesetzt werden. Später erwiesen sie sich auch bei anderen Herz-Kreislauf- und Nierenerkrankungen als nützlich:
- Akuter Myokardinfarkt (Herzinfarkt)
- Herzinsuffizienz (linksventrikuläre systolische Dysfunktion)
- Nierenkomplikationen bei Diabetes mellitus (diabetische Nephropathie) durch Senkung des Blutdrucks und Verbesserung der Durchblutung der glomerulären Arteriolen. ⓘ
Bei der Behandlung von Bluthochdruck sind ACE-Hemmer oft das Mittel der ersten Wahl, vor allem, wenn ein Diabetes vorliegt, aber das Alter kann zu einer anderen Wahl führen, und es ist üblich, dass mehr als ein Medikament benötigt wird, um die gewünschte Verbesserung zu erzielen. Es gibt fest dosierte Kombinationspräparate, wie z. B. Kombinationen aus ACE-Hemmern und Thiaziden. ACE-Hemmer werden auch bei chronischem Nierenversagen und Nierenbeteiligung bei systemischer Sklerose (Verhärtung des Gewebes, wie Sklerodermie-Nierenkrise) eingesetzt. Bei Personen mit stabiler koronarer Herzkrankheit, aber ohne Herzinsuffizienz, sind die Vorteile ähnlich wie bei anderen üblichen Behandlungen. ⓘ
2012 wurde im BMJ eine Metaanalyse veröffentlicht, in der die schützende Rolle von ACE-Hemmern bei der Verringerung des Lungenentzündungsrisikos im Vergleich zu ARBs (Angiotensin-II-Rezeptorblockern) beschrieben wurde. Die Autoren fanden ein geringeres Risiko bei Patienten mit vorangegangenem Schlaganfall (54 % Risikoreduktion), mit Herzinsuffizienz (37 % Risikoreduktion) und asiatischer Abstammung (43 % Risikoreduktion gegenüber 54 % Risikoreduktion in der nicht-asiatischen Bevölkerung). Es wurde jedoch keine Verringerung der Sterblichkeit im Zusammenhang mit Lungenentzündungen festgestellt. ⓘ
Andere
ACE-Hemmer können auch zur Verringerung des übermäßigen Wasserkonsums bei Menschen mit Schizophrenie eingesetzt werden, der zu psychogener Polydipsie führt. Eine doppelblinde, placebokontrollierte Studie zeigte, dass Enalapril bei 60 % der Betroffenen zu einer Verringerung des Wasserverbrauchs (bestimmt durch Urinausscheidung und Osmolalität) führte; dieselbe Wirkung wurde bei anderen ACE-Hemmern nachgewiesen. ⓘ
Darüber hinaus werden ACEi nach einer Nierentransplantation häufig zur Behandlung der Posttransplantations-Erythrozytose eingesetzt, einem Zustand, der durch einen anhaltend hohen Hämatokrit von mehr als 51 % gekennzeichnet ist und sich häufig 8-24 Monate nach einer erfolgreichen Transplantation entwickelt, da ACEi nachweislich die Erythropoetinproduktion verringern. ⓘ
Unerwünschte Wirkungen
Häufige Nebenwirkungen sind: niedriger Blutdruck, Husten, Hyperkaliämie, Kopfschmerzen, Schwindel, Müdigkeit, Übelkeit und Nierenfunktionsstörungen. ⓘ
Die wichtigsten unerwünschten Wirkungen der ACE-Hemmung lassen sich aus ihrer pharmakologischen Wirkung ableiten. Die anderen berichteten unerwünschten Wirkungen sind Leberprobleme und Auswirkungen auf den Fötus. Nierenprobleme können bei allen ACE-Hemmern auftreten, was sich direkt aus ihrem Wirkmechanismus ergibt. Bei Patienten, die mit der Einnahme eines ACE-Hemmers beginnen, kommt es in der Regel zu einer bescheidenen Verringerung der glomerulären Filtrationsrate (GFR). Bei bereits bestehender verminderter Nierendurchblutung, wie z. B. bei Nierenarterienstenose, Herzinsuffizienz, polyzystischer Nierenerkrankung oder Volumenmangel, kann der Rückgang jedoch erheblich sein. Bei diesen Patienten hängt die Aufrechterhaltung der GFR vom Angiotensin-II-abhängigen efferenten vasomotorischen Tonus ab. Daher sollte die Nierenfunktion in den ersten Tagen nach Beginn der Behandlung mit dem ACE-Hemmer bei Patienten mit verminderter Nierendurchblutung genau überwacht werden. Eine mäßige Verringerung der Nierenfunktion, d. h. ein Anstieg des Serumkreatinins um nicht mehr als 30 %, der sich nach einer Woche der Behandlung stabilisiert hat, wird als Teil des therapeutischen Effekts als akzeptabel angesehen, sofern die verbleibende Nierenfunktion ausreichend ist. ⓘ
Eine verringerte GFR ist insbesondere dann ein Problem, wenn der Patient gleichzeitig ein NSAR und ein Diuretikum einnimmt. Bei gleichzeitiger Einnahme der drei Medikamente ist das Risiko, eine Niereninsuffizienz zu entwickeln, deutlich erhöht. ⓘ
Ein hoher Kaliumspiegel im Blut ist eine weitere mögliche Komplikation der Behandlung mit einem ACE-Hemmer aufgrund seiner Wirkung auf Aldosteron. Die Unterdrückung von Angiotensin II führt zu einem Rückgang des Aldosteronspiegels. Da Aldosteron für die Erhöhung der Kaliumausscheidung verantwortlich ist, können ACE-Hemmer eine Kaliumretention verursachen. Manche Menschen können jedoch auch während der Einnahme eines ACE-Hemmers weiterhin Kalium verlieren. Eine Hyperkaliämie kann die Geschwindigkeit der Impulsleitung in den Nerven und Muskeln, einschließlich des Herzgewebes, verringern. Dies führt zu Herzfunktionsstörungen und neuromuskulären Folgen wie Muskelschwäche, Parästhesien, Übelkeit, Durchfall und anderen. Bei Patienten, die mit ACE-Hemmern behandelt werden und bei denen das Risiko einer Hyperkaliämie besteht, ist eine genaue Überwachung des Kaliumspiegels erforderlich. ⓘ
Eine weitere mögliche unerwünschte Wirkung, die spezifisch für ACE-Hemmer, aber nicht für andere RAAS-Blocker ist, ist ein Anstieg des Bradykininspiegels. ⓘ
Anhaltender trockener Husten ist eine relativ häufige unerwünschte Wirkung, von der angenommen wird, dass sie mit dem durch ACE-Hemmer verursachten Anstieg des Bradykininspiegels zusammenhängt, obwohl die Rolle des Bradykinins bei der Entstehung dieser Symptome umstritten ist. Viele Fälle von Husten bei Menschen, die ACE-Hemmer einnehmen, sind jedoch möglicherweise nicht auf das Medikament selbst zurückzuführen. Menschen, bei denen dieser Husten auftritt, werden häufig auf Angiotensin-II-Rezeptor-Antagonisten umgestellt. ⓘ
Einige (0,7 %) entwickeln aufgrund eines erhöhten Bradykininspiegels ein Angioödem. Es kann eine genetische Veranlagung bestehen. ⓘ
Eine schwere, seltene allergische Reaktion kann die Darmwand betreffen und sekundär Bauchschmerzen verursachen. ⓘ
Blut
Hämatologische Wirkungen, wie Neutropenie, Agranulozytose und andere Blutdyskrasien, sind während der Therapie mit ACE-Hemmern aufgetreten, insbesondere bei Personen mit zusätzlichen Risikofaktoren. ⓘ
Schwangerschaft
Bei schwangeren Frauen wurde berichtet, dass ACE-Hemmer, die während aller Trimester eingenommen werden, angeborene Missbildungen, Totgeburten und Todesfälle bei Neugeborenen verursachen können. Zu den häufig gemeldeten fötalen Anomalien gehören Hypotonie, Nierenfunktionsstörungen, Anurie/Oligoformität, Oligohydramnion, intrauterine Wachstumsverzögerung, pulmonale Hypoplasie, offener Ductus arteriosus und unvollständige Verknöcherung des Schädels. Insgesamt ist etwa die Hälfte der Neugeborenen, die ACE-Hemmern ausgesetzt sind, nachteilig betroffen, was zu Geburtsfehlern führt. ⓘ
ACE-Hemmer gehören zur ADEC-Schwangerschaftskategorie D und sollten bei Frauen, die schwanger werden könnten, vermieden werden. In den USA müssen ACE-Hemmer mit einem Warnhinweis versehen werden, der auf das Risiko von Geburtsschäden hinweist, wenn sie im zweiten und dritten Trimester eingenommen werden. Ihre Einnahme im ersten Schwangerschaftsdrittel ist außerdem mit einem Risiko für schwerwiegende angeborene Fehlbildungen verbunden, die insbesondere das Herz-Kreislauf-System und das zentrale Nervensystem betreffen. ⓘ
Überdosierung
Symptome und Behandlung: In der Literatur finden sich nur wenige Berichte über eine Überdosierung von ACE-Hemmern. Die wahrscheinlichsten Symptome sind Hypotonie, die schwerwiegend sein kann, Hyperkaliämie, Hyponatriämie und Niereninsuffizienz mit metabolischer Azidose. Die Behandlung sollte hauptsächlich symptomatisch und unterstützend sein, mit Volumenexpansion mit normaler Kochsalzlösung, um die Hypotonie zu korrigieren und die Nierenfunktion zu verbessern, und Magenspülung, gefolgt von Aktivkohle und einem Kathartikum, um eine weitere Absorption des Arzneimittels zu verhindern. Es ist bekannt, dass Captopril, Enalapril, Lisinopril und Perindopril durch Hämodialyse entfernt werden können. ⓘ
Kontraindikationen und Vorsichtsmaßnahmen
Die ACE-Hemmer sind kontraindiziert bei Menschen mit:
- Schwangerschaft oder Stillen
- Frühere Angioödeme in Verbindung mit einer ACE-Hemmer-Therapie
- Beidseitige Nierenarterienverengung
- Überempfindlichkeit gegen ACE-Hemmer ⓘ
ACE-Hemmer sollten mit Vorsicht bei Menschen mit:
- Beeinträchtigter Nierenfunktion
- Aortenklappenstenose oder Obstruktion des Herzausflusses
- Hypovolämie oder Dehydratation
- Hämodialyse mit High-Flux-Polyacrylnitril-Membranen ⓘ
Eine Kombination von ACE-Hemmern mit anderen Arzneimitteln kann die Wirkung dieser Arzneimittel, aber auch das Risiko unerwünschter Wirkungen erhöhen. Die am häufigsten gemeldeten unerwünschten Wirkungen einer Arzneimittelkombination mit ACE sind akutes Nierenversagen, Hypotonie und Hyperkaliämie. Die Medikamente, die mit ACE-Hemmern interagieren, sollten mit Vorsicht verschrieben werden. Besondere Aufmerksamkeit sollte der Kombination von ACE-Hemmern mit anderen RAAS-Blockern, Diuretika (insbesondere kaliumsparenden Diuretika), NSAIDs, Antikoagulantien, Cyclosporin, DPP-4-Hemmern und Kaliumpräparaten gewidmet werden. ⓘ
Aufgrund der hyperkaliämischen Wirkung von ACE-Hemmern sollte eine Kaliumergänzung nur mit Vorsicht und unter ärztlicher Aufsicht erfolgen. ⓘ
Die gleichzeitige Anwendung mit Cyclooxygenase-Hemmern verringert tendenziell die blutdrucksenkende Wirkung von ACE-Hemmern. ⓘ
ACE-Hemmer verstärken die Blutbild verändernden Nebenwirkungen immunsuppressiv wirkender Arzneistoffe (Immunsuppressiva, Zytostatika und Glucocorticoid). Ebenso verstärken ACE-Hemmer die Blutzucker senkende Wirkung oraler Antidiabetika und von Insulin. ⓘ
Durch Eingriff in den Wasser- und Elektrolythaushalt kann die Ausscheidung von Lithium verlangsamt werden. Ebenso kann eine Verstärkung des Anstiegs des Kaliumspiegels bei kombinierter Anwendung mit kaliumsparenden Diuretika beobachtet werden. ⓘ
Mechanismus der Wirkung
ACE-Hemmer reduzieren die Aktivität des Renin-Angiotensin-Aldosteron-Systems (RAAS) als primäres ätiologisches (ursächliches) Ereignis bei der Entwicklung von Bluthochdruck bei Menschen mit Diabetes mellitus, als Teil des Insulinresistenzsyndroms oder als Manifestation einer Nierenerkrankung. ⓘ
Renin-Angiotensin-Aldosteron-System

Das Renin-Angiotensin-Aldosteron-System ist ein wichtiger Mechanismus zur Regulierung des Blutdrucks. Marker für ein Elektrolyt- und Wasserungleichgewicht im Körper wie Hypotonie, eine niedrige Natriumkonzentration im distalen Tubulus, ein vermindertes Blutvolumen und ein hoher Sympathikustonus lösen die Freisetzung des Enzyms Renin aus den Zellen des juxtaglomerulären Apparats in der Niere aus. ⓘ
Renin aktiviert ein aus der Leber stammendes zirkulierendes Prohormon, das Angiotensinogen, durch proteolytische Spaltung aller bis auf die ersten zehn Aminosäurereste, die als Angiotensin I bekannt sind. ACE (Angiotensin Converting Enzyme) entfernt dann zwei weitere Reste und wandelt Angiotensin I in Angiotensin II um. ACE findet sich im Lungenkreislauf und im Endothel vieler Blutgefäße. Das System erhöht den Blutdruck, indem es die Salz- und Wassereinlagerungen im Körper erhöht, obwohl Angiotensin auch sehr gut dazu geeignet ist, die Blutgefäße zu verengen (ein starker Vasokonstriktor). ⓘ
Wirkungen
ACE-Hemmer blockieren die Umwandlung von Angiotensin I (ATI) in Angiotensin II (ATII). Dadurch verringern sie den Arteriolenwiderstand und erhöhen die Venenkapazität; sie verringern das Herzzeitvolumen, den Herzindex, die Schlagarbeit und das Volumen; sie verringern den Widerstand in den Blutgefäßen der Nieren und führen zu einer erhöhten Natriurese (Ausscheidung von Natrium im Urin). Die Reninkonzentration im Blut steigt als Folge der negativen Rückkopplung der Umwandlung von ATI in ATII. ATI steigt aus demselben Grund an; ATII und Aldosteron nehmen ab. Die Bradykininkonzentration steigt aufgrund einer geringeren Inaktivierung durch ACE. ⓘ
Unter normalen Bedingungen hat Angiotensin II diese Wirkungen:
- Die durch ATII hervorgerufene Vasokonstriktion (Verengung der Blutgefäße) und Hypertrophie (Vergrößerung) der glatten Gefäßmuskulatur kann zu einem erhöhten Blutdruck und Bluthochdruck führen. Außerdem führt die Verengung der efferenten Arteriolen der Niere zu einem erhöhten Perfusionsdruck in den Glomeruli.
- Es trägt zum ventrikulären Remodeling und zur ventrikulären Hypertrophie des Herzens durch Stimulierung der Proto-Onkogene c-fos, c-jun, c-myc, des transformierenden Wachstumsfaktors beta (TGF-B), durch Fibrogenese und Apoptose (programmierter Zelltod) bei.
- Durch ATII wird die Nebennierenrinde zur Ausschüttung von Aldosteron angeregt, einem Hormon, das auf die Nierentubuli einwirkt und die Retention von Natrium- und Chloridionen sowie die Kaliumausscheidung bewirkt. Natrium ist ein "wasserspeicherndes" Ion, so dass auch Wasser zurückgehalten wird, was zu einer Erhöhung des Blutvolumens und damit zu einem Anstieg des Blutdrucks führt.
- Die Stimulierung der Hypophysenhinterwand zur Freisetzung von Vasopressin (antidiuretisches Hormon, ADH) wirkt ebenfalls auf die Nieren, um die Wasserretention zu erhöhen. Wenn die ADH-Produktion bei Herzinsuffizienz übermäßig hoch ist, kann der Na+-Spiegel im Plasma sinken (Hyponatriämie), was ein Zeichen für ein erhöhtes Sterberisiko bei Patienten mit Herzinsuffizienz ist.
- Eine Abnahme der renalen Proteinkinase C ⓘ
Während der Einnahme von ACE-Hemmern wird die Produktion von ATII verringert, wodurch die Freisetzung von Aldosteron aus der Nebennierenrinde verhindert wird. Dadurch kann die Niere Natriumionen zusammen mit obligatem Wasser ausscheiden und Kaliumionen zurückhalten. Dadurch verringert sich das Blutvolumen, was zu einer Senkung des Blutdrucks führt. ⓘ
Epidemiologische und klinische Studien haben gezeigt, dass ACE-Hemmer das Fortschreiten der diabetischen Nephropathie unabhängig von ihrer blutdrucksenkenden Wirkung verringern. Diese Wirkung von ACE-Hemmern wird zur Vorbeugung von diabetischem Nierenversagen genutzt. ⓘ
ACE-Hemmer haben sich auch bei Patienten mit normalem Blutdruck für andere Indikationen als Bluthochdruck als wirksam erwiesen. Die Verwendung einer Höchstdosis von ACE-Hemmern bei solchen Patienten (u. a. zur Vorbeugung von diabetischer Nephropathie, kongestiver Herzinsuffizienz und zur Prophylaxe von kardiovaskulären Ereignissen) ist gerechtfertigt, da sie die klinischen Ergebnisse unabhängig von der blutdrucksenkenden Wirkung der ACE-Hemmer verbessert. Eine solche Therapie erfordert natürlich eine sorgfältige und schrittweise Titration der Dosis, um die Auswirkungen eines rasch sinkenden Blutdrucks (Schwindel, Ohnmacht usw.) zu vermeiden. ⓘ
ACE-Hemmer bewirken bei gesunden Probanden und Patienten mit Herzinsuffizienz nachweislich auch eine zentrale Verstärkung der Aktivität des parasympathischen Nervensystems. Diese Wirkung kann die Prävalenz bösartiger Herzrhythmusstörungen und die in großen klinischen Studien berichtete Verringerung des plötzlichen Herztodes verringern. ACE-Hemmer senken bei Patienten mit Herzinsuffizienz auch den Noradrenalin-Plasmaspiegel und die daraus resultierenden gefäßverengenden Wirkungen und durchbrechen so den Teufelskreis der Aktivierung des Sympathikus und des Renin-Angiotensin-Systems, der die Abwärtsspirale der Herzfunktion bei kongestiver Herzinsuffizienz aufrechterhält. ⓘ
Der ACE-Hemmer Enalapril reduziert nachweislich die kardiale Kachexie bei Patienten mit chronischer Herzinsuffizienz. Kachexie ist ein schlechtes prognostisches Zeichen bei Patienten mit chronischer Herzinsuffizienz. ACE-Hemmer werden derzeit für die Behandlung von Gebrechlichkeit und Muskelschwund (Sarkopenie) bei älteren Patienten ohne Herzinsuffizienz untersucht. ⓘ
Beispiele
ACE-Hemmer sind leicht an ihrer gemeinsamen Endung "-pril" zu erkennen. ACE-Hemmer lassen sich anhand der Molekularstruktur der Enzymbindungsstellen (Sulfhydryl, Phosphinyl, Carboxyl) an das aktive Zentrum von ACE in drei Gruppen einteilen: ⓘ
Sulfhydryl-haltige Wirkstoffe
- Alacepril
- Captopril (Handelsname Capoten), der erste ACE-Hemmer.
- Zofenopril ⓘ
Diese Wirkstoffe scheinen antioxidative Eigenschaften zu haben, können aber zu unerwünschten Ereignissen wie Hautausschlägen führen. ⓘ
Arzneistoffe
Die internationalen Freinamen der einzelnen ACE-Hemmer enden auf -pril. Derzeit sind in Deutschland folgende ACE-Hemmer als Arzneistoff (Substanz bzw. Prodrug) zugelassen:
- Benazepril
- Captopril
- Cilazapril (Wirkmetabolit: Cilazaprilat)
- Enalapril
- Fosinopril
- Imidapril
- Lisinopril
- Moexipril
- Perindopril (Wirkmetabolit: Perindoprilat)
- Quinapril (Wirkmetabolit: Quinaprilat)
- Ramipril (Wirkmetabolit: Ramiprilat)
- Spirapril
- Trandolapril
- Zofenopril ⓘ
Dies ist die größte Gruppe, zu der gehören:
- Enalapril (Vasotec/Renitec/Berlipril/Enap/Enalapril Profarma)
- Ramipril (Altace/Prilace/Ramace/Ramiwin/Triatec/Tritace/Ramitac)
- Quinapril (Accupril)
- Perindopril (Coversyl/Aceon/Perindo)
- Lisinopril (Listril/Lopril/Novatec/Prinivil/Zestril, Lisidigal)
- Benazepril (Lotensin)
- Imidapril (Tanatril)
- Trandolapril (Mavik/Odrik/Gopten)
- Cilazapril (Inhibace) ⓘ
Phosphonathaltige Wirkstoffe
- Fosinopril (Fositen/Monopril) ist der einzige Vertreter dieser Gruppe ⓘ
Natürlich vorkommend
- Eine umfassende Ressource über blutdrucksenkende Peptide ist in Form einer Datenbank verfügbar. Sie enthält rund 1700 einzigartige blutdrucksenkende Peptide
- Arfalasin (HOE 409) ist ein Angiotensin-Antagonist. ⓘ
Molkereiprodukte
- Casokinine und Lactokinine, Abbauprodukte von Casein und Molke, treten auf natürliche Weise nach dem Verzehr von Milchprodukten, insbesondere von Sauermilch, auf. Ihre Rolle bei der Blutdruckkontrolle ist ungewiss.
- Die Laktotripeptide Val-Pro-Pro und Ile-Pro-Pro, die vom Probiotikum Lactobacillus helveticus produziert oder aus Kasein gewonnen werden, haben nachweislich eine ACE-hemmende und blutdrucksenkende Wirkung. In einer Studie wurde L. helveticus PR4 aus italienischen Käsesorten isoliert. ⓘ
Vergleichende Informationen
Alle ACE-Hemmer haben eine ähnliche blutdrucksenkende Wirkung, wenn sie in gleicher Dosierung verabreicht werden. Die Hauptunterschiede liegen bei Captopril, dem ersten ACE-Hemmer. Captopril hat eine kürzere Wirkdauer und eine höhere Inzidenz von Nebenwirkungen. Er ist auch der einzige ACE-Hemmer, der die Blut-Hirn-Schranke passieren kann, obwohl die Bedeutung dieser Eigenschaft keine positiven klinischen Auswirkungen gezeigt hat. ⓘ
In einer großen klinischen Studie zeigte einer der Wirkstoffe aus der Klasse der ACE-Hemmer, Ramipril (Altace), die Fähigkeit, die Sterblichkeitsrate von Patienten mit einem Herzinfarkt zu senken und die anschließende Entwicklung einer Herzinsuffizienz zu verlangsamen. Diese Feststellung wurde getroffen, nachdem entdeckt worden war, dass die regelmäßige Einnahme von Ramipril die Sterblichkeitsrate auch bei Probanden ohne Bluthochdruck senkte. ⓘ
Es wird vermutet, dass der zusätzliche Nutzen von Ramipril auch für einige oder alle anderen Arzneimittel der ACE-Hemmer-Klasse gilt. Ramipril bleibt jedoch derzeit der einzige ACE-Hemmer, für den solche Wirkungen tatsächlich nachgewiesen sind. ⓘ
Eine Meta-Analyse hat bestätigt, dass ACE-Hemmer wirksam sind und sicherlich die erste Wahl bei der Behandlung von Bluthochdruck darstellen. Diese Meta-Analyse basierte auf 20 Studien und einer Kohorte von 158 998 Patienten, von denen 91 % Bluthochdruck hatten. ACE-Hemmer wurden in sieben Studien (n=76.615) und Angiotensinrezeptorblocker (ARB) in 13 Studien (n=82.383) als aktive Behandlung eingesetzt. ACE-Hemmer waren mit einer statistisch signifikanten Senkung der Sterblichkeit um 10 % verbunden: (HR 0,90; 95% CI, 0,84-0,97; P=0,004). Im Gegensatz dazu wurde bei der Behandlung mit ARB keine signifikante Verringerung der Sterblichkeit beobachtet (HR 0,99; 95% CI, 0,94-1,04; P=0,683). Die Analyse der Mortalitätssenkung durch verschiedene ACE-Hemmer ergab, dass die Behandlung mit Perindopril zu einer statistisch signifikanten Senkung der Gesamtmortalität um 13 % führt. In Anbetracht des breiten Spektrums der hypertensiven Bevölkerung könnte man erwarten, dass eine wirksame Behandlung mit ACE-Hemmern, insbesondere mit Perindopril, zu einem bedeutenden Gewinn an geretteten Leben führen würde. ⓘ
Äquivalente Dosen bei Bluthochdruck
Die ACE-Hemmer haben unterschiedliche Stärken mit unterschiedlichen Anfangsdosen. Die Dosierung sollte entsprechend dem klinischen Ansprechen angepasst werden. ⓘ
| ACE-Hemmer-Dosierungen bei Bluthochdruck ⓘ | |||||
|---|---|---|---|---|---|
| Dosierung | |||||
| Hinweis: bid = zwei Mal täglich, tid = drei Mal täglich, d = täglich Medikamentendosierungen aus Drug Lookup, Epocrates Online. | |||||
| Name | Äquivalente Tagesdosis | Beginn | Übliche | Höchstwert | |
| Benazepril | 10 mg | 10 mg | 20-40 mg | 80 mg | |
| Captopril | 50 mg (25 mg bid) | 12,5-25 mg bid-tid | 25-50 mg bid-tid | 150 mg/d | |
| Enalapril | 5 mg | 5 mg | 10-40 mg | 40 mg | |
| Fosinopril | 10 mg | 10 mg | 20-40 mg | 80 mg | |
| Lisinopril | 10 mg | 10 mg | 10-40 mg | 80 mg | |
| Moexipril | 7,5 mg | 7,5 mg | 7,5-30 mg | 30 mg | |
| Perindopril | 4 mg | 4 mg | 4-8 mg | 16 mg | |
| Quinapril | 10 mg | 10 mg | 20-80 mg | 80 mg | |
| Ramipril | 2,5 mg | 2,5 mg | 2,5-20 mg | 20 mg | |
| Trandolapril | 2 mg | 1 mg | 2-4 mg | 8 mg | |
Kombination mit Angiotensin-II-Rezeptor-Antagonisten
ACE-Hemmer weisen viele Gemeinsamkeiten mit einer anderen Klasse von Herz-Kreislauf-Medikamenten auf, den Angiotensin-II-Rezeptor-Antagonisten, die häufig eingesetzt werden, wenn Patienten die unerwünschten Wirkungen der ACE-Hemmer nicht vertragen. ACE-Hemmer verhindern die Bildung von Angiotensin II nicht vollständig, da die Blockade dosisabhängig ist. Angiotensin-II-Rezeptorantagonisten können daher nützlich sein, da sie die Wirkung von Angiotensin II am AT1-Rezeptor verhindern und den AT2-Rezeptor unblockiert lassen; letzteres könnte Folgen haben, die noch weiter untersucht werden müssen. ⓘ
Die Kombinationstherapie von Angiotensin-II-Rezeptorantagonisten mit ACE-Hemmern ist möglicherweise besser als eine der beiden Substanzen allein. Diese Kombination kann den Bradykininspiegel erhöhen und gleichzeitig die Bildung von Angiotensin II und dessen Aktivität am AT1-Rezeptor blockieren. Diese "duale Blockade" könnte wirksamer sein als die Verwendung eines ACE-Hemmers allein, da Angiotensin II über nicht ACE-abhängige Wege gebildet werden kann. Vorläufige Studien deuten darauf hin, dass diese Kombination von pharmakologischen Wirkstoffen bei der Behandlung von essentieller Hypertonie, chronischer Herzinsuffizienz und Nephropathie von Vorteil sein könnte. Die neuere ONTARGET-Studie zeigte jedoch keinen Nutzen der Kombination der Wirkstoffe und mehr unerwünschte Ereignisse. Zwar wurden statistisch signifikante Ergebnisse für die Rolle des Medikaments bei der Behandlung von Bluthochdruck erzielt, die klinische Bedeutung ist jedoch möglicherweise nicht gegeben. Es gibt Warnungen vor der Kombination von ACE-Hemmern mit ARB. ⓘ
Patienten mit Herzinsuffizienz können von der Kombination profitieren, indem sie die Morbidität und das ventrikuläre Remodeling verringern. ⓘ
Der überzeugendste Nachweis wurde für die Behandlung der Nephropathie erbracht: Diese Kombinationstherapie hat bei Patienten mit diabetischer Nephropathie und pädiatrischer IgA-Nephropathie die Proteinurie teilweise rückgängig gemacht und auch eine renoprotektive Wirkung gezeigt. ⓘ
Geschichte
Seit 1980 spielen die ACE-Hemmer eine wichtige Rolle für die Behandlung von koronaren Herzkrankheiten. Dafür mussten zuerst Erkenntnisse über das Renin-Angiotensin-Aldosteron-System (RAAS) gewonnen werden. Dessen Erforschung startete 1898 durch die Isolierung des Renins, ermöglicht durch Robert Tigerstedt und Per Gustav Bergman. Harry Goldblatt postulierte die Beteiligung des Enzyms an der Blutdruckregulation. Diese Hypothese konnte allerdings erst 1939 bewiesen werden. 1946 folgten dann Berichte, die aufzeigten, dass Patienten mit chronischer Herzinsuffizienz eine erhöhte Reninaktivität aufweisen. Aus diesem Grund verstärkte man ab den 1950er Jahren die Erforschung des RAAS bei Hypertonie. ⓘ
Der Grundstein für die Entwicklung der ACE-Hemmer wurde 1956 mit der Aufklärung der Funktion des Angiotensin Converting Enzyme (ACE) durch Leonard T. Skeggs Jr. gelegt. Die Bedeutung dieses Enzyms für die Blutdruckregulation wurde anfangs noch unterschätzt. ⓘ
14 Jahre nach der Entdeckung des Angiotensin Converting Enzyme fand der Pharmakologe Sérgio Henrique Ferreira 1965 heraus, dass das Gift der Jararaca-Lanzenotter in vitro zu einer Hemmung dieses Enzyms führt. 1970 isolierten er sowie, unabhängig von ihm, Miguel Ondetti das Pentapeptid BPP5a aus dem Schlangengift, welches die Angiotensin-I-Konversion hochspezifisch hemmt. ⓘ
Da BPP5a im Körper sehr instabil ist, startete fast gleichzeitig eine Suche nach potenteren und stabileren Inhibitoren des Enzyms. Ein erster Erfolg gelang 1971 mit der Entdeckung der ACE-hemmenden Wirkung des Nonapeptids Teprotid. Die Hersteller stellten die klinische Weiterentwicklung von Teprotid jedoch zwei Jahre später wegen mangelndem kommerziellen Interesses ein. Zudem musste Teprotid intravenös verabreicht werden, wodurch es sich für chronische Erkrankungen wie die Hypertonie als ungeeignet erwies. ⓘ
Die erste Synthese eines oralen ACE-Hemmers gelang David Cushman und Ondetti: Mithilfe des Wissens über die Strukturähnlichkeit des ACE mit der im Pankreas vorkommende Carboxypeptidase A konnte die Verbindung Succinylprolin hergestellt werden, welche bei weitem nicht so wirksam wie Teprotid war. ⓘ
Anfangs der 1970er-Jahre konnte die wirksame Teilstruktur der ACE-hemmenden Peptide BPP5a und Teprotid aufgeklärt werden. Aufgrund dieser Entdeckungen wurden neue nichtpeptidische ACE-Hemmer entwickelt. 1974 wurde erstmals der ACE-Hemmer Captopril als Produkt einer groß angelegten Wirkstoffsuche (Screening) der Pharmafirma Squibb beschrieben. 1981 wurde er als erster ACE-Hemmer unter dem Handelsnamen Lopirin in die Therapie eingeführt. Captopril ist in der Wirkstärke mit der von Teprotid gleichzusetzen. ⓘ
In den folgenden Jahren versuchte man strukturähnliche Verbindungen zu Captopril zu entwickeln. Dadurch stieß man auf Verbindungen mit SH-Gruppen, welche eine höhere Lipophilie besitzen. Da Captopril anfangs bei klinischen Studien in relativ hohen Dosen verwendet wurde, traten zahlreiche, teilweise auch schwerwiegende Nebenwirkungen auf, die man u. a. dem Sulfyhydrylanteil im Molekül zuschreiben konnte. Aus diesem Grund verringerte man die Dosen, wodurch auch Auftreten der Nebenwirkungen deutlich abnahm. Dennoch bemühte man sich weiter um die Synthese eines ACE-Hemmers ohne Sulfylhydrylanteil. Dieses Ziel wurde 1980 erreicht, indem Arthur A. Patchett und Charles S. Sweet den sulfylhydrylfreien ACE-Hemmer Enalapril bzw. Enalaprilat synthetisierten und vorstellten. Letzteres hatte allerdings nur eine geringe Bioverfügbarkeit, weshalb es in Form des Ethylesters als Prodrug unter den Handelsnamen Pres und Xanef auf den Markt gelangte. Das Enalapril galt nun als „Prototyp“ für andere strukturähnliche ACE-Inhibitoren. Aufgrund des großen therapeutischen und wirtschaftlichen Erfolges der Arzneistoffe Captopril und Enalapril wurde eine zweite Generation der ACE-Hemmer entwickelt, die seit Anfang der 1990er Jahre erhältlich sind. ⓘ
Leonard T. Skeggs und seine Kollegen (darunter Norman Shumway) entdeckten 1956 ACE im Blutplasma. Außerdem wurde festgestellt, dass Menschen, die in Bananenplantagen im Südwesten Brasiliens arbeiteten, nach dem Biss einer Grubenotter zusammenbrachen, was zur Suche nach einer blutdrucksenkenden Komponente in ihrem Gift führte. Der brasilianische Wissenschaftler Sérgio Henrique Ferreira berichtete 1965 über einen bradykininpotenzierenden Faktor (BPF) im Gift von Bothrops jararaca, einer südamerikanischen Grubenotter. Ferreira ging daraufhin als Postdoktorand mit seinem bereits isolierten BPF in das Labor von John Vane. Es wurde angenommen, dass die Umwandlung des inaktiven Angiotensin I in das potente Angiotensin II im Plasma stattfindet. Im Jahr 1967 zeigten Kevin K. F. Ng und John R. Vane jedoch, dass Plasma-ACE zu langsam ist, um die Umwandlung von Angiotensin I in Angiotensin II in vivo zu erklären. Nachfolgende Untersuchungen zeigten, dass die Umwandlung während der Passage durch den Lungenkreislauf schnell erfolgt. ⓘ
Bradykinin wird im zirkulierenden Blut schnell inaktiviert und verschwindet in einem einzigen Durchgang durch den Lungenkreislauf vollständig. Angiotensin I verschwindet ebenfalls im Lungenkreislauf, da es in Angiotensin II umgewandelt wird. Außerdem passiert Angiotensin II die Lunge ohne Verluste. Es wurde angenommen, dass die Inaktivierung von Bradykinin und die Umwandlung von Angiotensin I in Angiotensin II in der Lunge durch dasselbe Enzym verursacht werden. 1970 wiesen Ng und Vane unter Verwendung der von Ferreira bereitgestellten BPF nach, dass die Umwandlung während der Passage durch den Lungenkreislauf gehemmt wird. ⓘ
Captopril wurde 1981 von der United States Food and Drug Administration zugelassen. Der erste nicht sulfhydrylhaltige ACE-Hemmer, Enalapril, kam zwei Jahre später auf den Markt. Seither wurden mindestens 12 weitere ACE-Hemmer auf den Markt gebracht. ⓘ
1991 stellten japanische Wissenschaftler den ersten ACE-Hemmer auf Milchbasis her, und zwar in Form eines fermentierten Milchgetränks, bei dem spezielle Kulturen eingesetzt wurden, um das Tripeptid Isoleucin-Prolin-Prolin (IPP) aus dem Milchprotein freizusetzen. Bei diesem Prozess wird auch Valin-Prolin-Prolin (VPP) freigesetzt, ein weiteres Tripeptid der Milch mit einer sehr ähnlichen chemischen Struktur wie IPP. Zusammen werden diese Peptide jetzt oft als Laktotripeptide bezeichnet. 1996 wurde in der ersten Studie am Menschen die blutdrucksenkende Wirkung von IPP in fermentierter Milch bestätigt. Obwohl die doppelte Menge an VPP erforderlich ist, um die gleiche ACE-hemmende Wirkung zu erzielen wie das ursprünglich entdeckte IPP, wird davon ausgegangen, dass auch VPP zur gesamten blutdrucksenkenden Wirkung beiträgt. Seit der Entdeckung der ersten Laktotripeptide wurden mehr als 20 klinische Studien am Menschen in vielen verschiedenen Ländern durchgeführt. ⓘ
Pharmakologie
Wirkmechanismus

Der Wirkungsmechanismus der ACE-Hemmer beruht auf einer Hemmung des Angiotensin-I-umsetzenden Enzyms ACE. Dieses Enzym hat im Organismus zwei Hauptaufgaben: Einerseits ist es für die Synthese des gefäßverengend wirksamen Octapeptids (Peptid aus acht Aminosäuren) Angiotensin II aus seiner inaktiven Vorstufe, dem Decapeptid (zehn Aminosäuren) Angiotensin I unter Abspaltung der zwei C-terminalen Aminosäuren zuständig. Andererseits katalysiert es den Abbau des Mediators Bradykinin in inaktive Produkte. ⓘ
Die Hemmung des Angiotensin Converting Enzyme hat eine Abnahme der Angiotensin-II-Konzentration an den Angiotensinrezeptoren (AT1 und AT2) zur Folge. Primär sinkt dadurch der Blutgefäßtonus, und der Blutdruck nimmt ab. Es kommt also hämodynamisch zu einer Senkung der Vorlast und der Nachlast. Sekundär führt die Abnahme des Angiotensin-II-Spiegels zu einer Verringerung der Aldosteron-Freisetzung aus der Nebennierenrinde und somit zu einer Beeinflussung des Wasserhaushalts (siehe auch Renin-Angiotensin-Aldosteron-System, RAAS). Auf zellulärer Ebene kann ein Rückgang der durch Angiotensin II vermittelten mitogenen Effekte an Fibroblasten und Myozyten des Herzens, die insbesondere nach einem Herzinfarkt zu ungünstigen Veränderungen (Remodeling) führen, beobachtet werden. In welchem Ausmaß die Blutdrucksenkung erfolgt, hängt davon ab, wie hoch die Aktivität des RAA-Systems ist. Bei der Herzinsuffizienz ist die Aktivität des RAAS sehr hoch, sodass man auf jeden Fall nur einschleichend dosieren sollte, um eine zu starke Blutdrucksenkung zu vermeiden. ⓘ
Bei Nierenerkrankungen wie der diabetischen Nephropathie führen ACE-Hemmer zu einer verminderten Proteinausscheidung und verhindern ein Fortschreiten der Erkrankung (Nephroprotektion). ⓘ
Die Hemmung des Abbaus von Bradykinin führt hingegen zu dessen Kumulation und damit verbundenen Nebenwirkungen. ⓘ
Molekularer Wirkmechanismus
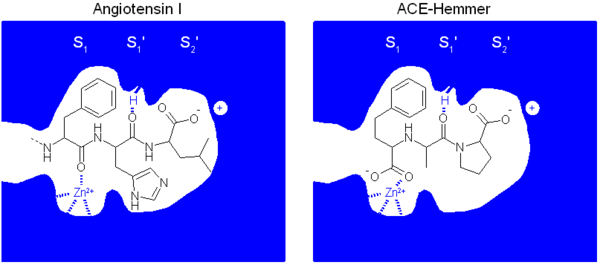
Auch der molekulare Wirkmechanismus der ACE-Hemmer konnte aufgeklärt werden. Er beruht auf der Ähnlichkeit der ACE-Hemmer zu einem Peptidkettenende des Angiotensin I. Dadurch werden ACE-Hemmer vom Angiotensin Converting Enzyme fälschlich für das physiologische Substrat Angiotensin I gehalten. Im Gegensatz zum physiologischen Substrat werden sie aber nicht vom Enzym umgesetzt, sondern blockieren es. Wichtig für die Bindung des Liganden sind drei Wechselwirkungen:
- eine Komplexierung des Zink-Ions des ACE. Dies ist in der Regel eine Carboxygruppe oder beim Captopril eine Thiolgruppe
- eine elektrostatische Wechselwirkung zwischen dem K511 des ACE und der Carboxylatfunktion des Prolins des Liganden
- eine Wasserstoffbrückenbindung zwischen H353 des ACE und dem Carbonyl des Alanins bzw. Lysins des Liganden ⓘ
Pharmakokinetik
Entsprechend ihrer chemischen Differenzen unterscheiden sich die ACE-Hemmer in ihrer Pharmakokinetik. Die Mehrzahl der derzeit verfügbaren ACE-Hemmer sind Prodrugs. Das heißt, dass sie nach einer 20%igen (Ramipril) bis fast 100%igen Aufnahme (Resorption) durch Enzyme im Körper aktiviert werden müssen (siehe Chemie). Lediglich Captopril und Lisinopril benötigen diesen Aktivierungsschritt nicht. Maximale Plasmaspiegel der Wirkformen werden nach 1 bis 8 Stunden erreicht. Die Plasmahalbwertszeiten schwanken zwischen 2 (Captopril) und 40 Stunden (Spirapril). Entsprechend variiert auch die Wirkdauer (8 bis 48 Stunden). Alle ACE-Hemmer werden überwiegend über die Niere ausgeschieden. Fosinopril, Moexipril und Spirapril zeigen darüber hinaus eine relevante biliäre Exkretion (Ausscheidung über die Galle). ⓘ
Ökonomische Bedeutung
In Deutschland nehmen etwa 20 % der Bevölkerung und jeder zweite über 55 Jahre Arzneimittel zur Behandlung des Bluthochdrucks ein. ACE-Hemmer sind mit einem Anteil von über 50 % die meistverordneten Antihypertensiva. Etwa 80 % der mit einem ACE-Hemmer behandelten Bluthochdruckpatienten verwenden ein Monotherapeutikum, der Rest nutzt ein Kombinationspräparat. Die Verordnungszahlen, die in Deutschland im Jahr 2009 etwa 5 Milliarden definierte Tagesdosen (DDD) erreichten, nahmen in den letzten zehn Jahren linear um etwa 200 % zu. Auf dem von Generika geprägten deutschen Markt dominiert der Arzneistoff Ramipril (68 %) deutlich vor Enalapril (18 %) und Lisinopril (10 %). ⓘ
Intensivmedizinischer Aspekt
In der Intensivmedizin hat sich gezeigt, dass Patienten, die vor dem Intensivstationsaufenthalt mit ACE-Hemmern therapiert wurden, oftmals einen höheren Verbrauch an Katecholaminen aufweisen, um den mittleren arteriellen Druck zu stabilisieren. Grund dafür dürfte ein Vasopressinmangel sein, der auf die vorhergehende Therapie mit ACE-Hemmern zurückzuführen wäre. Durch die Substitution von Vasopressin (ADH) kann häufig der Katecholaminbedarf (soweit keine weiteren Gründe für niedrigen Blutdruck vorliegen) rasch reduziert werden und danach das Vasopressin binnen 12–24 Stunden ausgeschlichen werden. ⓘ